全自动固相萃取-HPLC-FLD柱后衍生法测定粮食中黄曲霉毒素B1
2024-06-23李俊毅李窕妍
李俊毅 李窕妍

摘 要:采用全自动固相萃取仪,建立适用于粮食中黄曲霉毒素B1的检验方法。样品经提取液提取,用全自动固相萃取-免疫亲和柱净化,采用高效液相色谱-荧光检测(High Performance Liquid Chromatography-Fraunhofer Line Discriminator,HPLC-FLD)柱后衍生法进行测定。结果表明,黄曲霉毒素B1在0.1~
20.0 ng·mL-1线性良好,R2为0.999 987;检出限和定量限分别为0.03 μg·kg-1和0.1 μg·kg-1;3水平加标回收率为84.9%~88.5%。本方法自动化程度高、重现性好,可以满足粮食中黄曲霉毒素B1测定的要求。
关键词:全自动固相萃取;高效液相色谱-荧光检测;柱后衍生;黄曲霉毒素B1
Determination of Aflatoxin B1 in Grain by Automatic Solid Phase Extraction with HPLC-FLD Post-Column Derivatization
LI Junyi1, LI Tiaoyan2
(1.Jieyang Institute of Food Inspection, Jieyang 522000, China;
2.Guangdong Province Jieyang City Quality Measurement Supervision and Testing Institute, Jieyang 522000, China)
Abstract: A fully automatic solid-phase extractor was used to establish a method for the detection of aflatoxin B1 in grain. The samples were extracted by extraction, cleaned up with automatic solid-phase extraction-immunoaffinity column, and determined by high performance liquid chromatography-fraunhofer line discriminator (HPLC-FLD) post-column derivatization. The results showed that aflatoxin B1 had good linearity at 0.1~20.0 ng·mL-1, R2 was
0.999 987, and the limits of detection and quantification were 0.03 μg·kg-1 and 0.1 μg·kg-1, respectively. The recovery rate of horizontal spiking was 84.9%~88.5%. This method has a high degree of automation and good reproducibility, which can meet the requirements of the determination of aflatoxin B1 in grains.
Keywords: automatic solid phase extraction; high performance liquid chromatography-fraunhofer line discriminator; post-column derivations; aflatoxin B1
黄曲霉毒素(Aflatoxin,AFT)是一种双呋喃环类毒素,属于真菌类毒素,常见的黄曲霉毒素可分为B族、G族和M族三大类,目前已经发现的黄曲霉毒素及其衍生物超过20种[1]。黄曲霉会污染粮食、坚果、油脂及其制品,如大米、小麦、瓜子、大豆油等[2]。食品被黄曲霉和寄生曲霉污染后都可能会产生黄曲霉毒素,其中AFTB1的毒性最强[3],会对人体健康造成极大的危害,属Ⅰ类致癌物。
食品中黄曲霉毒素B1的检测方法主要有液质联用法[4]、高效液相色谱法[5]、QuEChERS法结合其他检测方法[6]、酶联免疫吸附筛查法[7]以及薄层层析法等[8]。其中,高效液相色谱法操作相对简单,实验人员易上手,仪器的使用和维护成本较低,检测灵敏度高、稳定性好[9]。本研究在国标方法高效液相色谱-荧光检测(High Performance Liquid Chromatography-Fraunhofer Line Discriminator,HPLC-FLD)柱后衍生法的基础上,对前处理方法进行改进和优化,结合全自动固相萃取仪-免疫亲和柱对样品进行全自动净化,有效解决了人工过柱流速不稳定、重现性较差、大批量样品处理效率不高等问题,避免了前处理阶段由人员操作带来的系统误差,提升了工作
效率。
1 材料与方法
1.1 材料与试剂
阴性大米样品;市售大米样品;甲醇、乙腈;乙腈中黄曲霉毒素B1标准物质(100 μg·mL-1),阿尔塔。
1.2 仪器与设备
Waters e2695/2475高效液相色谱仪,配荧光检测器和柱后衍生系统;AflaStar黄曲霉毒素免疫亲和柱(3 mL,200 ng);Fotector-02HT全自动固相萃取仪,Reeko公司;AutoEVA-20Plus全自动平行浓缩仪,Reeko公司;V20垂直振荡器,RayKal公司;BSA224S-CW电子天平,Sartorius公司。
1.3 实验方法
1.3.1 检测条件
Symmetry C18色谱柱(150 mm×4.6 mm,5 μm);等梯度洗脱;流动相:水+乙腈+甲醇(68+16+16);流速:1 mL·min-1;柱温:40 ℃;进样量:20 μL;激发波长:360 nm;发射波长:440 nm;柱后衍生溶液:0.05%碘溶液;衍生溶液流速:0.2 mL·min-1;衍生反应管温度:70 ℃。
1.3.2 标准曲线的配制
精确移取0.5 mL黄曲霉毒素B1标准物质
(100 μg·mL-1)至5 mL容量瓶中,用乙腈稀释混匀,得到10.0 μg·mL-1的标准储备液。精确移取1.0 mL标准储备液至100 mL容量瓶,用乙腈稀释混匀,得到100 ng·mL-1的标准中间液。用流动相(水+乙腈+甲醇,68+16+16)将标准中间液分别稀释成
0.1 ng·mL-1、0.5 ng·mL-1、2.0 ng·mL-1、5.0 ng·mL-1、10.0 ng·mL-1和20.0 ng·mL-1的标准工作曲线,供高效液相色谱仪测定。
1.3.3 样品的制备
称取5 g预先充分粉碎均匀的大米样品至50 mL离心管,加入20 mL 70%的甲醇溶液,漩涡混合后置于垂直振荡器中,以1 000 r·min-1振荡20 min,
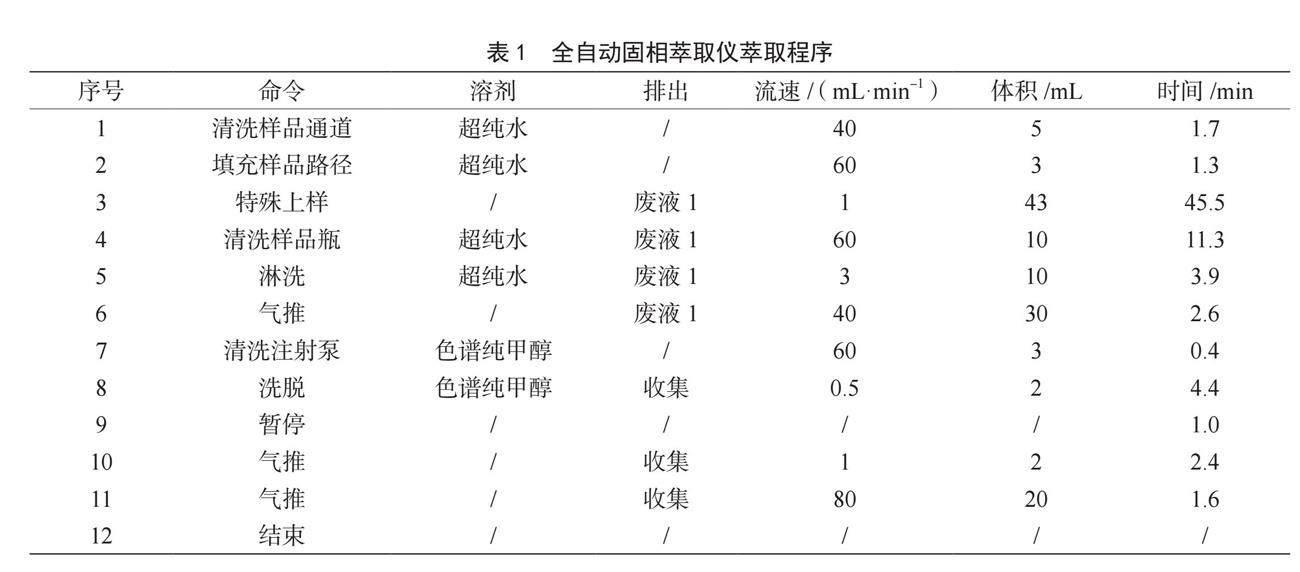
6 500 r·min-1离心10 min。移取4 mL上清液至进样管中,加入38 mL 1%曲拉通X-100的PBS,充分混合均匀。将上述样液置于高通量全自动固相萃取仪中萃取,收集洗脱液至20 mL浓缩管中,置于全自动平行浓缩仪,于50 ℃条件下将洗脱液氮吹至近干,用流动相定容至1.0 mL,置于涡旋混合器中涡旋30 s溶解残渣,用0.22 μm PTFE滤膜过滤,测定。固相萃取程序见表1。
2 结果与分析
2.1 标准曲线、检出限与定量限
将1.3.2项系列标准工作液注入液相色谱仪,以黄曲霉毒素B1的质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。得到黄曲霉毒素B1的线性回归方程为Y=3.76×106X-6.31×104,相关系数R2为
0.999 987,在0.1~20.0 ng·mL-1线性关系良好。
依据《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》(GB 5009.22—2016)的规定,当称取样品5 g时,高效液相柱后碘衍生法测定AFTB1的检出限(Limit of Detection,LOD)为
0.03 μg·kg-1,定量限(Limit of Quantification,LOQ)为0.1 μg·kg-1[10]。本实验结合国家标准规定,称取
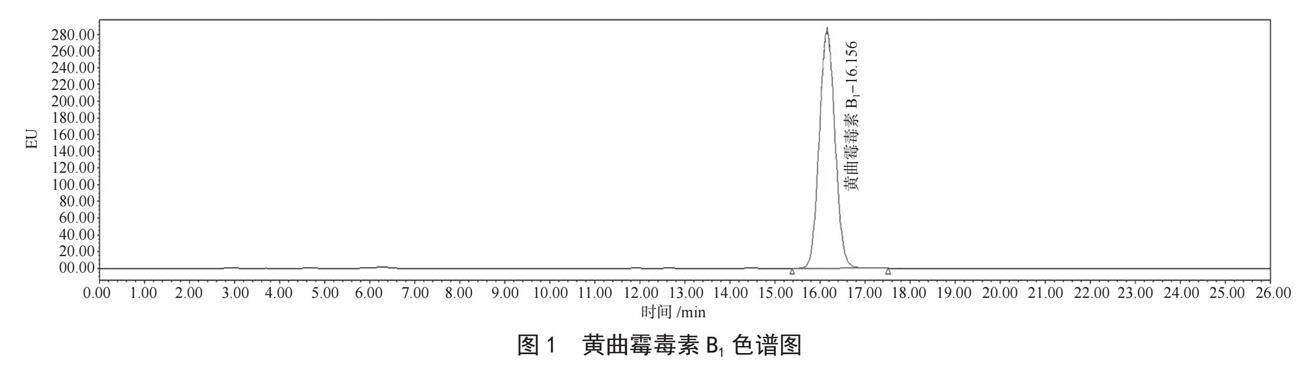
5 g阴性样品,加入1.5 μL 100 ng·mL-1标准中间液,按照1.3.3项方法进行样品制备,测得黄曲霉毒素B1的S/N值为34.18,满足S/N≥3的要求,且峰型清晰可辨(见图1),因此确定本方法AFTB1的LOD为
0.03 μg·kg-1;同理,确定本方法AFTB1的LOQ为
0.1 μg·kg-1。
2.2 精密度与加标回收率实验
在阴性样品中,采用外加法添加黄曲霉毒素B1标准物质,分别制备1×LOQ、2×LOQ、10×LOQ
3个添加浓度的加标样品,每个浓度制备3个平行,按照1.3.3项方法进行样品制备,加标回收实验结果见表2。从表2可以看出,3个添加水平下,平均加标回收率在84.9%~88.5%,相对标准偏差(Relative Standard Deviation,RSD)在2.24%~4.92%,符合《合格评定 化学分析方法确认和验证指南》(GB/T 27417—
2017)的规定,方法准确可靠。
2.3 实际样品检测
在多个商场、超市和市场随机采集30批次的大米样品,采用本方法进行测定,其中有13批次的样品检出AFTB1,含量在0.276~2.272 μg·kg-1。抽查的30批次大米样品中AFTB1含量均小于10 μg·kg-1,符合《食品安全国家标准 食品中真菌毒素限量》
(GB 2761—2017)规定的限量要求。
3 结论
本文建立了全自动固相萃取-HPLC-FLD柱后衍生法测定粮食中黄曲霉毒素B1的方法。实验采用了稳定性好的HPLC-FLD,同时结合全自动固相萃取仪、全自动平行浓缩仪、垂直振荡仪等一系列自动化设备替代人工操作,优化了前处理的关键条件,同时考察了标准曲线、方法检出限和定量限、精密度和加标回收率等。结果表明,该方法操作简便、准确度高、重现性好,有效避免了人工操作带来的系统误差,适合检测大批量样品,可以满足粮食中黄曲霉毒素B1的测定要求。
参考文献
[1]梁剑锋,李亚,梁燕妮,等.QuEChERS萃取-UPLC-MS/MS测定花生酱中黄曲霉毒素B1方法的研究[J].中国调味品,2020,45(5):182-185.
[2]姚唱,王伊乔,陈洁.高效液相色谱法测定粮油食品中黄曲霉毒素B1含量的不确定度分析[J].粮食与食品工业,2022,29(4):68-71.
[3]赵亮.粮油食品中的黄曲霉毒素检测技术分析[J].现代食品,2021(14):47-49.
[4]唐楚林.液质联用技术在食品真菌毒素检测中的应用[J].中国食品工业,2023(15):63-65.
[5]石格鑫.高效液相色谱法测定小麦中黄曲霉毒素B1含量[J].现代食品,2020,5(10):204-206.
[6]赵淑娥,肖庚鹏,袁璐,等.QuEChERS提取快速液相色谱-串联质谱法同时测定食品中多种真菌毒素[J].江西化工,2023,39(6):37-40.
[7]高志存,石露莎,余舒宁,等.酶联免疫吸附法与高效液相色谱法检测玉米中黄曲霉毒素B1的比较[J].云南畜牧兽医,2023(6):10-12.
[8]冯莉.薄层色谱法检测玉米中黄曲霉毒素B1[J].现代畜牧科技,2018(8):20.
[9]焦梓毅,李丽,刘金阳,等.样品前处理对超高效液相色谱法分析粮食中黄曲霉毒素的影响[J].粮油食品科技,2023,31(6):98-106.
[10]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中黄曲霉毒素B族和G族的测定:GB 5009.22—2016[S].北京:中国标准出版社,2016.
