人参锈腐病对人参品质和土壤相关因子的影响研究
2024-06-16张桐毓勾颖李琪杨莉
张桐毓 勾颖 李琪 杨莉

摘要:为研究锈腐病对人参品质和土壤相关因子的影响,以罹患锈腐病人参、健康人参及其根际土壤为试验材料,检测土壤理化性质、土壤酶活性,利用高效液相色谱法检测人参根及根际土壤内酚酸、皂苷含量,并利用分子手段检测土壤中病原菌数量。结果表明,人参根内大部分皂苷含量随锈腐病的加剧而减少,降幅为50.1%~72.5%;土壤中参根分泌的化感物质的种类、含量与人参病害程度密切相关,部分皂苷类物质含量升高,最高增长了7.5倍,且频率有所增加;丁二酸、肉桂酸含量显著高于健康株,较健康株分别增加3.69、2.39倍。对土壤因子的测定发现,除过氧化氢酶的活性随病害的加剧而升高,其余土壤质量指标均随病害的加剧而下降,其中速效磷降幅高达55.0%,且在病害初发时含量即开始下降,可以表征人参锈腐病的发生。相关性分析表明,病原菌数量与土壤因子的灰色关联度为0.362 5~0.497 5,与化感物质的灰色关联度为0.182 5~0.619 9。以上结果表明,人参患锈腐病后会影响人参品质,因此,改善土壤环境、调节土壤生态平衡、降低人参患病几率、是提高人参质量的有效途径。
关键词:人参质量;锈腐病;土壤理化性质;土壤酶活;分子检测
doi:10.13304/j.nykjdb.2022.0799
中图分类号:S41-30 文献标志码:A 文章编号:1008‐0864(2024)03‐0124‐10
人参化感物质主要分为酚酸类和皂苷类2种,其中人参皂苷是评价人参品质的主要指标,其产生与积累会受到环境因子的影响[1];而酚酸类物质进入土壤后,可能会引起微生物活力的改变[2]。植物根系分泌物中存在大量化感物质,作物连作时间越长,化感物质在土壤中的积累量越高,进而影响微生物的群落结构[3]。黄玉茜等[4]研究发现,随着花生种植年限的增加,其根际土壤中的放线菌、细菌数量显著下降,真菌的数量显著上升。李振方等[5]研究表明,地黄连作造成根际土壤细菌数量减少,土壤真菌和放线菌数量增多。同时,化感物质的积累影响了土壤酶活性及土壤中各种营养物质的交换和能量流动[6],导致养分元素比例失衡,土壤理化性质逐渐恶化,而土壤的生态环境与理化性质共同决定了土壤微生物的生存环境。丛微等[7]发现,土壤速效钾、全钾含量和pH是影响土壤微生物群落结构的重要因素。人参根际土壤微生物群落结构的失衡会导致人参病害加剧,最终影响人参品质。本研究分析了人参锈腐病不同病级罹病植株根际土壤理化性质,同时测定了土壤中人参主要化感物质——皂苷类物质和酸类物质的含量,研究锈腐病对土壤环境因子与人参品质的影响,以期探索影响人参品质的关键因素。
1 材料与方法
1.1 试验材料
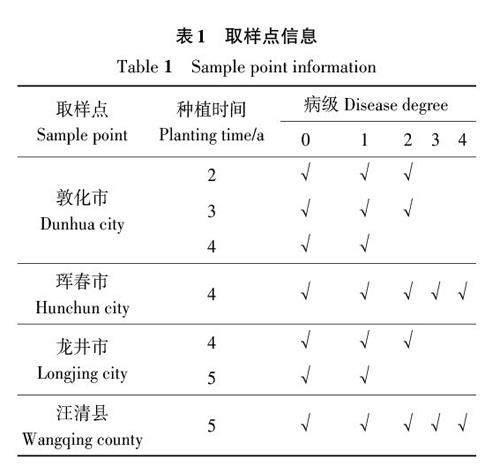
罹患锈腐病植株及其根际土壤于2021年9月采集于吉林省延边州珲春市、敦化市、龙井市及汪清县。取样点信息及罹病植株分级情况见表1,根据人参锈腐病病症将病株分为0级(健康株)、1级(病斑占参根表面积10%以下)、2级(病斑占参根表面积10%~30%)、3级(病斑占参根表面积30%~50%)、4级(病斑占参根表面积50%以上)[8]。
1.2 人参根内及根际土壤中化感物质含量的检测
1.2.1 人参供试品溶液制备 人参样品低温烘干,粉碎过筛,精密称取人参粉1.000 g于提取罐中,加入30 mL 80%的甲醇,微波提取30 min,过微孔滤膜后得到人参皂苷待测溶液。
1.2.2 人参根际土壤中化感物质的提取 抖根法收集根际土壤后立即定量称取土壤样品5.00 g,加入体积分数50% 的乙醇溶液50 mL,28℃、180 r·min-1 恒温振荡提取24 h,过滤后滤液减压浓缩,以甲醇溶解浓缩物并定容至10 mL,过0.22 μm微孔滤膜后备用。
1.2.3 人参皂苷含量检测 标准溶液的配制:称取Rg1、Re、Rf、Rb1、Rg2、Rc、Rb2、Rb3、Rd、Rg3 共10种单体人参皂苷标准品(默克生命科学有限公司),加入甲醇分别制成每毫升含人参皂苷0.125、0.250、0.500、1.000、2.000 μg 的混标溶液,过0.22μm微孔滤膜后备用。
色谱条件:色谱柱为依利特 Hypersil ODS2(250.0 mm×4.6 mm,5 μm),检测波长为203 nm,柱温(25.00±0.15) ℃,流速 0.8 mL·min-1,洗脱程序见表2。
1.2.4 酚酸类物质含量检测 酚酸标准溶液配制:精确称量肉桂酸、苯甲酸、邻苯二甲酸、丁二酸标准品各8.0 mg,以甲醇溶解,配成8.0 mg·mL-1的母液,然后分别稀释为6、4、2、1 mg·mL-1的供试标准液,过0.22 μm微孔滤膜后备用。
色谱条件:试验采用的色谱柱为ZORBAXSB-Aq(4.6 mm×250.0 mm),检测波长为210 nm,柱温(35.00±0.15) ℃,流速1 mL·min-1,进样体积10 μL。洗脱程序见表3。
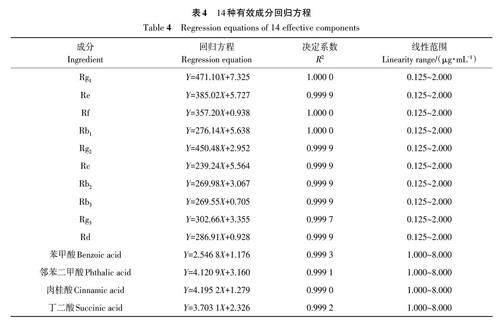
1.2.5 标准曲线的绘制 以对照品溶液质量浓度为横坐标(X),所测得化感物质的峰面积为纵坐标(Y),绘制标准曲线,建立回归方程(表4)。按上述色谱条件进样检测样品中各化感物质含量。
1.3 土壤理化性质和酶活的测定
1.3.1 土壤理化性质测定 土壤pH、土壤电导率(electrical conductivity,EC)用pH电导率仪进行测定;土壤有效磷(available phosphate,AP)的测定采用0.5 mol·L-1碳酸氢钠浸提-比色法;土壤碱解氮(available nitrogen,AN)含量的测定采用碱解扩散法;土壤有机质(organic matter,OM)含量的测定采用水合热重铬酸钾氧化-比色法;土壤速效钾(available potassium,AK)含量采用火焰原子吸收仪进行测定;具体操作参考《土壤农化分析》[9]。
1.3.2 土壤酶活测定 参照《土壤酶及其研究法》[10],土壤脲酶活性测定采用3,5二硝基水杨酸法,土壤过氧化氢酶活性测定采用高锰酸钾滴定法,土壤漆酶活性测定采用ABTS-分光光度计法。
1.4 人参根际土壤中病原菌数量的测定
1.4.1 测试菌种 目标菌株为强壮土赤壳菌(Ilyonectria robusta),阴性菌株为人参核盘菌(Sclerotinia ginseng)、灰葡萄孢菌(Botrytiscinerea)、尖孢镰刀菌(Fusarium oxysporum)、腐皮镰孢菌(Fusarium solani)、人参链格孢菌(Alternariapanax)、串珠镰刀菌(Fusarium moniliforme)、禾谷镰刀菌(Fusarium graminearum),强壮土赤壳近缘种为毁灭柱孢毁灭变种(Cylindrocarpondestructans)、毁灭柱孢、毁灭柱孢原变种(Cylindrocarpon sp.)。
1.4.2 人参锈腐病荧光定量PCR方法的建立 利用微生物DNA 提取试剂盒(Invitrogen)提取菌种DNA。根据强壮土赤壳菌的测序结果利用PrimerPremier 5.0设计引物及探针,采用NCBI-Blast验证引物的理论特异性,引物由上海生工生物技术有限公司合成。
以提取的菌种DNA为模板,并用特异性引物对不同菌株DNA进行PCR扩增,以强壮土赤壳菌作为阳性对照,对引物进行特异性验证。PCR反应体系:Mix10 μL,引物0.1 μL,探针0.1 μL ,DNA模板1.0 μL,ddH2O补足20 μL。反应条件:94 ℃预变性5 min;95 ℃变性30 s,64 ℃退火60 s,40个循环。
用微量核酸分析仪检测提取的强壮土赤壳基因组DNA,按10倍梯度依次稀释为1×10-3~10×10-3ng·μL-1,分别取1 μL不同含量的DNA作为模板进行扩增,测定特异性引物灵敏度。
1.4.3 标准曲线的建立 以强壮土赤壳菌的标准菌种特异性引物构建质粒,由上海生工生物技术有限公司合成。构建好的质粒经测序鉴定无误后,用微量分光光度计(Merinton Instrument,Inc SMA4000)测定质粒OD260 的值,通过公式换算成拷贝数(CFU·μL-1)。Ct值为横坐标,拷贝数为纵坐标构建标准曲线,获得回归方程(式1),R2=0.999 4,线性范围在0.08~7 558.21 CFU·μL-1。
y=-1 884x+576 72 (1)
1.4.4 病原菌数量的检测 土壤样品保存于-80℃的超低温冰箱中,测定前取出解冻,精密称取5 g土壤样品,采用土壤基因组DNA提取试剂盒(索莱宝,D2600-50T)提取土壤样品DNA,参照1.4.2进行荧光PCR定量检测。
1.5 数据分析
采用Origin 2018和DPS 9.50处理试验数据,对相关数据进行显著性分析。
2 结果与分析
2.1 罹病人参品质变化分析
人参病害发生时,会影响人参体内次生代谢产物合成,进而降低人参的品质。对不同病株体内的皂苷含量进行测定,检测到10种单体皂苷,由图1可知,皂苷Rd、Re、Rf、Rg2、Rb1、Rb2在病害达到4级时与健康株相比,含量显著下降,降幅分别为72.5%、53.9%、50.1%、52.2%、50.7%、50.1%。皂苷Rg1、Rc含量随着病害的加剧呈现“单峰型”变化,在病害达到2级时其皂苷含量最高,比健康株分别增加32.0%、62.3%,含量分别为1.344~5.043、1.649~8.044 mg·g-1。结果表明皂苷Rb3、Rg3受病害影响不大。
2.2 罹病人参根际土壤中皂苷类物质含量分析
分析人参健康株与不同病级罹病植株根际土壤中人参单体皂苷的含量(表5)可知,健康株(0级)根际土壤中共检测到10种单体皂苷,在健康株土壤中积累量较多的单体皂苷分别是Rf、Rb1、Rd,平均含量分别为15.97、4.45、4.22 μg·g-1;在健康株根际土壤中出现频率较高的分别是Rf、Rd、Rb1。1~4级病株根际土壤中检测到的单体皂苷种类分别为10、9、9、8种,随着病级的增加,土壤中可检测到的皂苷种类减少。其中,人参单体皂苷Rf、Rg2、Rb3是病株根际土壤中含量较高的皂苷类物质,平均含量分别为30.54、26.47、39.78 μg·g-1,单体皂苷Rg1、Rb1、Rf是病株根际土壤中出现频率较高的皂苷类物质。
根据检测到的人参单体皂苷平均含量分析,皂苷Rg1、Rc随病害的增加含量升高,分别增长了7.33、7.50倍;皂苷Re的含量随病害的加剧呈下降趋势,与健康株相比降低9.30倍;其余7种人参皂苷含量表现为先升高后下降。
2.3 罹病人参根际土壤中酚酸类物质含量分析
分析土壤中4种酚酸单体含量,由图2可知,肉桂酸和丁二酸在病株根际土壤中含量显著高于健康株,病害达到4 级时,在土壤中含量分别为3.69、18.61 μg·g-1,较健康株分别增加3.69、2.39倍。苯甲酸、邻苯二甲酸在病株与健康株间无显著差异,含量介于2.20~3.66、2.27~3.12 μg·g-1。综上可知,丁二酸在病株土壤中含量最高,肉桂酸含量受人参锈腐病影响增长速率最快。
2.4 罹病人参根际土壤质量分析
综合分析不同病级罹病人参与健康株土壤理化性质之间关系(图3)可知,土壤pH 范围5.8~6.1,随着病级的增长,pH有显著下降趋势,降幅为4.9%。土壤中速效磷、速效钾、碱解氮、有机质含量均随着病害的加剧而下降,其中碱解氮和速效钾含量在病害达到4级时下降显著,降幅分别为35.6%、46.4%,而速效磷和有机质含量在病害初发(2级)时与健康株相比便显著降低,病害达到4 级时,降幅分别为55.0%、37.9%。罹病人参土壤中电导率值与健康株无显著差异。综上表明,速效磷是表征人参罹病的重要指标。
土壤酶在土壤生态系统的物质循环和能量流动中起着重要作用,能够参与土壤生态系统中诸多代谢过程,促进土壤养分代谢。不同年份人参锈腐病与土壤酶活性的关系如图4所示,脲酶和漆酶随着病害的发生,活性开始逐步下降,与健康株相比差异显著,病害4级时降幅分别为63.8%、69.1%;过氧化氢酶的活性在病害为3级时,活性显著上升42.3%。
2.5 罹病人参根际土壤中病原菌数量分析
不同年生、不同病级罹病人参根际土壤中强壮土赤壳病菌数量如图5所示,人参健康株根际土壤中存在一定数量的强壮土赤壳病菌,其均值为1 659.67 CFU·g-1。随着锈腐病病级增加,病株根际土壤中病原菌数量增加。病级1~3级内,病原菌数量增加速率较平缓,病原菌数量分别为健康株的2.12、3.50、3.83 倍,均值在3 512.90~6 354.60 CFU·g-1;当病级达到4级时,土壤中病原菌数量迅速增加,病原菌数量为健康株的12.68倍,均值达到21 049.80 CFU·g-1。病级与病原菌数量之间的关系可以用线性函数进行模拟,模型的决定系数为0.729 2,表明病原菌数量与人参锈腐病的发生与加重有直接相关关系。
2.6 人参病原菌数量与环境因子的相关性分析
分析土壤中化感物质及土壤因子与人参锈腐病病原菌数量的关系,如表6所示,根据其灰色关联度可知,病原菌数量与土壤因子的灰色关联度在0.362 5~0.497 5,病原菌数量与化感物质的灰色关联度在0.182 5~0.619 9,说明人参病原菌主要影响人参化感物质中酚酸类物质的含量,其中影响最显著的因子为肉桂酸。
3 讨论
3.1 锈腐病对人参品质的影响
人参病害对参根体内皂苷含量产生影响。Rahman等[11]比较了西洋参患锈根症状的组织与健康的组织发现,皂苷含量下降40%~50%。刘延硕[12]发现,患病人参根中总皂苷含量低于健康人参,患病人参根中的单体皂苷Re、Rf、Rg2、Rb1、Rb2含量均低于健康人参。本研究检测了罹病人参的皂苷含量,发现皂苷Rd、Re、Rf、Rg2、Rb1、Rb2在病害达到4级时与健康株相比,含量显著下降,皂苷Rg1、Rc含量随着病害的加剧,呈现“单峰型”变化,在病害达到2级时皂苷含量最高。本研究结果与已有结果[11‐12]类似,均表明在患病的情况下,人参根内的皂苷含量会受到病害的影响。由此可见,人参锈腐病会影响人参根内皂苷含量,除部分皂苷含量短暂上升外,大多数皂苷含量均呈下降趋势,从而影响人参质量。
3.2 锈腐病对人参根际土中化感物质的影响
人参患病后会影响根系分泌的化感物质的种类与含量,而土壤中化感物质的积累会影响作物对养分的吸收与利用,对作物的生长和发育产生不利影响,甚至造成植株死亡[13]。人参分泌的化感物质主要包括皂苷类物质及酚酸类物质,不同含量的人参单体皂苷及皂苷混合物对人参种子、幼苗、根生长均具有抑制作用[14],从人参组织中分离出的细菌内生菌能够产生人参皂苷和生物活性代谢物,对人参的生长产生显著影响[15],同样,土壤中酚酸类化感物质的积累与连作障碍密切相关[16]。本研究发现,随着人参病害的发生,土壤中检测到的单体皂苷种类逐步减少,在人参健康株(0级)根际土壤中积累量较多的单体皂苷分别是Rf、Rb1、Rd;病株根际土壤中含量较高的人参单体皂苷分别是Rf、Rg2、Rb3,其中皂苷Rg1、Rc含量随病害的增加而升高,皂苷Re的含量随病害的加剧呈下降趋势,其余6种人参皂苷含量表现为先升高后下降的现象。肉桂酸、丁二酸在病株根际土壤中含量显著高于健康株,该结果与已有研究[17]一致,在酸性土壤环境中根系病害的侵染率更高,随着土壤中酚酸物质含量的上升,土壤酸性加强,导致人参的病害程度越深。综上表明,人参根际土壤中化感物质的种类和含量与其病害情况相关。通过相关性分析可知,人参患病后对酚酸类化感物质的影响大于皂苷类物质。
3.3 锈腐病对人参根际土土壤因子的影响
土壤是支撑植物生长发育的载体,植物病害的发生与根际土壤环境有一定关系。土壤中的营养元素是植物生长所必需的,也是作物优质及高产的限制因子,土壤的理化性质能够直观地反映土壤养分状况,体现土壤的质量优劣[18]。土壤pH会影响土壤中养分的周转循环、土壤微生物的多样性以及群落结构[19],有机质与土壤碱解氮、速效磷、速效钾等营养成分,都是评价土壤肥力和质量的重要指示因子[20]。植物连作会改变土壤的理化性质,研究表明,随着辣椒连作年限的延长土壤养分逐年降低[21]。本研究发现,人参患病后土壤pH下降,表明患病植株根际土壤酸化严重,土壤中速效磷、速效钾、碱解氮、有机质含量均随着病害的加剧而下降,其中碱解氮和速效钾在病害达到4级时含量显著下降,而速效磷和有机质含量在病害初发(2级)时与健株相比便显著降低,由此判断,人参患病后对土壤养分的影响较大,影响土壤质量的优劣,根据本研究可知,速效磷可以表征人参罹病。
土壤酶活是反映土壤环境与质量的指标,与土壤有机、无机养分密切相关[22]。战宇等[23]研究表明,以未栽参新林土为对照,根际土壤脲酶漆酶活性下降,过氧化氢酶活性先下降后上升。本研究发现,人参罹锈腐病后土壤中脲酶、漆酶活性降低,过氧化氢酶含量升高,可能是由于病原菌在内的土壤微生物会产生土壤酶,植株根际土壤中病原菌数量增加,则会导致土壤酶活发生变化[24]。本研究表明,病原菌数量与土壤理化性质的灰色关联度最高为0.497 5,与土壤酶活性的灰色关联度在0.365 1~0.421 6,可知人参患病后对土壤理化性质的影响较大。
综上所述,人参患病后首先直接影响参根内皂苷含量,其次对根系分泌物、土壤理化性质及土壤酶活产生影响,其中对酚酸类化感物质影响最大。而化感物质的积累以及土壤环境的改变均会影响土壤微生物的群落结构,进而加剧人参病害的发生,最终影响人参质量。因此改善土壤环境、调节土壤生态平衡,是提高人参质量的途径之一。
参 考 文 献
[1] 张道明. 人参皂苷Rg5对人食管癌细胞促凋亡及联合顺铂
抗肿瘤作用的研究[D]. 长春: 吉林大学, 2018.
ZHANG D M. Researches on anti-apoptosis effect of
ginsenoside Rg5 and anti-tumor effect combined with cisplatin
on human esophageal cancer cells [D]. Changchun: Jilin
University, 2018.
[2] 方斯文. 人参化感物质对土壤酶、微生物多样性的影响及
其在土壤中的迁移研究[D]. 长春: 吉林农业大学, 2012.
FANG S W. Ginseng allelochemicals impact on soil enzyme
activities and microbial diversity, as well as ginseng
allelochemicals mobility in soil [D]. Changchun: Jilin
Agricultural University, 2012.
[3] 王梓, 李勇, 丁万隆. 人参化感自毒作用与连作障碍机制研
究进展[J]. 中国现代中药, 2017, 19(7): 1040-1044.
WANG Z, LI Y, DING W L. Advances in allelopathic
autotoxicity and continuous cropping obstacle of Panax
ginseng [J]. Mod. Chin. Med., 2017, 19(7): 1040-1044.
[4] 黄玉茜, 韩晓日, 杨劲峰, 等.花生连作土壤微生物区系变化
研究[J]. 土壤通报, 2011, 42(3): 552-556.
HUANG Y Q, HAN X R, YANG J F, et al .. Studies on the
changes of soil microbial communities under peanuts continuous
cropping [J]. Chin. J. Soil Sci., 2011, 42(3): 552-556
[5] 李振方, 杨燕秋, 谢冬凤, 等. 连作条件下地黄药用品质及
土壤微生态特性分析[J]. 中国生态农业学报, 2012, 20(2):
217-224.
LI Z F, YANG Y Q, XIE D F, et al .. Effects of continuous
cropping on the quality of Rehmannia glutinosa L. and soil
micro-ecology [J]. Chin. J. Eco-Agric., 2012, 20(2): 217-224.
[6] ABBOROVA D, SAYYED R Z, AZIMOV A, et al .. Impact of
mineral fertilizers on mineral nutrients in the ginger rhizome
and on soil enzymes activities and soil properties [J]. Saudi J.
Biol. Sci., 2021, 28(9): 5268-5274.
[7] 丛微, 喻海茫, 于晶晶, 等. 人参种植对林地土壤细菌群落
结构和代谢功能的影响[J]. 生态学报, 2021, 41(1): 162-171.
CONG W, YU H M, YU J J, et al .. Effects of ginseng
cultivation on soil microbial community structure and
metabolic functions in forest land [J]. Acta Ecol. Sin., 2021,
41(1): 162-171.
[8] 李昕月, 付俊范, 魏晓兵, 等. 长白山区人参锈腐病发生危
害调查及杀菌剂田间药效试验[J]. 农学学报, 2015, 5(9):
69-72.
LI X Y, FU J F, WEI X B, et al .. Toxicity test and field control
effects of 11 new fungicides against cylindrocarpon destructans [J].
J. Agric., 2015, 5(9): 69-72.
[9] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000:
1-495.
[10] 关松荫. 土壤酶及其研究法[M]. 北京: 中国农业出版社,
1986:1-346.
[11] RAHMAN M, PUNJA Z K. Biochemistry of ginseng root
tissues affected by rusty root symptoms [J]. Plant Physiol.
Biochem., 2005, 43(12): 1103-1114.
[12] 刘延硕. 农田人参锈腐病影响因素的研究[D]. 长春: 吉林农
业大学, 2011.
LIU Y S. The study on influencing factors of the rust and rot of
farmland ginseng [D]. Changchun: Jilin Agricultural University,
2011.
[13] TAN G, LIU Y J, PENG S G, et al .. Soil potentials to resist
continuous cropping obstacle: three field cases [J/OL].
Environ. Res., 2021, 200: 111319 [2022-08-20]. https://doi.org/
10.1016/j.envres.2021.111319.
[14] 张爱华, 雷锋杰, 许永华, 等. 外源人参皂苷对人参种子萌
发和幼根抗氧化酶活性的影响[J]. 生态学报, 2009, 29(9):
4934-4941.
ZHANG A H, LEI F J, XU Y H, et al .. Effects of ginsenosides
on the germinating of ginseng seeds and on the activity of
antioxidant enzymes of the radicles of ginseng seedlings in
vitro [J]. Acta Ecol. Sin., 2009,29(9): 4934-4941.
[15] CHU L L, BAE H. Bacterial endophytes from ginseng and their
biotechnological application [J]. J. Ginseng Res., 2022, 46(1): 1-10.
[16] VIVIANE R, JANA B W, SUSANNE K, et al .. Correction to:
reduced microbial potential for the degradation of phenolic
compounds in the rhizosphere of apple plantlets grown in soils
affected by replant disease [J/OL]. Environ. Microbiome, 2019,
14(1): 9 [2022-08-20]. https://doi.org/10.1186/s40793-019-0346-2.
[17] 班洁静, 侯明生, 蔡丽. 土壤pH对芸薹根肿菌侵染及病害
发生的影响[J]. 植物保护, 2015, 41(6): 55-59.
BAN J J, HOU M S, CAI L. Effects of pH on Plasmodiophora
brassica infection and disease development [J]. Plant Prot.,
2015, 41(6): 55-59.
[18] XIE Z W, MA Q, PENG W Y, et al .. Research progress on
continuous cropping obstacle and green control of strawberry
[J/OL]. E3S Web of Conferences, 2021, 251: 02044 [2022-08-
20]. https://doi.org/10.1051/e3sconf/202125102044.
[19] DANIEL C S, KENDALL K, BRYAN C, et al .. Soil
acidification modifies soil depth-microbiome relationships in a
no-till wheat cropping system [J/OL]. Soil Biol. Biochem.,
2020, 149: 107939 [2022-08-20]. https://doi. org/10.1016/j.
soilbio.2020.107939.
[20] 洪艳华. 长期耕作对黑土理化性质及微生物群落结构的影
响[D]. 大庆:黑龙江八一农垦大学, 2021.
HONG Y H. Effects of long-term tillage on physicochemical
properties and microbial community structure of black soil [D].
Daqing: Heilongjiang Bayi Agricultural University, 2021.
[21] 韩海蓉, 李屹, 陈来生, 等. 设施辣椒连作对土壤理化性
状、酶活性及微生物区系的影响[J]. 中国土壤与肥料,
2021(3): 237-242.
HAN H R, LI Y, CHEN L S, et al .. Effects of continuous
pepper cultivation on soil physical and chemical properties,
enzyme activity and microbial flora [J]. Soil Fert. Sci. China,
2021(3): 237-242.
[22] 舒健虹, 蔡一鸣, 丁磊磊, 等. 不同放牧强度对贵州人工草
地土壤养分及活性有机碳的影响[J]. 生态科学, 2018, 37(1):
42-48.
SHU J H, CAI Y M, DING L L, et al .. Effects of different
grazing intensities on soil nutrient and active organic carbon in
Guizhou artificial grassland [J]. Ecol. Sci., 2018, 37(1): 42-48.
[23] 战宇, 张连学, 孟祥茹, 等. 不同盆栽人参土壤酚酸含量及
酶活性变化研究[J/OL]. 吉林农业大学学报, 2022 [2022-08-
20]. https://doi.org/10.13327/j.jjlau.2020.5987.
ZHAN Y, ZHANG L X, MENG X R, et al .. Changes of
phenolic acid content and enzyme activity in soil of different
pot ginseng [J/OL]. J. Jilin Agric. Univ., 2022 [2022-08-20].
https://doi.org/10.13327/j.jjlau.2020.5987.
[24] 李雪萍, 李建宏, 漆永红, 等. 青稞根腐病对根际土壤微生
物及酶活性的影响[J]. 生态学报, 2017, 37(17): 5640-5649.
LI X P, LI J H, QI Y H, et al .. Effects of naked barley root rot
on rhizosphere soil microorganisms and enzyme activity [J].
Acta Ecol. Sin., 2017, 37(17): 5640-5649.
(责任编辑:胡立霞)
