胰源性糖尿病的发病机制与诊治进展
2024-06-06王希望金晶晶王莹王晨晓张永华顾亚娇王晓
王希望 金晶晶 王莹 王晨晓 张永华 顾亚娇 王晓
摘要: 胰源性糖尿病是一种继发于胰腺外分泌疾病的糖尿病, 2014年被美国糖尿病学会正式提出, 其最常见的病因是慢性胰腺炎, 其次是胰腺癌。目前该病的临床误诊率极高, 且胰源性糖尿病患者相较于2型糖尿病患者有更高的死亡和再入院风险。因此, 充分了解、 并早期正确识别及诊断胰源型糖尿病, 对降低该病的致残率与病死率具有重要意义。本文全面总结了继发于胰腺炎及胰腺癌的胰源性糖尿病的可能发病机制、 诊治与管理等方面的研究进展。
关键词: 胰腺疾病; 糖尿病; 胰岛素; 诊断; 治疗学
基金项目: 河南省特色骨干学科中医学学科建设项目 (STG-ZYX02-202116); 河南省中医药科学研究专项课题 (2019JDZX2050)
Pathogenesis, diagnosis, and treatment of pancreatogenic diabetes
WANG Xiwang1, JIN Jingjing1, WANG Ying1, WANG Chenxiao2, ZHANG Yonghua2, GU Yajiao2, WANG Xiao2. (1. The First Clinical Medical College of Henan University of Chinese Medicine, Zhengzhou 450000, China;2. Spleen, Stomach and Hepatobiliary Department, The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, China)
Corresponding author: WANG Xiao, wangxiao1113@126.com (ORCID: 0000-0002-4676-2487)
Abstract:
Pancreatogenic diabetes is a type of diabetes mellitus secondary to exocrine pancreatic disease, and it was officially proposed by the American Diabetes Association in 2014, with chronic pancreatitis as the most common etiology, followed by pancreatic cancer. At present, the misdiagnosis rate of this disease is extremely high, and patients with pancreatogenic diabetes have a higher risk of death and readmission than patients with type 2 diabetes. Therefore, it is of great significance to fully understand, correctly identify, and diagnose pancreatogenic diabetes in the early state, so as to reduce the disability rate and mortality rate of this disease. This article reviews the advances in the possible pathogenesis, diagnosis, treatment, and management of pancreatic diabetes secondary to pancreatitis and pancreatic cancer.
Key words: Pancreatic Diseases; Diabetes Mellitus; Insulin; Diagnosis; Therapeutics
Research funding: Henan Characteristic Backbone Discipline Construction Project of Traditional Chinese Medicine (STG-ZYX02-202116); Special Project of Traditional Chinese Medicine in Henan Province (2019JDZX2050)
2014年, 美國糖尿病学会将由胰腺外分泌疾病导致的糖尿病命名为胰源性糖尿病或3c型糖尿病。胰源性糖尿病的综合发病率约6/100 000例[1] , 约占所有糖尿病的8%[2] 。胰源性糖尿最常见的病因是慢性胰腺炎, 约占79%; 其次是胰导管腺癌, 约占8%[3] 。据统计, 胰源性糖尿病的患病率显著高于1型糖尿病, 但仍显著低于2型糖尿病。胰源性糖尿病患者因各种原因导致的β细胞或α细胞缺乏, 其血糖水平难以控制, 故更易发生低血糖相关并发症, 甚至死亡。研究[4] 表明, 胰源性糖尿病患者相较于2型糖尿病患者的死亡和再入院风险更高。作为一种由胰腺外分泌疾病引起的糖尿病, 胰源性糖尿病常被误诊为2型糖尿病。研究[5-6]显示, 45%~90%的胰源性糖尿病患者被误归为2型糖尿病。目前,国内关于胰源性糖尿病的研究尚少, 充分了解、 正确识别并诊断胰源型糖尿对提高患者的生存及生活质量具有重要意义。
1 发病机制
1. 1 胰岛功能障碍, 胰岛素分泌不足 免疫介导下的胰岛功能障碍是胰源性糖尿病发生的关键机制。在胰腺炎早期, 高水平的细胞因子和应激性炎症环境导致β细胞功能障碍。胰腺实质因严重纤维化, 胰腺腺泡、 导管和神经束等有功能的胰腺组织最终被结缔组织取代,从而失去血管及分泌功能。而继发于胰腺癌的糖尿病不同于其他原因引起的糖尿病, 并非因纤维炎症破坏或胰腺切除引起, 而是由癌症释放的介质引起的副肿瘤效应[7] 。研究[8] 表明, 胰腺癌术后患者胰岛素抵抗和β细胞功能障碍均有所改善。加权基因共表达网络分析研究[9] 证实, 巨噬细胞活化和Toll样受体信号通路是胰源性糖尿病的重要病理生理学特征, 胰源性糖尿病患者巨噬细胞活化时, 胰岛中ITGAM (整合素αM)、 ITGB2 (整合素β2)、 PTPRC (蛋白酪氨酸磷酸酶受体C) 和CSF-1R(集落刺激因子-1受体) 的表达均显著上调, 上述生物标志物可能有助于胰源性糖尿病的辅助诊断。
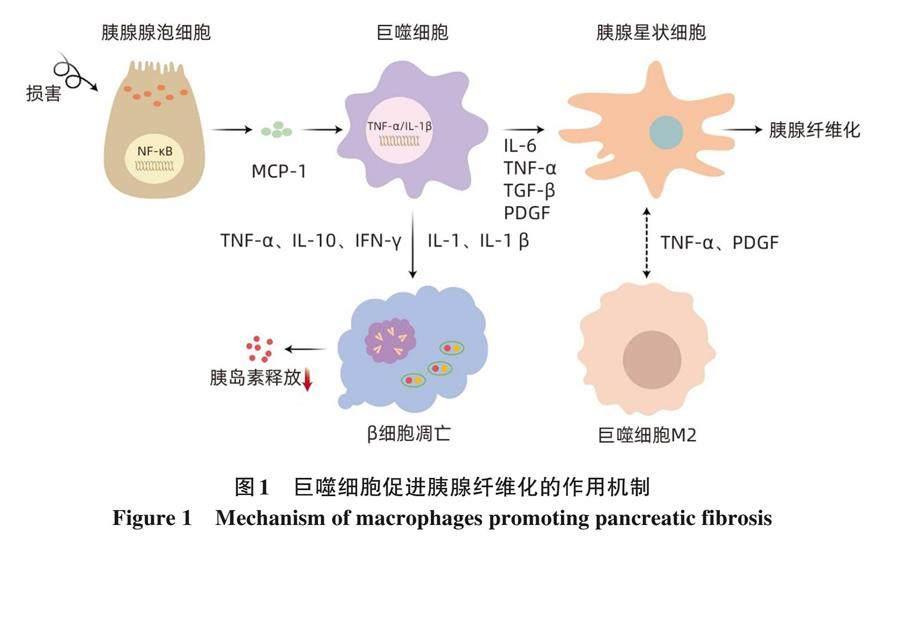
胰腺炎相关糖尿病的发生发展与巨噬细胞的募集和活化引发炎症细胞大量释放进而导致胰岛功能改变相关。研究[9] 表明, 巨噬细胞的早期募集和活化是加重胰腺细胞损坏的重要环节之一。巨噬细胞是慢性胰腺炎发展过程中浸润胰腺的主要炎症细胞, 在胰腺纤维化的进展中发挥重要作用 (图1)。在巨噬细胞和慢性胰腺炎的发病机制中, 核因子κB (NF-κB) 是巨噬细胞募集到胰腺的主要参与者之一, 受损的腺泡细胞可释放激活巨噬细胞的趋化因子和炎症因子, 促进NF-κB亚基P65和IL-6、 TNF-α、 单核细胞趋化蛋白-1等促炎细胞因子活化, 引起强烈的炎症反应[10]。促炎细胞因子如IL-10、TNF-α、 IFN-γ可抑制受葡萄糖刺激的胰岛素释放。高浓度IL-1受体和IL-1β可诱导β细胞凋亡[11], 而高浓度的 IFN- γ 可导致胰十二指肠同源盒 1(pancreatic and duodenal homebox 1, PDX-1) 或胰岛素启动子因子1的转录因子易位减少[12]。研究[13]表明, PDX-1对于胰腺细胞的发育至关重要, 其参与β细胞的成熟和十二指肠的分化。在慢性胰腺炎患者中, 由于PDX-1水平的降低, β細胞的分化和存活率也随之降低, 进而导致胰岛素的产生受损。另有研究[14] 发现肾上腺髓质素和泛酰巯基乙胺水解酶也是炎症产生的结果, 可能改变胰源性糖尿病患者的胰岛细胞功能。此外, 巨噬细胞与胰腺星状细胞(pancreatic stellate cell, PSC) 相互作用可促进慢性胰腺炎的进展, 巨噬细胞产生的转化生长因子-β和血小板源性生长因子 (PDGF) 是PSC的有效激活剂, 活化的PSC释放的细胞因子可能诱导胰腺巨噬细胞极化为M2表型,同时活化的M2巨噬细胞转化生长因子-β和PDGF高表达, 直接与PSC相互作用, 促进PSC的增殖和活化, 最终引起胰腺纤维化。
胰腺癌相关糖尿病患者的胰腺组织中存在高水平的钙卫蛋白 (S100A6/A8/A9) 和连接蛋白[15-17]。上述蛋白在胰腺导管癌患者的胰岛中过度表达, 在中性粒细胞和活化的巨噬细胞中可见大量S100A6/A8/A9, 原因可能在于胰腺癌早期单核细胞、 巨噬细胞、 中性粒细胞等细胞聚集。研究[18] 发现, 与健康人相比, 胰腺癌合并糖尿病患者的胰腺组织中S100A6的表达上调。有学者[16, 19]提出, 半乳糖凝集素-3、 基质金属蛋白酶-9、 脂联素和IL-1受体拮抗剂可作为鉴别2型糖尿病和胰腺癌相关糖尿病的生物标志物[20] 。
1. 2 胰岛素抵抗 胰岛素抵抗是糖尿病的一个突出特征[21], 同时也可能是胰腺炎后继发糖尿病的一个因素[22-23] 。研究[24] 证实, 胰源性糖尿病患者均存在肝胰岛素抵抗, 胰多肽应答不足在其中起着关键作用。目前, 胰多肽已被证实是一种调节肝脏胰岛素敏感性的血糖调节激素, 可以逆转胰腺炎中胰岛素受体的减少[25] ,对胰多肽缺乏的胰腺炎患者给予胰多肽可逆转肝胰岛素抵抗。除了胰岛素受体可用性改变外, 慢性胰腺炎患者肝胰岛素功能的改变也与肝细胞IκBβ和NF-κB的炎症激活有关, 阻止NF-κB活化可改善肝脏的胰岛素敏感性[26-27] 。
1. 3 促胰岛素效应减少——肠促胰岛素激素的减少胰高血糖素样肽-1 (glucagon-like peptide-1, GLP-1) 和葡萄糖依赖性促胰岛素多肽 (glucose-dependent insulinotropic polypeptide, GIP) 是肠道消化和吸收营养物质时释放的一种激素。GLP-1具有调节胰岛素分泌、 延缓胃排空等功能, 能够刺激胰岛素的释放, 抑制胰高血糖素的分泌, 降低食欲, 并减缓胃排空[28] 。研究[29-30] 发现, GLP-1还可促进胰腺β细胞的生长和分化, 保护β细胞的作用。GIP可促进胰岛素释放而抑制α细胞分泌胰高血糖素。这2种激素均可被二肽基肽酶-4迅速灭活。胰腺功能不全时营养物质吸收障碍, 肠促胰岛素激素释放减少, 餐后胰岛素也相应减少, 血糖相应升高。
1. 4 肠道菌群紊乱 肠道菌群在促进2型糖尿病的发生中发挥独特作用[31] 。肠道微生物群对人体的代谢和炎症反应具有调节功能[32] 。菌群紊乱与免疫细胞失调以及炎性细胞因子的水平有关, 因此被认为是不同炎症介导疾病的重要因素。慢性胰腺炎发生时的胰腺损伤和炎症反应可导致肠黏膜屏障完整性受损, 进而导致肠道微生物群发生变化[33] 。肠道生态系统和细菌代谢的变化反之导致糖尿病和代谢异常。因此, 肠道微生物群有可能在胰源性糖尿病的发生发展中发挥作用。印度一项研究[34] 招募的健康对照、 1型糖尿病患者、 2型糖尿病患者和继发于慢性胰腺炎的胰源性糖尿病患者中, 某些细菌物种的丰度存在明显组间差异, 包括瘤胃球菌属和粪杆菌门。另有研究[35] 在非糖尿病慢性胰腺炎患者中观察到粪杆菌丰度降低和血浆内毒素增加, 这一现象在糖尿病慢性胰腺炎中表现更为明显; 空腹和餐后血糖与粪杆菌丰度呈负相关, 而内毒素与血糖呈正相关, 与胰岛素呈负相关。上述结果提示, 肠道微生物疾病与慢性胰腺炎代谢变化相关。
1. 5 遗传因素 研究已经确定了慢性胰腺炎的特异性基因, 如PRSS1 (丝氨酸蛋白酶1), SPINK1 (丝氨酸肽酶抑制因子Kazal型1)、 CFTR (囊性纤维化跨膜传导调节因子)、 CTRC (胰凝乳蛋白酶-C) 和CASR (钙敏感受体)。PRSS1基因的突变增强了胰蛋白酶原的自身激活。研究[36] 表明, PRSS1外显子区域的突变与慢性胰腺炎继发糖尿病有关。在慢性胰腺炎患者中, 外显子异常有60%的概率发展为糖尿病[37] 。胰腺癌也具有遗传异质性, 早前已报道过的就包括CFTR、 BRCA1、 BRCA2、 CDKN2A、PALB2和ATM基因[39-40] 。有研究表明, 有胰腺癌家族史的个体患胰腺癌的风险更高。目前已鉴定出许多易感基因。BRCA2和PALB2是遗传性胰腺癌中最常见的突变基因。CFTR基因突变在年轻时发生胰腺癌的风险为中等[40] 。ATM基因突变与家族性胰腺癌易感性相关[41] 。
2 诊断
目前胰源性糖尿病尚无广泛认可的诊断标准。根据2021年美国糖尿病协会[42] 的叙述符合以下标准的患者可以做出诊断:(1) 符合糖尿病診断标准,(2) 胰腺分泌功能不全,(3) 影像学表明胰腺病理性改变,(4) 不具有1型糖尿病相关的自身免疫标志物。
3 治疗与管理
目前尚未形成系统的胰源性糖尿病的治疗指南, 这使胰源性糖尿病无法得到有效管理。此外在临床中胰源性糖尿病常被误诊为2型糖尿病, 这导致治疗效果常常不理想, 甚至会导致部分患者预后不良[4] 。目前急需提高临床医生对胰源性糖尿病的了解以帮助他们决定使用何种方案来控制患者的症状, 进而防止疾病恶化。目前可以从胰源性糖尿病发病机制入手, 对该型糖尿病进行基础的控制和治疗。针对胰源性糖尿病应严格控制血糖的升高、 解决外分泌功能不全、 预防并降低并发症, 同时还应重视饮食和营养的管理。
3. 1 控制血糖 二甲双胍和胰岛素是胰源性糖尿病最常用的药物, 这与近期的几项专家推荐[43-45] 一致。专家推荐将胰岛素作为继发于胰腺炎的糖尿病患者的一线治疗[46] , 因为这可以解决胰岛素缺乏的原发性缺陷。胰岛素可有效解决继发于慢性胰腺炎的晚期糖尿病患者胰岛素缺乏所引起的高血糖。然而, 使用胰岛素治疗胰源性糖尿病有使患者发生低血糖的风险, 尤其是对外周胰岛素敏感性可能增强的慢性胰腺炎患者来说, 另外Wu等[47] 的研究提及继发于慢性胰腺炎的糖尿病患者使用胰岛素有增加胰腺癌患病的风险。
二甲双胍作为一种胰岛素增敏剂能降低肝葡萄糖的输出并提高外周胰岛素敏感性, 常用于大多数2型糖尿病患者的一线治疗用药。Yang等[48] 的研究提及使用二甲双胍不仅可以减少每天降血糖所需的胰岛素量还具有保护β细胞的作用, 同时二甲双胍的抗肿瘤作用可能降低胰腺癌的发病风险[49-50] 。另外Maida等[51] 的实验表明二甲双胍能增强小鼠胰腺GLP-1和GIP受体的基因表达, 可对胰岛的胰岛素分泌产生有利影响。二甲双胍还被报道能够延长糖尿病合并非转移性胰腺癌患者的生存期。以上理论及研究可为二甲双胍作为胰源性糖尿病一线用药提供有力支撑。其他治疗2型糖尿病的药物如噻唑烷二酮类药物、 α-葡萄糖苷酶抑制剂、 磺脲类和二肽基肽酶-4抑制剂等也可用于胰源性糖尿病的治疗, 但考虑其副作用一般不作为常规治疗用药[52] 。目前尚无确切的治疗指南, 对于胰源性糖尿病的治疗只能在监测药物不良反应的基础上使用。
3. 2 解决外分泌功能不全 胰源性糖尿病患者常因合并外分泌功能不全而导致消化吸收障碍, 进而引发代谢并发症[53] 。临床上针对胰腺外分泌障碍常采用胰酶代替治疗的方法。即进食的同时给予胰酶, 并持续监测其疗效。胰酶有助于改善胰源性脂肪泻患者对胰岛素的反应, 并可逆转GIP反应性的下降。此外, 胰腺外分泌功能不全可能导致脂溶性维生素 (维生素A、 D、 E和K)的吸收障碍。Duggan等[54] 的研究提及慢性胰腺炎患者尤其是晚期疾病合并脂肪泻患者有极高概率会发生骨量丢失甚至骨质疏松。故应及时补充维生素D以预防代谢性骨疾病。
3. 3 日常营养与管理 一旦被诊断为糖尿病后应该立即改变生活方式。在日常生活中应该有意识地调整饮食结构, 应优先选择低升糖指数饮食并限制碳水类食物的摄入, 以尽可能减少高血糖发生的频率, 降低糖尿病并发症发生的风险。同时应避免饮用含糖饮料, 除非是发生低血糖时。肥胖患者同时应积极减重、 规律运动并戒烟戒酒。
3. 4 预防并降低并发症的发生 胰源性糖尿病又被称为 “脆性糖尿病”, 因胰腺炎症导致胰岛破坏, β细胞 (胰岛素)、 α细胞 (胰高血糖素)、 δ细胞 (生长抑素) 和PP细胞 (胰多肽) 丢失导致该类糖尿病患者的血糖较难控制[55] , 也因此胰源性糖尿病更容易发生低血糖及低血糖相关并发症。故在饮食管理中应优先预防患者经常发生的低血糖事件。促进低血糖的因素还包括碳水化合物吸收不良和不规律的饮食等。针对这些问题应加强对患者进行低血糖相关方面的教育, 同时患者还应进行血糖监测, 并详细记录血糖水平、 饮食摄入、 胰酶替代疗法使用情况和运动情况, 以积极调整饮食及药物的使用, 进而减少患者低血糖及其并发症的发生[56] 。
4 展望
现阶段由于缺乏对胰源性糖尿病系统的认识, 该类型糖尿病常会被误诊为2型糖尿病。但与2型糖尿病相比, 胰源性糖尿病患者的血糖控制更难, 低血糖发作更频繁、 胰岛素使用剂量多、 方案更复杂, 发生癌症的风险更高, 死亡年龄更早, 死亡风险更大。所以及时正确地诊断胰源性糖尿病的影响是深远的, 能大大提高此类型糖尿病患者的生存和生活质量并大大降低致残率和死亡率。遗憾的是目前胰源性糖尿病完整的发病机制尚不明确, 国内尚缺乏有关的流行病学数据, 尚无系统高效的用药安全性评估, 更未形成得到广泛认可的诊断、治疗和管理指南, 这无疑给临床工作带来了巨大的挑战, 给胰源性糖尿病患者带来巨大的伤痛, 给社会带来巨大的经济损失。期待未来能有更多相关方向的研究来解决目前临床存在的问题。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 王希望、 王晨晓、 张永华对研究思路或设计有关键贡献, 参与研究数据的获取、 分析、 解释工作;金晶晶、 王莹参与撰写及修改文章; 王晓、 顾亚娇对文章关键内容进行指导与修改。
参考文献:
[1] XIAO AY, TAN MLY, WU LM, et al. Global incidence and mortality of pancreatic diseases: A systematic review, meta-analysis, and meta-regression of population-based cohort studies[J]. Lancet Gastroenterol Hepatol, 2016, 1(1): 45-55. DOI: 10.1016/S2468-1253(16)30004-8.
[2] PETROV MS, BASINA M. DIAGNOSIS OF ENDOCRINE DISEASE: Diagnosing and classifying diabetes in diseases of the exocrine pancreas[J]. Eur J Endocrinol, 2021, 184(4): R151-R163. DOI: 10.1530/EJE-20-0974.
[3] HART PA, BELLIN MD, ANDERSEN DK, et al. Type 3c (pancreato?genic) diabetes mellitus secondary to chronic pancreatitis and pan?creatic cancer[J]. Lancet Gastroenterol Hepatol, 2016, 1(3): 226-237. DOI: 10.1016/S2468-1253(16)30106-6.
[4] CHO J, SCRAGG R, PETROV MS. Risk of mortality and hospitalization after post-pancreatitis diabetes mellitus vs type 2 diabetes mellitus: A population-based matched cohort study[J]. Am J Gastroenterol, 2019, 114(5): 804-812. DOI: 10.14309/ajg.0000000000000225.
[5] WOODMANSEY C, MCGOVERN AP, MCCULLOUGH KA, et al. Inci?dence, demographics, and clinical characteristics of diabetes of the exocrine pancreas (type 3c): A retrospective cohort study[J]. Dia?betes Care, 2017, 40(11): 1486-1493. DOI: 10.2337/dc17-0542.
[6] SANTOS R, COLEMAN HG, CAIRNDUFF V, et al. Clinical prediction models for pancreatic cancer in general and at-risk populations: A systematic review[J]. Am J Gastroenterol, 2023, 118(1): 26-40. DOI: 10.14309/ajg.0000000000002022.
[7] LIAO WC, CHEN PR, HUANG CC, et al. Relationship between pancre?atic cancer-associated diabetes and cachexia[J]. J Cachexia Sarco?penia Muscle, 2020, 11(4): 899-908. DOI: 10.1002/jcsm.12553.
[8] DONATH MY. Targeting inflammation in the treatment of type 2 dia?betes: Time to start[J]. Nat Rev Drug Discov, 2014, 13(6): 465-476. DOI: 10.1038/nrd4275.
[9] LI GQ, SUN JF, ZHANG J, et al. Identification of inflammation-related biomarkers in diabetes of the exocrine pancreas with the use of weighted gene co-expression network analysis[J]. Front Endocrinol (Lausanne), 2022, 13: 839865. DOI: 10.3389/fendo.2022.839865.
[10] ZHANG Y, ZHANG WQ, LIU XY, et al. Immune cells and immune cell-targeted therapy in chronic pancreatitis[J]. Front Oncol, 2023, 13: 1151103. DOI: 10.3389/fonc.2023.1151103.
[11] CASU AN, GRIPPO PJ, WASSERFALL C, et al. Evaluating the immu?nopathogenesis of diabetes after acute pancreatitis in the diabetes RElated to acute pancreatitis and its mechanisms study: From the type 1 diabetes in acute pancreatitis consortium[J]. Pancreas, 2022, 51(6): 580-585. DOI: 10.1097/MPA.0000000000002076.
[12] PONDUGALA PK, SASIKALA M, GUDURU VR, et al. Interferon-γ de?creases nuclear localization of pdx-1 and triggers β-cell dysfunction in chronic pancreatitis[J]. J Interferon Cytokine Res, 2015, 35(7): 523-529. DOI: 10.1089/jir.2014.0082.
[13] ELSHARKAWI I, PARAMBATH D, SABER-AYAD M, et al. Exploring the effect of epigenetic modifiers on developing insulin-secreting cells[J]. Hum Cell, 2020, 33(1): 1-9. DOI: 10.1007/s13577-019-00292-y.
[14] QIN WJ, KANG MX, LI C, et al. VNN1 overexpression in pancreatic cancer cells inhibits paraneoplastic islet function by increasing oxi?dative stress and inducing β -cell dedifferentiation[J]. Oncol Rep, 2023, 49(6): 120. DOI: 10.3892/or.2023.8557.
[15] HU FL, LOU N, JIAO JY, et al. Macrophages in pancreatitis: Mecha?nisms and therapeutic potential[J]. Biomed Pharmacother, 2020, 131: 110693. DOI: 10.1016/j.biopha.2020.110693.
[16] ANDERSEN DK, KORC M, PETERSEN GM, et al. Diabetes, pancreato?genic diabetes, and pancreatic cancer[J]. Diabetes, 2017, 66(5): 1103-1110. DOI: 10.2337/db16-1477.
[17] LIAO WC, HUANG BS, YU YH, et al. Galectin-3 and S100A9: Novel dia?betogenic factors mediating pancreatic cancer-associated diabetes[J]. Diabetes Care, 2019, 42(9): 1752-1759. DOI: 10.2337/dc19-0217.
[18] HU YF, ZENG N, GE YQ, et al. Identification of the shared gene sig?natures and biological mechanism in type 2 diabetes and pancreatic cancer[J]. Front Endocrinol (Lausanne), 2022, 13: 847760. DOI: 10.3389/fendo.2022.847760.
[19] XU TT, XU XX, LIU PC, et al. Transcriptomic analyses and potential therapeutic targets of pancreatic cancer with concomitant diabetes[J]. Front Oncol, 2020, 10: 563527. DOI: 10.3389/fonc.2020.563527.
[20] OLDFIELD L, EVANS A, RAO RG, et al. Blood levels of adiponectin and IL-1Ra distinguish type 3c from type 2 diabetes: Implications for earlier pancreatic cancer detection in new-onset diabetes[J]. EBio?Medicine, 2022, 75: 103802. DOI: 10.1016/j.ebiom.2021.103802.
[21] LEE SH, PARK SY, CHOI CS. Insulin resistance: From mechanisms to therapeutic strategies[J]. Diabetes Metab J, 2022, 46(1): 15-37. DOI: 10.4093/dmj.2021.0280.
[22] GILLIES N, PENDHARKAR SA, ASRANI VM, et al. Interleukin-6 is as?sociated with chronic hyperglycemia and insulin resistance in pa?tients after acute pancreatitis[J]. Pancreatology, 2016, 16(5): 748-755. DOI: 10.1016/j.pan.2016.06.661.
[23] OLESEN SS, SVANE HML, NICOLAISEN SK, et al. Clinical and bio?chemical characteristics of postpancreatitis diabetes mellitus: A cross-sectional study from the Danish nationwide DD2 cohort[J]. J Diabetes, 2021, 13(12): 960-974. DOI: 10.1111/1753-0407.13210.
[24] ASLAM M, VIJAYASARATHY K, TALUKDAR R, et al. Reduced pan?creatic polypeptide response is associated with early alteration of glycemic control in chronic pancreatitis[J]. Diabetes Res Clin Pract, 2020, 160: 107993. DOI: 10.1016/j.diabres.2019.107993.
[25] HENNIG R, KEKIS PB, FRIESS H, et al. Pancreatic polypeptide in pan?creatitis[J]. Peptides, 2002, 23(2): 331-338. DOI: 10.1016/s0196-9781(01)00605-2.
[26] CAI DS, YUAN MS, FRANTZ DF, et al. Local and systemic insulin re?sistance resulting from hepatic activation of IKK-beta and NF-kappaB[J]. Nat Med, 2005, 11(2): 183-190. DOI: 10.1038/nm1166.
[27] HEO YJ, CHOI SE, JEON JY, et al. Visfatin induces inflammation and insulin resistance via the NF-κB and STAT3 signaling pathways in hepatocytes[J]. J Diabetes Res, 2019, 2019: 4021623. DOI: 10.1155/2019/4021623.
[28] CHEANG JY, MOYLE PM. Glucagon-like peptide-1 (GLP-1)-based therapeutics: Current status and future opportunities beyond type 2 diabetes[J]. ChemMedChem, 2018, 13(7): 662-671. DOI: 10.1002/cmdc.201700781.
[29] TUDUR? E, L?PEZ M, DI?GUEZ C, et al. Glucagon-like peptide 1 analogs and their effects on pancreatic islets[J]. Trends Endocrinol Metab, 2016, 27(5): 304-318. DOI: 10.1016/j.tem.2016.03.004.
[30] DRUCKER DJ. Mechanisms of action and therapeutic application of glucagon-like peptide-1[J]. Cell Metab, 2018, 27(4): 740-756. DOI: 10.1016/j.cmet.2018.03.001.
[31] SALGA?O MK, OLIVEIRA LGS, COSTA GN, et al. Relationship be?tween gut microbiota, probiotics, and type 2 diabetes mellitus[J]. Appl Microbiol Biotechnol, 2019, 103(23-24): 9229-9238. DOI: 10.1007/s00253-019-10156-y.
[32] TILG H, ZMORA N, ADOLPH TE, et al. The intestinal microbiota fuel?ling metabolic inflammation[J]. Nat Rev Immunol, 2020, 20(1): 40-54. DOI: 10.1038/s41577-019-0198-4.
[33] TAO J, CHEEMA H, KESH K, et al. Chronic pancreatitis in a caerulein-in?duced mouse model is associated with an altered gut microbiome[J]. Pancreatology, 2022, 22(1): 30-42. DOI: 10.1016/j.pan.2021.12.003.
[34] TALUKDAR R, SARKAR P, JAKKAMPUDI A, et al. The gut microbi?ome in pancreatogenic diabetes differs from that of Type 1 and Type 2 diabetes[J]. Sci Rep, 2021, 11(1): 10978. DOI: 10.1038/s41598-021-90024-w.
[35] JANDHYALA SM, MADHULIKA A, DEEPIKA G, et al. Altered intesti?nal microbiota in patients with chronic pancreatitis: Implications in diabetes and metabolic abnormalities[J]. Sci Rep, 2017, 7: 43640. DOI: 10.1038/srep43640.
[36] ZOU WB, TANG XY, ZHOU DZ, et al. SPINK1, PRSS1, CTRC, and CFTR genotypes influence disease onset and clinical outcomes in chronic pancreatitis[J]. Clin Transl Gastroenterol, 2018, 9(11): 204. DOI: 10.1038/s41424-018-0069-5.
[37] LIU QC, ZHUANG ZH, ZENG K, et al. Prevalence of pancreatic dia?betes in patients carrying mutations or polymorphisms of the PRSS1 gene in the Han population[J]. Diabetes Technol Ther, 2009, 11(12): 799-804. DOI: 10.1089/dia.2009.0051.
[38] KIMURA H, KLEIN AP, HRUBAN RH, et al. The role of inherited patho?genic CDKN2A variants in susceptibility to pancreatic cancer[J]. Pan?creas, 2021, 50(8): 1123-1130. DOI: 10.1097/MPA.0000000000001888.
[39] YIN LD, WEI JS, LU ZP, et al. Prevalence of germline sequence variations among patients with pancreatic cancer in China[J]. JAMA Netw Open, 2022, 5(2): e2148721. DOI: 10.1001/jamanetworkopen.2021.48721.
[40] MCWILLIAMS R, HIGHSMITH WE, RABE KG, et al. Cystic fibrosis transmembrane regulator gene carrier status is a risk factor for young onset pancreatic adenocarcinoma[J]. Gut, 2005, 54(11): 1661-1662. DOI: 10.1136/gut.2005.074534.
[41] ABE K, KITAGO M, KITAGAWA Y, et al. Hereditary pancreatic can?cer[J]. Int J Clin Oncol, 2021, 26(10): 1784-1792. DOI: 10.1007/s10147-021-02015-6.
[42] ASSOCIATION AD. 2. classification and diagnosis of diabetes: Stan?dards of medical care in diabetes-2021[J]. Diabetes Care, 2021, 44(Suppl 1): S15-S33. DOI: 10.2337/dc21-S002.
[43] L?HR JM, DOMINGUEZ-MUNOZ E, ROSENDAHL J, et al. United European Gastroenterology evidence-based guidelines for the diag?nosis and therapy of chronic pancreatitis (HaPanEU) [J]. United European Gastroenterol J, 2017, 5(2): 153-199. DOI: 10.1177/2050640616684695.
[44] UC A, ANDERSEN DK, BELLIN MD, et al. Chronic pancreatitis in the 21st century-research challenges and opportunities: Summary of a national institute of diabetes and digestive and kidney diseases workshop[J]. Pancreas, 2016, 45(10): 1365-1375. DOI: 10.1097/MPA.0000000000000713.
[45] CUI YF, ANDERSEN DK. Pancreatogenic diabetes: Special consider?ations for management[J]. Pancreatology, 2011, 11(3): 279-294. DOI: 10.1159/000329188.
[46] BELLIN MD. Pancreatogenic diabetes in children with recurrent acute and chronic pancreatitis: Risks, screening, and treatment (mini-review) [J]. Front Pediatr, 2022, 10: 884668. DOI: 10.3389/fped.2022.884668.
[47] WU K, WANG WL, CHEN H, et al. Insulin promotes proliferation of pancreatic ductal epithelial cells by increasing expression of PLK1 through PI3K/AKT and NF- κB pathway[J]. Biochem Biophys Res Commun, 2019, 509(4): 925-930. DOI: 10.1016/j.bbrc.2018.12.182.
[48] YANG X, XU ZP, ZHANG CL, et al. Metformin, beyond an insulin sensitizer, targeting heart and pancreatic β cells[J]. Biochim Bio?phys Acta Mol Basis Dis, 2017, 1863(8): 1984-1990. DOI: 10.1016/j.bbadis.2016.09.019.
[49] WANG CC, ZHANG TP, LIAO Q, et al. Metformin inhibits pancreatic cancer metastasis caused by SMAD4 deficiency and consequent HNF4G upregulation[J]. Protein Cell, 2021, 12(2): 128-144. DOI: 10.1007/s13238-020-00760-4.
[50] CHEN K, QIAN WK, JIANG ZD, et al. Metformin suppresses cancer initia?tion and progression in genetic mouse models of pancreatic cancer[J]. Mol Cancer, 2017, 16(1): 131. DOI: 10.1186/s12943-017-0701-0.
[51] MAIDA A, LAMONT BJ, CAO X, et al. Metformin regulates the incretin receptor axis via a pathway dependent on peroxisome proliferator-acti?vated receptor- α in mice[J]. Diabetologia, 2011, 54(2): 339-349. DOI: 10.1007/s00125-010-1937-z.
[52] GOODARZI MO, PETROV MS. Diabetes of the exocrine pancreas: Im?plications for pharmacological management[J]. Drugs, 2023, 83(12): 1077-1090. DOI: 10.1007/s40265-023-01913-5.
[53] CAMPAGNOLA P, de PRETIS N, ZORZI A, et al. Chronic pancreati?tis and nutritional support[J]. Best Pract Res Clin Gastroenterol, 2023, 62-63: 101823. DOI: 10.1016/j.bpg.2023.101823.
[54] DUGGAN SN, SMYTH ND, MURPHY A, et al. High prevalence of os?teoporosis in patients with chronic pancreatitis: A systematic review and meta-analysis[J]. Clin Gastroenterol Hepatol, 2014, 12(2): 219-228. DOI: 10.1016/j.cgh.2013.06.016.
[55] DYTZ MG, MARCELINO PAH, de CASTRO SANTOS O, et al. Clini?cal aspects of pancreatogenic diabetes secondary to hereditary pancreatitis[J]. Diabetol Metab Syndr, 2017, 9: 4. DOI: 10.1186/s13098-017-0203-7.
[56] DUGGAN SN, EWALD N, KELLEHER L, et al. The nutritional manage?ment of type 3c (pancreatogenic) diabetes in chronic pancreatitis[J]. Eur J Clin Nutr, 2017, 71(1): 3-8. DOI: 10.1038/ejcn.2016.127.收稿日期:2023-08-02;
录用日期:2023-09-14
本文编辑:邢翔宇
