内质网应激蛋白激酶RNA样ER激酶(PERK)通路对肝星状细胞激活及Ⅰ型胶原蛋白表达的影响
2024-06-06黎凤炎刘泽峰夏雨艳王文娟李琪唐利瑕张国
黎凤炎 刘泽峰 夏雨艳 王文娟 李琪 唐利瑕 张国

摘要: 目的 探討内质网应激蛋白激酶RNA样ER激酶 (PERK) /真核生物翻译起始因子2α (eIF2α) 信号通路对肝星状细胞(HSC) 活化的影响。方法 收集11例肝穿刺病理提示S1~S4肝纤维化患者和9例肝血管瘤、 肝腺瘤患者术后周围正常肝组织病理切片, 进一步行组织免疫组化检测PERK、 eIF2α、 C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白 (CHOP) 表达情况; 使用不同浓度的内质网应激诱导剂毒胡萝卜素 (0、 125、 250、 500、 1 000 nmol/L) 作用于人HSC-LX2, 使用qRT-PCR检测PERK mRNA及Western Blot检测PERK、 肌醇需要酶1(IRE1)、 激活转录因子6(ATF6)、 CHOP及α平滑肌肌动蛋白(α-SMA) 表达水平。使用慢病毒转染构建PERK稳定过表达LX-2组及对照组, 并通过qRT-PCR检测PERK、 eIF2α、 α-SMA mRNA, Western Blot检测PERK、 p-eIF2α、 α-SMA蛋白表达, 免疫荧光检测胶Ⅰ型原蛋白 (COL1A1) 表达。符合正态分布的计量资料两组间比较采用成组t检验, 多组间比较采用单因素方差分析, 进一步两两比较采用LSD-t检验; 不符合正态分布的计数资料, 两组间比较采用Mann-Whitney U秩和检验。结果 与正常肝组织相比, 肝纤维化患者肝组织中PERK、 eIF2α及CHOP表达升高, 差异均有统计学意义 (Z=?3. 56、 t=?5. 75、 Z=?3. 52, P值均<0. 001)。不同浓度毒胡萝卜素作用后, 与溶媒组相比, 内质网相关蛋白PERK、 CHOP、 IRE1、 ATF6及α-SMA蛋白表达显著升高 (P值均<0. 05)。与对照空载慢病毒组相比, PERK稳定过表达组PERK mRNA、 eIF2α mRNA、 α-SMA mRNA表达及PERK、 p-eIF2α、 α-SMA蛋白表达明显升高 (P值均<0. 05)。细胞免疫荧光结果提示, PERK过表达组COL1A1表达升高 (P<0. 05)。结论 PERK过表达可诱导LX-2细胞α-SMA、 胶原蛋白COL1A1表达, 提示PERK信号通路可能是HSC活化的重要机制之一。
关键词: 内质网应激; 真核细胞起始因子2; 肝星状细胞; 胶原Ⅰ型
基金项目: 广西自然科学基金 (2023GXNSFBA026056); 广西壮族自治区人民医院青年基金 (QN2020-1)
Effect of the protein kinase RNA-like endoplasmic reticulum kinase pathway in endoplasmic reticulum stress on hepatic stellate cell activation and collagen type I expression
LI Fengyan , LIU Zefeng , XIA Yuyan , WANG Wenjuan , LI Qi , TANG Lixia , ZHANG Guo .
(1. Graduate School, Youjiang Medical University for Nationalities, Bose, Guangxi 533000, China; 2. Department of Gastroenterology, The People s Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China; 3. Department of Gastroenterology, Guangxi Hospital Division of The First Affiliated Hospital, Sun Yat-sen University, Nanning 530022, China)
Corresponding author: ZHANG Guo, zhangguogx@hotmail.com (ORCID: 0000-0001-7755-443X)
Abstract: Objective To investigate the effect of the protein kinase RNA-like endoplasmic reticulum kinase (PERK) /eukaryotic initiation factor 2α (eIF2α) pathway in endoplasmic reticulum stress on the activation of hepatic stellate cells (HSC) . Methods Pathological sections of normal liver tissue after surgery were collected from 11 patients with hepatic fibrosis (S1-S4) and 9 patients with hepatic hemangioma and hepatic adenoma confirmed by liver biopsy, and immunohistochemistry was used to measure the protein expression levels of PERK, eIF2α, and C/EBP homologous protein (CHOP) . Human HSC-LX2 cells were treated with different concentrations of the endoplasmic reticulum stress inducer thapsigargin (0, 125, 250, 500, and 1 000 nmol/L), and qRT-PCR was used to measure the mRNA expression level of PERK, while Western blot was used to measure the protein expression levels of PERK, inositol requiring protein 1 (IRE1), activating transcription factor 6 (ATF6), CHOP, and α-smooth muscle actin (α-SMA) . The method of lentivirus transfection was used to construct a PERK stable overexpression LX-2 group and a control group; qRT-PCR was used to measure the mRNA expression levels of PERK, eIF2α, and α -SMA, Western blot was used to measure the protein expression levels of PERK, phosphorylated eIF2α (p-eIF2α), and α-SMA, and immunofluorescence assay was used to measure the expression of collagen type I alpha 1 (COL1A1) . The independent samples t-test was used for comparison of normally distributed continuous data between two groups; a one-way analysis of variance was used for comparison between multiple groups, and the least significant difference t-test was used for further comparison between two groups. The Mann-Whitney U test was used for comparison of non-normally distributed continuous data between two groups. Results Compared with normal liver tissue, the liver tissue of patients with hepatic fibrosis had significantly higher expression levels of PERK, eIF2α, and CHOP (Z=?3.56,t=?5.75, Z=?3.52, all P<0.001) . Compared with the solvent group, the groups treated with different concentrations of thapsigargin had significant increases in the expression levels of the endoplasmic reticulum-associated proteins PERK, CHOP, IRE1, ATF6, and α-SMA (all P<0.05) . Compared with the control group, the PERK stable overexpression group had significant increases in the mRNA expression levels of PERK, eIF2α, and α-SMA and the protein expression levels of PERK, p-eIF2α, and α-SMA (all P<0.05), and immunofluorescence assay showed a significant increase in the expression level of COL1A1 in the PERK stable overexpression group (P<0.05) . Conclusion PERK overexpression can induce the expression of α-SMA and COL1A1 in LX-2 cells, suggesting that the PERK signaling pathway might be one of the important mechanisms of HSC activation.
Key words: Endoplasmic Reticulum Stress; Eukaryotic Initiation Factor-2; Hepatic Stellate Cells; Collagen Type I
Research funding: Guangxi Natural Science Foundation Project (2023GXNSFBA026056); The People s Hospital of Guangxi Zhuang Autonomous Region Youth Fund project (QN2020-1)
肝纤维化是许多慢性肝病的共同表现, 各种不良因素持续刺激造成肝脏结构和功能改变, 病变持续发展将最终引起肝硬化、 肝癌等严重并发症[1] 。全球健康负担数据[2] 显示, 肝硬化和其他慢性肝病仍是全球发病率和病死率的主要原因。因此, 深入研究肝纤维化的发病机制对疾病早期干预和阻断肝纤维化进程意义重大。内质网应激是内质网蛋白质折叠能力失衡, 引起非折叠蛋白在内质网腔聚集的现象。当内质网正常功能受损时将引起内质网应激, 并通过3种不同跨膜蛋白, 即蛋白激酶RNA样ER激酶 (protein kinase RNA-like endoplasmicreticulum kinase, PERK), 肌醇需要蛋白1 (inositol requiringprotein1, IRE1)及激活转录因子 6(activating transcriptionfactor 6, ATF6), 启动非折叠蛋白反应(unfolded protein response, UPR) [3]。近年研究[4]发现, 内质网应激参与肝纤维化发生发展及逆转过程, 可引起肝细胞凋亡、 促进肝星状细胞 (HSC) 活化引起肝纤维化发生发展; 另一方面内质网应激可导致HSC凋亡, 利于肝纤维化逆转。因此, 本研究聚焦于PERK信号通路对肝纤维化影响, 通过构建内质网应激HSC-LX2细胞模型, 探讨内质网应激对HSC激活及Ⅰ型胶原蛋白 (collagens type Ⅰ,COL1A1) 表达的影响; 同时通过过表达PERK蛋白, 探索内质网应激PERK信号通路在HSC活化及COL1A1表达中的作用。
1 材料与方法
1. 1 实验细胞及主要试剂 HSC-LX2细胞由纽约西奈山医学院Friedman教授赠送。主要试剂: 毒胡萝卜素(Thapsigargin, Tg, Sigma公司); 携带PERK的Tet-on过表达慢病毒和对照慢病毒 (上海吉凯生物科技有限公司);免疫组化通用二步法试剂盒 (中杉金桥); RNA快速提取试剂盒 (上海奕杉生物); 荧光定量PCR试剂盒、 cDNA逆转录体系试剂盒 (TaKara生物公司); 一抗: α平滑肌肌动蛋白(α-SMA)(CST 19245S)、 PERK(CST 3192S)、 IRE1(CST 3294S)、 磷酸化真核生物翻译起始因子2α (phospho eukaryotic initiation factor 2α, p-eIF2α)、 C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白 (C/EBP homologous protein,CHOP)(CST 2895S)、ATF6(CST 65880S);COL1A1 (武汉三鹰 67288-1-lg)、 β-actin (武汉三鹰 10077-1-AP)、 α-Tublin (武汉三鹰 66031-1-lg)、 ATF-4 (武汉三鹰 10835-1-AP); Alexa Fluor 555 (Cell Signaling公司); 山羊抗鼠、 山羊抗兔二抗及增强化学发光试剂盒 (Affinity公司); 聚偏二氟乙烯膜 (Millipore公司); 高糖DMEM培养基 (Gibco), 澳洲胎牛血清 (Gibco), 4%组织细胞固定液、TritonX-100、 青链霉素 (penicillin-streptomycin, PS, Solarbio)qRT-PCR所用引物均由武汉金开瑞公司设计合成。
1. 2 方法
1. 2. 1 患者分组及组织取样 收集广西壮族自治区人民医院既往诊断为慢性病毒性肝炎且病理诊断为肝纤维化的患者, 排除HIV或酗酒、 由于其他原因引起的肝损伤及合并肝癌患者。根据慢性肝炎分级分期标准对患者肝纤维化程度进行分级分期。本研究共收集11例慢性乙型肝炎合并肝纤维化患者的病理切片, 其中G2S1患者3例, G3S3患者4例, G3S4患者2例, G4S4 2例。此外, 收集了9例行手术切除肝血管瘤或肝腺瘤周围的正常肝组织病理切片。
1. 2. 2 免疫组化 将肝组织经过福尔马林固定、 乙醇脱水、 石蜡包埋、 切片、 烘烤 (68 ℃ 120 min)、 二甲苯脱蜡、 100%~70%梯度乙醇水化、 抗原修复 (柠檬酸盐高压修复4 min)、 封闭、 孵育一抗 (4 ℃过夜)、 孵育二抗、 DAB染色5 min、 苏木素复染5 min、 乙醇脱水后使用中性树脂胶封片。于显微镜下观察并拍照, 结果由2位研究者在未知切片信息的情况下进行, 每张切片随机选取5个高倍视野 (×200), 排除非特异性染色后进行评分; 结合细胞着色比例及染色颜色强度進行评分: 细胞着色比例<5%为0分; 5%~25%为1分; 26%~50%为2分; 51%~75%为3分; 76%~100%为4分。阳性强度按照如下方式进行打分: 无色记为0分, 浅黄色记1分, 棕黄色记2分, 棕褐色记3分; 将上述2个评分乘积作为该视野得分; 计算2位研究者评出每个视野的平均分, 若评分接近取平均值为最终得分, 若评分相差较远, 则请第3位研究者进行评分, 再计算平均值。最终获得3分以上者判断为阳性表达。
1. 2. 3 HSC-LX2细胞的分组及干预 细胞常规复苏后, 用含10%胎牛血清+1%PS的DMEM培养基在37 ℃、5% CO2的培养箱中进行细胞培养。将对数生长期的LX2细胞分5组接种在6孔培养板; 待细胞贴壁生长后, 按溶媒对照组, Tg 125 nmol/L、 Tg 250 nmol/L、 Tg 500 nmol/L、Tg 1 000 nmol/L组加入药物干预24 h。
1. 2. 4 慢病毒构建及转染 将生长良好的LX2细胞培养于6孔板, 接种密度为3×105/孔, 当细胞生长至汇合度30%~40%时感染慢病毒, 同时将培养基更换为不含血清和双抗的DMEM高糖培养基, 培养8~16 h后, 更换成完全培养基, 同时设置对照空载慢病毒 (NC) 组。48 h后加入嘌呤霉素进行筛选, 获得稳定株后, 根据Tet-on载体要求, 加入多西环素 (终浓度为0. 6 ?g/mL) 诱导48 h。随后提取总蛋白及RNA行qRT-PCR及蛋白免疫印迹法 (Western Blot) 验证。
1. 2. 5 Western Blot实验 细胞铺板干预24 h结束后,应用高效RIPA裂解液提取总蛋白, 用BCA法测定蛋白浓度, 经SDS-PAGE电泳分离蛋白质, 经转膜后将分离后的条带转至聚偏二氟乙烯膜上, 用快速封闭液 (碧云天公司) 室温下封闭15 min, TBST洗膜3次, 每次5 min,4 ℃下孵育一抗过夜。TBST洗膜3次, 每次10 min, 37 ℃孵育二抗1 h, TBST洗膜3次, 每次10 min, 应用双色红外激光成像系统扫描, 以β-actin或α-Tublin为内参计算目标蛋白相對表达量。
1. 2. 6 细胞免疫荧光 将生长良好的PERK过表达及空载病毒组细胞接种于装有盖玻片的6孔板内, 完全贴壁后, 用4%组织细胞固定液固定15 min后PBS洗3次,0. 5% TritonX-100通透30 min, PBS洗3次, 10%山羊血清封闭30 min, 4 ℃下孵育一抗过夜。PBST洗3次, 荧光二抗避光37 ℃孵育1 h, PBST洗3次, 加入DAPI复染, PBST洗2次, 荧光猝灭剂封片后置于荧光显微镜下观察。
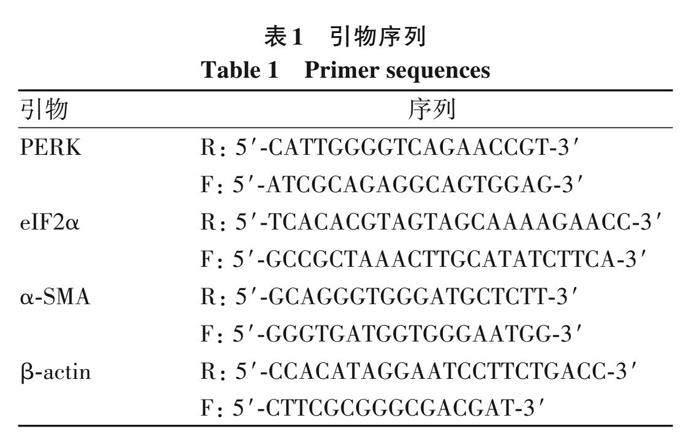
1. 2. 7 qRT-PCR 细胞铺板干预24 h后, 按RNA快速提取试剂盒说明书提取细胞总RNA, 按逆转录试剂盒说明书步骤将RNA转录成cDNA, 然后以cDNA为模板进行 qRT-PCR, 反应体系 TB Green ? Premix Ex Taq ? Ⅱ 10 ?L, 上下引物各0. 8 ?L, dH2O 6 ?L, cDNA 2 ?L。反应程序: 95 ℃预变性30 s; 95 ℃ 5 s, 60 ℃ 34 s, 扩增40个循环。引物序列见表1。以β-actin为内参, 应用2-△△Ct法计算目标因子的相对表达量。
1. 3 统计学方法 采用SPSS 24. 0统计学软件进行数据分析。符合正态分布的计量资料以x ˉ±s表示, 两组间比较采用成组t检验, 多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验; 不符合正态分布的计量资料以 M(P25~P75)表示, 两组间比较采用 MannWhitney U秩和检验。P<0. 05为差异有统计学意义。
2 结果
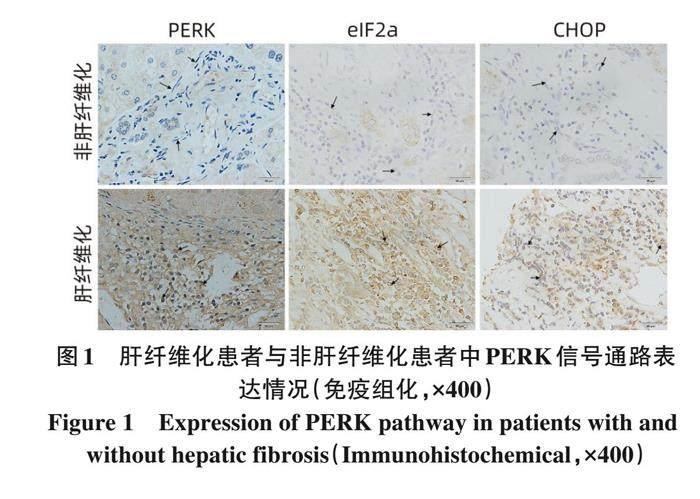
2. 1 肝组织中内质网应激PERK/eIF2α/CHOP通路蛋白的表达 肝纤维化患者肝组织病理切片中PERK、 eIF2α、CHOP细胞着色比例及染色强度得分均大于非肝纤维化患者 (P值均<0. 001)。与非肝纤维化肝组织相比, 肝纤维化患者肝组织样本中内质网应激PERK通路相关蛋白PERK、 eIF2α及CHOP在纤维化扩大的汇管区HSC细胞浆表达异常升高, 差异有统计学意义 (P<0. 001)(表2, 图1), 提示内质网应激可能参与肝纤维化过程。
2. 2 Tg诱导内质网应激作用下HSC-LX2中内质网相关蛋白表达情况 不同浓度Tg在不同时间点干预后, LX-2细胞形态变化不明显, 但LX-2细胞生长速度明显被抑制, 且作用时间越长, Tg浓度越大, 细胞被抑制越明显 (图2a)。Tg诱导内质网应激后行qRT-PCR检测, 结果显示,相较于空白组 (0 nmol/L), 250、 500、 1 000 nmol/L的Tg诱导下跨膜蛋白PERK表达升高, 差异均有统计学意义 (P值均<0. 05)(图2b)。Western Blot结果显示, 不同浓度Tg诱导下IRE1、 PERK、 CHOP表达均升高, 500、 1 000 nmol/L的Tg诱导下ATF6表达升高, 差异均有统计学意义 (P值均<0. 05), 提示Tg诱导LX2细胞内质网应激模型构建成功 (图2c、 d)。
2. 3 Tg诱导内质网应激下HSC-LX2中α-SMA表达情况qRT-PCR结果显示, 相较于空白组, 不同浓度的Tg诱导下α-SMA表达水平升高, 差异均有统计学意义 (P值均<0. 01)(图3a)。Western Blot结果显示, 不同浓度Tg刺激后LX2细胞α-SMA表达水平升高, 差异有统计学意义 (P<0. 05)(图3b), 提示内质网应激参与LX2细胞活化过程。
2. 4 PERK信号通路对HSC-LX2细胞活化的影响 过表达PERK慢病毒转染LX2细胞后, 光学显微镜观察LX2细胞形态发生微小改变, 无细胞区较对照组增加 (图4a); qRT-PCR结果显示, PERK过表达 (PERK OE) 组中PERK和eIF2αmRNA表达明显升高 (图4b、 c); 进一步行Western Blot实验结果提示, PERK OE组中PERK及p-eIF2α表达升高 (P<0. 05)(图4d), 提示PERK信号通路被激活。细胞免疫荧光结果提示, 与 NC 组相比, 过表达PERK组COL1A1表达升高 (P<0. 05)(图5a); qRT-PCR及Western Blot结果提示, PERK信号通路激活后LX2活化指标α-SMA的mRNA和蛋白表达升高(P<0. 05)(图5b、 c)。提示激活PERK相关通路能促进LX2细胞的活化及增加COL1A1表达。
3 讨论
肝纤维化是继发于各种慢性肝损伤的组织修复反应, 持续的肝纤维化可引起肝细胞功能障碍、 门静脉高压等一系列严重并发症[5] 。肝纤维化的本质主要是肝内细胞外基质 (ECM) 过度沉积, 而ECM主要由活化的HSC产生[6]。当肝损伤或体外培养时, HSC被激活分化为肌成纤维细胞, 肌成纤维细胞的大量增殖使ECM生成增加, 加之其降解失衡, 最终发展为肝纤维化[7]。而ECM相关成分α-SMA、 COL1A1和Ⅲ型胶原蛋白也随着纤维化程度加深而表达升高[8]。因此, α-SMA 及COL1A1均可作为HSC的活化标志物。
内质网是生物细胞的重要细胞器, 广泛参与蛋白质合成、 脂质合成转运及Ca2+平衡的维持等重要生物学过程中。当细胞受到缺氧、 损伤、 炎症等有害刺激时, 内质网功能紊乱诱导内质网应激发生。内质网应激诱导剂Tg是SERCA (sarco/endoplasmic reticulum Ca2+-ATPase) 泵特异性抑制剂, 可抑制内质网Ca2+-ATP酶, 阻止内质网从细胞质中重吸收Ca2+, 导致内质网中Ca2+的消耗, 从而抑制钙依赖性分子伴侣, 导致错误折叠蛋白质的累加, 继而导致内质网应激。目前常用UPR判断内质网应激的发生[9-10] 。本研究采用Tg诱导LX2细胞建立内质网应激细胞模型, 探讨内质网应激与HSC活化之间的潜在关系。结果表明, 从125~1 000 nmol/L不同浓度Tg刺激下均可明显增加内质网应激相关蛋白PERK/CHOP、 IRE1、 ATF6表达升高, 3条UPR通路激活, 表明Tg诱导内质网应激细胞模型构建成功。LX2细胞活化标志物α-SMA表达升高, 提示内质网应激可能参与LX2细胞的活化过程。
PERK相关通路是UPR的经典途径, 内质网应激时,PERK被葡萄糖调节蛋白78释放并激活, 随后催化eIF2α,使其发生磷酸化, 抑制翻译的启动及抑制蛋白合成, 促进CHOP的转录和表达[11] 。研究[12] 发现, 相较于轻度肝纤维化组织, 严重肝纤维化组织中PERK磷酸化水平升高;在小鼠肝纤维化模型中的PERK磷酸化增加与HSC激活标记的表达升高呈正相关[13] ; 小分子多肽激素鸢尾素可通过抑制原代HSC内PERK/eIF2α/CHOP途径抑制异质核磷酸化A1的降解缓解肝纤维化 [14] 。本研究发现, 相较于非肝纤维化患者, 肝纤维化患者PERK/eIF2α/CHOP通路相关蛋白表达升高, 提示PERK通路可能参与肝纤维化发生。为进一步验证, 本研究采用慢病毒干扰技术构建PERK过表达的LX2细胞株, 结果显示, 相较于空载病毒组, PERK过表达组PERK、 p-eIF2α表达水平升高, PERK通路被激活, 同时HSC活化标志物α-SMA及COL1A1表达水平升高, 提示PERK介导的信号通路参与HSC活化过程及增加Ⅰ型胶原蛋白表达。
本研究存在一定不足, 未针对Tg诱导的内质网应激进一步干预观察, 也缺少动物模型上相应表型的进一步验证。综上所述, 本研究通过对比肝纤维化患者与非肝纤维化患者病理切片免疫组化结果, 构建LX2内质网应激模型以及构建PERK过表达LX2细胞株, 初步探讨内质网应激PERK信号通路在HSC活化及Ⅰ型胶原蛋白表达中的影响, 为探索肝纤维化发病机制及临床寻找逆转肝纤维的治疗靶点提供新思路。
伦理学声明: 本研究方案于2022年8月12日经广西壮族自治区人民医院伦理委员会审批, 批号: KY-KJT-2023-310。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 黎凤炎负责设计论文框架, 實验实施, 收集数据, 资料分析, 撰写论文; 刘泽峰参与课题设计, 资料分析; 夏雨艳参与实验实施, 收集数据; 王文娟参与资料分析; 李琪、 唐利瑕参与统计分析; 张国负责研究选题, 指导文章撰写及修改。黎凤炎、 刘泽峰对本文贡献等同, 同为第一作者。
参考文献:
[1] HE YH, YAN YJ, ZHANG SF. Quantitative liver surface nodularity score based on imaging for assessment of early cirrhosis in patients with chronic liver disease: A protocol for systematic review and meta-analysis[J]. Medicine, 2021, 100(4): e23636. DOI: 10.1097/MD.0000000000023636.
[2] GBD 2017 Cirrhosis Collaborators. The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet Gastroenterol Hepatol, 2020, 5(3): 245-266. DOI: 10.1016/S2468-1253(19)30349-8.
[3] ZHANG J, GUO JF, YANG NN, et al. Endoplasmic reticulum stress-mediated cell death in liver injury[J]. Cell Death Dis, 2022, 13(12): 1051. DOI: 10.1038/s41419-022-05444-x.
[4] XIA SW, WANG ZM, SUN SM, et al. Endoplasmic reticulum stress and protein degradation in chronic liver disease[J]. Pharmacol Res, 2020, 161: 105218. DOI: 10.1016/j.phrs.2020.105218.
[5] SHAN S, ZHAO LH, MA H, et al. Definition, etiology, and epidemiol?ogy of liver cirrhosis[J]. J Clin Hepatol, 2021, 37(1): 14-16. DOI: 10.3969/j.issn.1001-5256.2021.01.003.
单姗, 赵连晖, 马红, 等. 肝硬化的定义、病因及流行病学[J]. 临床肝胆病杂志, 2021, 37(1): 14-16. DOI: 10.3969/j.issn.1001-5256.2021.01.003.
[6] XU LY, WEI ST, DONG Y, et al. Regulatory effect of lncRNA MALAT1 on activation of hepatic stellate cell and its mechanism[J]. J Jilin Univ Med Ed, 2023, 49(3): 697-705. DOI: 10.13481/j. 1671-587X.20230319.
徐菱遥, 魏书堂, 董勇, 等. lncRNA MALAT1对肝星状细胞活化的调节作用及其机制[J]. 吉林大学学报(医学版), 2023, 49(3): 697-705. DOI: 10.13481/j.1671-587X.20230319.
[7] TSUCHIDA T, FRIEDMAN SL. Mechanisms of hepatic stellate cell activation[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(7): 397-411. DOI: 10.1038/nrgastro.2017.38.
[8] SUN DL, GUO JB, WANG DD, et al. Effect of exosomes derived from mesenchymal stem cells on the proliferation and activation of hepatic stellate cells in vitro[J]. J Pract Hepatol, 2023, 26(1): 11-14. DOI: 10.3969/j.issn.1672-5069.2023.01.004.
孙东磊, 郭金波, 王丹丹, 等. 间充质干细胞外泌體对体外肝星状细胞增殖和活化的影响[J]. 实用肝脏病杂志, 2023, 26(1): 11-14. DOI: 10.3969/j.issn.1672-5069.2023.01.004.
[9] FABRE B, LIVNEH I, ZIV T, et al. Identification of proteins regulated by the proteasome following induction of endoplasmic reticulum stress[J]. Biochem Biophys Res Commun, 2019, 517(2): 188-192. DOI: 10.1016/j.bbrc.2019.07.040.
[10] PETERKOV? L, KMON??KOV? E, RUML T, et al. Sarco/endoplasmic reticulum calcium ATPase inhibitors: Beyond anticancer perspective[J]. J Med Chem, 2020, 63(5): 1937-1963. DOI: 10.1021/acs. jmed?chem.9b01509.
[11] IBRAHIM IM, ABDELMALEK DH, ELFIKY AA. GRP78: A cell's re?sponse to stress[J]. Life Sci, 2019, 226: 156-163. DOI: 10.1016/j.lfs.2019.04.022.
[12] KOO JH, LEE HJ, KIM W, et al. Endoplasmic reticulum stress in he?patic stellate cells promotes liver fibrosis via PERK-mediated degra?dation of HNRNPA1 and up-regulation of SMAD2[J]. Gastroenterol?ogy, 2016, 150(1): 181-193. e8. DOI: 10.1053/j.gastro.2015.09.039.
[13] MAIERS JL, MALHI H. Endoplasmic reticulum stress in metabolic liver diseases and hepatic fibrosis[J]. Semin Liver Dis, 2019, 39(2): 235-248. DOI: 10.1055/s-0039-1681032.
[14] LIAO X, ZHAN W, LI R, et al. Irisin ameliorates endoplasmic reticu?lum stress and liver fibrosis through inhibiting PERK-mediated desta?bilization of HNRNPA1 in hepatic stellate cells[J]. Biol Chem, 2021, 402(6): 703-715. DOI: 10.1515/hsz-2020-0251.
收稿日期:2023-10-12; 录用日期:2023-11-30
本文编辑:邢翔宇
