NLRP3基因敲减对高脂高糖饮食诱导的非酒精性脂肪性肝炎小鼠模型的影响
2024-06-06黄倩王卓媛安梓铭辛鑫孙沁梅苟小军胡义扬冯琴
黄倩 王卓媛 安梓铭 辛鑫 孙沁梅 苟小军 胡义扬 冯琴

摘要: 目的 探討NOD样受体热蛋白结构域相关蛋白3 (NLRP3) 基因敲减对高脂高糖诱导的非酒精性脂肪性肝炎 (NASH) 小鼠模型的影响。方法 将44只小鼠随机分为正常饮食组 (CON) 20只, 高脂高糖造模组 (HFHC) 24只。造模14周末, 随机选取4只HFHC组小鼠进行腺相关病毒9 (AAV9) 尾静脉注射预实验, 4周后验证NLRP3敲减模型是否成功。18周末确认敲减成功后, 对剩余40只小鼠进行AAV9一次性尾静脉注射, 分为CON+NLRP3敲减阴性对照组 (CON+NLRP3-NC)、 CON+NLRP3敲减组 (CON+NLRP3-KD)、 HFHC+NLRP3-NC及HHFHC+NLRP3-KD组, 每组10只, 继续造模6周。24周末取材观察炎症小体活化效应, 检测小鼠体质量、 肝质量、 肝指数及糖代谢 (空腹血糖、 空腹胰岛素及HOMA-IR指数) 指标; 检测小鼠肝脂质含量 (肝组织TG及油红O染色)、 肝脏炎症 (血清ALT活性、 HE染色及炎症相关基因) 及肝纤维化 (天狼星红染色及纤维化相关基因) 指标。计量资料多组间比较使用单因素方差分析, 进一步两两比较采用LSD-t检验。结果 与CON+NLRP3-NC组相比, Western Blot结果提示, HFHC+NLRP3-NC组的NLRP3、 pro-Caspase1、 Caspase1、 ASC及IL-1β蛋白水平均升高, HFHC+NLRP3-KD组均降低 (P值均<0. 05); HFHC+NLRP3-NC组小鼠体质量、 肝质量、 肝指数及糖代谢指标均有不同程度升高, HFHC+NLRP3-KD组均显著改善 (P值均<0. 05); 在肝脂肪沉积方面, 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组肝脏TG明显增高, 油红O染色显示大量红色脂滴, HFHC+NLRP3-KD组肝脏TG及肝脂滴数量显著减少 (P值均<0. 01); 在肝脏炎症方面, HFHC+NLRP3-NC组血清ALT, 非酒精性脂肪性肝病活动度 (NAS) 评分及炎症相关基因均较CON+NLRP3-NC组明显升高, HFHC+NLRP3-KD组均明显降低 (P值均<0. 01); 在肝纤维化方面, HFHC+NLRP3-NC组肝胶原纤维面积以及纤维化相关基因均较CON+NLRP3-NC组明显升高, HFHC+NLRP3-KD组纤维化相关基因均明显降低 (P值均<0. 05), 胶原纤维面积虽有降低趋势但差异无统计学意义(P>0. 05)。结论 NLRP3基因敲减可显著改善高脂高糖饮食诱导的NASH小鼠模型肝脂肪沉积及炎症。
关键词: 非酒精性脂肪性肝病; NLR家族, 热蛋白结构域包含蛋白3; 膳食, 高脂; 炎症; 小鼠, 近交C57BL
基金项目: 国家自然科学基金面上项目 (82174040); 上海中医药大学关键领域优秀博士培育项目 (2-089); 上海市宝山区
科学技术委员会医学卫生项目 (21-E-63)
Effect of NOD?like receptor family pyrin domain containing 3 knockdown on a mouse model of nonalcoholic
steatohepatitis induced by high-fat high-carbohydrate diet
HUANG Qian1a, 1b, 2, 3, WANG Zhuoyuan1a, 1b, 2, 3, AN Ziming1a, 1b, 2, 3, XIN Xin1a, 2, 3, SUN Qinmei1a, 2, 3, GOU Xiaojun4, HU Yiyang1a, 2, 3, FENG Qin1a, 1b, 2, 3. (1. a. Institute of Liver Diseases, b. Experimental Center for Science and Technology, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;2. Shanghai Key Laboratory of Traditional Chinese Clinical Medicine, Shanghai 201203, China;3. Key Laboratory of Liver and Kidney Diseases, Ministry of Education, Shanghai 201203, China;4. Baoshan District Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai 201900, China)
Corresponding author: FENG Qin, fengqin@shutcm.edu.cn (ORCID: 0000-0002-4641-1636)
Abstract: Objective To investigate the effect of NOD-like receptor family pyrin domain containing 3 (NLRP3) knockdown on amouse model of nonalcoholic steatohepatitis (NASH) induced by high-fat high-carbohydrate (HFHC) diet. Methods A total of 44mice were randomly divided into normal diet group (CON group) with 20 mice and HFHC group with 24 mice. At the end of week14 of modeling, 4 mice were randomly selected from the HFHC group for the pre-experiment of adeno-associated virus (AAV) bytail vein injection, and NLRP3 knockdown was verified after 4 weeks. After NLRP3 knockdown was verified at the end of week 18,the remaining 40 mice were given a single tail vein injection of AAV, and then they were divided into CON+NLRP3 knockdownnegative control group (CON+NLRP3-NC group), CON+NLRP3 knockdown group (CON+NLRP3-KD group), HFHC+NLRP3-NC group, and HFHC+NLRP3-KD group, with 10 mice in each group. At the end of week 24, the activation of NLRP3inflammasome was observed; related indicators were measured, including body weight, liver weight, liver index, and glucose metabolism (fasting blood glucose, fasting insulin, and Homeostasis Model Assessment of Insulin Resistance [HOMA-IR] index)the indicators of liver lipid content (liver triglyceride [TG] and oil red O staining), liver inflammation (serum alanine aminotransferase [ALT] activity, HE staining, and inflammation-related genes), and liver fibrosis (Sirius Red staining and fibrosis-related genes) were measured. A one-way analysis of variance was used for comparison of continuous data between multiplegroups, and the least significant difference t-test was used for further comparison between two groups. Results Compared with theCON+NLRP3-NC group based on the results of Western Blot, the HFHC+NLRP3-NC group had significant increases in the proteinexpression levels of NLRP3, pro-Caspase1, Caspase1, ASC, and IL-1β, while the HFHC+NLRP3-KD group had significant reductions in these levels (all P<0.05) . The HFHC+NLRP3-NC group showed varying degrees of increase in body weight, liver weight, liver index, and glucose metabolism indicators, while the HFHC+NLRP3-KD group showed significant improvements in these indicators (all P<0.05) . As for hepatic fat deposition, compared with the CON+NLRP3-NC group, the HFHC+NLRP3-NCgroup had a significant increase in liver TG, with a large number of red lipid droplets shown by oil red O staining, and the HFHC+NLRP3-KD group had significant reductions in liver TG and the number of lipid droplets in the liver (all P<0.01) . In terms of liverinflammation, compared with the CON+NLRP3-NC group, the HFHC+NLRP3-NC group had significant increases in serum ALT,NAFLD activity score, and inflammation-related genes, while the HFHC+NLRP3-KD group had significant reductions in these indicators (all P<0.01) . As for liver fibrosis, compared with the CON+NLRP3-NC group, the HFHC+NLRP3-NC group had significant increases in collagen fiber area and fibrosis-related genes, and the HFHC+NLRP3-KD group had significant reductionsin fibrosis-related genes (all P<0.05) and a tendency of reduction in collagen fiber area (P>0.05) . ConclusionNLRP3knockdown can significantly improve hepatic fat deposition and inflammation in a mouse model of HFHC-induced NASH.
Key words: Non-alcoholic Fatty Liver Disease; NLR Family, Pyrin Domain-Containing 3 Protein; Diet, High-Fat; Inflammation;Mice, Inbred C57BLResearch funding: National Natural Science Foundation of China (82174040) ; The Excellent Doctoral Projects in
Key Fields ofShanghai University of Traditional Chinese Medicine (2-089); District level Medical and Health Key Project of Shanghai BaoshanDistrict Science 21 E 63
非酒精性脂肪性肝病 (NAFLD) 是一种与胰岛素抵抗 (IR) 和遗传易感密切相关的慢性代谢应激性肝病其在全球成年人中的患病率约为25%, 是肝硬化和肝细胞癌发生的主要原因之一[1-2] 。NAFLD包括脂肪变性伴或不伴轻度炎症的非酒精性脂肪肝 (NAFL) 和非酒精性脂肪性肝炎 (NASH), 而NASH伴有更快的纤维化进展可能。NASH的发病机制至今尚未完全明确。“二次打击” 学说作为经典发病机制目前被广泛认同[3] 。
NOD 样受体热蛋白结构域相关蛋白 3(NOD-likreceptor thermal protein domain associated protein 3, NLRP3)参与NASH的发展, NLRP3炎症小体充当多个危险信号的传感器, 其包括内源性或外源性病原体信号的损伤相关分子模式诱导的无菌性炎症[4] , 在NASH的发展中发挥着关键作用[5-7] 。NLRP3主要表达于树突状细胞、 单核细胞、 巨噬细胞、 嗜中性粒细胞等免疫细胞[8] 。目前有多项研究表明NLRP3在NASH患者和小鼠模型中显著上调[9-11] , 其上调可以促进NLRP3/凋亡相关斑点样蛋白半胱氨酸蛋白酶突变体/效应分子前半胱氨酸天冬氨酸特异蛋白酶-1 (NLRP3/ASC/pro-Caspase-1) 炎症小体的组装、 激活, 进一步将pro-Caspase-1自剪切产生活化的Caspase-1, 活化的Caspase-1将IL-1β前体 (pro-interleukin-1β, pro-IL-1β) 剪切形成成熟的IL-1β并释放到胞外[12] ,IL-1β加重肝脏炎症反应, 并促进肝细胞的脂质累积, 甚至可以刺激肝星状细胞的活化推动肝炎向肝纤维化甚至肝硬化发展[13] 。
鉴于NLRP3在NASH发病中的作用, 需进一步明确敲减/敲除NLRP3基因对NASH相关表型的影响。有研究者[10, 14] 运用ob/ob小鼠或蛋氨酸胆碱缺乏饮食诱导NASH模型进行了相关探索。本研究运用更接近人类疾病特征的高脂高糖诱导的NASH小鼠模型[15] , 同时运用可靶向肝脏的腺相关病毒 (adeno-associated virus, AAV) 9对NLRP3基因进行敲减, 观察NLRP3基因敲减后NASH小鼠相关表型的改变, 以探究NLRP3在NASH发展中的潜在作用。
1 材料与方法
1. 1 实验动物 C57/BL6J雄性小鼠44只, 体质量22~24 g, SPF级, 购于上海吉辉实验动物中心, 饲养于上海中医药大学实验动物中心二楼饲养室, 自由进食和饮水, 饲养温度为26 ℃, 相对湿度为60%±10%, 光照时间为昼夜明暗交替。动物生产许可证编号: SCXK (沪) 2017-0012,动物使用许可证编号: SYXK (沪) 2020-0009。
1. 2 主要试剂和仪器
1. 2. 1 主要试剂 NLRP3抗体(英国abcam公司, 货号: ab263899); Caspase1抗体 (美国CST公司, 24232);ASC抗体 (美国CST公司, 67824); IL-1β抗体 (英国abcam公司, 货号: ab9722); GAPDH (美国CST公司, 货号: 5174);BCA蛋白定量试剂盒 (美国赛默飞世尔科技公司, 货号:NCI3225CH); 高脂饲料 (美国Research diets, 货号: D12492i);对照饲料 (美国Research diets, 货号: D12450B); 果糖 (南通特洛菲饲料科技有限公司, 货号: F0001); 蔗糖 (南通特洛菲饲料科技有限公司, 货号: S0001); ALT试剂盒 (南京建成生物科技有限公司, 货号: C009-2); 甘油三酯 (TG)试剂盒 (浙江东欧生物工程有限公司, 货号: A0-10017);苏木精-伊红 (HE) 染色试剂盒 (南京建成生物科技有限公司, 货号: D006-1-4); 油红O试剂盒 (南京建成生物科技有限公司, 货号: D027-1-4); AAV9 (上海吉凯基因医学科技股份有限公司, 货号: 105338-1; CON305)。
1. 2. 2 主要儀器 恒温气浴摇床 (上海一恒仪器有限公司, 型号: THZ-103B); 石蜡包埋机 (德国LEICA公司,型号: EG1160); 荧光酶标仪 (瑞士TECAN公司, 型号:F200 PR0); 脱水机 (德国LEICA公司, 型号: ASP300); 超声波清洗机 (宁波新芝生物科技公司, 型号: DTS)。
1. 3 实验方法
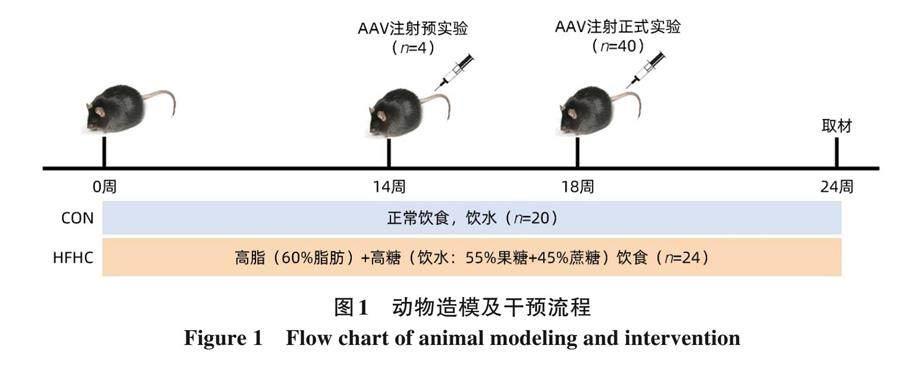
1. 3. 1 动物模型的建立和分组 44只C57/BL6小鼠适应性饲养1周后随机分为正常饮食组 (CON) 20只, 高脂高糖造模组 (HFHC) 24只 (其中4只用于NLRP3敲减预实验)。CON组给予正常饲料并饮用双蒸水, HFHC组小鼠采用高脂饲料联合高糖饮水 (浓度42 g/L, 糖水配比为55%果糖和45%蔗糖)。造模14周末, 进行小鼠AAV9尾静脉注射预实验, 给予1只HFHC组小鼠约1. 575×1011 v. g. 的NLRP3基因敲减阴性对照 (NLRP3-NC) 病毒, 剩余3只注射等量NLRP3基因敲减(NLRP3-KD)病毒。注射后第4周处死小鼠, 采用Western Blot验证敲减模型是否成功。18周末确认造模成功后, 对剩余40只小鼠进行AAV9一次性尾静脉注射, 分组如下: CON+NLRP3-NC、 CON+NLRP3-KD、 HFHC+NLRP3-NC和HFHC+NLRP3-KD, 每组10只, HFHC组继续给予高脂高糖饮食6周, 直至24周末。动物造模及干预流程见图1。
1. 3. 2 NLRP3基因敲减病毒的构建 基于AAV血清型的组织亲和性, 选用AAV9血清型对小鼠肝脏进行转染。AAV9包装步骤: 第一步, 将外源基因克隆进合适的病毒载体。第二步, 重组表达质粒同pHelper (携带腺病毒来源的基因) 和pAAV-RC (携带AAV复制和衣壳基因) 共转染进AAV-293细胞 (提供AAV复制和包装所需的反式作用因子)。转染2~3天后重组AAV9在包装细胞中组装完成。第三步, 从被感染AAV-293细胞中收集AAV9病毒颗粒。第四步, 浓缩并纯化第三步的病毒上清液。第五步, 用定量PCR法测定所得到病毒的滴度。病毒的储存: 收到病毒液后储存于?80 ℃冰箱备用。NLRP3敲减靶向序列: 5′ -CCAGGATCCTCTTCCTCAT-3′ 。
1. 3. 3 血清和肝组织生化指标检测
1. 3. 3. 1 肝组织TG含量检测 于肝组织中加入无水乙醇、 丙酮以及小磁珠进行充分匀浆, 后置于4 °C的冰箱静置过夜。将静置过夜后的肝组织样本离心, 吸取部分上清液与检测试剂充分混匀后加入96孔板, 充分反应后检测各孔的吸光度值。肝组织TG (mg/g) = (测量孔的值-空白孔的值) /标准孔×200×3/20。
1. 3. 3. 2 血清ALT活性的检测 按试剂盒说明书依次加入不同液体, 酶标仪检测各孔OD值, 绘制标准曲线,将测定值带入标准曲线方程中, 得到检测的ALT值。
1. 3. 3. 3 空腹血糖 (FBG)、 空腹胰岛素 (FIN) 及IR的稳态模型评估检测 FBG在小鼠取材当天使用血糖仪进行检测。FIN使用ELISA试剂盒根据说明书步骤进行检测。胰岛素抵抗的稳态模型评估 (HOMA-IR) = (FBG×FIN) /22. 5。
1. 3. 4 肝组织病理染色
1. 3. 4. 1 肝组织油红O染色 将冷冻切片机提前预冷,切片机厚度设置为10 ?m。切好后的组织样本于4 ℃的冰箱中保存备用。提前配置好储备溶液。染色前样本需提前置于室温下复温15 min, 之后将样本放入储备溶液中, 后水洗; 复染, 水洗。水性固封剂封片, 采用荧光显微分析仪进行拍片。
1. 3. 4. 2 肝组织HE和天狼星红染色 对肝组织进行固定, 脱水, 包埋, 切片。使用二甲苯和梯度酒精进行脱蜡处理, 苏木精染液染核, 经盐酸酒精分化后水洗至核变蓝, 放入伊红染液中染色, 梯度酒精及二甲苯中后封片。次日收取病理切片, 显微镜下观察。肝组织病理使用NAFLD活动评分 (NAS) 进行评价, NAS<3分可排除NASH, NAS>4分则可诊断为NASH, 介于两者之间为有NASH可能[16] 。为了观察肝纤维化的组织学改变, 肝组织经石蜡包埋后, 使用天狼星红染色法评估肝脏胶原沉积。
1. 3. 5 Western Blot检测 样本制备: 在肝组织中加入混合裂解液, 充分匀浆沉淀取上清, BCA法蛋白定量。电泳: 提前配好分离胶和浓缩胶, 加入样品和Marker开始电泳。转膜: 使用半干转法, 从下向上依次为滤纸-膜-凝胶- PVDF膜, 放好后即可开始转膜。抗体结合: 一抗NLRP3(1 ∶1 000)、 pro-Caspase1(1 ∶1 000)、 Caspase1(1 ∶1 000)、ASC (1 ∶1 000)、 IL-1β (1 ∶1 000) 及GAPDG (1 ∶5 000) 4 ℃孵育过夜, 次日二抗室温孵育1 h, 加ECL显影液进行显影。
1. 3. 6 qPCR檢测 样品RNA的提取: 此部分按照纯化柱法进行提取。样品逆转录: 逆转录之前, 先用分光光度计测总RNA浓度, 校正样品RNA浓度。逆转录根据试剂盒说明书完成, 结束后将逆转录完成的cDNA放入?20 °C备用。RT-PCR: 将配好的混合溶液加入到384孔板, 此步在冰盒上操作。PCR仪上按照试剂说明书上的反应参数进行设置, 完成检测。具体引物序列信息见表1。
1. 4 统计学方法 使用 SPSS 26. 0、 Graphpad prism 及Image J软件进行统计分析或可视化处理。计量资料采用x ˉ±s表示, 多组间比较使用单因素方差分析, 进一步两两比较采用LSD-t检验, P<0. 05为差异有统计学意义。
2 结果
2. 1 NLRP3基因敲减预实验鉴定 18周末预实验结束, 通过 Western Blot 实验检测 AAV9 转染后肝脏中NLRP3的蛋白表达情况。结果显示3只NLRP3-KD小鼠肝脏的NLRP3蛋白表达量均较NLRP3-NC小鼠降低, 提示NLRP3敲减模型构建成功 (图2)。
2. 2 NLRP3基因敲减对肝组织NLRP3炎症小体活化的影响
2. 2. 1 NLRP3基因敲减对NLRP3转录及蛋白水平的影响 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组小鼠肝脏NLRP3转录和蛋白水平显著上调 (P值均<0. 01)。与HFHC+NLRP3-NC组相比, HFHC+NLRP3-KD组肝脏NLRP3蛋白及转录水平均显著降低 (P值均<0. 01)(图3)。
2. 2. 2 NLRP3基因敲减对炎症小体及下游IL-1β蛋白的影响 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组小鼠肝组织pro-Caspase1、 Caspase1、 ASC及IL-1β蛋白显著上调 (P值均<0. 01)。与HFHC+NLRP3-NC组相比,HFHC+NLRP3-KD组上述蛋白水平显著降低 (P值均<0. 01)。表明在HFHC诱导的NASH小鼠模型中, 肝脏NLRP3炎症小体明显被激活, 同时IL-1β的分泌增加。NLRP3敲低后可明显抑制NASH小鼠肝脏炎症小体及IL-1β蛋白的表达 (图4)。
2. 3 NLRP3基因敲减对NASH小鼠肝质量、 体质量、 肝体比及糖代谢的影响
2. 3. 1 NLRP3基因敲减对小鼠肝质量、 体质量及肝体比的影响 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组小鼠肝质量、 体质量及肝体比显著上升 (P值均<0. 01)。NLRP3敲减后, HFHC+NLRP3-KD组小鼠较HFHC+NLRP3-NC组小鼠肝质量、 体质量及肝体比显著下降 (P值均<0. 01) (图5, 表2)。
2. 3. 2 NLRP3基因敲减对血糖相关指标的影响 HFHC+ NLRP3-NC组较CON+NLRP3-NC组的FBG、 FIN及HOMA-IR显著上升 (P值均<0. 01)。NLRP3敲减后, HFHC+NLRP3- KD组肝组织FIN和HOMA-IR相较于HFHC+NLRP3-NC组显著下降 (P值均<0. 05), FBG虽有降低趋势但差异无统计学意义 (P>0. 05)(表2)。
2. 4 NLRP3基因敲减对NASH小鼠肝脏脂肪沉积的影响 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组的肝组织TG明显升高 (P<0. 01); 肝脏形态明显更大, 颜色变为浅黄色, 质地较硬; 油红O染色显示肝细胞肿胀, 脂滴较多, 染色较深, 提示HFHC饮食可明显加重肝脏脂肪沉积。HFHC+NLRP3-KD 组较 HFHC+NLRP3-NC 组的肝脏形态减小, 肝脏TG及脂滴明显减少(P值均<0. 01)(图6, 表3)。
2. 5 NLRP3基因敲减对NASH小鼠肝脏炎症的影响
2. 5. 1 NLRP3基因敲减对ALT活性的影响 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组血清ALT水平显著上升 (P<0. 01), NLRP3敲低后NASH小鼠的ALT活性显著降低 (P<0. 05)(表4)。
2. 5. 2 NLRP3基因敲减对肝组织病理的影响 HE染色结果显示, 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组小鼠肝细胞出现大量的大泡性和小泡性脂质空泡, 小叶内炎症浸润和气球样变肝细胞增大, 细胞质水肿稀疏, 中央静脉周围肝细胞肿胀。脏脂肪变性、 小叶炎症和气球样变及NAS总评分明显增加, NLRP3基因敲减可以明显改善NASH小鼠的上述病理变化 (P值均<0. 01)(图7, 表4)。
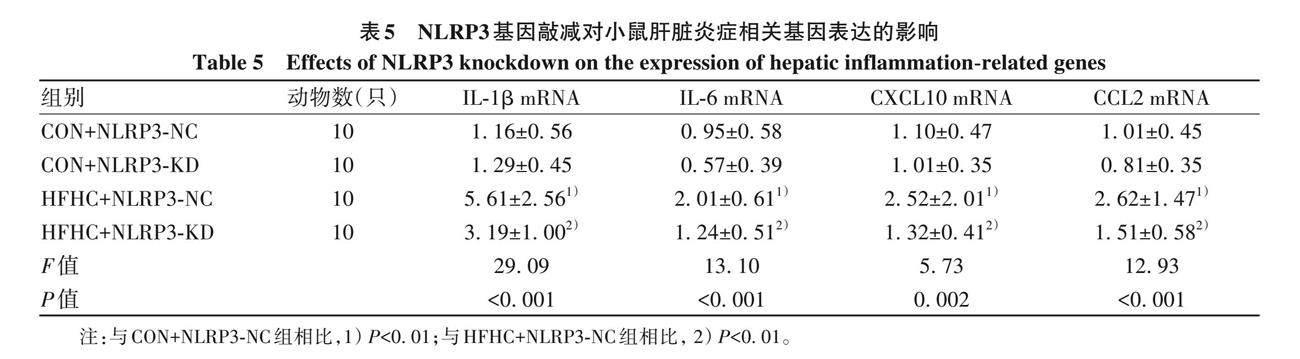
2. 5. 3 NLRP3基因敲减对小鼠肝脏炎症相关基因表达的影响 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组炎症相关指标IL-1β、 IL-6、 CXCL10及CCL2的mRNA水平均明显升高(P 值均<0. 01), HFHC+NLRP3-KD 组较HFHC+NLRP3-NC组均显著下降 (P值均<0. 01)(表5)。
2. 6 NLRP3基因敲减对NASH小鼠肝纤维化的影响
2. 6. 1 NLRP3基因敲减对肝纤维化的影响 天狼星红染色结果显示HFHC+NLRP3-NC组较CON+NLRP3-NC组胶原纤维明显增加 (P<0. 01), NLRP3敲减后NASH小鼠肝脏胶原纤维有减少趋势, 但差异无统计学意义 (图8, 表6)。
2. 6. 2 NLRP3基因敲减对肝纤维化相关指标转录水平的影响 与CON+NLRP3-NC组相比, HFHC+NLRP3-NC组纤维化相关指标α-SMA、 COL3α1及COL1α1的mRNA水平明显升高 (P值均<0. 05), HFHC+NLRP3-KD组均较HFHC+NLRP3-NC组显著下降 (P值均<0. 01)(表6)。
3 讨论
NLRP3炎症小体参与NASH的发生和发展, 如能有效抑制NLRP3, 就有可能阻止或逆转NASH。本研究借助AAV9载体进行尾静脉注射, 使其结合CAG肝脏特异性启动子, 实现对肝组织NLRP3的稳定转染。AAV作为一种常用的基因转染工具, 具有多种血清型、 免疫原性低、 长期稳定表达基因、 宿主范围广等优势, 在基因功能研究和基因治疗递送载体中占据主导地位。AAV每种血清型的靶器官亲和性不同, 与其他病毒载体相比更有器官选择性, 其中AAV9载体具有明显肝嗜性。但缺点在于AAV载体容量小, 目前最多只能容纳4. 7 kb外源DNA片段。
在本研究中, 首先证明了高脂高糖饮食喂养的NASH小鼠可以诱导NLRP3炎症小体的激活, 在采用AAV9载体实现肝脏NLRP3基因敲减后, NASH小鼠的肝脏炎症小体活化明显减弱, 肝脏脂肪沉积改善。同时, 观察了肝脏炎症和纤维化, 结果显示NLRP3敲减可以抑制NASH小鼠的肝脏炎症, 肝脏胶原纤维增生减少但差异无统计学意义。先前的研究[17] 表明, 与野生型小鼠相比, 高脂饮食诱导的NASH小鼠模型中, 肝脏病理显示NLRP3基因敲除导致肝脏脂肪变性减少。在Alms1突变 (foz/foz) 和蛋氨酸及胆碱缺乏饮食诱导的NASH小鼠中, 肝脏NLRP3、Caspase-1及IL-1β蛋白表达明显增加, 给予NLRP3抑制剂MCC950 (直接靶向NLRP3的NATCH结构域) 后, 肝脏炎症小体活性明显减弱[8, 10] 。另一研究[18] 发现抑制巨噬细胞NLRP3炎性小体的激活可进一步抑制炎性小体激活引起的肝细胞脂质积累, 有助于改善NASH。这些研究和本研究结果类似, 提示敲减或抑制肝脏NLRP3的表达可改善NASH。
本研究采用高脂高糖饮食来构建NASH动物模型,并评价了NLRP3敲减对NASH小鼠肝脂肪沉积、 炎症、纤维化的改善作用。在肝脏中, NLRP3高表达于巨噬细胞和单核细胞, 而肝细胞和肝星状细胞表达NLRP3的水平较低[19-20] , 本研究的局限性在于未使用細胞特异性基因敲除小鼠模型, 研究发现基因敲除模型通常能够取得更明显的表型, 对于探究基因作用、 疾病机制、 药物靶点等方面具有更高的研究效度。
總之, 本研究发现高脂高糖饮食喂养的小鼠可以出现NASH表型和肝脏NLRP3炎症小体, 通过敲低NLRP3的表达可以抑制肝脏炎症小体活化, 抑制肝脂肪沉积、炎症。本研究探讨了NLRP3在NASH小鼠模型中的作用, 这些结果表明NLRP3在NASH的发生发展中起着至关重要的作用, 可能是治疗NASH的关键靶点。伦理学声明: 本研究方案于2021年9月3日经由上海中医药大学实验动物伦理委员会审批, 批号: PZSHUTCM210903007,符合实验室动物管理与使用准则。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 黄倩负责设计论文框架, 起草论文; 黄倩、 王卓媛负责实验操作, 研究过程的实施; 黄倩、 安梓铭负责数据收集, 统计学分析, 绘制图表; 冯琴、 辛鑫、 孙沁梅负责论文修改; 冯琴、 胡义扬、 苟小军负责拟定写作思路; 冯琴指导撰写文章并最后定稿。
参考文献:
[1] YOUNOSSI ZM, KOENIG AB, ABDELATIF D, et al. Global epidemiol?ogy of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64(1): 73-84. DOI: 10.1002/hep.28431.
[2] YOUNOSSI Z, ANSTEE QM, MARIETTI M, et al. Global burden of NAFLD and NASH: Trends, predictions, risk factors and prevention[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(1): 11-20. DOI: 10.1038/nrgastro.2017.109.
[3] DAY CP, JAMES OF. Steatohepatitis: A tale of two “hits” ?[J]. Gas?troenterology, 1998, 114(4): 842-845. DOI: 10.1016/s0016-5085(98)70599-2.
[4] PR?CHNICKI T, MANGAN MS, LATZ E. Recent insights into the molecu?lar mechanisms of the NLRP3 inflammasome activation[J]. F1000Res, 2016, 5: F1000 Faculty Rev-1469. DOI: 10.12688/f1000research.8614.1.
[5] WU XF, ZHANG F, XIONG X, et al. Tetramethylpyrazine reduces inflam?mation in liver fibrosis and inhibits inflammatory cytokine expression in hepatic stellate cells by modulating NLRP3 inflammasome pathway[J]. IUBMB Life, 2015, 67(4): 312-321. DOI: 10.1002/iub.1348.
[6] YANG G, LEE HE, LEE JY. A pharmacological inhibitor of NLRP3 in?flammasome prevents non-alcoholic fatty liver disease in a mouse model induced by high fat diet[J]. Sci Rep, 2016, 6: 24399. DOI: 10.1038/srep24399.
[7] WEI Q, ZHU R, ZHU JY, et al. E2-induced activation of the NLRP3 in?flammasome triggers pyroptosis and inhibits autophagy in HCC cells[J]. Oncol Res, 2019, 27(7): 827-834. DOI: 10.3727/096504018X15462920753012.
[8] WANG L, HAUENSTEIN AV. The NLRP3 inflammasome: Mechanism of action, role in disease and therapies[J]. Mol Aspects Med, 2020, 76: 100889. DOI: 10.1016/j.mam.2020.100889.
[9] CALCAGNO DM, CHU A, GAUL S, et al. NOD-like receptor protein 3 activation causes spontaneous inflammation and fibrosis that mimics human NASH[J]. Hepatology, 2022, 76(3): 727-741. DOI: 10.1002/hep.32320.
[10] MRIDHA AR, WREE A, ROBERTSON AAB, et al. NLRP3 inflamma?some blockade reduces liver inflammation and fibrosis in experi?mental NASH in mice[J]. J Hepatol, 2017, 66(5): 1037-1046. DOI: 10.1016/j.jhep.2017.01.022.
[11] QU JW, YUAN ZQ, WANG GY, et al. The selective NLRP3 inflamma?some inhibitor MCC950 alleviates cholestatic liver injury and fibrosis in mice[J]. Int Immunopharmacol, 2019, 70: 147-155. DOI: 10.1016/j.intimp.2019.02.016.
[12] LATZ E, XIAO TS, STUTZ A. Activation and regulation of the inflammasomes[J]. Nat Rev Immunol, 2013, 13(6): 397-411. DOI: 10.1038/nri3452.
[13] NEGRIN KA, ROTH FLACH RJ, DISTEFANO MT, et al. IL-1 signaling in obesity-induced hepatic lipogenesis and steatosis[J]. PLoS One, 2014, 9(9): e107265. DOI: 10.1371/journal.pone.0107265.
[14] QIN WW, WENG JP. Hepatocyte NLRP3 interacts with PKCε to drive hepatic insulin resistance and steatosis[J]. Sci Bull (Beijing), 2023, 68(13): 1413-1429. DOI: 10.1016/j.scib.2023.06.003.
[15] KOHLI R, KIRBY M, XANTHAKOS SA, et al. High-fructose, medium chain trans fat diet induces liver fibrosis and elevates plasma coen?zyme Q9 in a novel murine model of obesity and nonalcoholic ste?atohepatitis[J]. Hepatology, 2010, 52(3): 934-944. DOI: 10.1002/hep.23797.
[16] KLEINER DE, BRUNT EM, VAN NATTA M, et al. Design and valida?tion of a histological scoring system for nonalcoholic fatty liver disease[J]. Hepatology, 2005, 41(6): 1313-1321. DOI: 10.1002/hep.20701.
[17] VANDANMAGSAR B, YOUM YH, RAVUSSIN A, et al. The NLRP3 in?flammasome instigates obesity-induced inflammation and insulin re?sistance[J]. Nat Med, 2011, 17(2): 179-188. DOI: 10.1038/nm.2279.
[18] HUANG SL, WU YW, ZHAO ZH, et al. A new mechanism of obeticholic acid on NASH treatment by inhibiting NLRP3 inflammasome activation in macrophage[J]. Metabolism, 2021, 120: 154797. DOI: 10.1016/j.metabol.2021.154797.
[19] BOARU SG, BORKHAM-KAMPHORST E, TIHAA L, et al. Expression analysis of inflammasomes in experimental models of inflammatory and fibrotic liver disease[J]. J Inflamm (Lond), 2012, 9(1): 49. DOI: 10.1186/1476-9255-9-49.
[20] CSAK T, GANZ M, PESPISA J, et al. Fatty acid and endotoxin acti?vate inflammasomes in mouse hepatocytes that release danger sig?nals to stimulate immune cells[J]. Hepatology, 2011, 54(1): 133-144. DOI: 10.1002/hep.24341.
收稿日期:2023-08-15; 录用日期:2023-08-31
本文编辑:朱晶
