程序性死亡受体1(PD-1)单抗联合索拉非尼或仑伐替尼治疗肝功能Child-PughB级不可切除肝癌患者的效果分析
2024-06-06孙巍丁晓燕陈京龙
孙巍 丁晓燕 陈京龙


摘要: 目的 回顧性分析酪氨酸激酶抑制剂联合免疫检查点抑制剂在肝功能Child-Pugh B级不可切除肝癌 (uHCC) 患者中的疗效和安全性。方法 纳入2020年12月31日—2023年3月30日首都医科大学附属北京地坛医院收治的肝功能Child-Pugh B级的uHCC患者96例, 接受仑伐替尼联合程序性细胞死亡-1 (PD-1) 抑制剂治疗者为L组 (63例), 接受索拉非尼联合PD-1抑制剂治疗者为S组 (33例)。主要终点为客观缓解率 (ORR), 次要终点包括疾病进展时间 (TTP)、 总生存期 (OS)、 毒性、 停药率和剂量调整率。符合正态分布的计量资料2组间比较采用成组t检验; 非正态分布2组间比较采用Mann-Whitney U检验。计数资料2组间比较采用χ2检验。绘制生存曲线, 运用Kaplan-Meier法计算2组患者的生存率, 并利用Log-rank检验比较2组差异。通过Cox回归模型计算风险比 (HR) 和95%置信区间 (95%CI), 实现预后影响因素的多因素分析。结果 96例uHCC患者中, Child-Pugh B级 (7分) 55例 (57. 3%), B级 (8~9分) 41例 (42. 7%)。L组患者的ORR显著高于S组 (46. 0% vs 15. 2%, P=0. 003)。L组和S组中位TTP (6. 6个月 vs 3. 5个月, P=0. 48) 或OS (13. 8个月 vs 13. 2个月, P=0. 95) 差异无统计学意义。Child-Pugh B级 (7分) 患者与Child-Pugh B级 (8~9分) 患者的中位TTP差异无统计学意义 (6. 6个月 vs 4. 8个月,P=0. 35), OS具有统计学意义 (14. 5个月 vs 8. 8个月, P=0. 045)。多因素分析显示, ORR是TTP (HR=0. 18, 95%CI: 0. 09~0. 36, P<0. 001) 和OS (HR=0. 20, 95%CI: 0. 09~0. 43, P<0. 001) 的保护因素。L组和S组总体不良反应 (98. 4% vs 97. 0%) 和≥3级不良反应的发生率 (68. 3% vs 63. 6%) 比较, 差异均无统计学意义。L组和S组在剂量调整率 (84. 8% vs 70. 2%) 或停药率 (56. 1% vs 72. 7%) 方面无显著差异。结论 与索拉非尼联合PD-1抑制剂方案相比, 仑伐替尼联合PD-1抑制剂方案改善了Child-Pugh B级uHCC患者的ORR, 但两组总体预后相似, 总体安全性相当。
关键词: 癌, 肝细胞; 肝功能不全; 索拉非尼; 仑伐替尼; 免疫检查点抑制剂; 治疗结果
基金项目: 首都卫生发展科研专项 (首发2022-2-2175)
Efficacy and safety of anti-PD-1 monoclonal antibody combined with sorafenib or lenvatinib in treatment of patients with Child-Pugh class B unresectable hepatocellular carcinoma
SUN Wei, DING Xiaoyan, CHEN Jinglong. (Department of Oncology, Beijing Ditan Hospital, Capital Medical University, Beijing 100015, China)
Corresponding author: CHEN Jinglong, dingxiaoyan198111@163.com (ORCID: 0000-0003-1640-7115)
Abstract: Objective To investigate the safety and efficacy of tyrosine kinase inhibitors combined with immune checkpoint inhibitors in the treatment of patients with Child-Pugh class B unresectable hepatocellular carcinoma (uHCC) . Methods A total of 96 patients with Child-Pugh class B uHCC who were admitted to Beijing Ditan Hospital, Capital Medical University, from December 31, 2020 to March 30, 2023 were enrolled as subjects, among whom 63 patients receiving lenvatinib combined with programmed death-1 (PD-1) inhibitor were enrolled as L group and 33 patients receiving sorafenib combined with PD-1inhibitor were enrolled as S group. The primary endpoint was objective response rate (ORR), and secondary endpoints included time to progression (TTP), overall survival (OS), toxicity, drug withdrawal rate, and dose adjustment rate. The The independent-samples t test was used for comparison of normally distributed continuous data between two groups, and the Mann-Whitney U test was used for comparison of non-normally distributed continuous data between two groups; the chi-square test was used for comparison of categorical data between two groups. Survival curves were plotted, and the Kaplan-Meier method was used to calculate the survival rate of patients in both groups, while the Log-rank test was used for comparison between the two groups. The Cox regression model was used to calculate hazard ratio (HR) and its 95% confidence interval (CI) and perform the multivariate analysis of influencing factors for prognosis. Results Among the 96 patients with uHCC, 55 (57.3%) had Child-Pugh class B (7 points) uHCC and 41 (42.7%) had Child-Pugh class B (8—9 points) uHCC. The L group had a significantly higher ORR than the S group (46.0% vs 15.2%, P=0.003), and there were no significant differences between the L group and the S group in median TTP (6.6 months vs 3.5 months, P=0.48) or OS (13.8 months vs 13.2 months, P=0.95) . There was no significant difference in median TTP between the patients with Child-Pugh class B (7 points) uHCC and those with Child-Pugh class B (8—9 points) uHCC (6.6 months vs 4.8 months, P=0.35), while there was a significant difference in OS between these two groups of patients (14.5 months vs 8.8 months, P=0.045) . The multivariate analysis showed that ORR was a protective factor for both TTP (HR=0.18,95%CI:0.09 — 0.36, P<0.001) and OS (HR=0.20,95%CI:0.09 — 0.43, P<0.001) . There were no significant differences between the L group and the S group in the overall incidence rate of adverse reactions (98.4% vs 97.0%) and the incidence rate of grade≥3 adverse reactions (68.3% vs 63.6%), and there were also no significant differences between the two groups in dose adjustment rate (84.8% vs 70.2%) and drug withdrawal rate (56.1% vs 72.7%) . Conclusion Compared with the regimen of sorafenib combined with PD-1 inhibitor, the regimen of lenvatinib combined with PD-1 inhibitor can improve the ORR of patients with Child-Pugh class B uHCC, with similar prognosis and safety profile between the two groups.
Key words: Carcinoma, Hepatocellular; Hepatic Insufficiency; Sorafenib; Lenvatinib; Immune Checkpoint Inhibitors; Treatment Outcome
Research funding: Capital Health Development Research Project (2022-2-2175)
肝细胞癌 (HCC) 占原发性肝脏肿瘤的90%, 是全球癌症相关死亡的第三大原因[1-2] 。60%~70%的HCC最初诊断为不可切除, 全身治疗是其标准一线治疗方案[2] 。然而, 超过 70% 的不可切除肝细胞癌(unresectable hepatocellular carcinoma, uHCC) 患者并发肝硬化, 其中高达30%的患者肝功能为Child-Pugh B级[3-7] 。由于Child-Pugh B级患者被排除在多种大规模、 多中心、 Ⅲ期随机对照临床试验之外, 因此Child-Pugh B级肝癌患者的全身治疗方式有限[8-9] 。索拉非尼及仑伐替尼均为国内外指南推荐对于uHCC的一线治疗药物。全球Ⅲ期多中心研究[9] 证明仑伐替尼疗效不劣于索拉非尼, 且在中国患者的亚组分析中, 仑伐替尼疗效明显优于索拉非尼,但肝功能分级为B级的HCC患者未被纳入此研究。越来越多的临床研究及临床实践显示靶向药物联合免疫检查点抑制剂 (immune checkpoint inhibitor, ICI) 的治疗方案疗效优于单药方案[10] 。但目前指南尚未明确推荐联合治疗方案用于Child-Pugh B级的uHCC患者。本研究回顾性分析比较了仑伐替尼联合程序性死亡受体1(programmed death-1, PD-1) 抑制剂与索拉非尼联合PD-1抑制剂一线治疗Child-Pugh B级uHCC的疗效和安全性。
1 资料与方法
1. 1 研究对象 收集2020年12月31日—2023年3月30日首都医科大学附属北京地坛医院收治的肝功能Child-Pugh B级uHCC患者。纳入标准:(1) 年龄>18岁;(2) 经临床表现、 影像学表现、 肿瘤标志物或病理组织学诊断符合 《原发性肝癌诊疗指南 (2022年版)》 [11] 的HCC患者;(3) 初治或根治性手术治疗后复发的初次就诊患者, 经外科会诊无法行根治性手术;(4) Child-Pugh评分7~9分,且预期寿命>3个月;(5) 东部肿瘤协作组 (ECOG) 评分≤2分[12] 。排除标准:(1) 具有索拉非尼、 仑伐替尼或免疫检查点抑制剂治疗的禁忌证;(2) 入组前3个月内接受过肝内病灶局部治疗 (包括外照射放射治疗);(3) 存在严重合并症或随访资料不全;(4) 拒绝接受索拉非尼、 仑伐替尼及免疫检查点抑制剂治疗。
1. 2 研究方法
1. 2. 1 药物疗法 索拉非尼: 入院后首先接受100 mg,2次/d, 1周后若无3级以上不良反应改为200 mg, 2次/d。仑伐替尼: 按体质量每日口服; 体质量<60 kg的患者给予仑伐替尼4 mg, 1次/d, 体质量≥60 kg的患者给仑伐替尼8 mg, 1次/d。患者在初次接受索拉非尼或仑伐替尼后第1天接受静脉注射信迪利单抗200 mg或卡瑞利珠单抗200 mg。在发生疾病进展或不可耐受的药物不良反应情况下减少剂量或中断治疗。
1. 2. 2 支持治疗 在基线评估肝功能后, 所有患者均允许接受必要的保肝、 抗病毒、 止吐等支持治疗, 并在随访过程中根据肝功能变化动态调整。
1. 2. 3 观察指标及定义 主要研究终点为客观缓解率(objective response rate, ORR), 使用改进的实体瘤疗效评估标准(modified response evaluation criteria in solid tumor, mRECIST) 及实体瘤免疫疗效评价标准 (immune response evaluation criteria in solid tumor, iRECIST), 通过对比增强动态CT或MRI评估肿瘤反应, 最佳总体反应被认为是最终反应。依据mRECIST标准记录为完全缓解(complete response, CR)、 部分缓解(partial response,PR)、 疾病稳定 (stable disease, SD) 或疾病进展 (progressive disease, PD), 达到完全缓解或部分缓解的患者比例(CR+PR) 定义为ORR[13] 。同时依据iRECIST标准记录了免疫完全缓解 (immunecomplete response, iCR)、 免疫部分缓解 (immune partial response, iPR)、 免疫疾病稳定(immune stable disease, iSD)、 免疫待确认的疾病进展(immune unconfirmed progressive disease, iUPD)以及免疫確认的疾病进展(immuneconfirmed progressive disease,iCPD) [14] 。次要终点包括疾病进展时间 (time to progression,TTP)、 总生存期 (overall survival, OS)、 疾病控制率 (disease control rate, DCR) 和安全性。TTP定义为从入组日期到疾病进展日期的时间间隔。OS定义为从入组之日起至因任何原因死亡的时间。达到完全缓解、 部分缓解或稳定的患者比例 (CR+PR+SD) 定义为DCR。
1. 2. 4 随访及资料评价 疗效评价: 入组后每8~12周评估一次肿瘤对整个治疗方案的反应。每次评估项目包括行腹部增强扫描CT或增强扫描MRI、 胸部CT; 其他检查根据临床医师的判断完成。安全性评估: 收集药物相关不良反应及严重并发症, 不良反应按照美国国家癌症研究所不良反应通用术语标准5. 0版[15] 进行分级和记录。
1. 3 统计学方法 采用R 4. 0. 5软件进行统计学分析。符合正态分布的计量资料以x ˉ±s表示, 2组间比较采用成组t检验; 非正态分布的计量资料以M (P25~P75) 表示,2组间比较采用Mann-Whitney U检验。计数资料2组间比较采用χ2检验。绘制生存曲线, 运用Kaplan-Meier法得出2组患者的生存率, 并利用Log-rank检验比较2组间差异。通过Cox回归模型计算风险比 (HR) 和95%置信区间 (95%CI), 实现预后影响因素的多因素分析。P<0. 05为差异具有统计学意义。
2 结果
2. 1 一般资料 本研究共纳入 96 例 Child-Pugh B 级uHCC患者。接受仑伐替尼联合PD-1抑制剂治疗者为L组(n=63), 接受索拉非尼联合PD-1抑制剂治疗者为S组(n=33)。在肿瘤治疗史方面, 分别有21例 (24. 9%)、 89例(95. 7%) 和62例 (66. 7%) 患者曾行肝切除术、 肝动脉化疗栓塞术和消融术。2组临床基线特征比较, 差异均无统计学意义 (表1)。
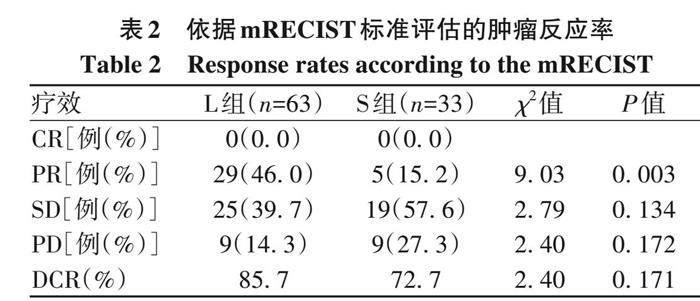
2. 2 治疗效果分析 本研究中位随访时间为14. 8个月,L组ORR明显高于S组 (46. 0% vs 15. 2%, P=0. 003)(表2)。L组和S组PR、 SD、 PD比较, 差异均无统计学意义 (P值均>0. 05)。在iRECIST标准评估下ORR与mRECIST标准无差异, 随访过程中未观察到免疫治疗假性进展及超进展发生 (表3)。
整个队列的中位TTP和OS分别为4. 0个月 (95%CI:3. 4~4. 6) 和13. 6个月 (95%CI: 9. 8~17. 4)。L组和S组的中位TTP (6. 6个月 vs 3. 5个月, P=0. 48) 或OS (13. 8个月 vs 13. 2个月, P=0. 95) 比较, 差异无统计学意义 (图1)。Child-Pugh B级 (7分) 和Child-Pugh B级 (8~9分) 的中位TTP比较, 差异无统计学意义 (6. 6个月 vs 4. 8个月, P=0. 35), 但OS组间差异有统计学意义 (14. 5个月 vs 8. 8个月, P=0. 045)(图2) 。
2. 2 预后因素分析 Cox回归分析显示, ORR为TTP的保护因素 (HR=0. 18, 95%CI: 0. 09~0. 36, P<0. 001)(表4)。同时, ORR也是OS的保护因素 (HR=0. 20, 95%CI: 0. 09~0. 43, P<0. 001)(表5)。
2. 3 安全性分析 94例 (97. 9%) 患者出现了不良反应,其中60例(62. 5%)为3级及以上治疗相关不良反应。L组总体不良反应和≥3级不良反应的发生率分别为98. 4%和68. 3%, S组为97. 0%和63. 6%, 两组比较差异均无统计学意义, L组和S组的安全性情况相当。L组中常见的不良反应包括高血压、 疲劳和腹泻, S组常见的不良反应包括皮疹、 疲劳和高血压。此外, 56例 (58. 3%)患者出现免疫相关不良反应, 其中L组38例 (60. 3%),S组18例 (54. 5%)。常见免疫不良反应为免疫性血小板减少症、 肝毒性和甲状腺功能减退症。在L组和S组之间, 报告的剂量调整率(84. 8% vs 70. 2%)或停药率(56. 1% vs 72. 7%) 均无显著差异。尽管76%的患者在治疗期间死亡, 但两组均未发现与治疗相关的死亡事件。
3 讨论
近年来uHCC的系统治疗药物选择越来越丰富, 但Child-Pugh B级的患者却往往被排除在临床试验之外。本研究以治疗选择有限的HCC为研究人群, 分析和探讨抗血管生成药物联合PD-1抑制剂在这些患者治疗中的可行性。结果显示, 与索拉非尼联合ICI相比, 仑伐替尼联合ICI虽然没有显著延长TTP和OS, 但改善了肿瘤对治疗的反应, 而未增加不可预测的毒性。此外, Child-Pugh B级 (7分) 组与Child-Pugh B级 (8~9分) 组比较,TTP及OS的差异均无统计学意义。
疗效方面, 本研究队列的中位TTP和中位OS分别为4. 0个月和13. 6个月, 高于单用索拉非尼和单用纳武单抗治疗Child-Pugh B级HCC[3-4, 16-17] 。一项荟萃分析[18]显示, 接受ICI治疗的Child-Pugh B级uHCC患者总体ORR为 14%(95%CI: 11%~17%), 中位 OS 为 5. 49(95%CI:3. 57~7. 42) 个月, 中位无进展生存期为2. 68 (95%CI:1. 85~3. 52) 個月, 均低于本研究结果。上述分析提示, 在Child-Pugh B级uHCC人群中酪氨酸激酶抑制剂联合ICI的治疗方式依然可能带来生存获益。虽然本研究纳入的患者均为失代偿期肝硬化, 但横向比较优于既往研究的生存数据, 提示在临床治疗uHCC中靶免联合治疗可能是一种有效的治疗策略。前期针对uHCC的一线临床治疗和临床试验多聚焦于Child-Pugh A级患者, LEAP-002研究[19] 结果显示仑伐替尼联合帕博利珠单抗的ORR为28. 1%, 中位无进展生存期为8. 2 (95%CI: 6. 4~8. 4) 个月, 中位生存期为21. 2 (95%CI: 19. 0~23. 6) 个月。另一项Ⅲ期临床研究[20] 结果提示, 卡瑞利珠单抗联合利沃塞尼布 (阿帕替尼) 的ORR为25. 4%, 中位无进展生存期为5. 6 (95%CI: 5. 5~6. 3) 个月, 中位生存期为22. 1 (95%CI:19. 1~27. 2) 个月。本研究共有34例 (L组29例, S组5例)患者有持续的影像学反应, 占总体人群的35. 4%, 与先前只纳入Child-Pugh A级患者的PD-1抑制剂联合抗血管药物临床试验中报道的ORR相似, 但OS结果低于既往研究[8, 19, 21-23] 。有研究[24] 也显示Child-Pugh分级可能是靶免联合治疗uHCC的独立不良预后因素。此外, 本研究发现接受仑伐替尼联合免疫治疗的研究队列在客观反应方面比索拉非尼联合免疫治疗有更显著的改善。本研究显示, Child-Pugh B级(7分)和 Child-Pugh B级(8~9分) 之间的中位TTP无显著差异, 但OS具有统计学差异, 分析原因, Child-Pugh B级 (7分) 患者死亡原因均为疾病进展导致的相关并发症, 但 Child-Pugh B级(8~9分) 中除外疾病相关死亡外, 有3例患者死于新型冠状病毒感染, 1例死于急性心肌梗死 (排除免疫性心肌炎), 1例死于急性脑梗导致的并发症, 这可能是两组OS存在统计学差异的原因。与单独使用索拉非尼相比, 仑伐替尼对HBV相关HCC的疗效更明显[9, 25-26] 。免疫治疗病毒性肝炎相关HCC的效果也更好[27-28] 。综上所述,仑伐替尼联合PD-1抑制剂应用于合并肝功能损伤的HBV相关性HCC可能是更有效的, 但需要更多的临床试验来验证。
安全性方面, 尽管本研究中Child-Pugh B的不良反应发生率较高, 但与其他纳入Child-Pugh B级的uHCC患者的研究结果相似[2-4, 7, 17] 。与既往涉及索拉非尼、 仑伐替尼、 信迪利单抗和卡瑞利珠单抗的临床试验相比,本研究没有出现新的安全性问题[8-9, 21, 23] 。另一个重要的安全问题是失代偿期肝硬化患者更有可能出现肝功能受损, 更高的上消化道出血和血小板减少症发生率。这类人群应密切监测肝功能。另外, 虽然本研究两组之间药物剂量调整率或停药率没有显著差异, 但高于一些既往的研究数据[8, 19-20] 。提示临床中应用靶向联合免疫治疗方式治疗存在肝功能失代偿的肝癌患者, 应密切观察不良反应, 及时调整药物。
本研究的局限性主要在于研究设计。首先, 回顾性分析会对纳入患者的选择产生偏倚, 而且现实世界与临床试验不同, 缺乏标准化; 其次, 本研究使用了两种PD-1抑制剂, 药物异质性可能影响数据分析; 最后, 没有建立Child-Pugh A级对照组来比较不同肝功能之间的疗效及安全性差异。尽管存在这些局限性, 本研究在更广泛的人群中进行了探索, 为进一步的研究提供了一些临床数据。
综上所述, 酪氨酸激酶抑制剂联合免疫检查点抑制剂治疗Child-Pugh B的uHCC具有较好的有效性和可控的毒性, 仑伐替尼联合PD-1抑制剂比索拉非尼联合PD-1抑制剂更能提高肿瘤治疗反应。目前尚缺乏此类患者的前瞻性数据, 值得在临床试验中进一步评估联合方案的安全性和有效性。
伦理学声明: 本研究于2021年9月1日经由首都医科大学附属北京地坛医院伦理委员会批准, 批号: JDLKZ-2021-041-01。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 孙巍负责设计论文框架, 起草论文, 研究过程的实施; 丁晓燕负责数据收集, 统计学分析, 绘制图表; 陈京龙负责论文修改, 负责拟定写作思路, 指导撰写文章并最后定稿。
参考文献:
[1] MITTAL S, EL-SERAG HB, SADA YH, et al. Hepatocellular carcinoma in the absence of cirrhosis in United States veterans is associated with nonalcoholic fatty liver disease[J]. Clin Gastroenterol Hepatol, 2016, 14(1): 124-131. e1. DOI: 10.1016/j.cgh.2015.07.019.
[2] CHAPIN WJ, HWANG WT, KARASIC TB, et al. Comparison of niv?olumab and sorafenib for first systemic therapy in patients with hepa?tocellular carcinoma and Child-Pugh B cirrhosis[J]. Cancer Med, 2023, 12(1): 189-199. DOI: 10.1002/cam4.4906.
[3] MARRERO JA, KUDO M, VENOOK AP, et al. Observational registry of sorafenib use in clinical practice across Child-Pugh subgroups: The GIDEON study[J]. J Hepatol, 2016, 65(6): 1140-1147. DOI: 10.1016/j.jhep.2016.07.020.
[4] MCNAMARA MG, SLAGTER AE, NUTTALL C, et al. Sorafenib as first-line therapy in patients with advanced Child-Pugh B hepatocel?lular carcinoma-a meta-analysis[J]. Eur J Cancer, 2018, 105: 1-9. DOI: 10.1016/j.ejca.2018.09.031.
[5] CHOI WM, LEE DB, SHIM JH, et al. Effectiveness and safety of nivolumab in child-pugh B patients with hepatocellular carcinoma: A real-world cohort study[J]. Cancers (Basel), 2020, 12(7): 1968. DOI: 10.3390/cancers12071968.
[6] OGUSHI K, CHUMA M, UOJIMA H, et al. Safety and efficacy of len?vatinib treatment in child-pugh A and B patients with unresectable hepatocellular carcinoma in clinical practice: A multicenter analysis[J]. Clin Exp Gastroenterol, 2020, 13: 385-396. DOI: 10.2147/CEG.S256691.
[7] KUDO M, MATILLA A, SANTORO A, et al. CheckMate 040 cohort 5: A phase I/II study of nivolumab in patients with advanced hepatocel?lular carcinoma and Child-Pugh B cirrhosis[J]. J Hepatol. 2021, 75(3): 600-609. DOI: 10.1016/j.jhep.2021.04.047.
[8] FINN RS, QIN SK, IKEDA M, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma[J]. N Engl J Med, 2020, 382(20): 1894-1905. DOI: 10.1056/NEJMoa1915745.
[9] KUDO M, FINN RS, QIN SK, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carci?noma: A randomised phase 3 non-inferiority trial[J]. Lancet, 2018, 391(10126): 1163-1173. DOI: 10.1016/S0140-6736(18)30207-1.
[10] FAN J, GAO Q. Immunotherapy for hepacellular carcinoma: where there is hope, there is brightness[J]. Chin J Dig Surg, 2022, 21(2): 199-204. DOI: 10.3760/cma.j.cn115610-20220215-00080.
樊嘉, 高强. 肝癌的免疫治疗:有希望便是光明[J]. 中华消化外科杂志, 2022, 21(2): 199-204. DOI: 10.3760/cma.j.cn115610-20220215-00080.
[11] General Office of National Health Commission. Standard for diagno?sis and treatment of primary liver cancer(2022 edition) [J]. J Clin Hepatol, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.
国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.
[12] MISCHEL AM, ROSIELLE DA. Eastern cooperative oncology group performance status #434[J]. J Palliat Med, 2022, 25(3): 508-510. DOI: 10.1089/jpm.2021.0599.
[13] LLOVET JM, LENCIONI R. mRECIST for HCC: Performance and novel refinements[J]. J Hepatol, 2020, 72(2): 288-306. DOI: 10.1016/j.jhep.2019.09.026.
[14] SEYMOUR L, BOGAERTS J, PERRONE A, et al. iRECIST: Guidelines for response criteria for use in trials testing immunotherapeutics[J]. Lancet Oncol, 2017, 18(3): e143-e152. DOI: 10.1016/s1470-2045 (17)30074-8.
[15] US Department of Health and Human Services, National Institutes of Health, National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE), Version 5.0. 2017. https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_5.0
[16] ABOU-ALFA GK, AMADORI D, SANTORO A, et al. Safety and effi?cacy of sorafenib in patients with hepatocellular carcinoma (HCC) and child-pugh A versus B cirrhosis[J]. Gastrointest Cancer Res, 2011, 4(2): 40-44.
[17] K?STNER AH, SORENSEN M, OLESEN RK, et al. Sorafenib in ad?vanced hepatocellular carcinoma: A nationwide retrospective study of efficacy and tolerability[J]. Sci World J, 2013, 2013: 931972. DOI: 10.1155/2013/931972.
[18] XIE ER, YEO YH, SCHEINER B, et al. Immune checkpoint inhibitors for child-pugh class B advanced hepatocellular carcinoma: A sys?tematic review and meta-analysis[J]. JAMA Oncol, 2023, 9(10): 1423-1431. DOI: 10.1001/jamaoncol.2023.3284.
[19] FINN RS, KUDO M, MERLE P, et al. LBA34 Primary results from the phase III LEAP-002 study: Lenvatinib plus pembrolizumab versus lenvatinib as first-line (1L) therapy for advanced hepatocellular car?cinoma (aHCC)[J]. Ann Oncol, 2022, 33: S1401. DOI: 10.1016/j.annonc.2022.08.031.
[20] QIN SK, CHAN SL, GU SZ, et al. Camrelizumab plus rivoceranib ver?sus sorafenib as first-line therapy for unresectable hepatocellular carci?noma (CARES-310): A randomised, open-label, international phase 3 study[J]. Lancet, 2023, 402(10408): 1133-1146. DOI: 10.1016/S0140-6736(23)00961-3.
[21] REN ZG, XU JM, BAI YX, et al. Sintilimab plus a bevacizumab biosimi?lar (IBI305) versus sorafenib in unresectable hepatocellular carci?noma (ORIENT-32): A randomised, open-label, phase 2-3 study[J]. Lancet Oncol, 2021, 22(7): 977-990. DOI: 10.1016/S1470-2045(21)00252-7.
[22] WU CJ, LEE PC, HUNG YW, et al. Lenvatinib plus pembrolizumab for systemic therapy-na?ve and-experienced unresectable hepato?cellular carcinoma[J]. Cancer Immunol Immunother, 2022, 71(11): 2631-2643. DOI: 10.1007/s00262-022-03185-6.
[23] XU JM, SHEN J, GU SZ, et al. Camrelizumab in combination with apa?tinib in patients with advanced hepatocellular carcinoma (RESCUE): A nonrandomized, open-label, phase II trial[J]. Clin Cancer Res, 2021, 27(4): 1003-1011. DOI: 10.1158/1078-0432.CCR-20-2571.
[24] TSUCHIYA K, KUROSAKI M, SAKAMOTO A, et al. The real-world data in Japanese patients with unresectable hepatocellular carcinoma treated with lenvatinib from a nationwide multicenter study[J]. Can?cers (Basel), 2021, 13(11): 2608. DOI: 10.3390/cancers13112608.
[25] KUO HY, CHIANG NJ, CHUANG CH, et al. Impact of immune check?point inhibitors with or without a combination of tyrosine kinase in?hibitors on organ-specific efficacy and macrovascular invasion in advanced hepatocellular carcinoma[J]. Oncol Res Treat, 2020, 43(5): 211-220. DOI: 10.1159/000505933.
[26] CASADEI GARDINI A, PUZZONI M, MONTAGNANI F, et al. Profile of lenvatinib in the treatment of hepatocellular carcinoma: Design, development, potential place in therapy and network meta-analysis of hepatitis B and hepatitis C in all Phase III trials[J]. Onco Targets Ther, 2019, 12: 2981-2988. DOI: 10.2147/OTT.S192572.
[27] PFISTER D, N??EZ NG, PINYOL R, et al. NASH limits anti-tumour surveillance in immunotherapy-treated HCC[J]. Nature, 2021, 592(7854): 450-456. DOI: 10.1038/s41586-021-03362-0.
[28] RIMINI M, RIMASSA L, UESHIMA K, et al. Atezolizumab plus bevaci?zumab versus lenvatinib or sorafenib in non-viral unresectable hepa?tocellular carcinoma: An international propensity score matching analysis[J]. ESMO Open, 2022, 7(6): 100591. DOI: 10.1016/j.esmoop.2022.100591.
收稿日期:2023-09-19; 录用日期:2023-10-18
本文编辑:朱晶
