1株六堡茶根际溶磷菌的鉴定、培养优化及促生与磷活化能力分析
2024-06-03马蕊覃爱颖刘迪
马蕊 覃爱颖 刘迪
摘要:自六堡茶根际分离得到1株高效溶磷菌菌株Lb-1,通过菌落形态及16S rRNA基因系统发育分析菌株的分类地位,并对其溶磷培养条件进行优化,利用盆栽试验研究其在土壤中的溶磷效果及对茶树的促生能力,以期为提高茶园土壤磷利用及开发微生物菌肥提供依据。结果表明,菌株Lb-1为贝莱斯芽孢杆菌(Bacillus velezensis),该菌株溶磷最佳碳源为葡萄糖,最佳氮源为胰蛋白胨,最佳初始pH值为6.0,最佳接种量为1%,最佳微量元素为Fe,最佳发酵温度为30 ℃,优化培养条件下溶磷量可达857.91 mg/L,且可显著提高菌株的柠檬酸、琥珀酸、丙二酸分泌量。盆栽试验表明,接菌处理下六堡茶鲜重、干重、株高、根系总长度、根系表面积、根系体积及磷含量分别显著提高59.09%、69.77%、38.75%、37.94%、44.82%、52.94%及108.35%,铝结合磷、闭蓄态磷含量显著降低,有效磷含量显著提高。综上,溶磷菌株Bacillus velezensis Lb-1可有效活化根际难溶磷、提高六堡茶树对磷的吸收及促进植株生长发育,或可作为开发磷高效菌肥的潜在资源。
关键词:芽孢杆菌;培养优化;六堡茶;磷活化;促生作用;溶磷菌
中图分类号:S182;S571.106 文献标志码:A
文章编号:1002-1302(2024)08-0226-07
收稿日期:2023-11-29
基金项目:2020年广西高等学校高水平创新团队及卓越学者计划(编号:桂教人才〔2020〕6号);2023年度广西高校中青年教师科研基础能力提升项目(编号:桂教科研〔2023〕2号2023KY1030、桂教科研〔2023〕2号2023KY1019);广西高等学校千名中青年骨干教师培育计划(编号:桂教教师[2022]60号)。
作者简介:马 蕊(1987—),女,黑龙江黑河人,硕士,副教授,从事茶叶生产加工及植物功能成分化学研究与教学工作。E-mail:313444924@qq.com。
磷(P)是植物生存和繁殖必需的大量营养素,同时也是核酸、膜磷脂以及许多能量代谢过程的重要组成部分[1]。许多土壤中,磷总含量范围为0.02%~0.50%[2],磷以多种形态存在,但植物仅能吸收同化无机二磷酸氢盐(Pi)和一磷酸氢盐,因此不足磷总量的0.1%可被植物吸收[3]。此外,Pi易与阳离子形成不溶性络合物,并且土壤磷的溶解度低、迁移性差,目前可利用性磷缺乏已成为全球农林业土壤中普遍存在的问题之一[4]。外源施用磷肥是现今人类补充农林业土壤有效磷含量的常规措施,然而施用到土壤中的Pi易被土壤矿物质和有机质固持,导致游离性磷减少[5],而土壤有效磷易随水体流动转移最终会导致富营养化[6]。因此,探索降低土壤固持磷以增加有效磷含量、提高植物磷利用,对农业可持续化发展至关重要。
挖掘溶磷菌(PSB)资源、探索PSB磷利用效率及其促生效果是提高土壤磷有效性的最佳策略[7]。目前,溶磷菌分离株已从多种环境中获得,包括植物体内、根际土壤、叶际及污水污泥等,其中假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)及泛菌属(Pantoea)是最具代表性的根际促生菌类群[8]。PSB在土壤中增溶磷的机制涉及将矿物溶解化合物(如有机酸阴离子和胞外酶)释放到土壤环境中,以及通过底物降解直接释放磷[9]。其中,分泌有机酸是PSB溶磷作用的核心机制,PSB可通过降低土壤pH值,增强与磷结合性阳离子的螯合,竞争土壤的磷吸附位点以及与不溶性磷相关的金属离子形成复合物等,从而提高土壤磷的有效性[10]。此外,PSB能够产生具有生理活性的吲哚-3-乙酸(IAA)、赤霉酸和铁载体等,从而多重影响植物的生长发育[11]。
六堡茶[Camellia sinensis (L.) Liubao]是我国名茶之一,因原产于广西壮族自治区苍梧县六堡镇而得名,是当地富农的特色产业和乡村振兴的支柱产业,也是广西大力发展的特色经济作物之一[12-13]。然而,由于茶树喜酸与长期化肥施用導致土壤酸化,从而使得土壤中的磷易被固持[14],磷缺乏一直是茶园生产面临的主要问题之一。采用生物策略以提高土壤固持磷的溶解度已成为茶叶田间生产的最佳选择。然而,在茶园弱酸乃至中酸性环境中,外源PSB可能因为环境恶劣以及与土著菌群竞争等因素而无法定殖[9,15]。有研究表明,来自同种类宿主的PSB往往能更好地定殖于相关植物的根际[16]。目前关于生长探索低磷土壤中茶树根际的潜在PSB资源的研究较少。本研究从茶树根际筛选得到的一株高效溶磷菌Lb-1,以其为对象,探索该菌株的培养条件,采用盆栽试验设计分析其对六堡茶生长及根际溶磷效果的影响,以期为茶树溶磷菌资源的培养优化及资源利用提供依据。
1 材料与方法
1.1 土壤来源与菌株的分离
带菌株的六堡茶根际土壤为笔者所在课题组2021年8月采集自广西苍梧县六堡茶茶园(23°39′48″N,111°35′27″E)。使用消毒的铲子和剪刀收集,将紧贴侧根的约50 g土壤样品收集在消毒塑料袋中,置于4 ℃冰箱中带回实验室,保存于 -80 ℃ 冰箱,根系外围包裹土壤用于后续盆栽基质用土。
称取约10.0 g根际土壤至无菌锥形瓶中,采用0.85%无菌生理盐水进行系列梯度(10-2、10-4、10-6)稀释[17],将梯度稀释的100 μL悬浮液等分试样涂在胰蛋白胨大豆琼脂(TSA)培养基平板上。将培养物在28 ℃下培养7 d,随后根据透明光晕的外观从平板中选择晕圈较清晰、较大的细菌菌落进行纯化培养,多次纯化培养后备注命名为Lb-1,储存在-20 ℃的甘油储备液中。
1.2 溶磷菌Lb-1的分子鉴定
采用细菌DNA试剂盒[DP302,天根生化科技(北京)有限公司]提取基因组DNA,使用引物 27F-5′-AGAGTTTGATCCTGGCTCAG-3′和1492 R-5′-GGTTACCTTGTTACGACTT-3′对Lb-1菌株的基因进行PCR扩增。PCR反应体系、PCR热循环参数参照陈海念等所述[18],Lb-1菌株的16S rRNA采用国家生物技术信息中心(NCBI)GenBank数据库中的序列进行比较,基于邻接法采用MEGA 7.0系统构建系统发育树。分子鉴定工作委托生工生物工程(上海)股份有限公司完成。
1.3 溶磷菌Lb-1的溶磷条件优化
在溶磷条件优化试验中分别采用不同碳源(葡萄糖、麦芽糖、山梨糖、果糖、蔗糖),不同氮源(尿素、草酸铵、硝酸钾、酵母粉、胰蛋白胨)替代常规NBRIP培养基中的碳、氮源;同时基于常规NBRIP培养基,调节培养液的pH值(4.0、5.0、6.0、7.0、8.0)、培养温度(25、28、30、32、35 ℃)、微量元素含量(Mg、Mn、B、Fe、Mo)以及菌株悬浊液的接种量(1%、2%、3%、4%、5%),其中微量元素用量皆为 1 g/L;上清液的有效磷含量、pH值分别采用钼锑抗比色法、电位法测定[19]。
1.4 基于溶磷条件优化下的溶磷效果及有机酸含量测定
分别取已活化的Lb-1菌柄至最优碳源、氮源、pH值、培养温度、微量元素组合的NBRIP液体培养基中,采用110 r/min、25 ℃摇床培养后,于 800 r/min 离心机离心后取上清液。上清液的磷含量用钼锑抗比色法测定;采用超高效液相色谱仪(UltiMate3000,美国赛默飞世尔科技公司)测定有机酸的种类及含量,相关液相色谱条件、流动相、仪器柱温及进样设置参考Zhang等所述[20]。
1.5 溶磷菌Lb-1对六堡茶幼苗促生与解磷效果试验
1.5.1 盆栽试验
盆栽试验于2022年4—7月在广西职业技术学院进行。采用无菌蛭石将六堡茶幼苗培养至3叶期。设置不接种(CK)、接菌处理(LB),各处理重复8次,共16盆。
将幼苗移植到装有1 kg不灭菌土壤的塑料盆中,该土壤为六堡茶根系包裹土壤,其理化特征如下:pH值为5.57,有效磷含量为8.86 mg/kg。接菌处理按最优接种量接种15 mL Lb-1菌株悬浊液,未接菌处理施入15 mL无菌培养液。试验期间,室内光暗周期为14 h/10 h,温度为28 ℃/22 ℃,空气湿度为75%~90%,光照时间中光照度为3 600 lx,盆栽周期为36 d。
1.5.2 指标测定
收获全部盆栽中的植物,将茶树全部取出,小心清洗根系,茶树幼苗的株高采用卷尺测量,采用EPSON V700 Photo扫描仪对根系进行扫描测量根系总根长,采用WIRHizo Basic 2013C软件(Regent Instruments Inc.,加拿大)进行测定分析;将茶树在105 ℃杀青30 min,70 ℃烘干记录干重。茶树总磷含量采用钒钼黄比色法测定[19]。
盆栽收获后收集茶树根际土,根际溶磷菌数采用平板稀释计数法进行测定。根际土铝磷(Al-P)及闭蓄态磷(O-P)含量的测定参考《土壤农业化学分析方法》中酸性土壤无机磷形态的分级测定[21]。土壤有效磷含量采用碳酸氢钠浸提-钼锑抗比色法测定。
1.6 数据处理与统计分析
采用SPSS 22.0软件進行方差分析,采用邓肯氏多重比较进行试验数据的统计分析,相关图形采用Origin 10.0绘制。
2 结果与分析
2.1 溶磷菌Lb-1的形态、溶磷能力及分子生物学鉴定
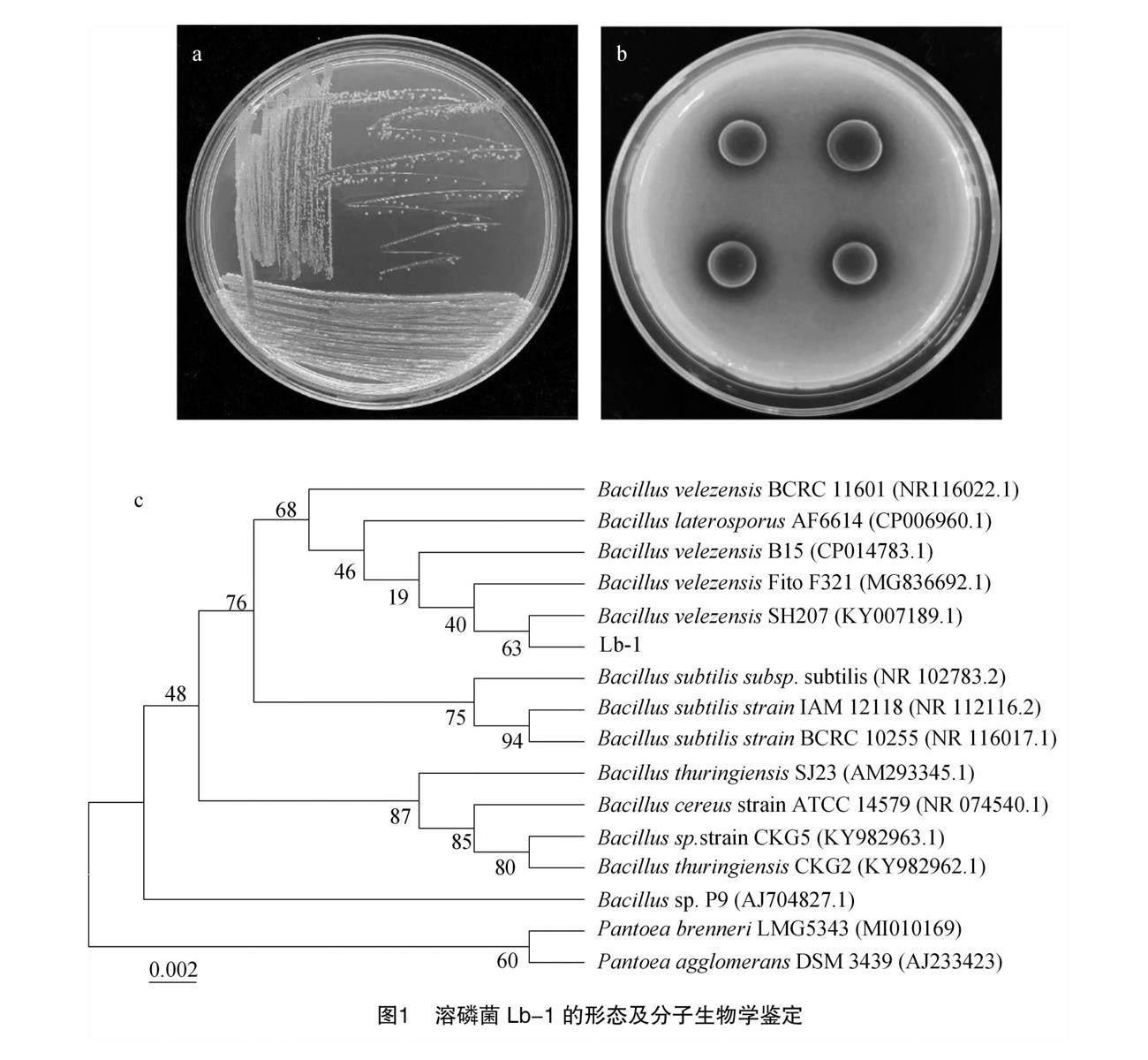
由图1-a可知,在TSA培养基上进行30 ℃环境培养24 h后,可见菌株Lb-1菌落呈椭圆杆状、光滑、黏液状、隆起形状,边缘清晰,说明菌株Lb-1可在室内进行分离培养。在NBRIP培养基培养条件下,接种Lb-1的4个位置中,对Ca3(PO4)2均具有较佳的溶解效果(图1-b)。
由图1-c可知,采用16S rRNA基因测序,测序结果通过NCBI数据库进行BLAST比对,其识别号为MWE73N01;采用邻接法构建系统发育树,选取相似度较高的序列及成团泛菌(Pantoea agglomerans)等相似度较低的菌株序列为外群,结果显示菌株Lb-1与贝莱斯芽孢杆菌(Bacillus velezensis SH207,序列号:KY007189.1)在同一分支上,BLAST比对相似性高达99.57%,确定菌株 Lb-1 为贝莱斯芽孢杆菌(B. velezensis)。
2.2 溶磷菌Lb-1溶磷条件的优化与结果
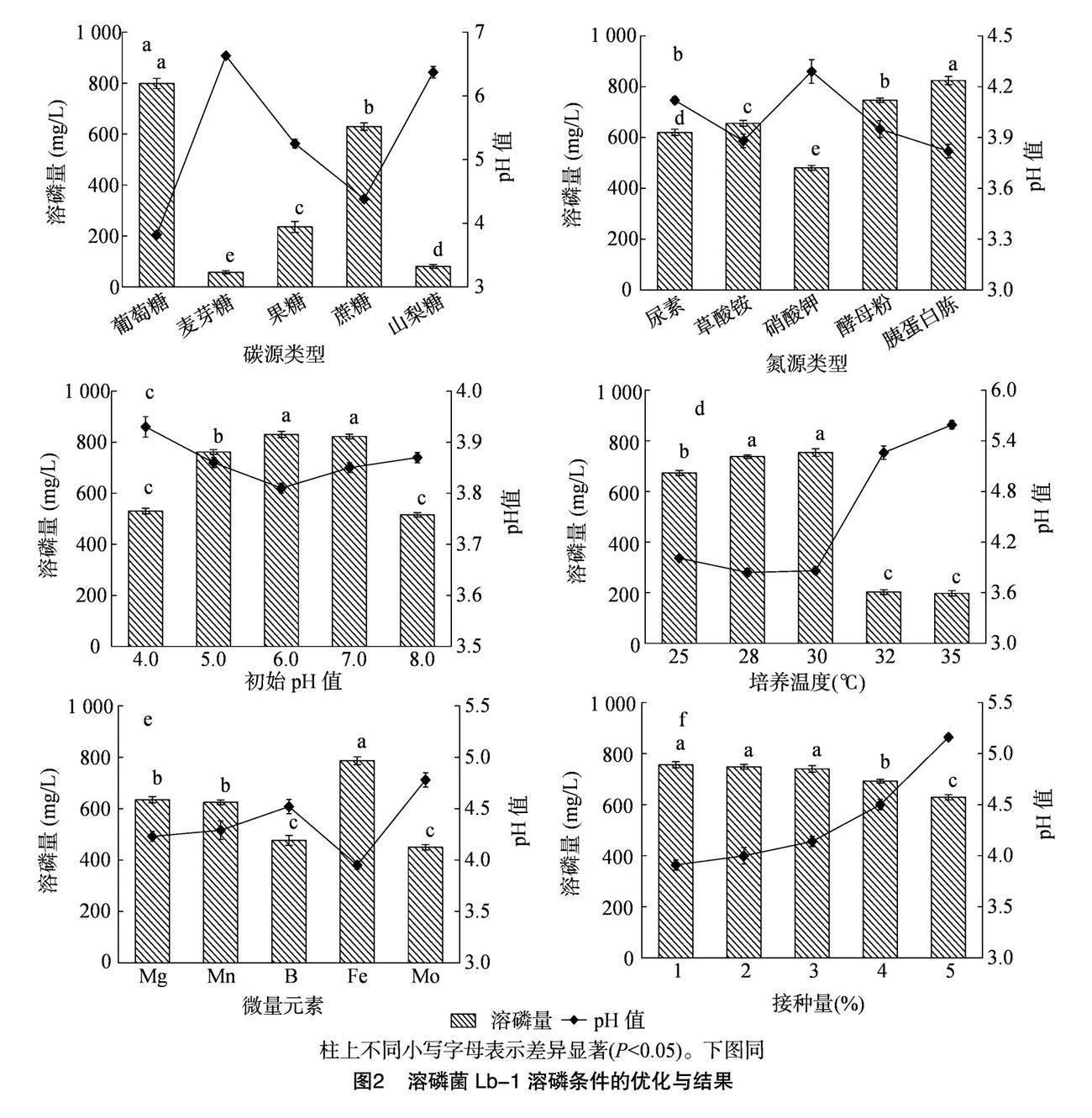
由图2-a可知,菌株B. velezensis Lb-1对不同碳源条件下的溶磷量表现为麦芽糖<山梨糖<果糖<蔗糖<葡萄糖,其中以葡萄糖为碳源时菌株Lb-1的溶磷量最高,为798.51 mg/L,与葡萄糖相比,麦芽糖、果糖、蔗糖及山梨糖处理的溶磷量分别显著(P<0.05)降低92.80%、70.47%、21.17%、89.92%。因此葡萄糖为菌株Lb-1发挥溶磷效果的最佳碳源。由图2-b可知,菌株Lb-1在5种氮源(尿素、草酸铵、硝酸钾、酵母粉、胰蛋白胨)中的溶磷量从大到小依次为硝酸钾<尿素<草酸铵<酵母粉<胰蛋白胨,两两氮源类型间差异显著,其中以胰蛋白胨为氮源时溶磷量最高,为824.46 mg/L,表明胰蛋白胨是菌株Lb-1的最佳溶磷氮源。由图 2-c 可知,在不同初始pH值下,菌株Lb-1的溶磷量为515.35~830.45 mg/L,其中pH值为6.0、7.0时溶磷量较高,二者pH值间差异不显著。其中,pH值为6.0更趋近于Lb-1的原始生长环境(pH值=5.57),pH值为6.0时溶磷量为830.45 mg/L,其他初始pH值较其降低0.99%~37.94%。由图2-d可知,在25~35 ℃菌株Lb-1溶磷量高低表现为35 ℃<32 ℃<25 ℃<28 ℃<30 ℃,培养温度为 30 ℃ 时溶磷量达754.03 mg/L,此时pH值为3.86;而当培养温度分别为32、35 ℃时,溶磷量较低,分别为202.57、197.44 mg/L,二者温度条件差异不大,且两者溶磷量显著低于较低培养温度(25、28、30 ℃)。由图2-e可知,添加的5种微量元素(Mg、Mn、B、Fe、Mo)中, 溶磷效果顺序依次为Mo<B<Mn<Mg<Fe,以Fe为微量元素时,其溶磷量为786.54 mg/L,Mg、Mn、B、Mo较其分别显著降低19.33%、20.57%、39.45%、42.83%。因此,选择Fe为最佳微量元素。 由图2-f可知,在1%~5%
接种量中,随着接种量的增加,菌株Lb-1的溶磷量随之逐渐降低,但1%、2%、3%接种量间差异不显著;当接种量大于3%时,溶磷量显著降低,尤其表现在5%接种量。接种量为1%时,溶磷量最高(756.11 mg/L),此时pH值为3.91。因此,菌株 Lb-1 溶磷的最佳接种量为1%。
2.3 培养优化条件下溶磷菌Lb-1的有机酸分泌水平
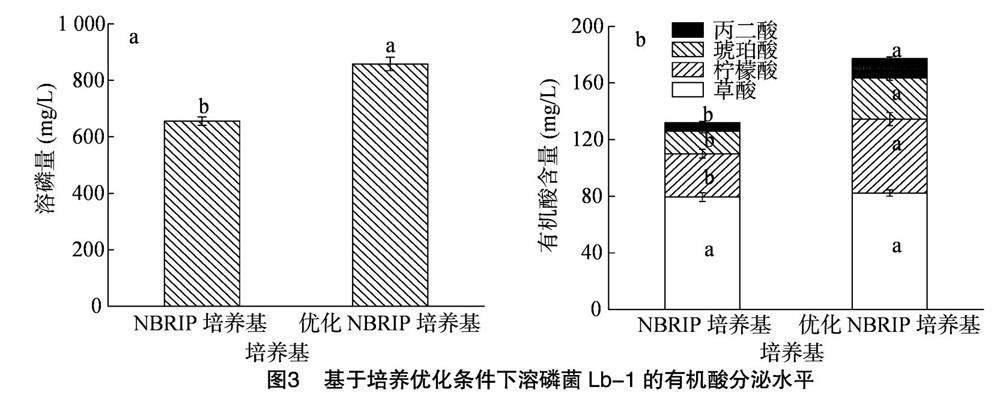
由图3-a可知,基于常规NBRIP培养基、优化NBRIP培养基条件下,B. velezensis Lb-1对 Ca3(PO4)2 的溶解效果具有显著差异,溶磷量分别为655.91、857.91 mg/L,与常规NBRIP培养基相比,菌株Lb-1在优化处理的NBRIP培养基中溶磷量显著提高30.89%。采用高效液相色谱法对二者的有机酸种类及含量进行测定,结果显示Lb-1在2种培养基中的有机酸种类完全一致,即均由草酸、柠檬酸、琥珀酸、丙二酸组成,但不同有机酸含量存在一定差异;其中与常规NBRIP培养基相比,优化NBRIP培养基草酸、柠檬酸、琥珀酸、丙二酸分别提高3.59%、70.65%、80.67%、131.36%,其中Lb-1在优化NBRIP培养基中的柠檬酸、琥珀酸、丙二酸含量显著高于常规NBRIP培养基。
2.4 溶磷菌Lb-1的盆栽定殖及溶磷效果
由图4-a可知,在盆栽0~16 d,菌株 B. velezensis Lb-1在六堡茶根际的数量整体呈增加趋势,同时在盆栽16 d菌落数量最高,为6.49×107 CFU/g;此后其菌落数量开始下降,且在16~36 d 期间,菌落数量较为稳定。由图4-b可知,在闭蓄态磷(Obs-P)含量中,随着盆栽周期延长,CK处理的Obs-P含量呈先降低后增加趋势,而LB处理则表现为逐渐降低趋势;同一盆栽培养时间中,除0 d外,16、36 d中与CK处理相比,LB分别显著降低35.09%、44.48%。不同培养阶段CK、LB处理的铝结合磷(Al-P)含量规律与Obs-P含量基本一致(图4-c)。由图4-d可知,随着培养周期的延长,CK处理的土壤有效磷(AP)含量随之显著降低,而LB处理呈先增加后降低趋势;此外,在16、36 d时,均以LB的AP含量显著大于CK处理的AP含量。
2.5 溶磷菌Lb-1的促生效果
由表1可知,B. velezensis Lb-1在酸性土壤中具有良好的促生长作用,可以显著促进六堡茶幼苗的生长发育与磷吸收处理。36 d菌株Lb-1处理六堡茶的鲜重、干重、株高、根系总长度、根系表面积、根系体积分别为5.95 g/株、1.46 g/株、28.18 cm、105.19 cm、16.77 cm2、0.52 cm3,较CK处理分别显著提高59.09%、69.77%、38.75%、37.94%、44.82%、52.94%。此外,LB處理植株全磷含量为28.46 mg/株,较CK显著提高108.35%。综上,菌株B. velezensis Lb-1对六堡茶植株具有较好的促生作用。
3 结论与讨论
芽孢杆菌属是植物根际重要的微生物组成部分,大量研究表明,芽孢杆菌具有解钾、螯合铁及分泌促生物质等功能;此外,芽孢杆菌是主要溶磷微生物菌群之一,其可有效溶解难溶性磷转化为可溶性磷酸盐[22]。张文韬等研究表明,从野生大豆根瘤内分离出的高地芽孢杆菌(Bacillus altitudinis)菌株Y1对有机、无机磷的溶磷量分别为71.48、152.36 mg/L[23];初旭等研究表明,来自杉木根际的苏云金芽孢杆菌(Bacillus thuringiensis CX-7)对磷酸钙、铁结合磷和铝结合磷具有较强的溶解能力,且在pH值为5~6和温度为20~30 ℃ 培养条件下,该菌株的溶磷能力最为稳定[24]。本研究中,采用NBRIP培养基培养显示,从六堡茶根际得到的菌株Lb-1可产生明显的溶菌圈(图 1-b),说明菌株Lb-1具有优良的溶磷功能。采用16S rRNA基因测序、BLAST比对显示,菌株Lb-1与贝莱斯芽孢杆菌SH207高度相似,确定菌株Lb-1为贝莱斯芽孢杆菌。
碳、氮及微量元素是微生物完成生长史的主要营养物质,充足而适宜的养分供应可显著影响微生物的生长繁殖、发育代谢及功能发挥[25]。李思思等研究发现,假单胞菌(Pseudomonas sp.)的最佳碳源为葡萄糖、最佳氮源为硫酸铵、最佳初始pH值为7.0、最佳发酵温度为28 ℃,溶磷量最高可达 827.12 mg/L[26]。本研究结果表明,菌株Bacillus velezensis Lb-1以葡萄糖为碳源时,具有较高的溶磷量;在氮源利用方面,菌株对酵母粉、胰蛋白胨的利用效果较好,即该菌株更倾向于有机氮源。这与郑喜清等的研究结果存在差异:来自玉米根际的巨大芽孢杆菌(Bacillus megaterium)PB3在无机氮源,尤其是硝酸钠为氮源条件下溶磷效果最为显著[27];芽孢杆菌属的2株菌株对氮源喜好差异的原因可能是由于原生环境差异所致,本研究土壤取自茶树根际,茶园补充氮肥较少,因此微生物多以利用有机氮源为主[28]。本研究试验结果表明,以葡萄糖为碳源、胰蛋白胨为氮源、初始pH值为6.0、接种量为1%、微量元素为Fe、发酵温度为30 ℃时,最有利于提高菌株B. velezensis Lb-1的溶磷能力。
溶磷菌增溶矿物磷的主要机制与分泌低分子量有机酸阴离子有关,这些阴离子可通过其羟基和羧基螯合磷酸盐结合阳离子以可溶形式释放磷[2,29]。不同溶磷菌分泌的有机酸种类往往存在差异,且不同培养条件所产生的有机酸种类和含量也可能不尽相同[30]。本研究中,基于葡萄糖为碳源、胰蛋白胨为氮源、初始pH值为6.0、接种量为1%、微量元素为Fe、发酵温度为30 ℃的最佳优化培养条件下,菌株Lb-1的溶磷效果显著提高30.89%,达857.91 mg/L。此外,有机酸种类及含量的试验表明,优化培养条件可影响菌株Lb-1的有机酸含量,其中柠檬酸、琥珀酸、丙二酸含量显著增加。
溶磷菌良好的室内效果是反映其能否成为潜在菌肥资源的重要前提,而实际的田间存活效率及功能作用是决定其最终应用潜力的参考[15,31]。本研究结果表明,菌株B. velezensis Lb-1在六堡茶根际数量在前中期持续增加,此后其菌落数量下降,菌落数量仍较高,表明该菌株均有良好的环境适应能力。在溶磷微生物的筛选研究中,菌株的实际促生、解磷效果是决定其是否由实验室走向田间的重要参考[32]。本研究结果表明,施加B. velezensis Lb-1 处理组的六堡茶鲜重、干重、株高、根系总长度、根系表面积、根系体积及磷含量分别显著提高59.09%、69.77%、38.75%、37.94%、44.82%、52.94%及108.35%。且培养过程中铝结合磷、闭蓄态磷含量显著降低、有效磷含量显著提高。说明该菌株可有效活化根际难溶磷、提高六堡茶树对磷的吸收及促进植株生长发育。
参考文献:
[1]孙 艳,洪婉婷,韩 阳,等. 植物内部磷循环利用提高磷效率的研究进展[J]. 植物营养与肥料学报,2021,27(12):2216-2228.
[2]Cho H,Bouain N,Zheng L Q,et al. Plant resilience to phosphate limitation:current knowledge and future challenges[J]. Critical Reviews in Biotechnology,2021,41(1):63-71.
[3]刘 瑾,杨建军. 近三十年农田土壤磷分子形态的研究进展[J]. 土壤学报,2021,58(3):558-567.
[4]何 敏,许秋月,夏 允,等. 植物磷获取机制及其对全球变化的响应[J]. 植物生态学报,2023,47(3):291-305.
[5]王经纬,王艳玲,姚 怡,等. 长期施肥对旱地红壤团聚体磷素固持与释放能力的影响[J]. 土壤学报,2017,54(5):1240-1250.
[6]韦高玲,卓慕宁,廖义善,等. 不同施肥水平下菜地耕层土壤中氮磷淋溶损失特征[J]. 生态环境学报,2016,25(6):1023-1031.
[7]吕 俊,王晓娅. 溶磷微生物及其对植物促生作用的研究进展[J]. 中国土壤与肥料,2023(1):231-239.
[8]温佳旭,陈雪丽,肖 洋,等. 土壤中主要溶磷菌种类及其作用机制[J]. 北方园艺,2023(14):139-145.
[9]陶冬雪,高英志. 土壤解磷微生物促进植物磷素吸收策略研究进展[J]. 生态学报,2023,43(11):4390-4399.
[10]师仁增,邓 霞,田 琳,等. 植物根系分泌物对解磷微生物的影响研究进展[J]. 山东农业科学,2023,55(8):174-180.
[11]吴玉洪,冷超凡,陈莹莹,等. 贝莱斯芽孢杆菌BMF03对黄瓜幼苗促生长作用及其生物学功能研究[J]. 东北农业科学,2023,48(3):106-111.
[12]彭学锐,周思裕,陈 翔,等. 广西梧州六堡茶主产区茶叶-土壤重金属污染现状及源解析[J]. 农业环境科学学报,2023,42(10):2231-2243.
[13]马 蕊,林 勇,马婷婷. 丛枝菌根真菌对六堡茶茶叶品质及其相关基因表达的影响[J]. 江苏农业科学,2022,50(17):157-163.
[14]颜 鹏,韩文炎,李 鑫,等. 中国茶园土壤酸化现状与分析[J]. 中国农业科学,2020,53(4):795-813.
[15]池景良,郝 敏,王志学,等. 解磷微生物研究及应用进展[J]. 微生物学杂志,2021,41(1):1-7.
[16]薛应钰,叶 巍,杨 树,等. 一株溶磷菌的分离鉴定及溶磷促生作用[J]. 干旱地区农业研究,2019,37(4):253-262.
[17]王 君,范延辉,尚 帅,等. 一株根际解磷菌的筛选鉴定及溶磷促生作用[J]. 中国土壤与肥料,2022(6):195-203.
[18]陈海念,冯 蓉,杨胜竹,等. 1株生防菌的鉴定及其发酵条件优化[J]. 浙江大学学报(农业与生命科学版),2020,46(2):177-188.
[19]鲍士旦. 土壤农化分析[M]. 2版.北京:中国农业出版社,2000.
[20]Zhang H,Chen Q F,Shang N,et al. The enhanced mechanisms of Hansschlegelia zhihuaiae S113 degrading bensulfuron-methyl in maize rhizosphere by three organic acids in root exudates[J]. Ecotoxicology and Environmental Safety,2021,223:112622.
[21]鲁如坤. 土壤农业化学分析方法[M]. 2版.北京:中国农业科学技术出版社,2000:63-67.
[22]Zhang N,Wang Z Q,Shao J H,et al. Biocontrol mechanisms of Bacillus:improving the efficiency of green agriculture[J]. Microbial Biotechnology,2023,16(12):2250-2263.
[23]张文韬,杨 皓,毛国豪,等. 一株高地芽孢杆菌的鉴定与促生能力研究[J]. 江苏农业科学,2022,50(5):225-229.
[24]初 旭,胡 霞,刘 静,等. 杉木根际溶磷菌的筛选鉴定及溶磷能力分析[J]. 西南林业大学学报(自然科学),2021,41(2):85-92.
[25]武若楠,周 莉,刘守德,等. 解淀粉芽孢杆菌BSK532的发酵条件优化及抑菌活性研究[J]. 化学与生物工程,2023,40(3):36-43.
[26]李思思,符运会,罗 宇,等. 一株高效溶磷菌的条件优化及其促生特性研究[J]. 河南农业科学,2022,51(11):73-81.
[27]郑喜清,邸 娜,张志超,等. 解磷细菌的分离筛选及培养条件优化[J]. 天津农业科学,2020,26(3):44-48.
[28]陈玉真,王 峰,吴志丹,等. 林地轉变为茶园对土壤固氮菌群落结构及多样性的影响[J]. 应用与环境生物学报,2020,26(5):1096-1106.
[29]Ma Q H,He S W,Wang X,et al. Isolation and characterization of phosphate-solubilizing bacterium Pantoea rhizosphaerae sp. nov. from Acer truncatum rhizosphere soil and its effect on Acer truncatum growth[J]. Frontiers in Plant Science,2023,14:1218445.
[30]尚晓静,侯 瑞,徐芳玲,等. 2株蓝莓溶磷内生真菌的筛选、鉴定及溶磷效果评价[J]. 江苏农业科学,2022,50(20):246-252.
[31]董 璐,王立新. 生物炭与不同芽孢杆菌配施对万寿菊基质性质及微生物群落组成的影响[J]. 北方园艺,2023(17):61-69.
[32]陈容彬,左振宇,黄博慧,等. 一株伯克霍尔德菌的筛选鉴定及溶磷性能优化[J]. 应用生态学报,2022,33(6):1669-1678.
