2型糖尿病并发肌少症患者血清Hcy、25(OH)D3、IL-6、TNF-α水平及相关性研究
2024-05-30苗翠晓张晓青董学勤安艳荣
苗翠晓,张晓青,谭 宓,马 楠,董学勤,安艳荣
肌少症临床特点主要为肌肉总量减少、肌肉力量下降,并伴不同程度的功能衰退,好发于中老年群体。疾病进展严重者可能导致残疾,甚至造成死亡[1-2]。有研究者发现,2型糖尿病(type 2 diabetes mellitus, T2DM)患者在起病初期阶段,也会有肌肉质量和功能丢失的类似症状,故T2DM患者为肌少症的好发人群[3]。T2DM并发肌少症老年患者面对应激事件的反应及处理能力降低,容易增加跌倒发生骨折的风险,不仅造成严重的医疗负担,还影响患者生活质量。当前,临床关于T2DM并发肌少症,多认为与慢性炎症反应、神经损伤和胰岛素抵抗等因素有关[4-5]。同型半胱氨酸(Hcy)是蛋氨酸和半胱氨酸代谢的中间产物,已有研究证实,高Hcy水平与老年人体能下降有关[6]。宝群等[7]研究发现,Hcy水平升高是维持性血液透析患者发生肌少症的独立危险因素,因此推测Hcy水平与肌少症之间或许存在某种内在联系。25-羟基维生素D3[25(OH)D3]可以较好反映机体内维生素D代谢水平,而肌少症发生与维生素D缺乏有关[8]。炎性因子可以促进肌肉萎缩,最终刺激蛋白质分解代谢,抑制肌肉合成。有研究发现,T2DM并发肌少症患者C反应蛋白水平明显高于未合并肌少症患者[5],故认为炎性因子水平与肌少症存在相关性,但目前25(OH)D3和炎性因子表达与肌少症的具体机制与关系尚不明朗。此次研究分析并探讨T2DM患者血清Hcy、25(OH)D3和炎性因子水平情况及其与肌少症的关系,旨在为临床提供一定参考。
1 资料与方法
1.1 一般资料
选取2023年1—12月石家庄市人民医院收治的30例T2DM并发肌少症作为肌少症组,另选取同期收治的30例单纯T2DM作为无肌少症组。
纳入标准:1)符合T2DM诊断标准[9];2)肌少症组满足肌少症诊断标准[10]:a.男性骨骼肌质量指数(SMI)<7.0 kg/m2、女性SMI<5.4 kg/m2,b.男性握力<28.0 kg、女性握力<18.0 kg,c.步速<1.0 m/s。符合a且满足b和(或)c即可诊断。3)年龄≥18岁。
排除标准:严重肝肾功能不全;合并严重心脑血管疾病,并存在后遗症者,如肢体活动受限;合并恶性肿瘤、甲状旁腺功能障碍性疾病或肾上腺疾病;合并骨关节或神经系统疾病;长期卧床者;临床资料欠缺者。本研究经石家庄市人民医院医学伦理委员会审批通过[院科伦审【2024】第(004)号],患者均知情同意。
1.2 研究方法
1)临床资料搜集:收集患者入院时相关资料,包括性别、年龄、体质量指数(BMI)、T2DM病程、空腹血糖(FBG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)。
2)实验室指标检测:所有入组对象在入院禁食8 h后收集空腹静脉血,并离心处理(3 000 r/min,10 min,离心半径15 cm)。采用双循环酶法测定血清Hcy水平,试剂盒购自杭州中翰盛泰医疗器械有限公司。采用化学发光法测定25(OH)D3水平,试剂盒购自四川沃文特技术有限公司。采用多重微球流式免疫荧光发光法测定白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平,试剂盒购自瑞斯凯尔生物科技有限公司。
3)步速与握力检测:所有入组对象在入院时以6 m步行速度评价T2DM患者步行速度是否异常,若测定<0.8 m/s则为步速下降。在T2DM患者静息状况下,握力测试器测量优势手的握力,测量3次后取均值,男性<28 kg和女性<18 kg为肌力下降。测试人员均为我院专业检测人员。
4)肌少症五项评分问卷(SARC-F)评分[11]:所有入组对象在入院时进行测评,包括肌肉力量、行走辅助和自行从椅子上坐起等5个条目,总分0~10分,评分越高提示患者肌少症症状越严重。测评人员均为我院经统一培训后的专业人员。
1.3 观察指标
比较肌少症组与无肌少症组一般资料、步速、握力、SARC-F评分及血清Hcy、25(OH)D3、IL-6、TNF-α水平。分析血清Hcy、25(OH)D3、IL-6和TNF-α诊断T2DM并发肌少症的价值;分析T2DM并发肌少症患者血清Hcy、25(OH)D3、IL-6和TNF-α与步速、握力、SARC-F评分的关系。
1.4 统计学方法
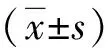
2 结果
2.1 肌少症组与无肌少症组一般资料比较
肌少症组与无肌少症组一般资料比较差异无统计学意义(P>0.05)。见表1。
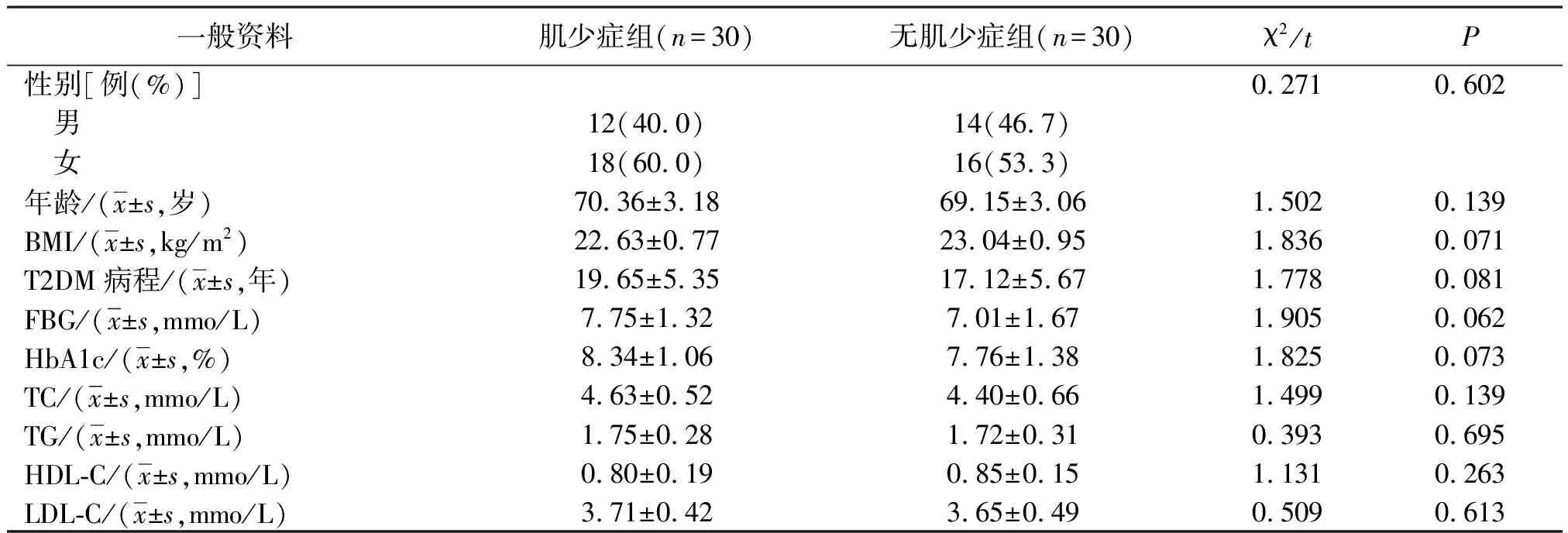
表1 肌少症组与无肌少症组患者一般资料比较
2.2 肌少症组与无肌少症组步速、握力和SARC-F评分比较
肌少症组步速、握力低于无肌少症组,SARC-F评分高于无肌少症组(P<0.05,P<0.01)。见表2。

表2 肌少症组与无肌少症患者步速、握力和SARC-F评分比较
2.3 肌少症组与无肌少症组血清Hcy、25(OH)D3水平比较
肌少症组血清Hcy水平高于无肌少症组,25(OH)D3水平低于无肌少症组(P<0.01)。见表3。

表3 肌少症组与无肌少症患者血清Hcy、25(OH)D3水平比较
2.4 肌少症组与无肌少症组炎性因子水平比较
肌少症组血清IL-6、TNF-α水平较无肌少症组高(P<0.01)。见表4。
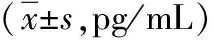
表4 肌少症组与无肌少症患者炎性因子水平比较
2.5 ROC曲线分析血清Hcy、25(OH)D3、IL-6和TNF-α诊断T2DM并发肌少症的价值
将入组患者血清Hcy、25(OH)D3、IL-6和TNF-α作为检测变量,将肌少症作为状态变量(1=肌少症,0=无肌少症),绘制ROC曲线,结果显示:血清Hcy、25(OH)D3、IL-6和TNF-α及联合检测诊断T2DM并发肌少症的曲线下面积(AUC)均较高,均>0.700,诊断价值较好,且以联合检测诊断价值最佳。见表5和图1。
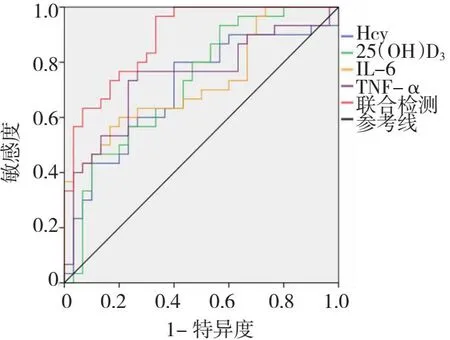
Hcy为同型半胱氨酸,25(OH)D3为25-羟基维生素D3,IL-6为白细胞介素-6,TNF-α为肿瘤坏死因子-α,T2DM为2型糖尿病,ROC为受试者工作特征。

表5 血清Hcy、25(OH)D3、IL-6和TNF-α诊断T2DM并发肌少症的ROC曲线分析
2.6 Pearson相关性分析T2DM并发肌少症患者Hcy、25(OH)D3、IL-6和TNF-α与步速、握力、SARC-F评分的关系
T2DM并发肌少症患者血清Hcy、IL-6、TNF-α与步速、握力呈负相关(P<0.01),与SARC-F评分呈正相关(P<0.01);25(OH)D3与步速、握力呈正相关(P<0.01),与SARC-F评分呈负相关(P<0.01)。见表6和图2。

表6 Pearson相关性分析T2DM并发肌少症患者Hcy、25(OH)D3、IL-6和TNF-α与步速、握力、SARC-F评分的关系

T2DM为2型糖尿病,Hcy为同型半胱氨酸,25(OH)D3为25-羟基维生素D3,IL-6为白细胞介素-6,TNF-α为肿瘤坏死因子-α,SARC-F为肌少症五项评分问卷。
3 讨论
肌肉与骨骼可以维持机体内外环境稳定,但随着年龄增长,肌量和肌强度会逐渐衰退,导致肌少症发生[12-14]。T2DM好发于中老年群体,因该类人群身体各项功能减退,并存在胰岛素抵抗的病理现象,较难完全摄取并代谢葡萄糖,致肌肉组织总量降低,骨骼收缩力较年轻时明显减退[15-16]。探索T2DM与肌少症之间的关系有利于了解其发病机制,进而更好指导临床工作。本次研究发现,肌少症组步速、握力低于无肌少症组,SARC-F评分高于无肌少症组。步速、握力和SARC-F评分均是诊断肌少症及评估疾病严重程度的重要参考依据,可以较好反映肌肉的功能和强度。
本次研究结果显示,肌少症组血清Hcy水平高于无肌少症组,25(OH)D3水平低于无肌少症组。既往研究显示,Hcy水平的升高与肌肉力量的加速下降有关[17]。结合本次研究结论可以认为Hcy表达水平与肌少症之间存在某种潜在关系,或许与下列3个因素有关:1)Hcy升高会降低线粒体功能,限制肌肉的收缩能力导致肌肉功能降低;2)Hcy还可使基质金属蛋白酶-9诱导炎症反应,引起骨骼肌细胞损伤及骨骼肌纤维化;3)Hcy还可增加机体氧化应激反应,增强P38丝裂原活化蛋白激酶信号通路最终导致肌无力。维生素D可以调节钙磷代谢、促进骨骼发育,维持骨骼肌、平滑肌的神经电生理活动,还可刺激骨骼肌纤维增殖与分化,改善肌力[18-20]。本次研究结果显示,肌少症组25(OH)D3水平明显偏低,提示维生素D可能参与肌少症的发生。分析可能原因为,T2DM患者随着疾病进展,钙磷代谢和糖脂代谢紊乱更加严重,导致机体对维生素D吸收功能减退,进而使T2DM患者肌肉质量和肌力下降,发生肌少症。
本次研究发现,肌少症组血清IL-6、TNF-α水平高于无肌少症组,与王一栋等[21]研究结论部分类似。肌少症与高龄患者慢性炎症感染有某种关联,其特征表现为IL-6、TNF-α水平升高。IL-6不仅是一种促炎细胞因子,还是一种肌生长因子,可以由骨骼肌细胞分泌,还可由身体内环境调节肌肉合成或代谢[22-24]。故推测IL-6水平长期较高可能导致肌肉萎缩,并影响肌肉的分解与代谢状态。TNF-α不仅参与细胞增殖、分化和免疫反应,还可促进骨细胞生长,抑制碱性磷酸酶活性,并促使骨形成受阻,导致骨骼的吸收能力障碍[25]。本次研究结果显示肌少症组患者IL-6、TNF-α均为较高水平,其原因可能是IL-6和TNF-α等炎性因子通过激活泛素蛋白酶体途径,促进骨骼肌细胞中蛋白质的分解能力,进而导致肌少症发生。
绘制ROC曲线显示,血清Hcy、25(OH)D3、IL-6和TNF-α诊断T2DM并发肌少症的AUC均>0.700,价值较为理想,且联合诊断效果更好。可见上述指标联合检测有助于进一步提高T2DM并发肌少症的诊断率。进一步相关性分析后发现,T2DM并发肌少症患者血清Hcy、IL-6、TNF-α与步速、握力呈负相关,与SARC-F评分呈正相关;25(OH)D3与步速、握力呈正相关,与SARC-F评分呈负相关。步速、握力、SARC-F评分为肌少症病情评估的常见参数,说明Hcy、25(OH)D3和炎性因子可促进肌少症疾病进展,临床可以通过上述指标检测评估肌少症疾病严重程度。
综上,T2DM并发肌少症患者血清Hcy、IL-6、TNF-α水平明显升高,25(OH)D3水平明显降低,共同参与肌少症的发生进展。然本次研究为回顾性研究,可能因样本纳入量较少造成结果存在一定偏倚,未来将会扩大样本量继续深入探讨。
