1 例人偏肺病毒感染中年女性的临床分析
2024-05-29于明霞林蕊艳祝兆萌
于明霞 林蕊艳 祝兆萌
1 病史简介
患者女性, 48 岁, 2023 年6 月25 日主因“发热伴咳嗽、咳痰3 d”入住潞河医院感染呼吸与危重症医学科病房。病史:①前次住院:2023 年6 月13 日主因间断发热伴咳嗽、咳痰14 d 首次入本科住院治疗, 胸部CT(图1)示双肺多发小片磨玻璃影, 测新型冠状病毒核酸阳性, 予抗病毒药物、莫西沙星抗感染等治疗,无发热, 核酸转阴后, 于6 月19 日出院;②此次住院:6 月22 日再次出现发热, 体温(T)最高38.1℃, 伴畏寒、肌肉酸痛, 查胸部CT(图2)提示双肺多发斑片状磨玻璃影、实变影, 部分较前吸收, 部分较前新发, 于6 月25 日再次入本科住院治疗。既往史及个人史:免疫球蛋白A(IgA)肾病10 年, 否认哮喘病史;已婚, 育有1 子,全职家庭主妇;北京市通州区人, 久居本地, 近3 个月否认外出史。
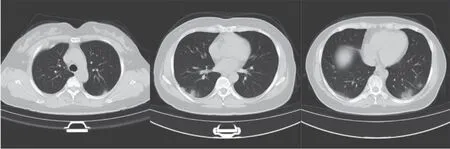
图1 2023 年6 月13 日胸部CT
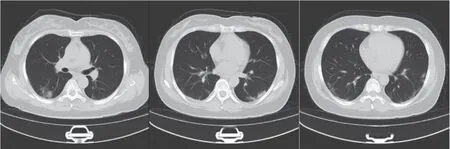
图2 2023 年6 月22 日胸部CT
2 入院检查
2.1 体格检查 体温38.1℃, 脉搏(P)92 次/min, 呼吸(R)22 次/min, 血压(BP):134/84 mm Hg。身高160 cm,体重63 kg, 体质量指数(BMI)24.61 kg/m2。神清, 呼吸稍促, 双肺可闻及散在哮鸣音, 双下肺可闻及湿啰音。心律齐, 腹平软, 全腹未及压痛、反跳痛。下肢不肿,四肢活动可。
2.2 实验室检查 血气分析(不吸氧):pH 7.41, PaCO236 mm Hg, PaO257 mm Hg, P/F ratio 282 mm Hg。血常规:WBC 5.85×109/L, NEU% 68%, LYM 26%, Hb 116 g/L。炎症标志物:超敏C 反应蛋白(hs-CRP)45.6 mg/L,血沉(ESR)48 mm/h, 降钙素原(PCT)0.11 ng/ml。生化:血肌酐(Scr)134 μmol/L, 血尿素氮(BUN)5.6 mmol/L, 血清尿酸(UA)498 μmol/L。凝血功能:凝血酶原时间(PT)12.2 s, 纤维蛋白原3.2 g/L, D-二聚体0.6 mg/L。结核感染T 细胞斑点试验(T-SPOT.TB):抗原A/B 1/0(阴性对照0/阳性对照425), 复测新型冠状病毒核酸、甲乙流/合胞病毒核酸、(1, 3)-β-D 葡聚糖试验(G 试验)、半乳甘露聚糖(GM)试验、隐球菌荚膜抗原、EB 病毒(EBV)/巨细胞病毒(CMV-DNA)阴性。肿瘤标志物:神经元特异性烯醇化酶(NSE)15.9 ng/ml, 鳞状上皮细胞癌抗原(SCC)2.0 ng/ml, 细胞角蛋白19 的可溶性片段(CYFRA21-1)4.7 ng/ml;余阴性。抗核抗体(ANA)、抗中性粒细胞胞浆抗体(ANCA)及免疫球蛋白等阴性。
2.3 辅助检查 心电图:正常心电图。心脏超声:静息状态下未见异常。肺部CT(2023 年6 月25 日):两肺多发斑片状高密度影。较6 月13 日胸部CT 有新发病灶出现。
3 临床分析
病史特点:患者中年女性, 急性病程, 以“发热伴咳嗽咳痰”为主, 肺部CT 提示短期进展较快的两肺炎症, 既往IgA 肾病, 考虑以下鉴别诊断。
3.1 病毒性肺炎 根据症状发生时间、流行病学特点及肺部影像学表现, 该患者首先需排查病毒性肺炎。病毒性肺炎常见病原体有新型冠状病毒、流感病毒、人高致病禽流感病毒、腺病毒、呼吸道合胞病毒(respiratory syncytial virus, RSV)、疱疹病毒、人类偏肺病毒(human metapneumovirus, hMPV)、鼻病毒等, 病毒性肺炎基本表现为:斑片或弥漫磨玻璃密度影, 伴或不伴实变、网格状表现, 不同病原体CT 表现多样、相互重叠。流感病毒肺炎以多灶性实变或毛玻璃影最为常见,新型冠状病毒肺炎典型表现为下肺区外周分布的毛玻璃影、粗糙的水平线性影和实变, 本例新型冠状病毒和流感影像学不支持, 同时新型冠状病毒核酸、甲乙流/合胞病毒核酸、EBV/CMV-DNA 均阴性, 故此类病毒感染可除外, 可进一步完善病原体宏基因检测协助诊断。
3.2 细菌性肺炎 细菌性肺炎常见病原学包括肺炎链球菌、流感嗜血杆菌、金黄色葡萄球菌等, 通常起病急,以高热寒战、咳嗽咳痰为典型特征, 白细胞及炎症指标升高, 部分患者存在基础肺部疾病[如支气管扩张、慢性阻塞性肺疾病(COPD)], 影像学呈肺段、肺叶实变影。本例患者发热伴咳痰、咳黄痰, 炎症指标稍高,但白细胞不高、肺部影像学不典型, 可进一步完善痰细菌涂片及培养协助诊断。
3.3 非典型肺炎 临床通常指肺炎支原体、肺炎衣原体、鹦鹉热衣原体、军团菌感染, 可存在相关的环境接触史或流行病学特点, 临床表现与其他社区获得性肺炎相似, 以发热、咳嗽和呼吸急促为特征, 典型可表现单侧肺叶斑片影, 可并发呼吸衰竭、脓胸、胸腔积液,血清学抗原或抗体、呼吸道样本核酸检测可协助诊断。
4 进一步检查、诊治过程和治疗反应
2023 年6 月26 日查呼吸道病毒十三项:偏肺病毒核酸阳性, 余阴。予鼻导管吸氧, 头孢曲松2 g, i.v.gtt.,q.d., 经验性抗感染治疗。
2023年6月28日查支气管镜灌洗液NGS(图3, 图4):偏肺病毒序列数24469 条。综合分析, 考虑社区获得性肺炎, hMPV 感染引起, 未发现合并其他病原体感染,故停头孢曲松抗感染药物。予以口服止咳化痰等对症治疗及中药治疗。
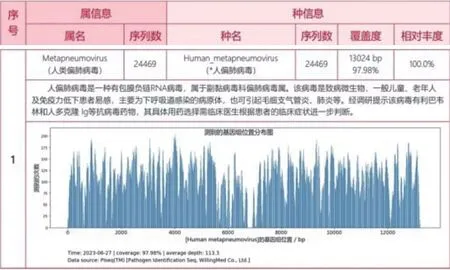
图3 支气管镜灌洗液NGS 检验单

图4 支气管镜灌洗液NGS 检测结果
2023 年6 月29 日查体温正常, 咳嗽咳痰气促略好转, 7 月3 日复查炎症标志物:WBC 8.39×109/L,NEU% 67.7%, hs-CRP 19.4 mg/L, ESR 33 mm/h, 血气(不吸氧):PaO281 mm Hg, P/F ratio 358 mm Hg, 炎症标志物及氧合情况较前改善。
2023 年7 月5 日查复查胸部CT(图5):两肺散在斑片影较6 月25 日的CT 片明显吸收。
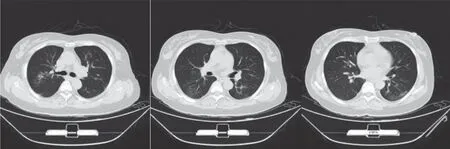
图5 2023 年7 月5 日复查胸部CT
5 最终诊断与诊断依据
最终诊断:肺炎(hMPV), Ⅰ型呼吸衰竭, IgA 肾病,慢性肾功能不全, 高尿酸血症。
诊断依据:患者为中年女性, 急性病程, 因“发热伴咳嗽咳痰3 d”入院。既往IgA 肾病, 慢性肾功能不全病史。入院查体双肺可闻及散在哮鸣音, 双下肺可闻及湿啰音。肺部影像学提示两肺多发磨玻璃影及斑片状高密度影, 呼吸道病毒十三项提示偏肺病毒核酸阳性, 支气管镜灌洗液NGS 检测出大量hMPV RNA序列, 故hMPV 感染肺炎诊断成立。
6 经验与体会
病毒学方面, hMPV 归为肺病毒科(pneumoviridae),该科由有包膜单股负链RNA 病毒构成。肺病毒科以前是副粘病毒科(paramyxoviridae)的一个亚科, 在2016 年重新分类为一个单独病毒科, 包含两个属:包括hMPV在内的偏肺病毒属(metapneumovirus)以及包括RSV 在内的正肺病毒属(orthopneumovirus)。
一项研究数据表明[1], 约4%社区获得性肺炎成人住院患者检出hMPV, 今年春季以来, hMPV 在美国各地呈高发态势, 在重症监护病房和儿科医院大型肆虐, 而我国似乎未受到这波影响, 尚未出现流行高峰。流行病学模型估计[2], 2018 年全球5 岁以下儿童中发生了1420 万例hMPV 相关急性下呼吸道感染, <1 周岁的婴幼儿院内死亡率高达64%, 老年人、肺部基础疾病和免疫功能低下者可快速重症化, 应尽早诊断、及早干预支持。
hMPV 最早是荷兰学者Van den Hoogen 在2001 年儿童中发现的新型呼吸道病毒(有包膜单负链RNA 病毒), 2016 年归为肺病毒科-偏肺病毒属。其具有季节流行性, 欧美国家多发生于冬末春初, 我国则春末、夏季好发, 主要经呼吸道或亲密接触传播, 大多数病例潜伏期为5~9 d, hMPV 传播给家庭成员的效率似乎很高,从指示病例出现症状到接触者出现症状的间隔时间估计为5 d。临床上多引起幼儿和老年人临床症状, 成年人下呼吸道感染少见。本病例有慢性肾病病史, 慢性肾功能不全, 为病毒感染的高危人群, 随访中未发现明确的接触史, 其家庭成员未见发病。
hMPV 很可能通过与污染的分泌物直接或密切接触而传播, 污染的分泌物可能包括大颗粒气溶胶、飞沫或污染物, 而不包括小颗粒气溶胶。因此, ≥6 英尺的物理距离可阻断气溶胶传播。据病例报导, 院内感染已在住院儿童[3](包括儿童血液肿瘤科病房[4])、住院成人[5]以及居住在专业护理机构的成人[6]中发生。一些关于长期护理机构居住者中hMPV 所致严重下呼吸道感染暴发的报告显示, hMPV 的感染率为34%~72%[6,7]。本病例发病前后接触的家人及患者中均未见发病。
感染hMPV 的黑猩猩和猴子的实验已经证实存在呼吸道病毒复制, 并伴有轻度上呼吸道体征[8]。有研究明确了整合素α-Ⅴ-β-1 是促进上皮细胞感染的受体[9]。在感染了hMPV 的小鼠模型中, 病毒RNA 和明显的呼吸道炎症持续时间均较长[10]。感染也伴有黏液高分泌和呼吸道上皮增生, 这会导致气道梗阻及醋甲胆碱激发后气道高反应性。这些资料与其他呼吸道病毒的研究资料一致, 均表明儿童期严重呼吸道感染的发病机制可能与哮喘的发生或易感性有关[11]。
hMPV 感染组织学模式包括坏死性细支气管炎, 可发展为慢性细支气管炎、急性或组织性弥漫性肺泡损伤(DAD)和肺泡出血, 影像学对应支气管壁增厚、肺部磨玻璃样(GGO)和模糊不清的小叶中心结节的典型表现, 感染患儿可有发热、咳嗽、鼻炎、哮喘发作等表现,最常见以急性细支气管炎和肺炎住院, 罕有病毒性脑炎病例报道。呼吸困难、哮鸣、声音嘶哑在成人感染中更多见, 免疫功能低下宿主由于病毒清除能力差, 可能病情更为严重、病程更长。并不十分清楚病毒排出的动力学及病毒排出和临床症状之间的关系, 因为尚未使用野生型病毒进行人类的病毒攻击研究。
hMPV 病原学检测方法包括:呼吸道标本实时荧光聚合酶链式反应(PCR)、鼻咽分泌物快速抗原或荧光抗体直接检测、特异性血清抗体[酶联免疫吸附试验(ELISA)或中和抗体检测, 多用于血清流行病学或疫苗研究]。快速抗原直接检测(rapid antigen direct test,RADT)可在30 min 完成简单的筛检, 随着宏基因组学的应用普及, 越来越多社区获得性肺炎病原体得以明确,应注意选择覆盖RNA 病毒的测序流程, 这对于聚集性发病病例进行早期诊断和预防控制, 也对新发呼吸道传染病的发现有所助力。
治疗方面, 患者的治疗采用支持性疗法, 并且根据临床表现的不同而异。利巴韦林等一些药物可能在体外实验中显示对hMPV 有活性[12]。但尚无关于利巴韦林或其他抗病毒药物治疗hMPV 感染效果的临床资料。因此, 不推荐对hMPV 感染患者使用抗病毒治疗。
尚不明确hMPV 感染患者继发肺部细菌感染或菌血症的发生率, 但认为这种几率较低。因此, 对于hMPV 支气管炎或肺炎的住院婴儿, 治疗往往并不需要抗生素。hMPV 感染的病程多为自限性, 一般采用支持性治疗, 尚无有效的抗病毒药物, 继发细菌感染几率较低, 故hMPV 支气管炎或肺炎的住院患者, 治疗往往并不需要抗生素[13,14]。本病例在明确hMPV 感染后停用抗生素, 给予对症治疗及中药治疗, 症状减轻, 病情好转出院, 无不良反应。临床面临各种病原体感染, 如细菌、病毒、原虫等, 应严格遵守治疗指南, 严格控制抗生素、激素使用指征。联合传统医学治疗病毒感染性疾病的可行性、必要性有待进一步探索。
预防方面, hMPV 可能通过与受污染的分泌物直接或密切接触而传播。疑诊或确诊hMPV 感染时, 需要使用针对RSV 和其他急性呼吸道疾病的感染控制措施, 包括接触预防措施, 如在所有环境情况下洗手。疫苗研发方面, 活的和亚单位实验性候选疫苗正处于临床前研发阶段, 但还没有快要获得批准的疫苗[15,16]。已设计出了稳定融合前(prefusion)和融合后(postfusion)构象蛋白的重组hMPV F 蛋白结构, 并且已在X 射线照片上确定了两种构象的晶体结构[17,18]。对于相关病毒RSV, 融合前特异性抗体主导保护性反应, 但对于hMPV F, 实验显示融合后或融合前hMPV F 蛋白免疫引起的抗体反应相似[19]。
在新型冠状病毒大流行期间[20], hMPV 感染在发病率和临床特征方面没有明显改变, 但可模仿新型冠状病毒, 可同时独立传播, 尽管近年的关注点集中于新型冠状病毒、流感病毒的大流行, 但临床医生仍需关注hMPV 等其他散发或出现聚集性暴发的呼吸道病毒。本病例感染新型冠状病毒后, 肺炎住院治疗, 核酸转阴后出院。间隔3 d 再次发热, 咳嗽咳痰, 支气管镜灌洗液NGS检测出大量hMPV, 诊断明确, 但是感染源难以确定,考虑社区感染, 亦不排除前次住院期间感染的可能。
通过该病例学习, 系统认识了hMPV 感染性疾病,包括病毒性特征、传播途径、临床表现、诊断标准、治疗原则及预防措施等。认识到呼吸系统疾病病原学检测的重要性、复杂性及难度。通过病原学检测确定某种病原体感染, 对临床医师的用药进行指导, 还可以对标本进行药敏试验, 指导医师选择正确的抗生素进行治疗, 避免抗生素滥用、抗生素耐药。这样的临床案例应当引起重视, 警示临床医生提高感控意识, 促进医防融合发展。
