宫腔灌注联合多西环素对慢性子宫内膜炎合并反复种植失败患者妊娠结局的影响
2024-05-29韦成厚张婧黄丽艳
韦成厚 张婧 黄丽艳
CE 是一种具有非特异性表现的子宫内膜持续性炎症, 多由病原体感染所致, 使子宫内膜容受性和内膜局部免疫微环境发生改变, 从而影响胚胎着床, 造成患者不孕, 病理学上以子宫内膜间质中浆细胞浸润为特征[1]。CE 发病率在不孕症女性中为2.8%~46%, 在RIF 女性中高达 67.6%[2], 目前临床上CE 一线治疗方法是口服多西环素, 二线治疗方法是宫腔灌注、中医药保留灌肠等方案[3]。本文探讨宫腔灌注左氧氟沙星加地塞米松和绒促性素联合多西环素口服治疗对CE合并RIF 患者妊娠结局的影响, 现总结如下。
1 资料与方法
1.1 一般资料 选取2021年2 月~2023 年2 月本院生殖中心102 例CE 合并RIF 患者为研究病例, 根据随机数字表法分为观察组和对照组, 各51 例。观察组患者年龄21~38 岁, 平均年龄(31.39±5.18)岁;平均体质量指数(BMI)(24.45±3.27)kg/m2;窗口期平均子宫内膜厚度(8.23±0.16)mm。对照组患者年龄21~37 岁, 平均年龄(31.33±4.97)岁;平均BMI(24.27±3.57)kg/m2;窗口期平均子宫内膜厚度(8.20±0.18)mm。两组患者一般资料比较无统计学差异(P>0.05), 有可比性。病例纳入标准:①育龄期女性, 月经规律, 月经周期 26~35 d;②既往胚胎移植失败≥2 次者;③宫腔镜检查并内膜活检病理确诊CE 且宫腔形态正常;④子宫内膜发育正常(窗口期内膜厚度≥8 mm);⑤至少有1~2 个优质胚胎;⑥年龄< 40 岁。病例排除标准:①子宫腔粘连;②子宫腔形态异常;③卵巢储备功能下降[抗苗勒管激素(AMH)<1.1 ng/ml)]。入选所有患者均自愿签署知情同意书, 且已经本院伦理委员会批准。
1.2 方法
1.2.1 治疗方法 观察组在月经干净3 d 后给予宫腔灌注治疗, 灌注液配方:用20 ml 无菌注射器抽取乳酸左氧氟沙星氯化钠注射液[浙江医药股份有限公司新昌制药厂, 国药准字H20153223, 规格:100 ml∶乳酸左氧氟沙星0.25 g(以C18H20FN3O4计)与氯化钠0.9 g]18 ml+地塞米松磷酸钠注射液(广州白云山天心制药股份有限公司, 国药准字H44022091, 规格:1 ml∶5 mg)2 ml, 将2000 U 注射用绒促性素(宁波人健药业集团股份有限公司, 国药准字H33021021, 规格:2000 U)溶于其中稀释组成混悬液, 阴道常规消毒后, 经宫颈插入导尿管对子宫腔进行冲洗, 持续时间6~10 min, 每隔1 d 宫腔灌注1 次, 1 个疗程灌注7 次, 同时口服盐酸多西环素肠溶胶囊[德全药品(江苏)股份有限公司,国药准字H20030627, 规格:0.1 g], 2 次/d, 0.1 g/次,14 d 为1 个疗程。对照组口服盐酸多西环素肠溶胶囊治疗, 用法用量同观察组。两组均治疗1 个疗程。
1.2.2 标本收集及处理 治疗前后子宫内膜标本均通过宫腔镜下内膜活检留取, 采用免疫组化方法检测CD138(+)为确诊CE 标准。晨起抽取空腹外周静脉血5 ml, 置于10 ml 玻璃干燥促凝试管中, 室温放置30 min 内, 然后以高速离心机3000×g 离心30 min, 收集血清液存放于无菌的EP 管中, 立刻保存在-80℃冰箱中冻存待测备用, 避免反复冻融循环。采用酶联免疫吸附试验(ELISA)法检测IL-1β、IL-6、TNF-α,依照相关试剂盒说明操作, 用酶标仪在450 nm 波长下测定吸光度(OD 值)并计算样品浓度, 批内及批间变异<10%。
1.3 观察指标及判定标准 ①比较两组治疗效果。疗效判定标准[4]:治疗后3 个月内行宫腔诊刮术并行内膜活检, 以多个高倍视野(HPF)下染色标本中未见浆细胞浸润, 且CD138 均阴性为治愈;与治疗前比较,治疗后浆细胞数量明显减少, 多个HPF 下仍见≥1 个浆细胞, CD138 均阴性为显效;其他情况为无效。总有效率=(治愈+显效)/总例数×100%。②比较两组治疗前后血清炎性细胞因子(IL-1β、IL-6、TNF-α)水平。③比较两组治疗后妊娠结局。全部患者在结束治疗后均行冻融胚胎移植助孕, 记录治疗后首次助孕妊娠结局,包括生化妊娠率、早期流产率、临床妊娠率、活产率。
1.4 统计学方法 运用SPSS22.0 统计软件进行统计分析。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组治疗前后血清炎性细胞因子水平比较 治疗前, 两组外周静脉血IL-6、IL-1β、TNF-α 水平比较, 无统计学差异(P>0.05);治疗后, 两组外周静脉血IL-6、IL-1β、TNF-α 水平均降低, 且观察组IL-6、IL-1β、TNF-α 水平明显低于对照组, 组间比较有统计学差异(P<0.05)。见表1。
表1 两组治疗前后血清炎性细胞因子水平比较( ±s, ng/L)

表1 两组治疗前后血清炎性细胞因子水平比较( ±s, ng/L)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 IL-6 IL-1β TNF-α治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 51 40.57±9.08 20.17±5.29ab 188.73±18.84 101.23±13.14ab 86.53±8.26 45.28±9.07ab对照组 51 40.49±9.94 30.68±4.98a 188.91±17.96 128.57±11.81a 86.44±8.54 62.78±9.62a t 0.042 10.331 0.049 11.051 0.054 9.452 P 0.966 0.000 0.961 0.000 0.957 0.000
2.2 两组治疗效果比较 观察组治疗总有效率高于对照组, 组间比较有统计学差异(P<0.05)。见表2。
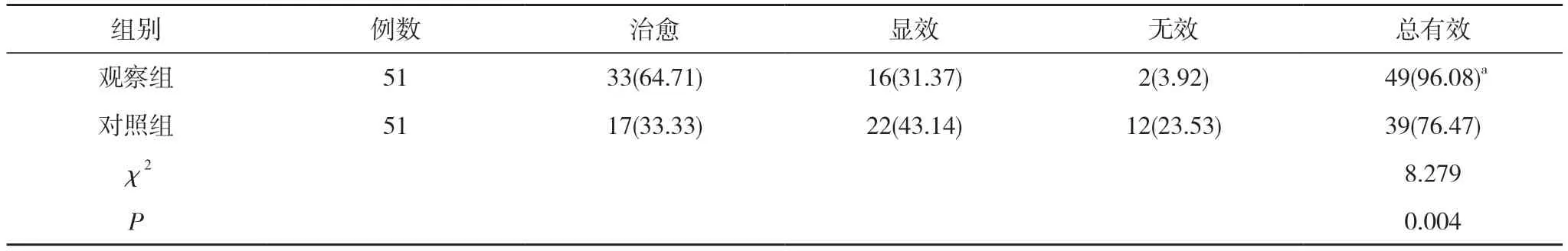
表2 两组治疗效果比较[n(%)]
2.3 两组治疗后妊娠结局比较 观察组临床妊娠率76.47%高于对照组的56.86%, 组间比较有统计学差异(P<0.05);两组生化妊娠率、早期流产率、活产率比较,无统计学差异(P>0.05)。见表3。
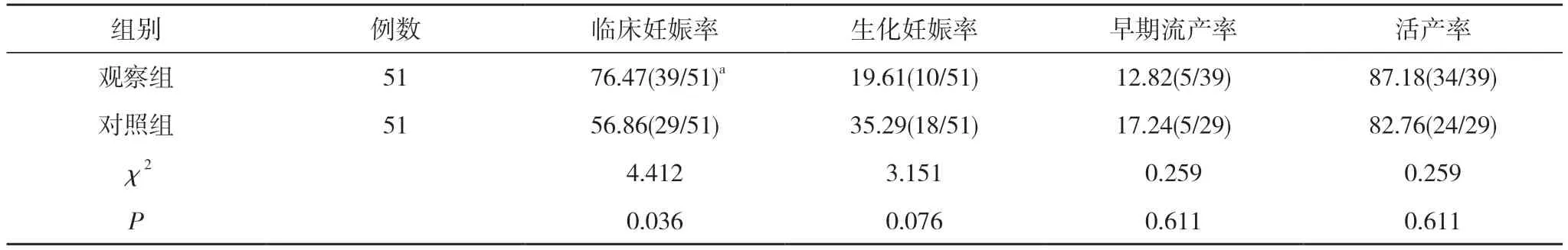
表3 两组治疗后妊娠结局比较(%)
3 讨论
近年来随着人工辅助生殖技术的普及, RIF 日益成为临床上亟需解决的棘手问题。发生RIF 的原因复杂, 与胚胎质量、子宫内膜容受性、免疫因素及宫腔异常等密切相关[5]。研究认为[6,7], CE 发生时通过各种途径到达子宫内膜的病原微生物会激活机体免疫反应, 产生大量免疫淋巴细胞和促炎症因子, 使子宫内膜容受性下降及内膜免疫微环境发生破坏, 干扰了胚胎植入过程中内膜生发有关基因及雌/孕激素受体表达,从而影响子宫内膜基质细胞蜕膜化、早期胎盘绒毛微血管生成和子宫收缩, 造成胚胎停育和流产、RIF 等不良妊娠结局。可见CE 与女性生殖预后密切相关。
长期以来由于多西环素口服方便, 抗菌谱较广,具有较好脂溶性以及较强组织穿透力, 可发挥显著的抗炎作用, 一直是临床上治疗CE 的一线抗菌药物[8-10],但口服抗菌药物存在诸多不利因素, 如子宫内膜局部药物浓度较低以及长期服药产生耐药性问题, 对于部分CE 患者口服抗菌药物的有效性有限[11]。宫腔灌注属于局部治疗, 可以直接使药物直达子宫内膜, 提高子宫内膜局部区域的血药浓度, 从而更有效杀死细菌, 达到改善宫腔微环境的目的, 且与多西环素口服联合应用则可以发挥协同增强的作用, 同时兼顾局部与整体,显著提高治疗效果[12-14]。本研究基于CE 可能同时存在的三大潜在致病机制(病原体感染、宫腔局部免疫微环境变化、子宫内膜容受性改变), 在用宫腔局部灌注左氧氟沙星增强抗感染的同时, 还加入了地塞米松改变宫腔的免疫微环境, 绒促性素改善子宫内膜容受性[15]。本文研究结果显示, CE 患者经治疗后镜下观察显示子宫内膜间质浆细胞和淋巴细胞浸润数量明显减少甚至消失, 治疗总有效率对照组明显低于观察组(P<0.05), 与文献报道类似[16,17];治疗后两组患者外周静脉血中促炎因子(IL-6、IL-1β、TNF-α)水平均降低, 且观察组炎症因子水平明显低于对照组, 而观察组的临床妊娠率明显高于对照组(P<0.05), 与相关研究结果一致[18,19]。而生化妊娠率、活产率及早期流产率,两组比较无统计学差异(P>0.05), 可能与本研究样本量小有关, 尚有待后续加大样本量进一步研究。
总之, 宫腔灌注左氧氟沙星加地塞米松和绒促性素联合多西环素口服治疗CE 合并RIF 患者具有显著疗效, 有助于消除子宫内膜炎症, 促进胚胎在宫腔的着床和发育, 对提高RIF 患者妊娠率和改善患者妊娠结局具有明显作用, 值得临床推广。
