靶向调控PTEN和PI3K对肾母细胞瘤细胞增殖和凋亡的影响
2024-05-29耿耿鹿洪亭李庆浩明明
耿耿 鹿洪亭 李庆浩 明明

[摘要] 目的 探讨靶向调控张力蛋白同源物(PTEN)和磷脂酰肌醇激酶(PI3K)对肾母细胞瘤细胞增殖和凋亡的影响及其机制。
方法选取15例肾母细胞瘤患儿的术后肿瘤组织及癌旁正常组织,采用免疫印迹实验及实时荧光定量PCR方法检测组织中
PTEN和PI3K蛋白及mRNA的表达水平;将肾母细胞瘤SK-NEP-1细胞分为对照组(A组,转染NC siRNA及Flag空载体)、PTEN过表达组(B组,转染NC siRNA及Flag-PTEN表达载体)、PI3K敲低组(C组,转染siPI3K及Flag空载体)、联合靶向组(D组,转染siPI3K及Flag-PTEN)。采用免疫印迹实验检测各组转染24 h后SK-NEP-1细胞中PI3K、蛋白激酶A(AKT)及磷酸化蛋白激酶A(p-AKT)的表达水平;采用CCK-8实验检测干预第24、48、72小时时SK-NEP-1细胞增殖情况;采用流式细胞术分析各组SK-NEP-1细胞转染24 h后细胞凋亡率及细胞周期。
结果与癌旁正常组织相比,肾母细胞瘤肿瘤组织中PI3K蛋白及mRNA表达水平均显著升高(t=22.862、7.098,P<0.05),PTEN蛋白及mRNA表达水平均显著降低(t=25.634、8.379,P<0.05);体外细胞实验结果显示,B、C、D组SK-NEP-1细胞中p-AKT蛋白水平明显低于A组(t=8.386~11.900,P<0.05);CCK-8实验显示,干预第48、72小时时,B、C、D组SK-NEP-1细胞吸光度值明显低于A组(t=5.163~8.647,P<0.05),干预第72小时时,D组SK-NEP-1细胞吸光度值明显低于B、C组(t=3.982、4.021,P<0.05);B、C、D组SK-NEP-1细胞早期凋亡率和晚期凋亡率均明显高于A组(t=4.673~9.563,P<0.05),D组SK-NEP-1细胞早期凋亡率和晚期凋亡率明显高于B、C组(t=5.829~8.075,P<0.05);B、C、D組SK-NEP-1细胞G1期细胞比例明显高于A组(t=7.518~14.747,P<0.05),S期细胞比例明显低于A组(t=8.029~13.451,P<0.05),D组SK-NEP-1细胞G1期细胞比例明显高于B、C组(t=9.930、9.732,P<0.05),S期细胞比例明显低于B、C组(t=10.281、9.927,P<0.05)。
结论相比于单一靶向PTEN或PI3K,联合靶向调控PTEN和PI3K可更显著抑制肾母细胞瘤细胞生长,促进肾母细胞瘤细胞凋亡,其作用机制可能与其抑制PI3K/AKT信号通路、阻断细胞周期有关。
[关键词] Wilms瘤;细胞增殖;细胞凋亡;细胞周期;PTEN磷酸水解酶;磷酸肌醇3-激酶类
[中图分类号] R737.11
[文献标志码] A
Effect of targeted regulation of phosphatase and tensin homolog and phosphatidylinositol 3-kinase on the proliferation and apoptosis of nephroblastoma cells
GENG Geng, LU Hongting, LI Qinghao, MING Ming
(Department of Pediatric Surgery, The Affiliated Taian City Central Hospital of Qingdao University, Taian 271000, China) ;
[ABSTRACT] Objective To investigate the effect and mechanism of targeted regulation of phosphatase and tensin homolog (PTEN) and phosphatidylinositol 3-kinase (PI3K) on the proliferation and apoptosis of nephroblastoma cells.
Methods Posto-perative tumor tissue and normal paracancerous tissue were collected from 15 children with nephroblastoma, and Western blotting and quantitative real-time PCR were used to measure the protein and mRNA expression levels of PTEN and PI3K in tissue. Nephroblastoma SK-NEP-1 cells were divided into control group (group A, transfected with NC siRNA and Flag empty vector), PTEN overexpression group (group B, transfected with NC siRNA and Flag-PTEN expression vector), PI3K knockdown group (group C, transfected siPI3K and Flag empty vector), a nd combined targeting group (group D, transfected siPI3K and FLAG-PTEN). Western blotting was used to measure the expression levels of PI3K, protein kinase A (AKT), and phosphorylated AKT (p-AKT) in SK-NEP-1 cells at 24 h after transfection; CCK-8 assay was used to observe the proliferation of SK-NEP-1 cells at 24, 48, and 72 h of intervention; flow cytometry was used to observe apoptosis rate and cell cycle at 24 h after transfection.
Results
Compared with normal paracancerous tissue, nephroblastoma tumor tissue showed significant increases in the protein and mRNA expression levels of PI3K (t=22.862,7.098,P<0.05) and significant reductions in the protein and mRNA expression levels of PTEN (t=25.634,8.379,P<0.05). The results of in vitro cell experiments showed that compared with group A, groups B, C, and D had a significantly lower protein expression level of p-AKT (t=8.386-11.900,P<0.05). CCK-8 assay showed that groups B, C, and D had a significantly lower absorbance value of SK-NEP-1 cells than group A at 48 and 72 h of intervention (t=5.163-8.647,P<0.05), and at 72 h of intervention, group D had a significantly lower absorbance value of SK-NEP-1 cells than groups B and C (t=3.982,4.021,P<0.05). Groups B, C, and D had significantly higher early and late apoptosis rates of SK-NEP-1 cells than group A (t=4.673-9.563,P<0.05), and group D had significantly higher early and late apoptosis rates of SK-NEP-1 cells than groups B and C (t=5.829-8.075,P<0.05). Compared with group A, groups B, C, and D had a significantly higher proportion of SK-NEP-1 cells in G1 phase (t=7.518-14.747,P<0.05) and a significantly lower proportion of cells in S phase (t=8.029-13.451,P<0.05), and compared with groups B and C, group D had a significantly higher proportion of SK-NEP-1 cells in G1 phase (t=9.930,9.732,P<0.05) and a significantly lower proportion of cells in S phase (t=10.281,9.927,P<0.05).
Conclusion Compared with the targeted regulation of PTEN or PI3K alone, the targeted regulation of PTEN and PI3K can significantly inhibit the growth of nephroblastoma cells and promote cell apoptosis, possibly by inhibiting the PI3K/AKT signaling pathway and blocking cell cycle.
[KEY WORDS] Wilms tumor; Cell proliferation; Apoptosis; Cell cycle; PTEN phosphohydrolase; Phosphatidylinositol 3-kinases
腎母细胞瘤又称维尔姆斯瘤,是临床常见的儿童肾脏恶性肿瘤,主要采用手术、放化疗等综合方案进行治疗,但是少数患儿因对化疗药物不敏感,导致预后效果欠佳[1-3]。靶向基因治疗的副作用相对较少,已有靶向治疗肾母细胞瘤患儿的成功案例[4],有望成为肾母细胞瘤一线治疗方式。张力蛋白同源物(PTEN)基因是细胞内重要的抑癌基因,可以通过抑制磷脂酰肌醇激酶(PI3K)/蛋白激酶A(AKT)信号通路,影响细胞迁移、增殖以及分化等重要生理过程[5-11],是当前肿瘤治疗的热门靶点。此前有研究发现,PTEN在肾母细胞瘤组织中表达水平显著下调[12-13],并且一些非编码RNA可以通过对PI3K/AKT信号通路的调控而影响肾母细胞瘤的疾病进展[14]。但目前通过联合靶向PTEN和PI3K是否能有效抑制肾母细胞瘤的生长仍缺乏直接的研究证据。鉴于此,本研究通过在肾母细胞瘤细胞中过表达PTEN同时敲低PI3K,探讨联合靶向调控肾母细胞瘤细胞中的PTEN及PI3K对肾母细胞瘤细胞增殖和凋亡的影响,以期为该肿瘤靶向药物的研发提供新方向。
1 材料和方法
1.1 主要试剂
Lipofectamine 2000(美国赛默飞世尔科技公司);组织总RNA提取试剂盒、逆转录试剂盒以及SYBR green qPCR试剂盒(北京全式金生物技术有限公司);鼠源抗Flag抗体、PI3K抗体、AKT抗体、p-AKT(S308)抗体和GAPDH抗体(美国CST公司),兔源抗PTEN抗体(武汉艾美捷科技有限公司);HRP偶联抗小鼠IgG抗体、HRP偶联抗兔IgG抗体[生工生物工程(上海)股份有限公司];CCK-8细胞增殖试剂盒(上海碧云天生物技术有限公司)。
1.2 细胞培养及分组
人肾母细胞瘤SK-NEP-1细胞购买于美国典型菌种保存中心,接种于6孔板中,加入完全培养基(DMEM高糖培养基中加入10%胎牛血清及1%青链霉素),置于37 ℃ 含体积分数0.05 CO2的培养箱中传代培养。待培养至第2代时分为4组,对照组(A组)细胞转染NC siRNA及Flag空载体,PTEN过表达组(B组)细胞转染NC siRNA以及Flag-PTEN表达载体,PI3K敲低组(C组)细胞转染siPI3K及Flag空载体,联合靶向组(D组)细胞转染siPI3K及Flag-PTEN。使用Lipofectamine 2000转染试剂转染表达载体及siRNAs,转染操作依照产品说明书进行。
1.3免疫印迹实验检测组织和细胞当中的PI3K、PTEN、Flag、AKT、p-AKT蛋白
收集2019年11月—2022年10月青岛大学附属泰安市中心医院儿童外科收治的15例肾母细胞瘤患儿手术切除的肿瘤组织及癌旁正常组织,剪碎后加入PBS研磨,离心以后弃上清液,加入1~2 mL组织裂解液以后继续研磨,待充分裂解后于4 ℃下12 000 r/min离心10 min,取上清液,获得组织总蛋白。取转染24 h后的A~D组SK-NEP-1细胞置于1 mL Ep管中,加入PBS 500 μL重悬,以2 000 r/min离心3 min,弃去上清液,然后向其中加入500 μL RIPA细胞裂解液,置于冰上裂解30 min后,4 ℃下12 000 r/min离心10 min,取上清液,得到细胞总蛋白。采用BCA法检测组织和细胞中的总蛋白浓度。从各组组织及细胞中选取30 μg的蛋白样品进行加热变性,SDS-PAGE电泳、转膜并封闭。在装有PVDF膜的容器中加入一抗及GAPDH抗体,4 ℃下孵育过夜,洗膜后加入对应的二抗, 室温孵育1 h,最后加入化学发光底物,进行蛋白条带成像。采用Image J软件对图像进行分析,以GAPDH作为内参,蛋白相对表达水平以目的蛋白条带灰度值/内参蛋白条带灰度值表示。实验重复3次,结果取均值。
1.4实时荧光定量PCR(RT-qPCR)检测组织当中PI3K、PTEN mRNA的表达
取15例肾母细胞瘤患儿术后肿瘤组织及癌旁正常组织,采用Trizol法提取组织中总RNA,检测RNA浓度与纯度,引物名称及其序列见表1。取0.5 μg总RNA,采用逆转录试剂盒获得cDNA,并以cDNA为模板进行RT-qPCR,每个样品设置3个复孔,实验重复3次,以GAPDH为内参,采用2-△△CT法计算目的基因相对表达量。
1.5 细胞增殖实验
取转染24 h后的A~D组SK-NEP-1细胞,待细胞处于对数生长期且生长状态良好时,加入胰酶消化细胞,然后将消化好的细胞加入1 mL Ep管中,2 000 r/min离心3 min,弃上清液,以DMEM培养基重悬细胞后,接种于96孔板中,每孔2×105个细胞,置于37 ℃培养箱中培养。分别于接种后第24、48 和72小时时取出培养板,加入10 μL CCK-8反应液,于37 ℃下孵育4 h,采用酶标仪检测波长450 nm处的吸光度值。实验设置3个复孔,结果取均值。
1.6 细胞凋亡实验
取转染24 h后的A~D组SK-NEP-1细胞,弃去原培养基,用1 mL磷酸盐缓冲液漂洗细胞1次,于37 ℃下用胰酶消化90 s,重悬细胞,收集至15 mL离心管中,4 ℃下1 000 r/min离心3 min,弃上清液,用500 μL磷酸盐缓冲液重悬细胞,加入5 μL FITC-Annexin V溶液及1 μL PI溶液,室温避光染色15 min,使用流式细胞仪分析FITC和PI标记比例。采用FCSalyzer软件分析流式细胞仪的数据,得到Q1~Q4四個象限,其中Q3象限为早期凋亡率,Q2象限为晚期凋亡率。实验重复3次,结果取均值。
1.7 细胞周期检测
取转染24 h后的A~D组SK-NEP-1细胞,待细胞处于对数生长期且生长状态良好时,加入胰酶消化细胞,然后将消化好的细胞加入1mL Ep管中, 2 000 r/min离心3 min,弃去上清液,以500 μL磷酸盐缓冲液漂洗细胞1次,2 000 r/min离心3 min,弃去上清液,以体积分数0.70的乙醇(已于-20 ℃预冷)重悬细胞后,置于-20 ℃固定1 h。取出后再以1 000 r/min离心10 min,弃上清液,用磷酸盐缓冲液漂洗2次后,弃上清液,加入500 μL磷酸盐缓冲液重悬,加入1 μL PI溶液,避光染色5 min以后,使用流式细胞仪分析PI通道脉冲积分信号,并用Flowjo软件Dean-Jett-Fox拟合模型计算S期细胞比例、G2/M期细胞比例及G1期细胞比例。实验重复3次,结果取均值。
1.8 统计分析
采用Graphpad Prism 8.0软件进行统计分析,计量资料以 ±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。多组多时间点比较采用重复测量设计的方差分析。以P<0.05为差异具有统计学意义。
2 结 果
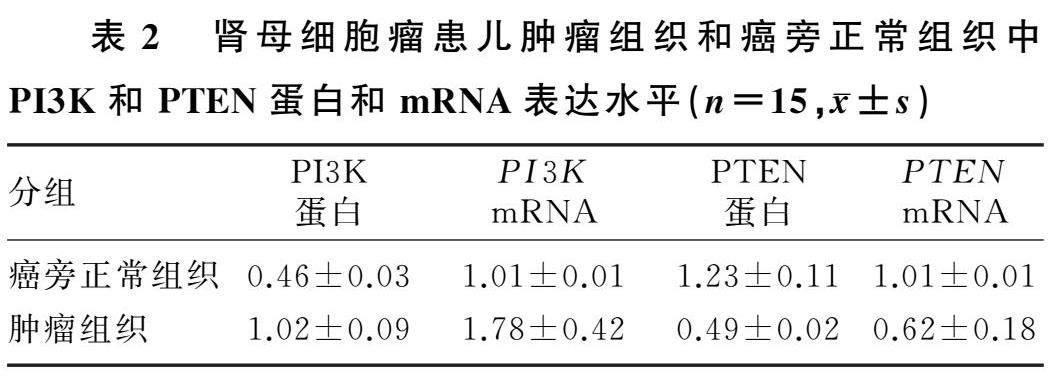
2.1肾母细胞瘤患儿肿瘤组织和癌旁正常组织中PI3K、PTEN蛋白和mRNA表达水平
与癌旁正常组织相比,肾母细胞瘤肿瘤组织中PI3K蛋白及mRNA表达水平均显著性升高(t=22.862、7.098,P<0.05),PTEN蛋白及mRNA表达水平均显著降低(t=25.634、8.379,P<0.05),详见表2。
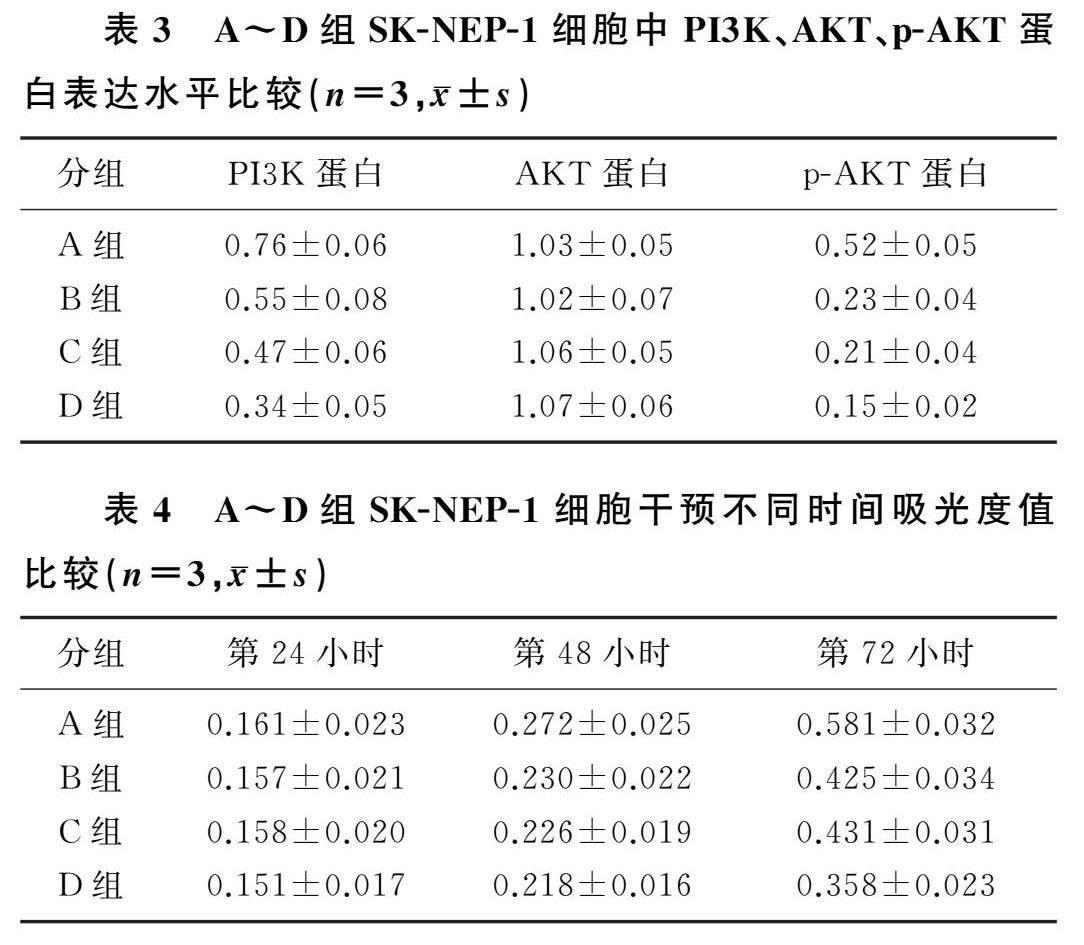
2.2各组SK-NEP-1细胞中PI3K、AKT、p-AKT蛋白表达水平
免疫印迹实验结果显示,A~D组SK-NEP-1细胞中PI3K、p-AKT蛋白水平比较差异有显著性(F=6.388、5.831,P<0.05),AKT蛋白水平比較差异无显著性(P>0.05)。与A组相比,B、C、D组中PI3K和p-AKT蛋白水平均明显降低(t=5.677~11.900,P<0.05),与B、C组相比,D组PI3K和p-AKT蛋白水平明显降低(t=3.786~4.321,P<0.05)。见表3。
2.3各组SK-NEP-1细胞中细胞增殖情况比较
重复测量设计的方差分析显示,时间、组别及时间与组别交互作用均对SK-NEP-1细胞吸光度值有显著影响
(F时间=464.912,F组别=25.201,F组别*时间=11.570,P<0.05)。单独效应分析结果显示,与第24小时相比,A~D组SK-NEP-1细胞吸光度值在干预的第48、72小时时均明显升高(F=83.021~195.72);干预第24小时时,A~D组吸光度值差异无显著性(P>0.05);干预第48小时时,与A组相比,B、C、D组吸光度值均显著降低(F=4.067,t=5.452~7.821,P<0.05);干预第72小时时,与A组相比,B、C、D组吸光度值均显著降低(F=29.003,t=5.163~8.647,P<0.05),与B、C组相比,D组吸光度值均显著降低(t=3.982、4.021,P<0.05)。详见表4。
2.4各组SK-NEP-1细胞凋亡情况比较
A~D组的SK-NEP-1细胞早期凋亡率分别为(1.76±0.21)%、(3.16±0.44)%、(3.02±0.27)%、(4.60±0.38)%,其晚期凋亡率分别为(1.38±0.18)%、(2.85±0.23)%、(2.77±0.20)%、(4.42±0.35)%。四组之间细胞早期凋亡率、晚期凋亡率比较差异有显著性(F=11.665、8.854,P<0.05)。与A组相比,B、C、D组细胞早期凋亡率和晚期凋亡率明显升高(t=4.673~9.563,P<0.05);与B组、C组相比,D组细胞早期凋亡率和晚期凋亡率明显升高(t=5.829~8.075,P<0.05)。
2.5各组SK-NEP-1细胞的细胞周期比较
细胞周期检测结果显示,A~D组SK-NEP-1细胞G1期细胞比例、S期细胞比例比较差异有显著性(F=10.921、12.661,P<0.05),G2/M期细胞比例比较差异无显著性(P>0.05)。与A组相比,B、C、D组G1期细胞比例明显升高(t=7.518~14.747, P<0.05),S期细胞比例明显降低(t=8.029~13.451,P<0.05);与B、C组相比,D组G1期细胞比例明显升高(t=9.930、9.732,P<0.05),S期细胞比例明显降低(t=10.281、9.927,P<0.05)。见表5。
3 讨 论
目前,肾母细胞瘤确诊后的治疗仍以常规外科手术及术后放疗和化疗为主,尽管这些常规治疗方案可以一定程度上提高患者的生存率,但手术创伤及化疗药物的不良反应会给患儿带来极大痛苦[15]。由于肾母细胞瘤缺乏有效的早期诊断标记物,因此,探究肾母细胞瘤的早期诊断方式,寻找新的靶向干预策略成为当前该疾病研究的热门方向。PTEN是重要的抑癌基因,许多泌尿系统肿瘤如前列腺癌、膀胱癌等的发生都伴随PTEN基因的缺失或低表达,而PTEN低表达与肿瘤发生及不良预后均密切相关[5-10]。GRILL等[12]研究发现,与癌旁正常组织相比,肾母细胞瘤组织中PTEN表达及活性下降。CUI等[13]研究也发现低表达PTEN的肾母细胞瘤恶性程度更低,这些结果提示PTEN在肾母细胞瘤发生中应该发挥着比较重要的作用,因此通过过表达载体靶向上调PTEN的表达水平,对于PTEN低表达的肾母细胞瘤患者的治疗可能有益。
PI3K/AKT信号通路是经典的被PTEN抑制的下游信号通路,PTEN低表达可能会引起PI3K、AKT的活性升高,进而促进细胞增殖、迁移[16-19]。PI3K由一个调节亚基(p85)以及一个催化亚基(p110)构成。胞外信号作用于受体酪氨酸激酶,进一步催化PI3K调节亚基磷酸化,激活的PI3K将细胞质膜上的PIP2转变成为PIP3,PIP3进一步与AKT及磷脂酰肌醇依赖的蛋白激酶1(PDK1)的PH结构域结合,促使PDK磷酸化AKT。活化的AKT可进一步促进下游诸多信号分子如mTOR、p27、GSK3等蛋白的磷酸化,影响下游蛋白的生理活动[20-22]。PTEN可以将PIP2转变成为PIP3,进而抑制PDK1对AKT的磷酸化[23]。因此,在细胞当中过表达PTEN或敲低PI3K都可以实现对PI3K/AKT信号通路的抑制作用。PI3K/AKT信号通路的激活可以使mTOR和GSK-3β等关键蛋白磷酸化,磷酸化的GSK-3β激酶活性受到抑制,进而促进β-catenin的激活并增强细胞周期关键蛋白如Cyclin D1的转录,促进细胞G1/S期转化及细胞增殖,抑制细胞凋亡[24-25]。然而PI3K/AKT信号通路在肾母细胞瘤中的作用仍缺少研究,在过表达PTEN的同时抑制PI3K是否更能有效抑制肾母细胞瘤的增殖活性,尚待进一步研究。
为了验证PTEN及PI3K是否在肾母细胞瘤组织中异常表达,本研究使用蛋白质免疫印迹实验及RT-qPCR实验对15例肾母细胞瘤患儿的肿瘤组织及癌旁正常组织中的PI3K、PTEN蛋白及mRNA表达水平进行了检测,结果显示,与癌旁正常组织相比,肾母细胞瘤肿瘤组织中PI3K蛋白及mRNA表达水平均显著升高,PTEN蛋白及mRNA表达水平均显著降低。该结果提示肾母细胞瘤肿瘤的发生可能与PI3K和PTEN表达异常有关。为了进一步研究PI3K和PTEN在肾母细胞瘤肿瘤发生发展中的作用,本研究又通过细胞转染技术在肾母细胞瘤细胞中过表达PTEN以及敲低PI3K,观察PI3K/AKT信号通路相关蛋白表达水平的变化,结果显示肾母细胞瘤细胞中过表达PTEN或敲低PI3K都抑制了p-AKT,但并不影响AKT蛋白的表达,且过表达PTEN并同时敲低PI3K的细胞中,p-AKT表达水平最低,这说明联合靶向调控PTEN和PI3K能增强p-AKT表达下调,抑制PI3K/AKT信号通路。
随后本研究对各组肾母细胞瘤细胞增殖、凋亡及细胞周期等情况进行了分析,结果显示,肾母细胞瘤细胞通过表达PTEN或敲低PI3K都可抑制细胞增殖,提高细胞早期凋亡率、晚期凋亡率,提高细胞周期中G1期细胞比例,降低细胞周期中S期细胞比例;另外本研究又对细胞进行了过表达PTEN的同時敲低PI3K的处理,发现相比单一靶向PTEN或PI3K,联合靶向的细胞吸光度值、S期细胞比例显著下降,早期凋亡率、晚期凋亡率、G1期细胞比例显著升高。细胞增殖实验中的吸光度值可反映细胞增殖活性,吸光度值越高代表增殖活性越强,所以该结果提示,联合靶向调控PTEN和PI3K能增强抑制肾母细胞瘤细胞增殖,促进细胞凋亡,阻断细胞周期。联合靶向调控PTEN和PI3K的细胞被阻断在有丝分裂G1期,细胞周期的阻断会减慢细胞的增殖,细胞无法通过细胞周期检验点则会激活细胞凋亡相关信号通路,进而引起细胞凋亡。
综上所述,本研究初步揭示了靶向PTEN以及PI3K影响肾母细胞瘤细胞增殖、凋亡的作用及其机制。相较于单一靶向PTEN或PI3K,联合靶向调控PTEN和PI3K可更显著抑制肾母细胞瘤细胞生长,促进肾母细胞瘤细胞凋亡,其作用机制可能与其抑制PI3K/AKT信号通路、阻断细胞周期有关。后续的研究可以尝试开发靶向调控PTEN和PI3K的病毒载体,为PTEN低表达的肾母细胞瘤患者的基因治疗提供实验数据参考。
伦理批准和知情同意: 本研究涉及的所有试验均已通过泰安市中心医院医学伦理委员会的审核批准,文件号为(2019)伦审第(18)号。所有试验过程均遵照《赫尔辛基宣言》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明: 耿耿、李庆浩参与了研究设计;耿耿、鹿洪亭、明明参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]GROENENDIJK A, SPREAFICO F, DE KRIJGER R R, et al. Prognostic factors for wilms tumor recurrence: A review of the literature[J]. Cancers, 2021,13(13):3142.
[2] ZHAO Y X, CHENG H Y, SONG H C, et al. Duplex kidney complicated with preoperative inferior nephroblastoma rupture in children: A case report and literature review[J]. BMC Pe-
diatr, 2021,21(1):441.
[3] NELSON M V, VAN DEN HEUVEL-EIBRINK M M, GRAF N, et al. New approaches to risk stratification for Wilms tumor[J]. Curr Opin Pediatr, 2021,33(1):40-48.
[4] WANG J J, FAN S Q, FENG Y Q, et al. Antiangiogenic therapy for Wilms tumor in an adult and literature review[J]. Anticancer Drugs, 2019,30(6):640-645.
[5] ZHU J M, LIU B, WANG Z Y, et al. Exosomes from nicotine-stimulated macrophages accelerate atherosclerosis through miR-21-3p/PTEN-mediated VSMC migration and proliferation[J]. Theranostics, 2019,9(23):6901-6919.
[6] HOPKINS B D, HODAKOSKI C, BARROWS D, et al. PTEN function: The long and the short of it[J]. Trends Biochem Sci, 2014,39(4):183-190.
[7] LEE Y R, CHEN M, PANDOLFI P P. The functions and re-
gulation of the PTEN tumour suppressor: New modes and prospects[J]. Nat Rev Mol Cell Biol, 2018,19(9):547-562.
[8] SKELTON P D, STAN R V, LUIKART B W. The role of PTEN in neurodevelopment[J]. Mol Neuropsychiatry, 2020,5(Suppl 1):60-71.
[9] MANOGARAN P, BEERAKA N M, PAULRAJ R S, et al. Impediment of cancer by dietary plant-derived alkaloids through oxidative stress: Implications of PI3K/AKT pathway in apoptosis, autophagy, and ferroptosis[J]. Curr Top Med Chem, 2023,23(10):860-877.
[10] HARA S, OYA M, MIZUNO R, et al. Akt activation in renal cell carcinoma: Contribution of a decreased PTEN expression and the induction of apoptosis by an Akt inhibitor[J]. Ann Oncol, 2005,16(6):928-933.
[11] ZHANG J H, YANG W M, ZHOU S W. Expression and significance of PTEN in bladder TransitionalCell carcinoma[J]. Chin Ger J Clin Oncol, 2005,4(4):218-220.
[12] GRILL C, GUELLY C, EBNER B, et al. Loss of PTEN/MMAC1 activity is a rare and late event in the pathogenesis of nephroblastomas[J]. Hum Pathol, 2010,41(8):1172-1177.
[13] CUI M Y, LIU W, ZHANG L J, et al. Over-expression of miR-21 and lower PTEN levels in wilms tumor with aggressive behavior[J]. Tohoku J Exp Med, 2017,242(1):43-52.
[14] DE S PEREIRA B M, MONTALVO DE AZEVEDO R, DA SILVA GUERRA J V, et al. Non-coding RNAs in Wilms tumor: Biological function, mechanism, and clinical implications[J]. J Mol Med, 2021,99(8):1043-1055.
[15] NJUGUNA F, MARTIJN H A, KUREMU R T, et al. Wilms tumor treatment outcomes: Perspectives from a low-income setting[J]. J Glob Oncol, 2017,3(5):555-562.
[16] XU Z R, HAN X, OU D M, et al. Targeting PI3K/AKT/mTOR-mediated autophagy for tumor therapy[J]. Appl Microbiol Biotechnol, 2020,104(2):575-587.
[17] NEPSTAD I, HATFIELD K J, GRNNINGSTER I S, et al. The PI3K-akt-mTOR signaling pathway in human acute myeloid leukemia (AML) cells[J]. Int J Mol Sci, 2020,21(8):2907.
[18] LIU R, CHEN Y W, LIU G Z, et al. PI3K/AKT pathway as a key link modulates the multidrug resistance of cancers[J]. Cell Death Dis, 2020,11(9):797.
[19] DUAN Y, HAYBAECK J, YANG Z H. Therapeutic potential of PI3K/AKT/mTOR pathway in gastrointestinal stromal tumors: Rationale and progress[J]. Cancers, 2020,12(10):2972.
[20] WANG L, WANG J, CHEN L. TIMP1 represses sorafenib-triggered ferroptosis in colorectal cancer cells by activating the PI3K/Akt signaling pathway[J]. Immunopharmacol Immunotoxicol, 2023,45(4):419-425.
[21] 熊艷,陈雨柔,王艺,等. PLOD2通过PI3K/AKT通路促进宫颈癌细胞增殖、侵袭和迁移[J]. 武汉大学学报(医学版), 2023,9(3):304-309.
[22] 叶雅丽,阮荣华,蔡莎莎,等. UBE2Q1靶向PI3K/AKT通路对胃癌细胞凋亡、增殖的影响[J]. 中国卫生检验杂志, 2022,32(9):1080-1083.
[23] XIANG H G, ZHANG J F, LIN C C, et al. Targeting autop-
hagy-related protein kinases for potential therapeutic purpose[J]. Acta Pharm Sin B, 2020,10(4):569-581.
[24] SATI I S E E, PARHAR I. MicroRNAs regulate cell cycle and cell death pathways in glioblastoma[J]. Int J Mol Sci, 2021,22(24):13550.
[25] KUMAR N, MANDAL C C. Cholesterol-lowering drugs on Akt signaling for prevention of tumorigenesis[J]. Front Ge-net, 2021,12:724149.
(本文编辑 耿波 厉建强)
