低聚木糖对高脂饮食致脂肪肝小鼠的保护作用及其机制
2024-05-29李翰卿李宇鹍张震田字彬齐兴四
李翰卿 李宇鹍 张震 田字彬 齐兴四
[摘要] 目的 探討低聚木糖对高脂饮食所致脂肪肝小鼠的保护作用及机制。
方法5周龄C57/BL6J雄性小鼠40只,随机分为4组,每组10只。低脂饮食对照组(LFD组)和高脂饮食模型组(HFD组)分别喂饲脂肪含量10%的低脂饲料和脂肪含量60%的高脂饲料,高脂饮食+低剂量低聚木糖干预组(XOS.L组)和高脂饮食+高剂量低聚木糖干预组(XOS.H组)小鼠在HFD组基础上分别灌胃0.35和1.0 g/kg低聚木糖,每日1次,LFD组、HFD组小鼠同时灌胃等剂量生理盐水。第16周时收集各组小鼠血液、肝脏组织、粪便样本,测定各组小鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、三酰甘油(TG)水平,HE染色和油红O染色对肝脏进行组织学评估;通过16S rRNA微生物测序技术及代谢组学检测分析各组小鼠粪便肠道菌群和代谢物的变化。
结果与LFD组相比,HFD组肝脏出现明显脂肪变性,花生四烯酸、亚油酸(LA)等多种代谢产物紊乱,Faecalibaculum、Bacteroidaceae等致病菌群丰度均显著增加,Bacteroides、Ruminococcaceae等有益菌群丰度降低。XOS.H组较HFD组Ruminococcaceae、Actinobacteria等相关菌群丰度和肝脏脂肪变性明显改善,肝脏SAF评分降低,前列腺素H2等促炎代谢物富集强度降低,前列腺素D2、二十二碳五烯酸、LA等代谢物富集强度增加。
结论低聚木糖可以明显改善高脂饮食所致脂肪肝小鼠的肝脏脂肪变性,改善高脂饮食介导的肠道菌群失调及代谢物紊乱,其机制可能是通过调节肠道菌群干预花生四烯酸、LA等代谢通路来实现。
[关键词] 寡糖类;益生元;非酒精性脂肪性肝病;胃肠道微生物组;脂类代谢;代谢网络和途径
[中图分类号] R575.5
[文献标志码] A
Protective effect of xylo-oligosaccharides on mice with fatty liver induced by high-fat diet and related mechanisms
LI Hanqing, LI Yukun, ZHANG Zhen, TIAN Zibin, QI Xingsi
(Department of Gastroenterology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
;[ABSTRACT] Objective To investigate the protective effect of xylo-oligosaccharides on mice with fatty liver induced by high-fat diet and related mechanisms.
Methods A total of 40 male C57/BL6J mice, aged 5 weeks, were randomly divided into low-fat diet control group (LFD group), high-fat diet model group (HFD group), high-fat diet+low-dose xylo-oligosaccharide intervention group (XOS.L group), and high-fat diet+high-dose xylo-oligosaccharide intervention group (XOS.H group), with 10 mice in each group. The mice in the LFD group were fed a low-fat diet containing 10% fat, and those in the HFD group were fed a high-fat diet containing 60% fat; in addition to the treatment in the HFD group, the mice in the XOS.L group were given xylo-oligosaccharides at a dose of 0.35 g/kg by gavage once a day, and those in the XOS.H group were given xylo-oligosaccharides at a dose of 1.0 g/kg by gavage once a day; the mice in the LFD group and the HFD group were given an equal volume of normal saline by gavage. At the end of week 16, blood, liver tissue, and fecal samples were collected from each group of mice; the serum levels of alanine ami-
notransferase (ALT), aspartate aminotransferase and triglyceride (TG) were measured; HE staining and oil red O staining were used to perform a histological evaluation of the liver; 16S rRNA microbial sequencing technology and metabolomics were used to measure the changes in fecal gut microbiota and metabolites.
Results compared with LFD group, the HFD group showed significant steatosis of the liver, disturbances in various metabolites including arachidonic acid and linoleic acid (LA), significant increases in the abundances of the pathogenic bacteria such as Faecalibaculum, Bacteroidaceae, and significant reductions in the abundances of the probiotic bacteria such as Ruminococcaceae, Bacteroides. Compared with the HFD group, the XOS.H groups showed a significant improvement in liver steatosis and the abundances of related microbiota such as Ruminococcaceae and Actinobacteria, significant reductions in liver SAF scores and the enrichment intensities of the proinflammatory metabolites such as Prostaglandin H2, and significant increases in the enrichment intensities of the metabolites such as Prostaglandin D2, LA, and docosahexaenoic acid.
Conclusion Xylo-oligosaccharides can significantly improve liver steatosis, gut microbiota dysbiosis, and metabolite disturbances induced by high-fat diet in mice, possibly by regulating the gut microbiota to interfere with the metabolic pathways such as arachidonic acid and LA.
[KEY WORDS] Oligosaccharides; Prebiotics; Non-alcoholic fatty liver disease; Gastrointestinal microbiome; Lipid metabolism; Metabolic networks and pathways
随着人们生活水平的提高,高脂饮食致脂肪肝(fatty liver disease,FLD)的发病率呈上升趋势,该病已经成为世界范围内最常见的慢性肝病之一[1]。FLD除可直接导致失代偿性肝硬化、肝细胞癌外,还可增加2型糖尿病、心血管疾病的发病风险[2],因此高脂饮食所致FLD的防治已成为目前临床关注的热点之一。低聚木糖(XOS)是一种稳定性好、安全性高的益生元。目前研究表明,XOS可通过提高大鼠肠道有益菌的丰度水平,调整短链脂肪酸(SCFAs)组成、减少酪氨酸和异戊酸含量,从而改善肝脏脂肪堆积状况[3-4],但具体机制尚不明确。本研究从肠道菌群及粪便代谢组学角度探讨不同剂量XOS对高脂饮食所致FLD的影响效果及机制,为FLD的临床防治提供一定的实验基础。
1 材料与方法
1.1 小鼠的分组与处理
5周龄C57/BL6J雄性小鼠40只,购自济南朋悦实验动物繁育有限公司,于18~24 ℃光暗各12 h环境下饲养,适应性喂饲7 d后,随机分为低脂饮食对照组(LFD组)、高脂饮食模型组(HFD组)、高脂饮食+低剂量XOS干预组(XOS.L组)、高脂饮食+高剂量XOS干预组(XOS.H组)4组,每组10只。LFD组和HFD组分别喂饲脂肪含量10%的低脂饲料和脂肪含量60%的高脂饲料,XOS.L组和XOS.H组小鼠在HFD组基础上分别灌胃0.35和1.0 g/kg的XOS(将0.35 g和1.0 g的XOS分别溶于10 mL生理盐水中),每日1次;LFD组、HFD组小鼠灌胃等剂量生理盐水。所有小鼠共灌胃16周。每日记录小鼠进食量,每日测量小鼠体质量。
1.2 小鼠血生化指标的检测及肝脏的组织学评估
第16周时,小鼠禁饮食12 h后,腹腔麻醉,眼球取血,分离血清,使用自动生化分析仪检测小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、三酰甘油(TG)含量。采血后断颈处死小鼠,立即剝离出小鼠的肝脏组织;收集小鼠近段结肠内的新鲜粪便,液氮冷冻后于冰箱-80 ℃保存,备用。各组小鼠分别取1/4肝脏组织,用4%多聚甲醛固定24 h之后,石蜡包埋后切片,洗脱石蜡后切片行苏木素-伊红(HE)染色;另取各组小鼠1/4肝脏组织于4%多聚甲醛固定24 h后,OCT包埋后切片,洗脱OCT后行油红O染色。由2位经验丰富的病理学专家对各组小鼠肝脏的HE染色切片,通过光学显微镜进行组织学评估,评分标准参照SAF评分系统[5]。
1.316S rRNA基因测序和数据分析
取各组小鼠的新鲜粪便样本,使用DNA抽提试剂盒提取粪便中的基因组DNA,以16S rRNA为聚合酶链式反应的扩增靶向引物行PCR扩增,使用琼脂糖凝胶电泳和NanoDrop 2000检测扩增产物的DNA浓度并将其纯化后,通过上海欧易生物医学科技有限公司的Illumina MiSeq平台进行测序。将所获得的测序数据,通过FLASH软件进行拼接、序列质控后得到有效序列,使用Vsearch软件将有效序列归类为多个可操作分类单元(OTUs)。通过Muscle(version v.1.30)软件对各组基于OUTs结果的小鼠肠道菌群种类进行α多样性分析,获得代表肠道菌群种类多样性的Shannon指数,使用R语言工具绘制各组菌群种类多样性的分布热图和箱式图;通过多变量主坐标分析(PCoA)对各组小鼠肠道菌群丰度的β多样性进行分析,即基于欧式距离算法和95%置信区间,来分析各组肠道菌群的距离尺度,得到横坐标(PC1)和纵坐标(PC2)的PCoA图。通过MetaStats分析各组小鼠肠道菌群在科水平和属水平相对丰度,并进行比较,获得各组间差异较大的肠道菌群。
1.4 小鼠粪便代谢组学分析
取各组小鼠的新鲜粪便样本,经PBS预处理后,采用液质联用系统(由Nexera UPLC超高效液相串联QE高分辨质谱仪组成)分析在ESI正离子和负离子模式下的粪便代谢谱。通过Proteo Wi-zard软件把粪便代谢谱的原始数据转化成mzXML格式,然后应用Progenesis QI v2.3软件处理质谱数据。将处理好的数据通过正交偏小二乘判别分析(OPLS-DA)模型来区分各组小鼠代谢谱的差异。为了验证该模型的可靠性,采用置换验证对其进行200次置换检验。
1.5 差异代谢物获取与通路富集分析
将从各组小鼠粪便中分析得到的粪便代谢谱数据,利用R语言中的Metabo Analyst R包,以P<0.05且VIP>1为筛选条件进行代谢物差异分析。将获得的差异代谢物导入Metabo Analyst 5.0平台,再使用KEGG Compound数据库对差异代谢物进行通路富集分析,比较差异代谢物在共同通路中的富集强度。采用Speraman方法对各组小鼠的差异肠道菌群与差异代谢物进行相关性分析,以获得肠道菌群与代谢物之间的相互关系。
1.6 统计学分析
采用SPSS 26.0和Graphapd 8.2软件进行统计分析。计量资料以 ±s表示,多组间比较采用单因素方差分析或MetaStat分析,两组间比较采用t检验。使用QIIME(1.8.0)、R软件(3.6.2)对数据进行分析并绘制图形。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠血清指标及肝脏组织学比较
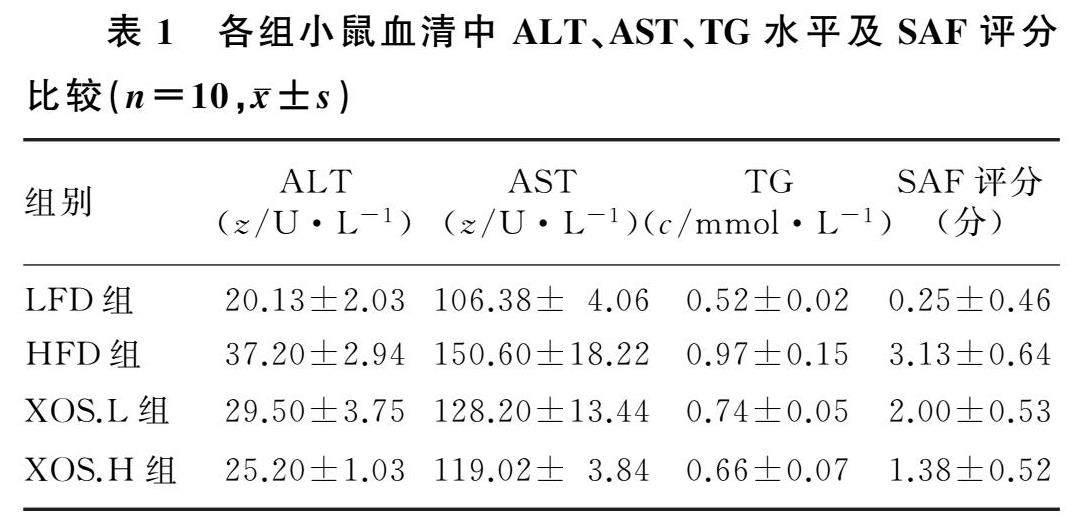
单因素方差分析结果显示,4组小鼠血清中ALT、AST、TG水平及肝脏SAF评分比较差异均有显著性(F=39.17~113.80,P<0.05)。其中与LFD组比较,HFD组血清ALT、AST、TG水平及SAF评分均显著增高(t=8.26~15.68,P<0.05);与HFD组比较,XOS.L组和XOS.H组小鼠上述各项指标均显著降低(t=5.89~12.19,P<0.05);XOS.H组较XOS.L组小鼠上述各项指标均显著降低(t=2.37~3.79,P<0.05)。见表1。
肝脏组织切片HE染色显示,LFD组小鼠肝小叶结构清晰,肝细胞排列较为整齐,肝索呈放射状排列,无明显纤维化;XOS.H组小鼠肝小叶结构基本正常,肝索排列尚整齐,轻度纤维化;XOS.L组小鼠肝小叶结构紊乱,肝索排列不齐,部分肝细胞气球样变,纤维化较XOS.H组重;HFD组小鼠肝脏损伤严重,肝小叶结构模糊,肝细胞肿胀、肝索排列紊乱,有大量气球样变,明显纤维化。油红O染色显示,LFD组肝脏组织切片几乎无油红着色,XOS.H组有轻微着色,XOS.L组着色较LFD组、XOS.H组深,但比HFD组轻,而HFD组小鼠肝脏内着色均较余3组明显。见图1。
2.2 小鼠肠道菌群多样性分析
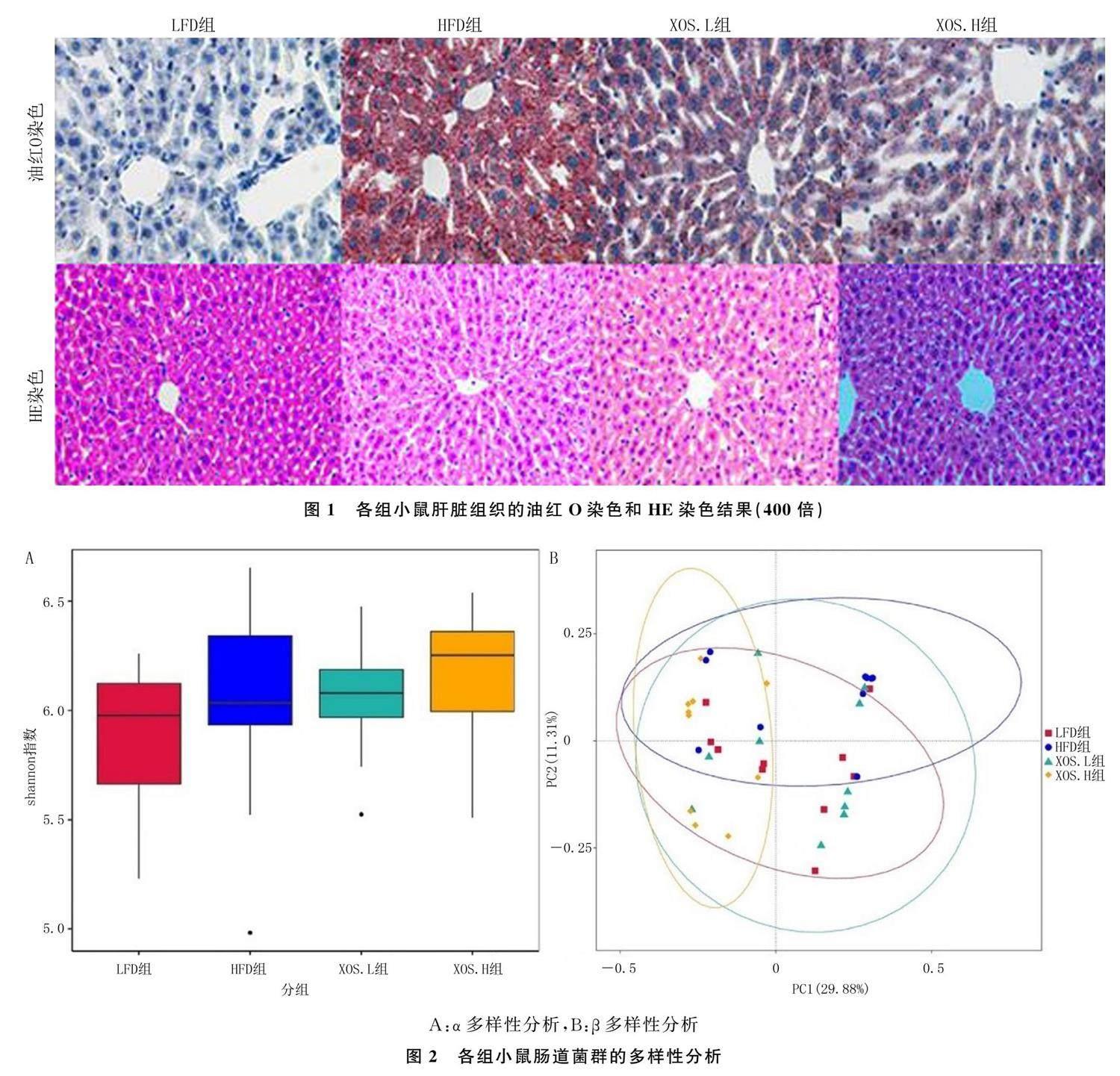
α多样性分析的结果显示,LFD组、HFD组、XOS.L组、XOS.H组小鼠肠道菌群种类多样性均未见显著性差异(P>0.05),Shannon指数分别为5.81±0.94、6.07±0.85、6.13±0.61、6.25±0.37,各组间比较差异无显著性(P>0.05);同时通过Shan- non指数所绘制的箱式图也呈窄、扁形状,见图2A,说明各组Shannon指数值相对稳定。
4组小鼠肠道菌群丰度的β多样性分析详见图2B,图中4组肠道菌群丰度以4种不同的颜色的符号表示,以95%置信区间将各组肠道菌群丰度进行聚类,显示HFD组与LFD组、XOS.L组和XOS.H组椭圆重叠度均较低,说明HFD组与余3组的菌群丰度差异较大;LFD组、XOS.L组和XOS.H组椭圆重叠度较高,说明这3组菌群丰度差异较小;XOS.H组与LFD组椭圆重叠度最高,说明这两组的肠道菌群丰度差异最小。
MetaStat分析结果显示,在属水平方面,4组小鼠中肠道菌群相对丰度均较高的属分别为Bacteroides、Parabacteroides、Faecalibaculum、Alistipes、Colidextribacter、Oscillibacter、Coriobacte-riaceae_UCG_00等。其中与LFD组相比较,HFD组Bacteroides、Parabacteroides等菌群丰度显著降低(P<0.01),而Faecalibaculum、Alistipes、Colidextribacter、Oscillibacter等菌群的豐度显著升高(P<0.05);与HFD组相比,XOS.H组Actinobacteria、Coriobacteriia、Coriobacteriaceae_UCG_002等菌群丰度显著降低(P<0.05);XOS.L组与其余三组比较,各菌群丰度差异不明显(P>0.05)。科水平方面,4组小鼠中肠道菌群相对丰度均较高的科分别为Lachnospiraceae、Prevotellaceae、Ruminococcaceae等。与LFD组相比, HFD组Ruminococcaceae、 Erysipelatotrichaceae、Lachnospiraceae、 Oscillospirace等菌群的丰度显著升高(P<0.05),Bacteroidaceae、Muribaculaceae、Prevotellaceae等菌群的丰度显著降低(P<0.05);与HFD组相比,XOS.H组Ruminococcaceae、Atopobiaceae、Bacteroidaceae、Faecalibaculum、Erysipelatotrichaceae等菌群丰度显著降低(P<0.05),Bifidobacterium、Alloprevotella、Prevotellaceae等菌群丰度显著升高(P<0.01);XOS.L组较其余的3组仅Fusobacterium、Erysipelatotrichaceae菌群的丰度显著降低(P<0.05)。
2.3 各组小鼠粪便差异代谢物分析
在OPLS-DA模型中,4组小鼠粪便差异代谢物的分布明显分离,互不重叠,说明OPLS-DA模型无过度拟合,稳定性良好,对粪便代谢物差异性分析的评价结果可靠度高。同时对模型经200次置换检验后,显示R2=0.97,Q2=-0.2, R2表示模型的拟合情况,其值接近1.0,证明模型的稳定性好;Q2为模型的预测指数,其值为负值,证明模型的预测能力可靠。
对小鼠粪便代谢物分析显示,HFD组与LFD组比较有117种上调,66种下调(VIP=1.0~2.0,P<0.05);XOS.L组与HFD组比较有84种上调,77种下调(VIP=1.0~3.0,P<0.05);XOS.H组与HFD组比较有247种上调,91种下调(VIP=1.0~1.5,P<0.05);XOS.H組与XOS.L组比较有100种上调,15种下调(VIP=0.5~2.5,P<0.05)。各组间两两比较得到的最显著的差异代谢物包括前列腺素H2(PGH2)、前列腺素D2(PGD2)、白三烯B4(LTB4)、△12-前列腺素J2(△12-PGJ2)、亚油酸(LA)、二十二碳五烯酸(DPA)等。
2.4 各组差异代谢物KEGG通路富集分析
分析结果显示,4组小鼠的差异代谢物在花生四烯酸代谢途径、LA代谢途径、不饱和脂肪酸代谢途径中均发生显著富集,其中,HFD组较LFD组△12-PGJ2、PGH2等差异代谢物富集强度显著上调(P<0.001),PGD2等差异代谢物富集强度显著下调(P<0.05),XOS.H组较HFD组的PGH2富集下调,而PGD2以及不饱和脂肪酸LA、DPA富集强度显著上调(P<0.01),XOS.L组较HFD组仅DPA、PGD2的富集强度上调(P<0.01)。
2.5 各组小鼠肠道菌群与差异代谢物相关性分析
Spearman相关性分析显示,差异代谢物PGH2与Alistipes、Rikenellaceae_RC9_gut_group、Lactobacillus、Ileibacterium等的丰度呈正相关性(P<0.01),同时与Lachnospiraceae_NK4A136_group、Allobaculum、Faecalibaculum的丰度呈负相关性(P< 0.05)。 PGD2与Lachnospiraceae_ NK4A136_group的丰度呈正相关(P<0.05),而与Rikenellaceae_RC9_gut_group、Lactobacillus、Ileibacterium以及Alistipes的丰度呈现负相关(P<0.01)。△12-PGJ2与Colidextribacter的丰度呈正相关性(P<0.01),与Bacteroides、Alloprevotella丰度呈负相关(P<0.01)。同时LA与Lachnospiraceae_NK4A136_group、Oscillibacter、Colidextribacter的丰度呈正相关(P<0.05), 与Rikenellaceae_RC9_gut_group、Ileibacterium、Lactobacillus、[Eubacterium]_fissicatena_group的丰度呈负相关(P<0.05)。另外DPA与Lachnospiraceae_NK4A136_group的丰度呈正相关(P<0.001),而与Rikenellaceae_RC9_gut_group、Ileibacterium、Lactobacillus、Alistipes的丰度呈负相关(P<0.05)。
3 讨 论
通过改善肠道菌群治疗高脂饮食所致FLD是目前比较受关注的治疗手段之一[6-7],“肠-肝轴”理论是支持该治疗策略的主要依据[8-9]。益生元可刺激肠道有益菌群的活性和生长,对宿主健康产生积极影响[10]。XOS是一种更具耐酸性和抗热性的益生元,在经过上消化道时不会被分解,可以稳定地进入肠道[11]。
本研究对5周龄C57/BL6J雄性小鼠分别喂饲低脂和高脂饲料,并对高脂饲料喂饲小鼠分别灌胃不同剂量的XOS,16周后,HFD组较LFD组、XOS.H组、XOS.L组血清ALT、AST、TG水平显著升高,XOS.H组较XOS.L组的ALT、AST、TG水平显著降低,与已有研究结果一致[12]。说明XOS的干预可显著降低小鼠血液中的ALT、AST、TG水平,提高肝细胞血脂代谢能力,且高剂量较低剂量效果更显著。同时本研究对小鼠的肝脏切片行油红O染色及HE染色,观察显示,HFD组小鼠肝脏肝索紊乱,肝细胞水肿,细胞内脂滴浸润严重,肝脏中重度纤维化,SAF评分最高;LFD组小鼠肝脏切片示肝细胞排列较为整齐,无明显纤维化,肝细胞内几乎无油红O着色,无明显脂滴积累、水肿;XOS.L组上述特征较HFD组减轻,且XOS.H组上述特征较HFD组改善更加明显,与LFD组比较接近,说明了XOS可改善FLD小鼠肝细胞内的脂滴堆积及细胞水肿,显著降低肝细胞损伤,且高剂量较低剂量效果更显著。
本研究对4组小鼠肠道菌群种类的α多样性分析结果显示,4组小鼠的Shannon指数无显著差异,说明4组小鼠肠道菌群种类没有明显差异,即4组间菌群种类相似。对肠道菌群丰度的β多样性分析结果显示,HFD组与LFD组菌群丰度差异较大,提示肠道菌群对FLD发生发展有显著影响,XOS.H组与LFD组的菌群丰度的差异最小,提示XOS对FLD小鼠肠道菌群有显著调节作用。
目前研究显示FLD小鼠肠道中Erysipelatotrichaceae、Faecalibaculum等菌群丰度较正常小鼠显著升高[13];此外,有研究发现Ruminococcaceae、Lachnospiraceae菌群丰度在肥胖人群肠道中显著升高,对T2DM进展有促进作用,肠道中Muriba-culaceae具有促进脂质氧化代谢,减轻脂质堆积的作用[14-15]。本研究同时对小鼠肠道菌群丰度进行了MetaStat分析,结果显示,在属水平上,HFD组较LFD组的小鼠肠道中Faecalibaculum、Alistipes、Colidextribacter、Oscillibacter等菌群的丰度显著升高,高剂量XOS干预可以显著地降低HFD组小鼠Actinobacteria、 Coriobacteriaceae_UCG_002、Co- riobacteriia等菌群丰度,低剂量XOS干预较HFD组未见明显差异;科水平上,HFD组较LFD组小鼠Ruminococcaceae、Erysipelatotrichaceae、Lachnospiraceae、Oscillospirace等菌群丰度显著升高,高剂量XOS干预可显著降低HFD组小鼠Ruminococcaceae、Atopobiaceae、Bacteroidaceae、Faecalibaculum、Erysipelatotrichaceae等菌群的丰度,而低剂量XOS干预较HFD组仅有Fusobacterium、Erysipelatotrichaceae菌群丰度降低,提示XOS在属水平和科水平上对肠道菌群均有调节作用,且高剂量较低剂量明显。研究显示FLD小鼠中Erysipelatotrichaceae、Faecalibaculum等菌群的丰度相较正常小鼠显著升高[13], Ruminococcaceae、Lachno- spiraceae菌群丰度在肥胖人群当中显著性升高,并且对T2DM进展有促进作用,Muribaculaceae具有促进脂质氧化代谢,减轻脂质堆积的作用[14-15],以上研究进一步提示,XOS可能是通过调节属水平及科水平的多种肠道菌群,来改善FLD小鼠的肝脏脂肪变性。
本研究对小鼠粪便代谢组学分析的结果显示,PGH2、PGD2、LTB4、△12-PGJ2、LA和DPA为最显著的共同差异代谢物。既往研究显示,PGH2是合成血栓素及PGD2的前体物质,可被前列腺素D2合成酶(L-PGDS)催化异构化形成PGD2,L-PGDS缺乏会导致正常小鼠血脂异常及肥胖,促进脂肪肝的形成[16-17]。高脂饮食可以影响花生四烯酸代谢途径中的PGH2、PGD2等相关代谢物的水平。本研究KEGG通路富集分析的结果提示,HFD组较LFD组PGH2水平显著上调,PGD2水平显著下调,XOS.H组相较HFD组PGH2水平显著下调,PGD2水平显著上调,表明XOS可能通過PGD2抑制花生四烯酸途径中炎症因子聚集黏附,减轻炎症反应,又经调节L-PGDS表达来改善肝脏的脂肪变性。有研究显示,XOS可降低脂肪肝小鼠肝脏的脂质含量[3],这也与本研究结果相符,因此,我们推测XOS可能通过阻断脂质氧化、抑制炎症反应,从而改善肝细胞脂肪样变。有研究显示,LA可以诱导胆固醇转换而具有降血脂作用;DPA可以降低脂肪酸合成基因以及一些炎症相关基因如肿瘤坏死因子α的表达,减轻肝脏的脂肪累积及炎症反应[17-18]。在本研究中,LA、DPA在各组中强度也发生显著改变,高剂量XOS干预组与HFD组相比LA、DPA富集强度升高,而低剂量XOS干预组与HFD组相比DPA的富集强度上调,表明XOS可能通过调节LA、DPA等代谢物富集强度,加速肝细胞内胆固醇、脂肪酸等脂质代谢,从而改善FLD小鼠的肝脏脂肪变性,且高剂量组效果好于低剂量组。
本研究KEGG通路富集分析显示,花生四烯酸代谢途径、LA代谢途径、不饱和脂肪酸代谢途径是PGH2、PGD2、LTB4、12-PGJ2、LA、DPA共有的富集通路,Spearman相关性分析结果表明,LA、DPA与Ileibacterium、Rikenellaceae_RC9_gut_group、Lactobacillus的丰度呈负相关性。同时与Lachnospiraceae_NK4A136_group的丰度呈正相关,表明上述菌群可能参与了促进脂质氧化分解进程,从而改善小鼠FLD进展。有研究 表明Lachnospira-ceae_NK4A136_group是一种有益菌,可通过花生四烯酸代谢途径改善小鼠肥胖状况[18],这与本研究结果相符。PGH2与Alistipes、 Rikenellaceae_RC9_gut_group、Lactobacillus、Ileibacterium等丰度呈正相关,PGD2则呈负相关。因此,XOS可能通过影响Lachnospiraceae_NK4A136、Ileibacterium、Rikenellaceae_RC9、Lactobacillus等菌群的丰度,调节花生四烯酸代谢途径、LA代谢途径、不饱和脂肪酸代谢途径中PGH2、PGD2、LA和DPA等代谢物富集强度,进而促进肝细胞内脂质代谢,减轻脂肪变性。以上结果均表明XOS具有改善FLD进展的作用,但肠道菌群并非是影响FLD的唯一途径,年龄、地理位置、饮食习惯、肠道菌群等因素间的复杂相互作用共同影响人体的健康,且XOS对FLD的作用,也可能并非仅仅是对肠道菌群的影响,所以后续需进行更多计量梯度及更深入的临床试验研究,来验证对FLD人群肠道菌群的影响。
综上所述,本研究通过对FLD模型小鼠的组织病理特征分析显示,XOS的干预可显著降低FLD小鼠血液中的ALT、AST、TG水平,改善肝细胞内的脂滴堆积及肝细胞水肿,显著降低肝细胞损伤;对小鼠肠道菌群及代谢物的HEGG通路分析显示,XOS可能通过花生四烯酸代谢、亚油酸代谢及不饱和脂肪酸代谢等途径调节PGH2、PGD2、LA以及DPA等代谢物水平,进而影响肠道菌群Lachnospiraceae_ NK4A136_group、Rikenellaceae_RC9_gut_group、Lactobacillus、Ileibacterium等科到属水平及其肠道代谢物的变化,从而改善FLD小鼠肝脏脂肪样变,延缓肝损伤进展。因此,XOS作为益生元可能具有改善高脂饮食所致FLD的效果。
伦理批准和动物权利声明: 本研究涉及的所有动物实验均已通过青岛大学附属医院实验动物福利伦理委员审核批准(文件号AHQU-MAL202106-01)。所有实验过程均遵照《实验动物管理条例》条例进行。
作者声明: 李翰卿、李宇鹍、齐兴四参与了研究设计;李翰卿、张震、田字彬、齐兴四参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]YOUNOSSI Z M, KOENIG A B, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016,64(1):73-84.
[2] DONGIOVANNI P, LANTI C, RISO P, et al. Nutritional therapy for nonalcoholic fatty liver disease[J]. J Nutr Biochem, 2016,29:1-11.
[3] LENSU S, PARIYANI R, MKINEN E, et al. Prebiotic xylo-oligosaccharides ameliorate high-fat-diet-induced hepatic steatosis in rats[J]. Nutrients, 2020,12(11):3225.
[4] CHRISTENSEN E G, LICHT T R, LESER T D, et al. Dietary xylo-oligosaccharide stimulates intestinal bifidobacteria and lactobacilli but has limited effect on intestinal integrity in rats[J]. BMC Res Notes, 2014,7:660.
[5] 中华医学会内分泌学分会. 非酒精性脂肪性肝病与相关代谢紊乱诊疗共识(第二版)[J]. 临床肝胆病杂志,2018,34(10):2103-2108.
[6] SHELDON R D, NICOLE BLAIZE A, FLETCHER J A, et al. Gestational exercise protects adult male offspring from high-fat diet-induced hepatic steatosis[J]. J Hepatol, 2016,64(1):171-178.
[7] MARKOWIAK P, LIEWSKA K. Effects of probiotics, prebiotics, and synbiotics on human health[J]. Nutrients, 2017,9(9):1021.
[8]LE ROY T, LLOPIS M, LEPAGE P, et al. Intestinal microbiota determines development of non-alcoholic fatty liver di-sease in mice[J]. Gut, 2013,62(12):1787-1794.
[9] VOLTA U, BONAZZI C, BIANCHI F B, et al. IgA antibo-dies to dietary antigens in liver cirrhosis[J]. Ric Clin Lab, 1987,17(3):235-242.
[10] SHEVELEVA S A. Probiotics, prebiotics and probiotic pro-ducts. Current status[J]. Voprosy Pitaniia, 1999,68(2):32-40.
[11] AACHARY A, PRAPULLA S. Xylooligosaccharides (XOS) as an emerging prebiotic: Microbial synthesis, utilization, structural characterization, bioactive properties, and applications[J]. Compr Rev Food Sci Food Saf, 2011,10:2-16.
[12] MARRA F, SVEGLIATI-BARONI G. Lipotoxicity and the gut-liver axis in NASH pathogenesis[J]. J Hepatol, 2018,68(2):280-295.
[13] 簡程芳,张博宇,王存萍,等. 藏族药二十五味松石丸调控肠道菌群改善非酒精性脂肪性肝炎的作用机制研究[J]. 中国中药杂志, 2022,47(8):2038-2048.
[14] YE X L, LIU Y, HU J J, et al. Chlorogenic acid-induced gut microbiota improves metabolic endotoxemia[J]. Front Endocrinol, 2021,12:762691.
[15] HU W B, GAO W Y, LIU Z M, et al. Specific strains of Faecalibacterium prausnitzii ameliorate nonalcoholic fatty liver disease in mice in association with gut microbiota regulation[J]. Nutrients, 2022,14(14):2945.
[16] ISLAM M A, KHAIRNAR R, FLEISHMAN J, et al. Lipocalin-type prostaglandin D2 synthase protein——A central player in metabolism[J]. Pharm Res, 2022,39(11):2951-2963.
[17] KUMAR S, SRIVASTAVA A, PALAIA T, et al. Lipocalin-type prostaglandin D2 synthase deletion induces dyslipidemia and non-alcoholic fatty liver disease[J]. Prostaglandins Other Lipid Mediat, 2020,149:106429.
[18] DONG W C, MAO Y L, XIANG Z H, et al. Traditional Chinese medicine formula Jian Pi Tiao Gan Yin reduces obesity in mice by modulating the gut microbiota and fecal metabolism[J]. Evid Based Complement Alternat Med, 2022,2022:9727889.
(本文编辑 耿波 厉建强)
