低温/中温花生粕蛋白的理化特性及结构特性分析
2024-05-29张彤冯雨禾戚朝霞郭浩曾里贾利蓉段飞霞冉旭
张彤 冯雨禾 戚朝霞 郭浩 曾里 贾利蓉 段飞霞 冉旭
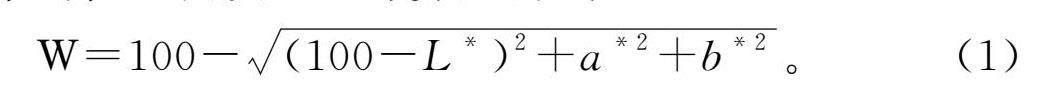
摘要:对低温/中温花生粕的感官色差、功能特性和结构特性进行了研究和分析,旨在为提高花生粕的综合利用价值提供理论基础。结果表明,低温花生粕呈象牙色,中温花生粕呈灰白色。从功能特性上来看,低温/中温花生粕蛋白的持油性、乳化性和泡沫稳定性无显著性差异。低温花生粕蛋白具有更好的溶解度、起泡性、持水性、热稳定性,中温花生粕蛋白具有更好的乳化稳定性。进一步通过分子量、二级结构、DSC对蛋白质结构进行分析,低温花生粕和中温花生粕蛋白质二级结构主要是β-折叠、β-转角,中温花生粕蛋白变性程度更高,低温花生粕的蛋白结构相对更松散。低温花生粕蛋白具有更高的变性温度和热焓值,且具有更好的热稳定性。
关键词:低温花生粕;中温花生粕;功能特性;结构特性
中图分类号:TS201.21 文献标志码:A 文章编号:1000-9973(2024)04-0032-06
Analysis of Physicochemical and Structural Chracteristics of Low-Temperature/
Medium-Temperature Peanut Meal Protein
ZHANG Tong1, FENG Yu-he1, QI Zhao-xia1, GUO Hao1, ZENG Li1,2*,
JIA Li-rong1,2, DUAN Fei-xia1,2, RAN Xu1,2*
(1.College of Biomass Science and Engineering, Sichuan University, Chengdu 610065, China;
2.Key Laboratory of Food Science and Technology in Institutions of Higher Education
in Sichuan Province, Sichuan University, Chengdu 610065, China)
Abstract: The sensory color difference, functional characteristics and structural characteristics of low-temperature/medium-temperature peanut meal are studied and analyzed, in order to provide a theoretical basis for improving the comprehensive utilization value of peanut meal.The results show that low-temperature peanut meal is ivory tint, and medium-temperature peanut meal is grayish white. In terms of functional characteristics, there is no significant difference in the oil-holding capacity, emulsibility and foam stability of low-temperature/medium-temperature peanut meal protein. Low-temperature peanut meal protein has better solubility, foamability, water-holding capacity and thermal stability, while medium-temperature peanut meal protein has better emulsification stability. The protein structure is further analyzed through molecular weight, secondary structure and DSC. The secondary structure of low-temperature peanut meal protein and medium-temperature peanut meal protein is mainly β-folding and β-turning. The denaturation degree of medium-temperature peanut meal protein is higher, and the structure of low-temperature peanut meal protein is relatively looser. Low-temperature peanut meal protein has higher denaturation temperature and enthalpy, and better thermal stability.
Key words: low-temperature peanut meal; medium-temperature peanut meal; functional characteristics; structural characteristics
收稿日期:2023-10-02
基金項目:四川大学青岛研究院“8122计划”项目(21GZ30201)
作者简介:张彤(2000—),女,硕士研究生,研究方向:食品工程。
*通信作者:曾里(1973—),女,高级工程师,硕士,研究方向:保健食品与健康食品的研究与开发;
冉旭(1968—),男,副教授,博士,研究方向:新资源食品的研究与开发。
花生(Arachis hypogaea L.)是世界第五大油料作物,也是一种宝贵的脂质来源,在我国主要用于生产花生油,并产生大量富含蛋白质的副产物[1]。目前,我国花生油的主要生产工艺可分为冷榨(压榨温度低于 60 ℃)和温榨(压榨温度90~95 ℃),温度较高的工艺主要用于加工具有浓郁烘烤和坚果风味的油,更受我国消费人群喜爱[2-3]。
花生粕是生产花生油的副产品,含有大量蛋白质、氨基酸、膳食纤维、钾、镁和锌[4],还含有其他功能成分,如花生凝集素、白藜芦醇苷等[5]。花生粕中的粗蛋白质含量达40%~50%,通常被用作饲料,造成了严重的资源浪费[6]。蛋白质的功能特性包括溶解性、起泡性、乳化性以及吸水、吸油能力,这些特性决定了花生粕蛋白在食品加工、运输和储存过程中的性能,因此在食品配制和加工过程中花生粕蛋白可能发挥着不可或缺的利用价值[7]。然而,目前国内外关于冷榨工艺和温榨工艺的研究主要集中于花生油的质量、化学成分和挥发性成分,对于脱脂花生粕的研究主要集中在产品应用层面,鲜见有关不同类型的花生粕的功能特性和蛋白质结构对比的研究报道。
因此,本研究旨在评价冷压和温压花生油提取工艺的副产物低温花生粕和中温花生粕的感官色差、氨基酸组成、功能特性及蛋白质结构特性,提出潜在应用场景,为花生粕的进一步加工提供方向,拓展其在市场上的开发和应用,为食品工业中花生粕的高值化产品开发提供理论基础。
1 材料和方法
1.1 材料及生产工艺
低温花生粕:蛋白质含量为51.2%,干燥温度为50~55 ℃,榨油温度为55~60 ℃。
中温花生粕:蛋白质含量为45.8%,干燥温度为120~125 ℃,榨油温度为90~95 ℃。
样品均由乳山市金果食品股份有限公司提供。
花生粕生产工艺流程:白沙花生→验收筛选→干燥→脱皮→榨油→原油
↓
花生粕。
1.2 试剂
Tris-HCl缓冲液、甘油、考马斯亮蓝染色液、考马斯亮蓝脱色液:北京索莱宝科技有限公司;Tris-甘氨酸电泳缓冲液、4×Tris/SDS分离胶缓冲液、4×Tris/SDS浓缩胶缓冲液、彩色预染蛋白Marker:北京兰杰柯科技有限公司;十二烷基硫酸钠、β-巯基乙醇:上海阿拉丁生化科技股份有限公司;BCA蛋白质定量试剂盒:上海碧云天生物技术有限公司;盐酸、氢氧化钠、磷酸氢二钾、磷酸二氢钾(均为分析纯):成都市科隆化学品有限公司。
1.3 主要仪器与设备
Gel Doc XR型凝胶成像仪 美国伯乐公司;QW-YC-20ST型多功能水平摇床 杭州齐威仪器有限公司;VE-M2电泳仪 上海泰坦科技股份有限公司;HH-6型数显恒温水浴锅 常州金南仪器制造有限公司;TG16-WS型台式高速离心机 湖南湘仪离心机仪器有限公司;DSC 204 F1差示扫描量热仪 德国耐驰仪器制造有限公司;IR-Tracer-100 FTIR光谱仪 日本岛津公司。
1.4 方法
1.4.1 感官色差分析
采用色度测定仪对花生粕进行色度的测定。采用规定白板校准后,记录L*值、a*值、b*值,测量6次取平均值。白度(W)计算见公式(1):
W=100-(100-L*)2+a*2+b*2。(1)
式中:L*代表明度,a*代表红度,b*代表黄度。
1.4.2 氨基酸组成分析
氨基酸的测定参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。
1.4.3 蛋白质溶解度(PS)的测定
参考王志鹏等[8]的方法测定不同pH值下的蛋白质溶解度。将样品分散在去离子水中,用0.1 mol/L HCl或0.1 mol/L NaOH將分散液的pH值调整到3.0~11.0,搅拌30 min。将悬浮液以5 000 r/min的速度离心10 min。在适当的稀释下,通过BCA蛋白质定量试剂盒测定上清液的蛋白质含量,并用标准公式计算蛋白质溶解度(PS),见公式(2):
PS(%)=W1W2×100%。(2)
式中:W1表示上清液蛋白质含量(mg),W2表示样品中水溶性蛋白质含量(mg)。
1.4.4 持水性(WHC)及持油性(OHC)的测定
将4.0 g样品与20 mL去离子水(或花生油)混合后,使用涡旋混合器涡旋3 min。常温下静置30 min,以4 500 r/min离心10 min,在去除上清液后,称离心管和沉淀物的重量[9]。每克花生蛋白分离物吸收的水和油的重量分别表示为WHC和OHC,按公式(3)计算:
WHC/OHC(g/g)=M2-M1M。(3)
式中:M为样品质量(g);M1为离心管和沉淀物的总质量(g);M2为离心管和样品的总质量(g)。
1.4.5 乳化特性的测定
将样品溶于磷酸钠缓冲液(100 mmol/L,pH 7.0)中,配制成1%的样品溶液,按照3∶1加入花生油,用均质机均质2 min(13 500 r/min)。均质后,在0 min和10 min时从试管底部取200 μL乳剂等份,与10 mL的0.1%十二烷基硫酸钠(SDS)溶液混合。稀释后的乳剂被短暂地涡旋,在500 nm处测量吸光度。以SDS溶液为空白。乳化活性指数(EAI)和乳化稳定性指数(ESI)分别根据公式(4)和公式(5)计算:
EAI=2×2.303×DF×A0(1-θ)×c×L×10 000。(4)
ESI=10×A0A0×A10。(5)
式中:c为初始蛋白质浓度(g/mL);θ为用于形成乳剂的大豆油的比例;L为比色皿的光径(1 cm);DF为稀释因子(50);A0为乳剂在0 min时的吸光度;A10为乳剂在10 min时的吸光度。
1.4.6 起泡特性的测定
起泡能力和起泡稳定性通过分析泡沫的形成量来确定。将样品溶解于蒸馏水中,配制样品溶液(50 mL,3%),在10 000 r/min下均质2 min,立刻转移至量筒中,测量搅打后的泡沫体积V1,静置60 min,再次测量静置后的泡沫体积V2。分别根据公式(6)和公式(7)计算蛋白质的起泡能力(FC)和起泡稳定性(FS):
FC(%)=(V1-50)50×100%。(6)
FS(%)=V1-50V2-50×100%。(7)
1.4.7 SDS-PAGE
采用Chen等[10]描述的SDS-PAGE方法,并对实验方法进行了一些改进。称取2 mg样品溶于0.5 mL 样品缓冲液中,在沸水中加热10 min,冷却至室温,离心(10 min,6 000 r/min)。取5 μL蛋白样品的等份试样,分别装入4%和12%的堆积凝胶和分离凝胶的每个孔中。电泳在恒定电压下进行,从80 V开始,当溴酚蓝条带迁移到凝胶浓缩物的底部时切换到110 V,直到跟踪染料迁移到凝胶的底部。电泳停止后,用考马斯亮蓝R250染色2 h,随即用脱色液进行振荡脱色4 h,之后用超纯水冲洗掉染色剂,直到条带清晰可见。采用Gel Doc XR凝胶成像仪(美国Bio-Rad公司)获得电泳图谱。
1.4.8 热力学性质(DSC)
使用差示扫描量热仪监测样品的热行为。取8 mg样品放置在密封的铝锅中,在60 mL/min的干燥N2吹扫下,以10 ℃/min的速度从20~120 ℃扫描样品,一式三份。每个样品的水分含量通过在105 ℃下干燥来确定,以便将热数据与干物质含量标准化。测定每个样品的温度峰值(℃)和转化焓ΔH(J/g)。
1.4.9 傅里叶红外光谱分析
准确称取1.000 g样品,与溴化钾粉末按1∶100的比例混合。将混合后的粉末置于研钵中精细研磨并压制成颗粒状。在4 000~400 cm-1范围内记录FTIR光谱,分辨率为4 cm-1,扫描次数为32次。使用Omnic软件对FTIR光谱进行基线校正、傅里叶去卷积处理后用PeakFit 4.0软件对二级结构的特征峰进行高斯曲线拟合。
2 结果与分析
2.1 感官色差分析
L*代表明度,a*代表红度,b*代表黄度,W代表白度。表1中低温花生粕的L*值、a*值、b*值分别是85.87±0.24,0.10±0.02,12.09±0.03,中温花生粕的L*值、a*值、b*值分别是82.59±0.01,1.50±0.01,15.46±0.07。低温花生粕具有更高的明度和白度。
由图1可知,低温花生粕呈象牙色,中温花生粕呈灰白色。
2.2 氨基酸組成分析
由表2可知,低温花生粕和中温花生粕的总氨基酸含量分别是47.88,49.73 g/100 g,必需氨基酸含量分别是13.40,13.60 g/100 g,说明两者氨基酸种类和含量差别不大。根据FAO/WHO的蛋白质理想模式,氨基酸组成评分不具有显著性差异。低温和中温花生粕中谷氨酸(Glu)、天冬氨酸(Asp)、精氨酸(Arg)和亮氨酸(Leu)约占每个样品中总氨基酸的53%,其中谷氨酸(Glu)含量最高,与颜孙安等[11]的研究结果一致。含量最低的均为蛋氨酸(Met),分别约占低温和中温花生粕总氨基酸的0.93%和0.97%,这与孙泓希等[12]的研究结果相一致。缬氨酸(Val)、蛋氨酸(Met)、丙氨酸(Ala)、脯氨酸(Pro)等疏水性氨基酸的含量差异可能影响花生粕的功能特性,如溶解度、乳化性、起泡性等。
2.3 花生粕蛋白功能特性分析
2.3.1 溶解度
溶解度是蛋白质尤为重要的功能特性,其决定着乳化、起泡及凝胶能力,可用来评价其在食品中的潜在应用。
由图2可知,pH值对低温和中温花生粕蛋白的溶解度均具有显著性影响。在等电点附近,pH在4.0~5.0时,两种花生粕蛋白的溶解度均较差。随着pH的增加,溶解度呈现上升趋势,低温花生粕蛋白的溶解度显著高于中温花生粕蛋白。当pH>7时,两种花生粕蛋白均具有较好的溶解状态,具有较高的溶解度。溶解度在碱性条件(pH为9)下达到峰值,低温花生粕蛋白达到99.67%,中温花生粕蛋白溶解度(15.4%)显著低于低温花生粕蛋白,这与Figueroa-González等[13]的研究结果一致。
2.3.2 持水性(WHC)、持油性(OHC)、乳化特性、起泡特性
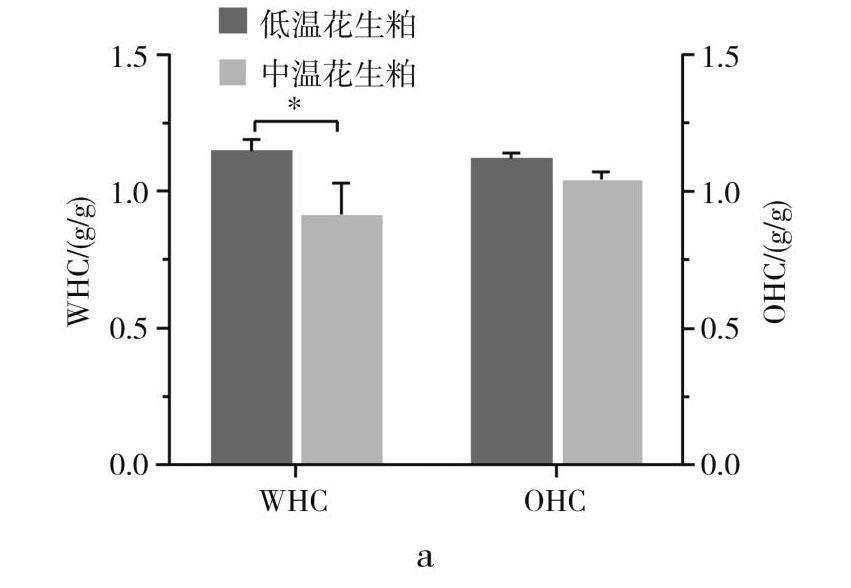
持水性和持油性表示蛋白质和水、油之间的相互作用,决定了蛋白质在不同食品体系中的行为,用于调节食品的质地和稠度[14]。
由图3中a可知,低温花生粕蛋白的持水性更好,为(1.15±0.04) g/g,而持油性不具有差异性。
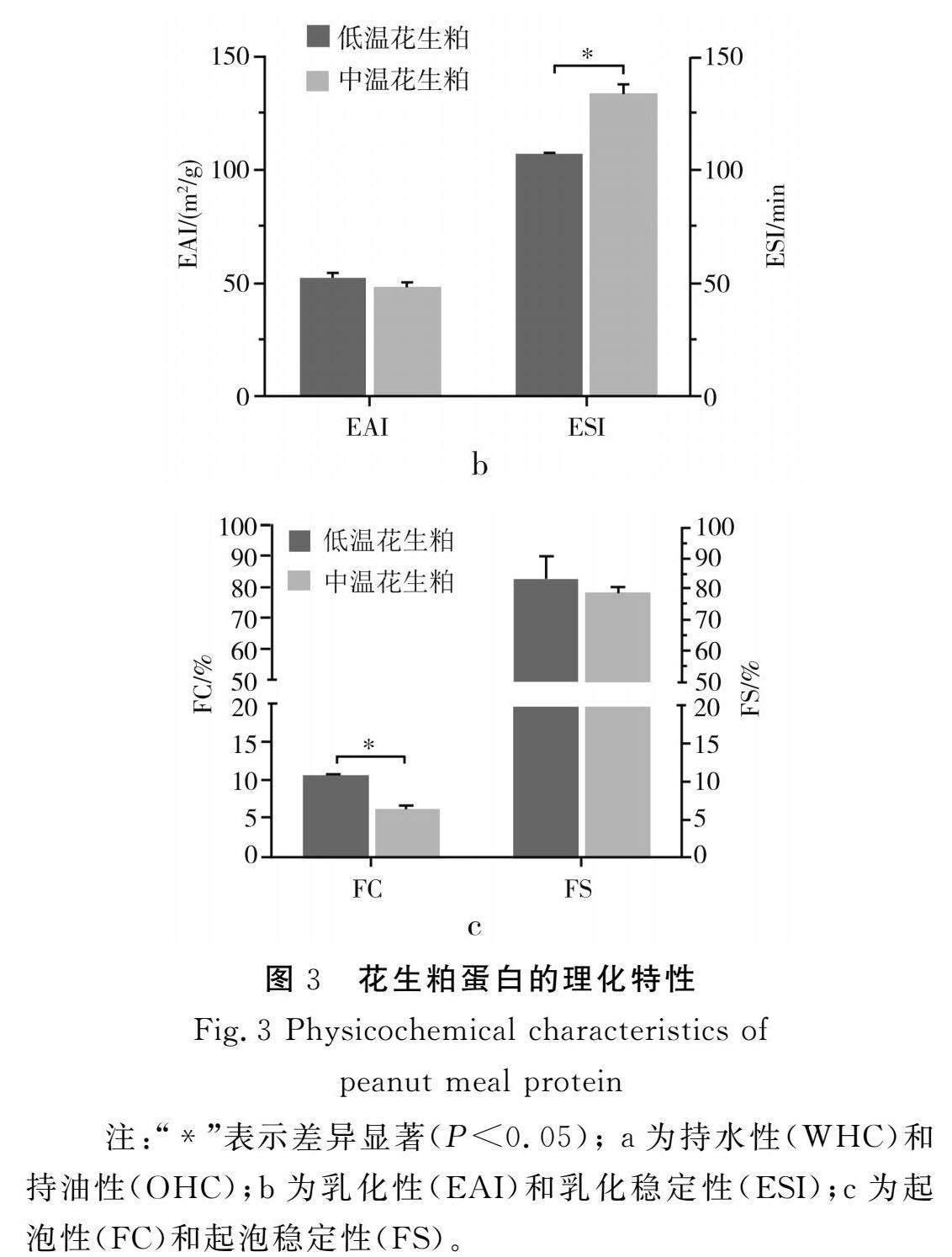
乳化性(EAI)及乳化稳定性(ESI)可以表征蛋白质在油水界面的吸收能力,取决于其蛋白质的结构构象和理化特性[15]。由图3中b可知,低温花生粕蛋白的乳化性为(52.60±1.78) m2/g,中温花生粕蛋白的乳化性为(48.49±1.70) m2/g。中温花生粕蛋白的ESI((133.633±3.89) min)显著高于低温花生粕蛋白((107.14±0.39) min)。低温花生粕蛋白和中温花生粕蛋白的乳化性无显著性差异,而中温花生粕蛋白表现出更好的乳化稳定性。
起泡能力是蛋白质形成液体-空气分散体的能力,是蛋白质具有在界面处吸附的内在能力,可以降低界面张力并构建一致的薄膜[16]。由图3中c可知,低温花生粕蛋白的起泡性和起泡稳定性分别为(10.64±0.02)%和(83.33±7.22)%,中温花生粕蛋白的起泡性和起泡稳定性分别为(6.22±0.41)%和(78.93±1.85)%。低温花生粕蛋白相比中温花生粕蛋白表现出更好的起泡能力,而起泡稳定性无显著性差异。
2.4 蛋白结构特性分析
2.4.1 SDS-PAGE
SDS-PAGE用于分析花生粕中各类蛋白质分子量组成,花生蛋白质的SDS-PAGE图谱见图4。
由图4可知,低温和中温花生粕蛋白亚基的分子质量分布一致。花生球蛋白显示3个条带,分别为48 kDa、35~48 kDa、25~35 kDa,伴球蛋白Ⅰ的分子量为17 kDa,伴球蛋白Ⅲ的分子量为75 kDa。
2.4.2 热力学性质
蛋白质分子吸收的热量随温度增加的变化主要归因于蛋白质的变性,因此焓的变化与蛋白变性和结构的展开有关[17]。通过热力学实验,获得有关花生粕蛋白的变性温度(Td)和热焓值(ΔH),由图5可知,低温花生粕蛋白和中温花生粕蛋白的DSC曲线均显示单个焓峰。变性温度Td反映花生粕蛋白对温度的敏感性,数值越大说明热稳定性越好。热焓值ΔH反映蛋白质的变性程度,ΔH越大说明升温至变性温度之前蛋白质的变性程度越小,热稳定性越好[18]。
由表3可知,低温花生粕蛋白的Td和ΔH分别为(89.10±0.88) ℃和(-62.12±2.08) J/g,显著高于中温花生粕蛋白的Td和ΔH((84.40±3.30) ℃和(-49.33±1.92) J/g, P<0.05)。中温花生粕蛋白具有较低的焓值是因为较高的温度破坏了蛋白质的结构以及维持蛋白质热稳定性的化学和物理力,中温花生粕蛋白的Td比低温花生粕蛋白的Td更低,这归因于中温花生粕蛋白温度较高导致部分氢键断裂[19]。低温花生粕蛋白的变性温度为89.10 ℃,中温花生粕蛋白的变性温度为84.40 ℃。低温花生粕蛋白的加工工艺中干燥和榨油的温度均低于60 ℃,均未达到低温花生粕蛋白的变性温度89.10 ℃。而中温花生粕蛋白加工工艺中,干燥温度为120~125 ℃,榨油温度为90~95 ℃,均超过中温花生粕蛋白的变性温度,从而使其变性,蛋白质的结构发生变性,使之暴露出更多的疏水基团,导致蛋白质的溶解性差,从而影响花生粕蛋白的功能特性[20]。
2.4.3 傅里叶红外光谱
傅里叶红外光谱能提供蛋白质分子的蛋白质环状结构、酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带的波段信息。酰胺Ⅰ带(1 600~1 700 cm-1)主要由肽键的CO拉伸振动引起,是用来研究蛋白质二级结构的光谱区域[21]。二级结构分为无序结构和有序结构,前者包含β-转角和无规则卷曲,后者包含α-螺旋和β-折叠。选择酰胺Ⅰ带的吸收峰进行蛋白质二级结构,β-折叠对应1 610~1 640 cm-1, 无规则卷曲对应1 640~1 650 cm-1, α-螺旋对应1 650~1 660 cm-1, β-转角对应1 660~1 700 cm-1[22]。
由表4可知,低温花生粕蛋白和中温花生粕蛋白的二级结构主要是β-折叠、β-转角,相比中温花生粕蛋白((36.66±4.59)%)而言,低温花生粕蛋白具有更高的β-转角((44.65±0.11)%,P<0.05),β-转角是连接蛋白质分子中的二级结构(β-折叠和α-螺旋),多数情况下处于蛋白质分子的表面。β-转角往往会形成大的二级结构来提高蛋白质的构象稳定性,因此低温花生粕蛋白具有更好的构象稳定性,这与热特性分析一致。β-折叠和α-螺旋结构分别以链间氢键和链内氢键维持,是维持蛋白质刚性结构的重要结构[23]。α-螺旋主要由多肽链上的羰基和氨基之间的链内氢键维持,低温花生粕蛋白的α-螺旋更少,表明花生粕蛋白内部的疏水性位点暴露程度更多,其疏水性与之增大,从而导致蛋白质表面张力降低,更容易吸附水-空气界面形成泡沫,因此起泡性更好。而由于疏水基团暴露,花生粕蛋白在水油界面的吸附能力下降,乳化后界面油滴絮凝,从而导致乳化稳定性降低[24]。低温花生粕蛋白的β-折叠和α-螺旋的比例低于中温花生粕蛋白,则低温花生粕蛋白的柔性结构单元多,有序结构减少,维持蛋白质结构稳定的氢键断裂,形成了松散的结构,产生更多的储水空间,导致低温花生粕蛋白的持水性更好[25]。
3 结论
通过主要感官色差、氨基酸组成、功能特性和结构特性对来自花生油冷榨工艺和温榨工艺的花生粕进行综合评价,并提出潜在的应用场景。低温/中温花生粕的白度值分别为81.40和76.67,因此低温花生粕具有更高的白度,呈现象牙色,中温花生粕呈现灰白色。低温花生粕和中温花生粕的蛋白质二级结构主要是β-折叠、β-转角。低温花生粕蛋白具有更高的变性温度和热焓值以及更好的热稳定性,中温花生粕蛋白的变性程度更高,低温花生粕的蛋白结构相对更松散。在不同的 pH 值下,低温花生粕比中温花生粕显示出相对更好的增溶潜力,这可作为食品配方中的一项重要特性。此外,低温花生粕蛋白和中温花生粕蛋白的持油性、乳化性和泡沫稳定性无显著性差异。低温花生粕蛋白具有更好的溶解度、起泡性、持水性、热稳定性,更适用于作为组织化植物肉制品、烘焙产品、饮料的食品原料。中温花生粕蛋白具有更好的乳化穩定性,更适用于乳制品、肉制品的食品配料。
参考文献:
[1]ZHENG L, REN J Y, SU G W, et al. Comparison of in vitro digestion characteristics and antioxidant activity of hot- and cold-pressed peanut meals[J].Food Chemistry,2013,141(4):4246-4252.
[2]DUN Q, YAO L, DENG Z Y, et al. Effects of hot and cold-pressed processes on volatile compounds of peanut oil and corresponding analysis of characteristic flavor components[J].LWT-Food Science and Technology,2019,112:107648.
[3]庄荣旭,马颖川,赖升敬,等.酶联美拉德反应制备天然烤花生风味物质的研究[J].中国调味品,2021,46(7):47-51.
[4]曾斌,唐敏,唐伟,等.花生粕和花生秸秆在动物饲用中的研究进展[J].中国饲料,2023(5):152-162.
[5]SALES M J, RESURRECCION A V A.Maximising resveratrol and piceid contents in UV and ultrasound treated peanuts[J].Food Chemistry,2009,117(4):674-680.
[6]韩杰,赵路苹,王丹,等.高温花生粕功能肽的酶法制备[J].食品研究与开发,2023,44(1):110-116.
[7]LI D, YAO M J, YANG Y, et al. Changes of structure and functional properties of rice protein in the fresh edible rice during the seed development[J].Food Science and Human Wellness,2023,12(5):1850-1860.
[8]王志鹏,王璐.绿原酸脱除工艺对葵花蛋白功能性质影响的研究[J].中国调味品,2022,47(6):61-64,68.
[9]范三红,贾槐旺,张锦华,等.不同提取方法对紫苏籽粕蛋白功能性质的影响[J].中国调味品,2021,46(12):61-69.
[10]CHEN Q L, ZHANG J C, ZHANG Y J, et al. Microscopic insight into the interactions between pea protein and fatty acids during high-moisture extrusion processing[J].Food Chemistry,2022,404:134176.
[11]颜孙安,林香信,刘文静,等.福建名特花生氨基酸营养价值评价[J].食品工业科技,2022,43(17):316-321.
[12]孙泓希,任亮,王海新,等.食用型花生外观和营养品质综合评价[J].中国油料作物学报,2023,45(5):907-915.
[13]FIGUEROA-GONZ LEZ J J, LOBATO-CALLEROS C, VERNON-CARTER E J, et al. Modifying the structure, physicochemical properties, and foaming ability of amaranth protein by dual pH-shifting and ultrasound treatments[J].LWT-Food Science and Technology,2022,153:112561.
[14]KHUSHAR F, MUHAMMAD I, HASEEB M A, et al. Ultrasound-assisted extraction of protein from Moringa oleifera seeds and its impact on techno-functional properties[J].Molecules,2023,28(6):2554.
[15]LI J X, SHI A M, LIU H Z, et al. Effect of hydrothermal cooking combined with high-pressure homogenization and enzymatic hydrolysis on the solubility and stability of peanut protein at low pH[J].Foods,2022,11(9):1289.
[16]YANG J, ZHU B, DOU J J, et al. pH and ultrasound driven structure-function relationships of soy protein hydrolysate[J].Innovative Food Science and Emerging Technologies,2023,85:103324.
[17]王立峰,朱洁,熊文飞,等.热效应对小麦醇溶蛋白起泡性与结构的影响[J].中国农业科学,2021,54(4):820-830.
[18]李颖畅,师丹华,赵淞民,等.超声波辅助没食子酸对鲈鱼肌原纤维蛋白结构特性的影响[J].中国食品学报,2023,23(7):88-98.
[19]朱燕丽,范小平,邹子爵,等.挤压膨化对美藤果饼粕蛋白的理化及功能性质的影响[J].中国调味品,2023,48(4):43-49.
[20]曾丹,邹波,徐玉娟,等.荔枝浊汁粗蛋白组分的结构和特性研究[J].食品科技,2018,43(8):227-233.
[21]张文刚,杜春婷,杨希娟,等.不同加工方式对藜麦蛋白质结构与功能特性的影响[J].食品科学,2022,43(7):88-95.
[22]陶健,蒋炜丽,丁太春,等.基于水平衰减全反射傅里叶变换红外光譜的食品中反式脂肪酸的测定[J].中国食品学报,2011,11(8):154-158.
[23]郑环宇,赵晓明,张梦,等.不同酶切方式引发大豆蛋白构象变化及功能特性评价[J].中国粮油学报,2022,37(6):103-111.
[24]衣程远,孙冰玉,刘琳琳,等.超声处理对大豆蛋白结构及性质的影响研究进展[J].中国调味品,2022,47(12):197-200.
[25]李侠,孙圳,杨方威,等.适宜冻结温度保持牛肉蛋白稳定性抑制水分态变[J].农业工程学报,2015,31(23):238-245.
