丝素-聚苯胺复合纳米纤维膜的制备及其性能
2024-05-29周家宝刘涛仇巧华朱灵奇王艳敏丁新波
周家宝 刘涛 仇巧华 朱灵奇 王艳敏 丁新波
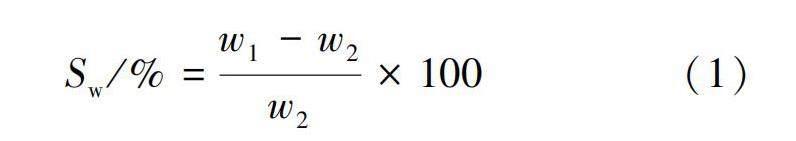
摘 要:以再生丝素蛋白(SF)为原料,以聚苯胺(PANI)为功能添加剂,采用静电纺丝技术制备了丝素-聚苯胺(SF-PANI)复合纳米纤维膜。通过SEM、XRD和FTIR等对其形貌、结构和性能进行表征。结果表明:SF-PANI复合纳米纤维膜孔隙率在70%以上;在磷酸盐缓冲液中其溶胀度可达158%;最大拉伸应力可达2.5 MPa。当SF-PANI复合纳米纤维膜中PANI质量分数为5%时,对大肠杆菌的抑菌率为80.08%,对金黄色葡萄球菌的抑菌率为75.20%;对PANI质量分数为5%的SF-PANI复合纤维膜进行卤化处理后,其对金黄色葡萄球菌及大肠杆菌的抑菌率均能达到100%。该复合膜具有良好的理化性能和抗菌性能,在抗菌型生物材料方面具有一定的应用前景。
关键词:聚苯胺;丝素蛋白;静电纺丝;卤化处理;抗菌性能
中图分类号:TB332 文献标志码:A 文章编号:1009-265X(2024)05-0009-09
收稿日期:20231124 网络出版日期:20240116
基金项目:国家自然科学基金项目(37900964);浙江理工大学科研启动基金项目(11150131722120)
作者简介:周家宝(1999—),男,安徽六安人,硕士研究生,主要从事现代纺织技术和产品开发应用方面的研究。
通信作者:丁新波,E-mail:dxblt@zstu.edu.cn
蚕丝主要由30%的丝胶蛋白和70%的丝素蛋白(Silk fibroin,SF)构成。SF作为一种天然纤维结构蛋白,具有良好的物理机械性能、可调节的生物降解性和优异的生物相容性,是一种理想的组织工程支架材料[1-5]。然而,单一SF缺乏抗菌性,植入时易导致感染,这些限制了其在临床与组织工程中的应用。加入抗菌性材料与SF复合使其具有抗菌性能,可以有效解决这一难题[6]。抗菌性材料分为无机抗菌材料和有机导电高聚物抗菌材料,与无机抗菌材料相比,有机导电高聚物抗菌材料重量轻、成本低且对环境稳定。有机导电高聚物包括聚苯胺(PANI)、聚吡咯(PPy)和聚(3, 4-乙烯二氧噻吩)(PEDOT)在内的本征导电聚合物(ICP)常被用于开发电荷载体,具有优异的抗菌性能。其中PANI已被广泛应用在电刺激、抗菌-敷料等领域[7-8]。此外,将PANI进行卤化处理,即将PANI中的氨基转化为N-卤胺结构,形成N-卤胺类有机物,有利于提高PANI抗菌性能。N-卤胺类有机物是指胺、酰胺或酰亚胺基的前体化合物与氧化剂(如次氯酸盐),反应后生成的含有一个或多个N-X(X=Cl,Br,I)共价键的有机化合物。含有N-X共价键的N-卤胺类有机化合物具有成本低、持久、可再生、无毒稳定、无腐蚀等优点,可广泛应用于抗菌型生物材料及医疗器械等领域[9]。
静电纺丝是一种以天然或合成聚合物为原料制备直径几十到几百纳米纤维膜的技术,通过静电纺丝技术所制备的纳米纤维因其比表面积大、孔隙率高、形状可控等特性受到关注[10]。通过静电纺丝,可以将纳米抗菌材料,与聚合物纳米纤维进行混纺[11-12]。导电高聚物抗菌材料因其独特的化学稳定性、抗菌性以及电学和光学性能而占有重要地位。而带有高密度正电荷的掺杂态导电高聚物聚苯胺由于其良好的生物相容性和抗菌性受到广泛关注[13-14]。因此,将PANI与SF混纺,所形成的丝素-聚苯胺(SF-PANI)复合纳米纤维膜拥有良好的生物相容性与抗菌性,具有良好的医学应用前景[15]。
本文以具有抗菌性能的PANI和良好的生物相容性的SF为原料,通过静电纺丝技术制备了具有高孔隙率和优异抗菌性能的SF-PANI复合纳米纤维膜,研究其微观形貌及理化性能。同时,使用NaClO进行卤化处理,探究卤化前后的化学组成和晶体结构以及对大肠杆菌和金黄色葡萄球菌的抗菌性能。研究结果有助于SF-PANI复合纳米纤维膜在伤口辅料及抗菌型生物材料领域中的应用。
1 实验
1.1 原料及试剂
苯胺(AN,分析纯,杭州高晶精细化工有限公司),水杨酸(SA,分析纯,杭州高晶精细化工有限公司),过硫酸铵(APS,分析纯,杭州高晶精细化工有限公司),去离子水(实验室自制),再生丝素蛋白(实验室自制),无水乙醇(EtOH,分析純,上海阿拉丁生化科技股份有限公司),甲酸(HCOOH,分析纯,上海阿拉丁生化科技股份有限公司)。
1.2 实验设备
WL-2 C型静电纺丝机(北京艾博智业有限公司),S 82-1型磁力搅拌器(上海志威电器),DF-101 S 恒温集热式磁力搅拌器(杭州惠创仪器设备有限公司),TG 16-WS 台式高速离心机(杭州惠创仪器设备有限公司),BCD-201 E/A冰箱(海信容声冰箱(广东)有限公司),KQ 5200 E超声波清洗器(昆山超声仪器有限公司)。
1.3 实验方法
1.3.1 聚苯胺(PANI)微球的制备
将1 mL苯胺和1.380 g水杨酸分别加入50 mL去离子水中,在室温下进行30 min超声处理,使水杨酸与苯胺充分混合。在50 mL去离子水中溶解2.282 g的APS,并进行10 min超声处理。将此溶液注入水杨酸/苯胺溶液中,混合后于10 ℃反应24 h。反应完成后,移除上层清液,用去离子水将不溶物洗涤至pH值为7。以乙醇继续清洗,直到滤液呈无色。最后将产物在真空烘箱中干燥12 h,获得聚苯胺微球。
1.3.2 SF-PANI复合纳米纤维膜的制备
将1 g丝素和9 g甲酸混合,在室温下搅拌至丝素完全溶解,加入不同比例的PANI微球,超声使其均匀分散获得纺丝原液。经过静电纺丝技术得到SF-PANI复合纳米纤维膜。纺丝参数:电压为20 kV,接收距离为14 cm,速度为0.3 mL/h,纺丝时长10 h。将SF、将SF/PANI质量分数为1%、SF/PANI质量分数为2%、SF/PANI质量分数为3%、SF/PANI质量分数为4%、SF/PANI质量分数为5%、SF/PANI6质量分数为6% 分别命名为S、S/P1、S/P2、S/P3、S/P4、S/P5、S/P6,数字代表PANI含量占SF纺丝液的质量分数。
1.3.3 SF-PANI复合纳米纤维膜的卤化处理
将SF-PANI复合纳米纤维膜剪切成规则的正方形,先用无水乙醇处理10 min;然后将其放置在10%的次氯酸钠溶液中,处理15 min;取出复合纳米纤维膜用70%的乙醇清洗,烘干得到卤化处理的SF-PANI复合纳米纤维膜。
1.4 测试与表征
1.4.1 表面形貌及结构分析
将SF-PANI复合纳米纤维膜在室温下干燥,置于电镜台上,镀金100 s。使用扫描电子显微镜(SEM)观察SF与SF-PANI复合纳米纤维膜的表面形貌。
1.4.2 化学组成与结构分析
利用傅里叶红外光谱仪(FTIR),选用ATR模式,在4000~400 cm-1的波数区域内对复合纤维进行扫描分析化学结构。通过X 射线衍射仪(XRD)来评估纤维的结晶特性,探测范围设置在5°~80°之间。
1.4.3 溶胀与孔隙性能测试
将含SF与不同PANI比例的SF-PANI复合纳米纤维膜进行脱水处理,记干重为w2。再将其浸入pH=7.4的磷酸缓冲液中,在37 ℃对其进行溶胀性能测试,在不同时间间隔时,取出纳米纤维膜并用过滤纸擦拭纤维膜表面,去除纤维膜表面的液体后进行称重,记为w1。样品的溶胀率(Sw)通过式(1)计算得到:
采用无水乙醇为介质,使用比重瓶测定SF与SF-PANI复合纳米纤维膜的孔隙率,每个样品重复进行测试3次。孔隙率Р通过式(2)计算得到:
式中:P用百分比来表示;m1为比重瓶加上乙醇的总质量,g;m2为反复抽取真空后样品及乙醇、比重瓶的总质量,g;m3为反复抽取真空之后比重瓶与乙醇的总质量,g;m0为复合膜的干重,g。
1.4.4 力学性能测试
利用万能材料测试机对纤维膜进行拉伸应力-应变测试,夹头间距为10 mm,试样宽5 mm,长20 mm。制备20 mm×5 mm的长方形样品,在温度为(20 ± 2) ℃,相对湿度为(55 ± 3) ℃下对纳米纤维膜的力学性能进行测试。
1.4.5 抗菌性能测试
细菌培养基的配置:将25.6 g琼脂加入到800 mL去离子水中,搅拌均匀。使用高压灭菌锅灭菌2 h,待其温度降至40 ℃以下,取出营养琼脂,将其倒入培养基至刻度线处,室温下静置20 min,待其冷却凝固,形成固体培养基。营养肉汤:将0.36 g营养肉汤加入20 mL去离子水中,摇匀在120 ℃高温灭菌2 h,待高压灭菌锅温度降至60 ℃以下,取出冷却备用[16]。细菌培养:取出大肠杆菌和金黄色葡萄球菌,在外包装表面喷洒酒精消毒将其放于超净台中,使用菌刮器将细菌涂抹在营养琼脂培养基上,放入搖床,恒温培养18~24 h。细菌培养结束后,再用菌刮器将培养菌放入营养肉汤中,在37 ℃恒温摇床中培养18~24 h。抑菌率实验:将培养好的大肠杆菌和金黄色葡萄球菌,使用pH=7.4的PBS缓冲液稀释,使其菌液浓度达到1×108 个 /mL,在稀释后的菌液中加入不同百分比的复合膜,在摇床中培养8 h,取出溶液进行稀释,将稀释后的溶液涂抹在营养琼脂培养基上,在37 ℃下倒置培养18~24 h,数出相对应百分比复合膜的菌落数,并拍摄培养基的照片,复合膜的抑菌效果由抑菌率R表示,计算公式如式(3)所示:
式中:R为抑菌率,A为对比照样品菌落数;B为测试组样品菌落数。
2 结果与讨论
2.1 PANI的微观结构
以APS为氧化剂,AN为原料,同时掺杂酸SA制备出的具有抗菌性能的PANI微球,并通过SEM观察它的微观结构,结果如图1所示。SA是一种有机酸,而AN具有碱性,两者在水溶液中发生酸碱反应形成了SA/An盐。在表面张力的影响下,An和SA在中SA/An水溶液中能共同形成O/W球形胶束。当加入过硫酸铵时,苯胺的聚合反应在胶束和水的界面上进行。胶束在反应过程中充当模板的作用[17]。
2.2 SF-PANI复合纳米纤维膜微观形貌
图2为SF和不同PANI比例的SF-PANI复合纳米纤维膜的微观形貌及对应直径分布图。图2(a)为SF纤维膜SEM照片和直径分布图,其纤维直径主要集中在150~250 nm;图2(b)为PANI微球质量分数1%的SF-PANI复合纳米纤维膜的SEM照片和纤维直径分布图,其纤维直径主要分布在250~400 nm;图2(c)为PANI微球质量分数3%的SF-PANI复合纤维膜的SEM照片和纤维直径分布图,其纤维直径主要分布在150~200 nm。PANI微球质量分数6%的SF-PANI复合纤维膜的SEM照片和纤维直径分布图如图(d)所示,当PANI质量分数为6%时,SF-PANI纤维直径分布不均程度逐渐增大,这是因为随着PANI含量的增加,PANI在SF-PANI复合纤维膜中发生团聚而导致电纺时出液量不均,进而导致电纺过程中射流不稳定,最后形成直径不均的纳米纤维。
2.3 化学组成与晶体结构
图3为SF和经NaClO处理前后不同PANI比例的SF-PANI复合纳米纤维膜的FTIR。如图3(a)所示,1627 cm-1(酰胺I)、1516 cm-1(酰胺II)和1235 cm-1(酰胺III)处的特征峰表明了SF的β-折叠构象。3300 cm-1是SF中—OH的伸缩振动峰[18]。1560 cm-1和1140 cm-1处的吸收峰分别对应PANI的苯胺酮结构和苯环弯曲振动[19],这表明SF-PANI复合纳米纤维膜的成功制备。对SF和不同PANI比例的SF-PANI纳米复合纤维膜的红外光谱进行比较发现:PANI的加入未对纳米纤维膜的化学结构产生明显变化,这表明PANI和SF之间主要为物理作用。由图3(b)可知,经NaClO处理后的SF-PANI复合纳米纤维膜,SF原本的特征峰1627 cm-1(酰胺I)、1519 cm-1(酰胺II)和1235 cm-1(酰胺III)处的特征峰发生偏移,说明SF-PANI复合纳米纤维膜中的N—H转变为N—Cl。
图4为S/P3复合纳米纤维膜经NaClO卤化处理前后的XRD图。S/P3复合纳米纤维膜的XRD图在20.16°、26.05°和30.10°的峰与SF纤维膜在20.26°、26.05°和29.30°处的酰胺I和酰胺II结构相对应[20-21]。从图4可以看出:SF的晶体结构没有因为PANI颗粒添加而受到影响[22]。而经过NaClO卤化处理后,酰胺I和酰胺II结构对应的特征峰消失。这表明NaClO溶液卤化处理对S/P3复合纳米纤维膜的酰胺I和酰胺II结构产生了影响。
2.4 溶胀性能与孔隙率
图5为SF和不同PANI比例的SF-PANI复合纳米纤维膜的溶胀性能测试结果。如图5所示,24 h的S与S/P1、S/P2、S/P3、S/P4、S/P5、S/P6复合纤维膜的溶胀率分别为99%、101%、106%、137%、138%、148%和158%。由图5可以看出,SF和不同PANI比例的SF-PANI复合纳米纤维膜在前4 h内的溶胀率增长较快。这是由于水分子在进入复合纳米纤维膜后,与PANI及丝素蛋白大分子相互作用所致,最终溶胀率在12 h后趋于稳定。与纯SF纳米纤维膜相比,添加了PANI纳米颗粒的SF-PANI复合纳米纤维膜溶胀率有所增加,尤其是PANI质量分数为5%和6%时的SF-PANI复合纳米纤维膜溶胀率达到139%、158%。这不仅得益于SF-PANI复合纳米纤维膜的高孔隙率,也因为亲水PANI纳米微球改善了复合纳米纤维膜的亲水性。
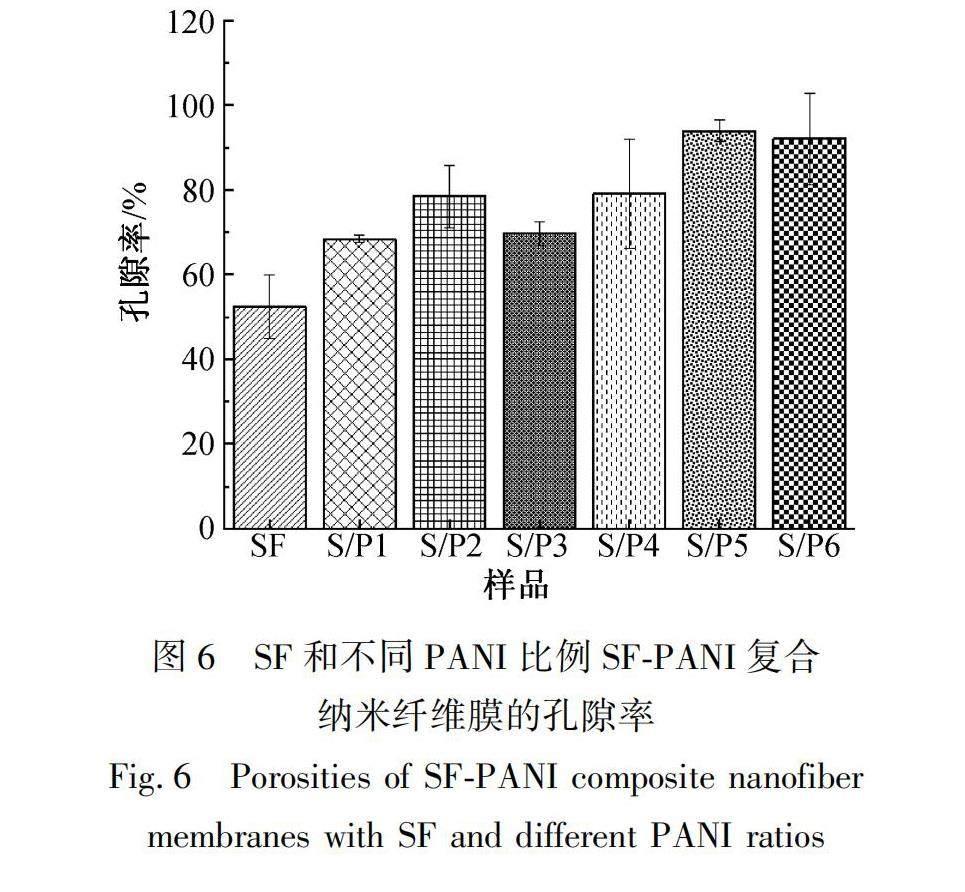
图6为SF和不同PANI比例SF-PANI复合纳米纤维膜的孔隙率测试结果。孔隙率是纳米纤维膜的一个重要参数,高孔隙率说明纤维膜具有较高的吸附能力和较大的比表面积,有助于吸收伤口的渗出液。如图6所示:SF和SF-PANI复合纳米纤维膜均具有较高的孔隙率,分别为52.4%±7.50%、68.40%±0.80%、78.40%±7.40%、69.63%±2.90%、79.10%±12.90%、94.00%±2.50%及92.00%±10.80%,说明PANI微球的加入提高了复合纳米纤维膜的孔隙率。
2.5 力学性能分析
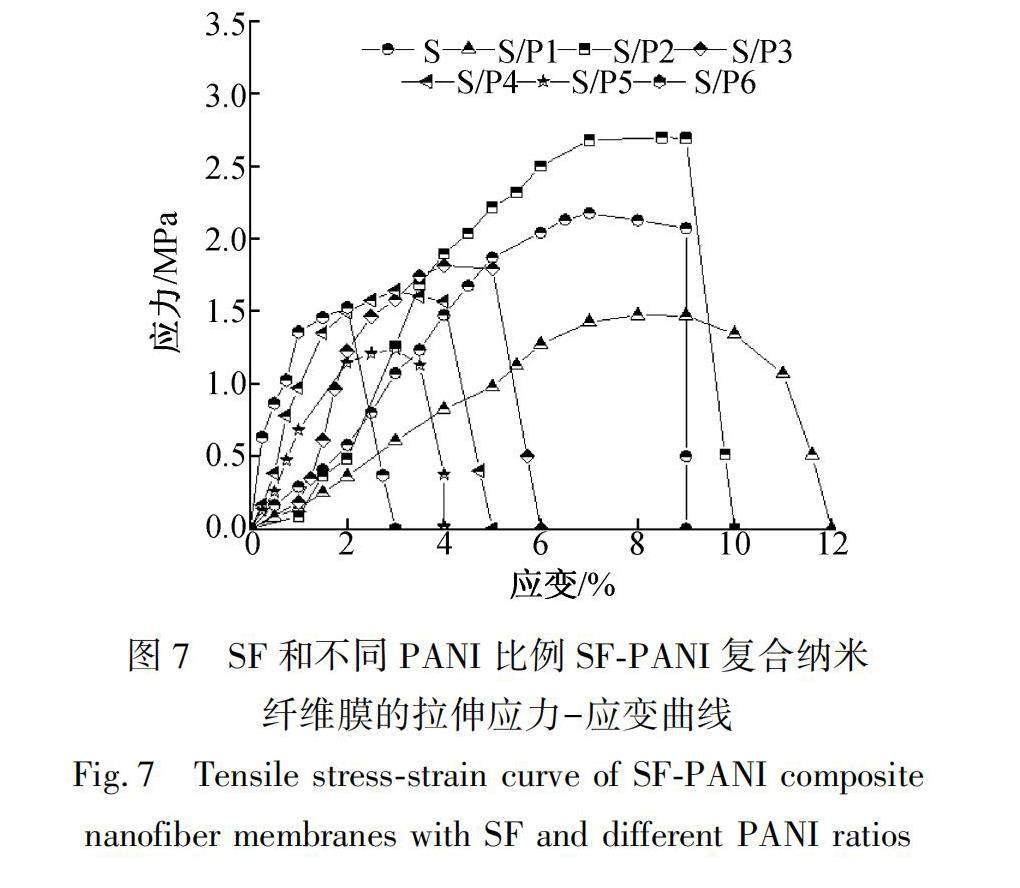
图7为SF和不同PANI比例的SF-PANI复合纳米纤维膜的应力-应变曲线。纯SF的断裂应力与拉伸应变分别为2.174 MPa与9%。当PANI含量逐渐增加时,断裂应力分别为1.466、2.693、1.806、1.633、1.224、1.489 MPa;拉伸应变分别为12%、10%、6%、5%、4%、3%。当PANI含量为1%、2%时,其拉伸应变大于纯SF。这主要是由于PANI微球黏附在单根SF纳米纤维的表面,对SF纳米纤维起到了支撑作用,有利于复合纳米纤维膜断裂伸长率的增加。當PANI含量超过2%,SF-PANI复合纳米纤维膜的断裂应力与拉伸形变逐渐降低,这是由于聚苯胺微球在SF纳米纤维膜中发生团聚,降低了纤维之间的接触面积,导致拉伸过程中更容易发生滑移。因此少量PANI的增加,有利于力的传导与分布,使复合纳米纤维膜体现出较好的力学性能。
2.6 抗菌性能
图8为通过稀释涂板法比较SF与不同PANI比例SF-PANI复合纳米纤维对金黄色葡萄球菌和大肠杆菌的平板菌落照片,图9为SF-PANI复合纳米纤维膜的抗菌性能。从图8(a)中看出,随着SF-PANI复合纳米纤维膜中PANI含量的增加,大肠杆菌及金黄色葡萄球菌的菌落数逐渐减少,表明在细菌生长过程中,部分细菌被PANI杀死,导致菌落数逐渐减少。从图8(b)可以看出,经过卤化处理的SF-PANI复合纳米纤维膜,抗菌性更强,使得质量分数为4%时,杀死培养基中所有细菌,使其达到无菌落的状态。从图9(a)可以看出,以未负载PANI的SF纤维膜为对照组,SF-PANI复合纤维膜中PANI质量分数由1%至6%,其对大肠杆菌的抑菌率分别为1.20%、2.56%、5.01%、74.10%、80.08%、87.70%,对金黄色葡萄球菌的抑菌率分别为0.50%、1.25%、3.40%、25.56%、75.20%、86.56%。随着PANI纳米颗粒含量的增加,SF-PANI复合纳米纤维膜的抑菌效果逐渐增强。这是因为PANI的大分子链中含有大量的醌环与苯环,使得主链的大部分处于带正电的状态,这会与细菌细胞壁上的负电荷相互吸引,通过库仑力吸附细菌并破坏其细胞壁,最终导致细菌死亡[23-24]。从图9(a)可以看出,在PANI质量分数达到5%时,对大肠杆菌及金黄色葡萄球菌的抑菌率均达到70.00%以上,说明当SF-PANI复合纤维膜中PANI质量分数达到5%时,复合膜PANI含量能够达到对两种细菌的最低抑菌浓度。从图9(b)可以看出,经过卤化处理的SF-PANI复合纳米纤维膜,其N—H被卤化为N—Cl,当其与水分子接触后,N—Cl释放出强氧化性的Cl离子,破坏细菌的细胞膜,从而进入到细菌体内,影响细胞酶的代谢过程及其活性,最终使细菌死亡,达到抗菌效果[25]。卤化后的SF-PANI复合纳米纤维膜在PANI质量分数为2%时,对大肠杆菌的抑菌率为80.96%以上,对金黄色葡萄球菌的抑菌率为78.73%,均在70.00%以上,并且在PANI质量分数达到4%时,对大肠杆菌及金黄色葡萄球菌的抑菌率达到100.00%。
3 结论
本文通过静电纺丝制备SF-PANI复合纳米纤维膜,使用NaClO对其进行改性处理,使PANI中氨基转化为N—Cl,对其改性前后的抗菌性能进行研究。并对复合膜的微观结构、化学组成和晶体结构进行表征,对其溶胀率、孔隙率和力学性能进行测试分析,探究其物理、化学性能。结论如下:
a)通过静电纺丝成功制备了SF-PANI复合纳米纤维膜,XRD和FTIR的结果表明经过NaClO处理后SF-PANI复合纳米纤维膜中的氨基转化成了N-卤胺。
b)SF-PANI复合纳米纤维膜具有良好的溶胀性能、较高的孔隙率和良好的力学拉伸性能。随着PANI含量的增加,该复合纳米纤维膜的溶胀率达到158%,孔隙率达到92%。最大拉伸应力超过2.5 MPa。
c)SF-PANI复合纳米纤维膜对大肠杆菌及金黄色葡萄球菌均体现出良好的抗菌性能,且伴随PANI含量的增高,其抑菌能力逐渐增强。当PANI质量分数为5%时,SF-PANI复合纳米纤维膜对大肠杆菌及金黄色葡萄球菌的抑菌率均超过70.00%。经过NaClO处理的SF-PANI复合纳米纤维膜,当PANI质量分数为2%时,其对大肠杆菌及金黄色葡萄球菌的抑菌率超过70.00%;当PANI质量分数为4%时,其对大肠杆菌及金黄色葡萄球菌的抑菌率可达100.00%。
综上所述,本文通过静电纺丝技术制备的SF-PANI复合纳米纤维膜拥有优异理化性能和抗菌性能,表明其在抗菌型生物材料领域中具有良好的应用前景。
参考文献:
[1]CHEN K, LI Y H, LI Y B, et al. Silk fibroin combined with electrospinning as a promising strategy for tissue regeneration[J]. Macromolecular Bioscience, 2022, 23(2): 2200380-2200394.
[2]范苏娜, 陈杰, 顾张弘, 等. 丝素蛋白纤维及功能化材料的设计与构筑[J]. 高分子学报, 2021, 52(01): 29-46.
FAN Suna, CHEN Jie, GU Zhanghong, et al. Design and fabrication of silk fibroin-based fibers and functional materials[J]. Acta Polymerica Sinica, 2021, 52(01): 29-46.
[3]LU H H, WANG J L, LI J, et al. Advanced silk fibroin biomaterials-based microneedles for healthcare.[J]. Macromolecular Bioscience, 2023, 23(11): 14-26.
[4]XIE X, YU J, ZHAO Z, et al. Fabrication and drug release properties of curcumin-loaded silk fibroin nanofibrous membranes[J]. Adsorption Science Technology,2019,37(5-6): 412-424.
[5]SONG J K, KLYMOV A, SHAO J Y, et al. Electropun nanofibrous silk fibroin membranes containing gelatin nanospheres for controlled delivery of biomolecules[J]. Advanced Healthcare Materials, 2017, 6: 1700014-1700023.
[6]ZHU B G, LI Y H, HUANG F H, et al. Promotion of the osteogenic activity of an antibacterial polyaniline coating by electrical stimulation[J]. Biomaterials Science, 2019, 7(11), 4730-4737.
[7]HE J H, LIANG Y P, SHI M T, et al. Anti-oxidant electroactive and antibacterial nanofibrous wound dressings based on poly(ε-caprolactone)/quaternized chitosan-graft-polyaniline for full-thickness skin wound healing[J]. Chemical Engineering Journal, 2020, 385, 123464-123476.
[8]PANG Q, WU K H, JIANG Z L, et al. A polyaniline nanoparticles crosslinked hydrogel with excellent photothermal antibacterial and mechanical properties for wound dressing[J]. Macromolecular Bioscience, 2022, 22(3), 386-396.
[9]李平, 董阿力德尔图, 孙梓嘉,等. N-鹵胺类高分子与纳米抗菌材料的制备及应用[J]. 化学进展, 2017, 29(Z2): 318-328.
LI Ping, DONG Alideertu, SUN Zijia, et al. Synthesis and applications of antibacterial N-halogen amine polymers and nanomaterials[J]. Progress in Chemistry, 2017, 29(Z2): 318-328.
[10]苏芳芳, 经渊, 宋立新, 等. 我国静电纺丝领域研究现状及其热点:基于CNKI数据库的可视化文献计量分析[J]. 东华大学学报(自然科学版), 2024,50(1):45-54.
SU Fangfang, JING Yuan, SONG Lixin, et al. Present situation and hotspot of electrospinning in China: Visual bibliometric analysis based on CNKI database[J]. Journal of Donghua University (Natural Science), 2024,50(1):45-54.
[11]SOWA I, WOJCIAK M, TYSZCZUK-ROTKO K, et al. Polyaniline and polyaniline-based materials as sorbents in solid-phase extraction techniques[J]. Materials, 2022, 15(24): 8881-8903.
[12]MOHAMMADKHAH S, SARABI A A, EIVAZ MOHAMMADLOO H, et al. Improvement of active/passive anti-corrosion/weathering properties of epoxy-siloxane structure via cloisite 30B/polyaniline inclusion as new hybrid nanocomposite coatings[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2023, 666: 131297-131313.
[13]ANDRIIANOVA A N, LATYPOVA L R, VASILOVA, L Y, et al. Antibacterial properties of polyaniline derivatives[J]. Journal of Applied Polymer Science, 2021, 138(47): 51397-51407.
[14]LATYPOVA L R, USMANOVA G S,VASILOVA L V, et al. Synthesis and characterization of N-substituted polyanilines and polyindoles and their antibacterial activity[J]. Chemical Papers, 2023, 77(1): 473-483.
[15]HANG M Y, GUO B L. Electroactive 3D scaffolds based on silk fibroin and water-borne polyaniline for skeletal muscle tissue engineering[J]. Macromolecular Bioscience, 2017, 17(9): 147-156.
[16]王悅, 徐国平, 仇巧华,等. 聚乙烯醇/海藻酸钠载药复合水凝胶的制备及其抗菌性能[J]. 现代纺织技术, 2023, 31(3): 145-154.
WANG Yue, XU Guoping, QIU Qiaohua, et al. Preparation and antibacterial properties of polyvinyl alcohol alginate-loaded composite hydrogels[J]. Advanced Textile Technology, 2023, 31(3): 145-154.
[17]任冠桥, 刘红缨, 朱英. 尺寸可控的自组装聚苯胺微/纳米空心球[J]. 内蒙古科技大学学报, 2008, 27(4): 337-345.
REN Guanqiao, LIU Hongying, ZHU Ying. Size-controlled self-assembled polyaniline micro/nano hollow spheres[J]. Journal of Inner Mongolia University of Science and Technology, 2008, 27(4): 337-345.
[18]SANTI S, MANCINI I, DIRE S, et al. A bio-inspired multifunctionalized silk fibroin[J]. ACS Biomateriaos Science & Engineering, 2021, 7(2): 507-516.
[19]YUAN T S, HUANG Y, DONG S J, et al. Infrared reflection of conducting polyaniline polymer coating[J]. Polymer Testing, 2002,21(6): 641-646.
[20]ZHOU Y S, YANG H J, LIU X, et al. Electrospinning of carboxyethyl chitosan/poly(vinyl alcohol)/silk fibroin nanoparticles for wound dressings[J]. International Journal of Biological Macromolecules, 2013, 53: 88-92.
[21]ZHOU J A, CAO C B, MA X L, et al. Electrospinning of silk fibroin and collagen for vascular tissue engineering[J]. International Journal of Biological Macromolecules, 2010, 47(4): 514-519.
[22]LI X, MING J, NING X. Wet-spun conductive silk fibroin-polyaniline filaments prepared from a formic acid-shell solution[J]. Journal of Applied Polymer Science, 2019, 136(9): 47127-47133.
[23]FALAK F, SHIN B K, HUH D. Antibacterial activity of polyaniline coated in the patterned film depending on the surface morphology and acidic dopant[J]. Nanomaterials, 2022, 12(7): 1085-1103.
[24]ROBERTSON J, GIZDAVIC-NIKOLAIDIS M, NIEUWOUDT M K, et al. The antimicrobial action of polyaniline involves production of oxidative stress while functionalisation of polyaniline introduces additional mechanisms[J]. PeerJ, 2018, 6: 5135-5170.
[25]CAI W, WANF J X, QUAN X D, et al. Preparation of bromo-substituted polyaniline with excellent antibacterial activity[J]. Journal of Applied Polymer Science, 2018, 135(1): 45657-45664.
Preparation and antibacterial properties of silk fibroin-polyaniline
composite nanofiber membranes
ZHOU Jiabao, LIU Tao, QIU Qiaohua, ZHU Lingqi, WANG Yanmin, DING Xinbo
(College of Textile Science and Engineering (International Institute of Silk), Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract: This article used electrospinning technology to prepare composite antibacterial (SF PANI) dressings with polyaniline (PANI) and regenerated silk fibroin (SF) as raw materials. Silk fibroin is a structural protein that is spun into fibers by thousands of arthropods and used in vitro. It is a natural high molecular fiber protein and is often used as an ideal dressing for repairing oral, maxillofacial, and systemic skin wounds. The modification of silk fibroin materials with different antibacterial properties has received extensive research and attention. Finished silk fibroin is obtained by degumming, dialysis, and freeze-drying of silkworm cocoons. Due to the easy availability of raw materials, diverse chemical structures, simple synthesis methods, unique doping mechanisms, low cost, and good biological stability, polyaniline functionalized derivatives are a new type of antibacterial agent with the potential to provide anti-fouling surfaces as non-leaching additives, and have broad prospects in textile-based flexible applications.
Electrospinning is a simple, cost-effective, and controllable method for preparing nanofibers or microfibers from polymers in solution or melt state under high voltage electric fields. Through scanning electron microscopy (SEM), it can be seen that as the PANI content in the SF-PANI composite nanofiber membrane increases, the fiber diameter of the composite membrane gradually decreases from a microscopic perspective, and becomes more and more uneven in thickness. From a macro perspective, with the increase of PANI content, the overall color of the nanocomposite fiber membrane changes from pure white to dark green. The chemical composition and structure of PANI were characterized by instruments such as infrared spectroscopy (FTIR) and X-ray powder diffraction (XRD). It was found that PANI was successfully loaded on the SF fiber membrane, and the addition of PANI did not react with SF to produce a new chemical structure. By analyzing the swelling and porosity of the SF-PANI composite fiber membrane, it can be concluded that the overall performance of the composite membrane meets the basic requirements for antibacterial materials. From the mechanical properties of the composite membrane, it can be seen that as the PANI content gradually increases, the mechanical properties of the composite membrane first increase and then decrease. When the PANI content reaches 2%, the mechanical properties are the best. This article studied the antibacterial properties of composite membranes before and after halogenation. It can be seen that before halogenation treatment, the SF-PANI composite nanofiber membrane has good antibacterial performance against Staphylococcus aureus and Escherichia coli. After halogenation, its antibacterial mechanism undergoes a transformation. Compared with the original antibacterial property of polyaniline, N-halogenation releases strong oxidizing poplar ions, which destroy the bacterial cell membrane and enter into the bacterial body, affecting the metabolic process and activity of cellular enzymes, and eventually the bacteria die.
The results indicate that the chemical composition of the SF-PANI composite nanofiber membrane prepared in this article does not change with the content and modification of polyaniline, and the SF-PANI composite nanofiber membrane has good pore swelling and mechanical properties. It has good application prospects in terms of antibacterial activity against Escherichia coli and Staphylococcus aureus.
Keywords: polyaniline; silk fibroin; electrospinning; halogenation; antimicrobial properties