甲壳素纤维的制备及应用研究进展
2024-05-24刘云翠邵晓宇朱波涛张如全涂虎
刘云翠 邵晓宇 朱波涛 张如全 涂虎

摘要:甲壳素作为自然界中唯一带正电荷的天然多糖,具有生物降解性、生物相容性、抗菌性和可再生性等优点,在生物医学、制药工程、食品添加和食品包装等方面得到广泛应用。甲壳素纤维是甲壳素经纺丝后制成的新型生物质纤维,在保留原有甲壳素优异性能的同时使其拥有巨大的发展潜力应用于各种领域。系统总结了近年来制备甲壳素纤维的多种方法和工艺流程,对比了不同制备方法体系的差异性影响因素,涵盖了其在多个领域的应用前景,并结合现存的一些问题对其未来发展趋势做出展望,为甲壳素纤维的进一步开发应用提供依据。
关键词:甲壳素;再生纤维;湿法纺丝;可降解;功能化应用
中图分类号:TS195.644 文献标志码:A 文章编号:2097-2911-(2024)02-0001-09
Research development on the preparation and application of chitin fibers
LIU Yuncui 1a, SHAO Xiaoyu 1a, ZHU Botao 2, ZHANG Ruquan 1ab, TU Hu 1ab*
(1. Wuhan Textile University a. School of Textile Science and Engineering; b. State Key Laboratory of New Textile Materials and Advance Processing Technologies, Wuhan,430073, China;
2. CHTC Jiahua Nonwoven company, Ltd, Xiantao, 433000, Hubei China)
Abstract: As the only positively charged natural polysaccharide in nature, chitin has been widely used in bio- medicine, pharmaceutical engineering, food addition and food packaging because of its advantages of excellent biocompatibility, renewing and natural antibacteria. Chitin fiber is a new type of biomass fiber via spinning, which has great potential for development and application in various fields while retaining the excellent proper- ties of the original chitin. A variety of methods and technological processes for the preparation of chitin fiber in recent years are systematically summarized,when differential influencing factors of different preparation meth- ods are compared, its application prospects in many fields are included, and the future development trend of chi- tin fiber is prospected in combination with some existing problems, so as to provide a basis for further develop- ment and application of chitin fiber.
Keywords: chitin ; regenerated fiber ; wet spinning ; degradable ; functional applications
隨着社会的高速发展与进步,人类挥霍与享受大自然环境带来的丰富的矿产、水源以及生物等资源,无节制的排放温室气体导致全球变暖加剧,引发极端天气事件、海平面上升等问题,对人类和生态系统造成了严重危害[1]。因此,越来越多的国家将研究重点由高碳排放的化石燃料转为开发绿色经济的可持续发展材料。海洋里丰富的生物质资源引起了学者们的广泛关注,甲壳素作为海洋中储量最丰富的天然多糖资源,价格低廉使其具有良好的经济价值,回收利用则符合当下人类可持续发展的战略目标。此外,甲壳素具有与生物体细胞外基质相似的化学结构,这些结构可被溶菌酶降解并随后在体内消化。甲壳素具有很好的生物相容性和生物降解性。它们不仅没有毒性,还表现出抗菌活性和低免疫原性[2]。因此,对甲壳素的性能深入研究以及开发具有深远意义。
甲壳素富含于甲壳纲昆虫和水产动物的甲壳中,也存在于菌类、藻类等细胞壁中,它是自然界中唯一带正电荷的天然高分子,属于直链氨基多糖,学名为[(1,4)-2-乙酰氨基-2-脱氧-β-D-葡萄糖],分子式为(C8H13NO5)n,单体之间以β(1→4)甙键连接(图1)。甲壳素的结晶结构可以分为α、β和γ三种。α甲壳素的分子链朝对立的方向排列(一正一反),而β甲壳素[3]的分子链朝同一个方向排列,γ甲壳素中的分子链以两正一反的形式排列。甲壳素独特的结晶结构和大量分子内和分子间氢键,使其不能熔融且难以溶解,因而一直以来甲壳素材料[4]的开发应用发展缓慢。
制备甲壳素纤维并将其制作为纺织品是甲壳素的有效应用途径。以六氟异丙醇(HFIP)、DMAC/LiCl、离子液体、低共熔溶剂、NaOH/尿素等多种溶剂溶解甲壳素,再通过不同纺丝方法制成甲壳素纤维,在保留原有甲壳素优异性能同时使其拥有巨大的发展潜力应用于各种领域。本综述主要概述了甲壳素的几种常用溶剂及制备甲壳素纤维的不同纺丝方法体系和工艺流程,并进行对比、分析和总结。同时,介绍了甲壳素纤维的应用及其发展趋势,以期为开发高性能甲壳素纤维材料提供参考。
1甲壳素的溶剂
甲壳素纤维的制备需先对甲壳素进行溶解,再通过纺丝制备成纤维。因此,需要寻找适合的溶剂来溶解甲壳素。由于甲壳素存在大量的分子间和分子内氢键,具有较高的结晶度,使甲壳素不溶于水和一般的有机溶液,这给甲壳素的溶解和纺丝带来了一定的难度[5]。因此,甲壳素的溶解体系的开发对其应用的发展有着至关重要的作用。经过研究者的不断探索,目前溶解甲壳素的溶剂有:离子液体、DMAC/LiCl、低共熔溶剂、强极性氟化物和碱/尿素水溶液等。
1.1离子液体
离子液体是由阳离子和阴离子构成的盐,在室温条件下呈液态,具有优良的溶解性,热稳定性和无挥发性的特点[6]。常用溶解甲壳素的离子液体有氯化1-丁基-3-甲基咪唑等[7-11]。离子液体可以与甲壳素分子链间形成氢键,破坏甲壳素分子内和分子间氢键,使甲壳素溶解在离子液体中。据报道使用1-乙基-3-甲基咪唑乙酸盐可直接对虾蟹壳进行处理,通过一步法溶解并提取甲壳素,大大简化了生产步骤和生产成本,成为了一种高效制备提纯甲壳素的方法,并且以这种方法得到的甲壳素分子量和纯度比商品甲壳素高[12]。虽然离子液体对甲壳素有较高的溶解力,但是成本高,经济价值低,且回收困难的缺点成为离子液体溶解体系发展的阻碍。
1.2 DMAC/LiCl
N,N-二甲基乙酰胺与氯化锂(DMAC/LiCl)被发现是一种无需降解甲壳素即可使其溶解的溶剂,是甲壳素溶剂体系的重大突破。甲壳素在 DMAC/LiCl中的溶解是通过LiCl与甲壳素分子间氢键羟基和乙酰氨基的强相互作用发生的。这种相互作用破坏了甲壳素本身的分子间氢键,并通过每个不稳定质子固定一个LiCl分子使大分子溶解在溶剂中[13]。但由于LiCl有毒且容易残留在甲壳素中无法彻底去除,限制了其发展[14]。
1.3氯化钙/甲醇
氯化钙/甲醇溶解体系的甲壳素溶解度由水的含量,钙离子的含量和甲壳素的乙酰度等因素决定[15]。溶解甲壳素时需要用到水合氯化钙,无水氯化钙和甲醇无法溶解甲壳素。同时,乙酰度越高,甲壳素的溶解度越高。该溶解体系可以调节甲壳素分子中N-乙酰基葡萄糖胺和葡萄糖胺间的分布,且钙离子可以和甲壳素形成复合物,溶解在甲醇中[16]。但氯化钙/甲醇溶解体系得到的甲壳素溶液黏度较大,给后续的加工和使用带来的困难。
1.4低共熔溶剂
低共熔溶剂是由阳离子卤化物盐做氢键受体和氢键给体组成的络合物[17]。由于其强氢键相互作用阻止了各组分结晶,低共熔熔剂的主要特点是其熔点低于其氢键受体和氢键给体各组成部分,因此,低共熔熔剂在100℃下为液态。 MUKESH等[18]使用氯化胆碱/尿素、溴化胆碱/尿素、氯化胆碱/硫脲、氯化胆碱/尿素和盐酸甜菜碱/尿素组成的低共熔溶剂溶解甲壳素,发现甲壳素均能溶解,并在氯化胆碱/硫脲體系中有最大溶解度9%。且在溶解过程中无明显的降解现象发生。但低共熔溶剂溶解体系无法溶解壳聚糖,可能与甲壳素溶解与甲壳素上的乙酰基团有关[19]。
1.5强极性氟化物
强极性氟化物溶液如HFIP和六氟丙酮倍半水合物也可溶解甲壳素。HFIP使甲壳素分子间和分子内氢键断裂而溶解,在再生过程中 HFIP 易于挥发,甲壳素链重新形成氢键发生自组装而形成直径均匀的纳米纤维[20]。然而强极性氟化物都具有高毒性且价格昂贵,在使用过程中需完全回收溶剂才有利于其开发利用。
1.6碱/尿素
我国科学家张俐娜院士[21]发现了利用碱/尿素体系可以在低温下快速溶解甲壳素。甲壳素在冷阱(-30℃)中经过11wt%NaOH/4wt%尿素水溶液冷冻4小时,然后解冻而溶解[22]。FENG等[23]发现通过增加冷冻/解冻处理次数,可以有效提高甲壳素的溶解效率。蔡等人通过进一步研究发现氢氧化钾/尿素水溶液体系对甲壳素具有更优异的溶解效果,仅需冻融一次即可实现对甲壳素的全部溶解,且溶解温度可提高至-18℃ , 这有利于降低溶解时所需能耗[24-27]。其溶解机理为碱中的 OH?离子通过氢键与尿素上的氨基相互作用,而尿素水合物与甲壳素之间没有发生强相互作用。也就是说,NaOH“水合物”更容易在低温下与甲壳素链形成新的氢键,而尿素水合物自组装在NaOH/甲壳素链形成的氢键表面形成水溶性包合物,导致其溶解。甲壳素在低温下的溶解是一个焓驱动的物理过程。然而,甲壳素在碱/尿素中的溶解经常需要多次冷冻和解冻过程,该过程消耗较多能量并且缺乏连续性,这也限制了其大规模的工业应用。
1.7其他溶剂
一些无机盐水溶液通过水合作用也可溶解甲壳素,并且溶解度依次为:LiCNS > Ca(CNS)2> CaI2> CaBr2> CaCl2[28]。但将甲壳素溶解在过饱和的硫氰酸锂溶液中,溶剂难以去除的问题限制了其应用。
2甲壳素纤维制备
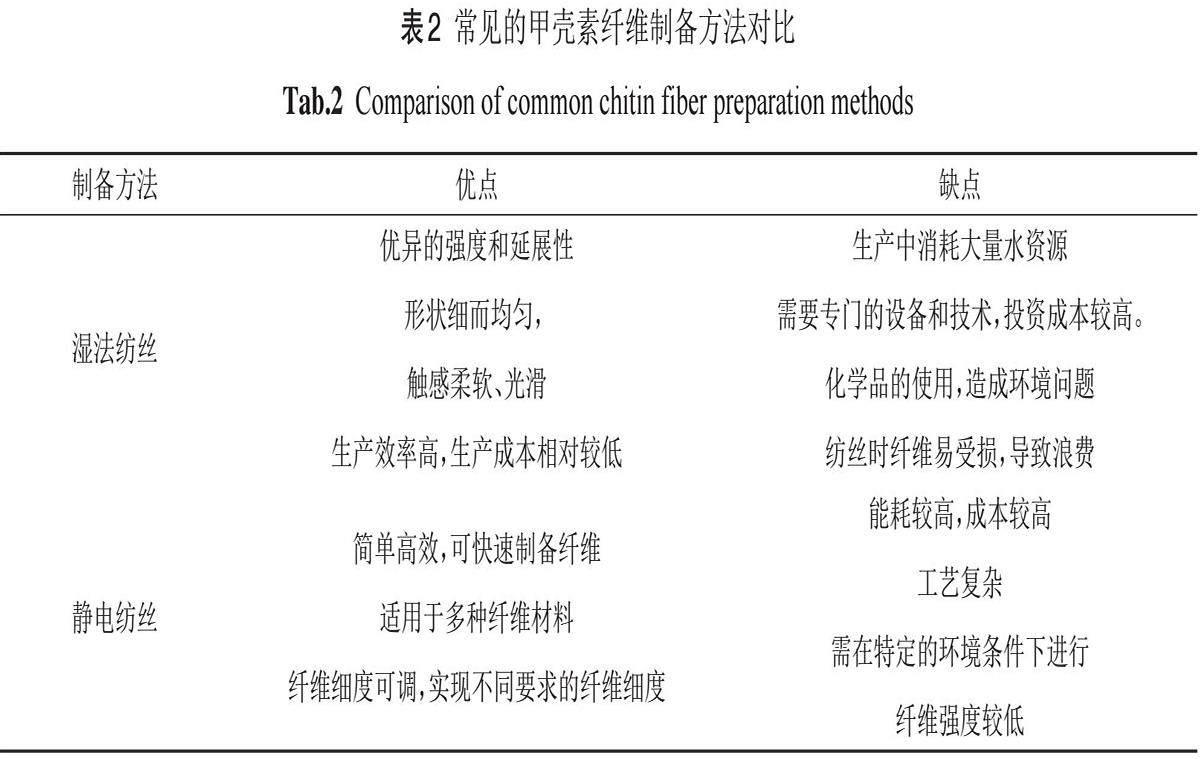
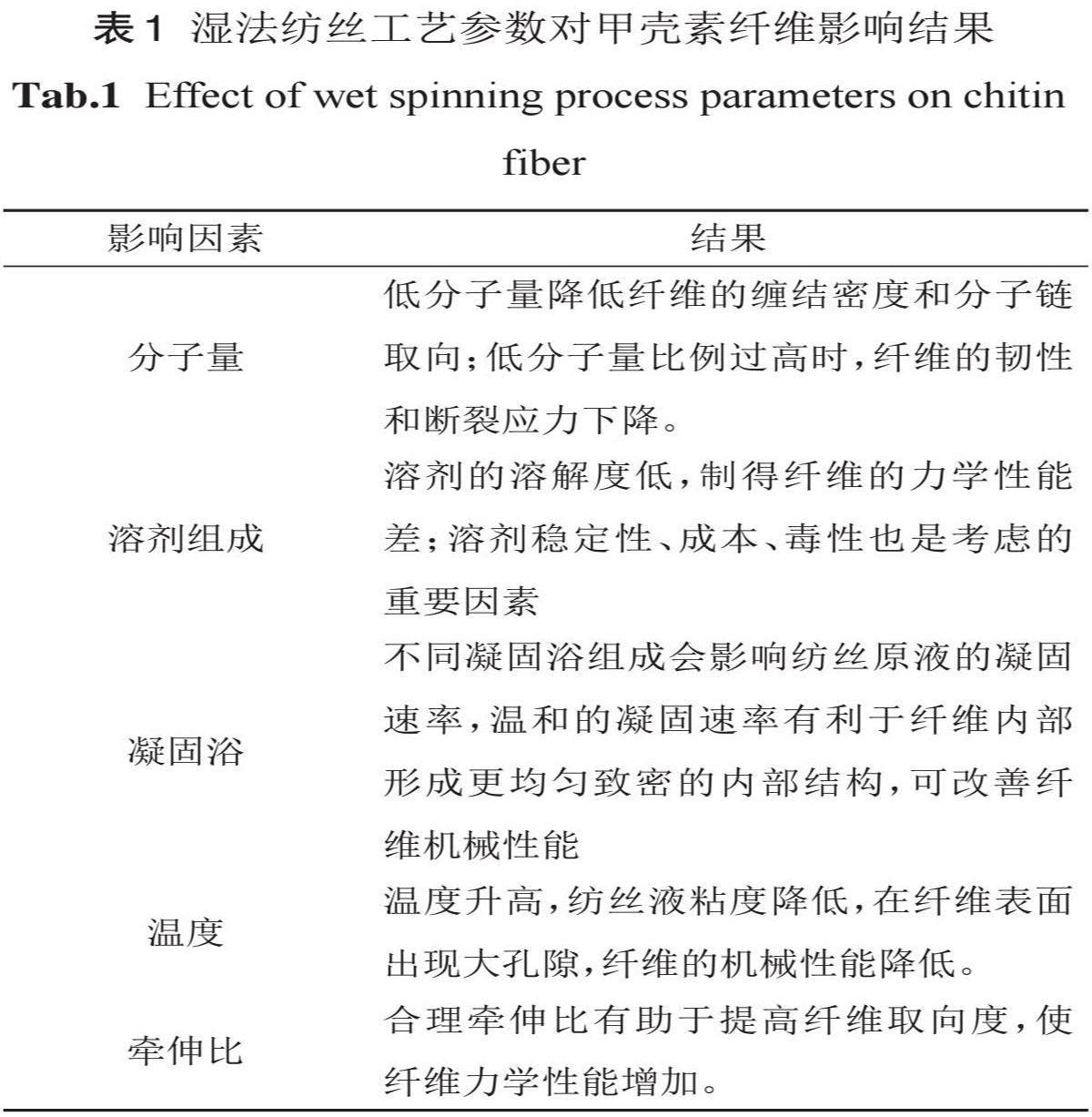
2.1湿法纺丝
湿法纺丝是制备甲壳素纤维最常用的方法。通过将甲壳素溶解在合适溶剂中配制成纺丝原液,然后经过滤脱泡后,在一定压力下经喷丝头喷入凝固浴中,呈细流状的原液在凝固浴中凝固形成固态水凝胶纤维,再经牵伸、洗涤、干燥等后处理即可。HUANG等[29]通过在KOH/尿素水溶液中溶解和制备稳定的甲壳素纺丝原液,采用湿法纺丝和醇/盐水溶液凝固法制备甲壳素复丝(图2)。使用氢氧化钾几分钟即可快速溶解甲壳素,该方法效率高且节省能源。
在湿法纺丝过程中,会因不同的工艺参数影响最终成型的甲壳素纤维性能,主要影响因素如下:
(1)分子量的影响:分子量会影响到纺丝液的粘度和纺丝液的质量分数,决定了纤维的可纺性和制备效率[30]。随着低分子量的甲壳素增加,纺丝液的粘度降低,有利于纺丝。但低分子量的甲壳素会降低甲壳素纤维的缠结密度和分子链取向。低分子量甲壳素含量过高时,纤维的韧性和断裂应力同时下降,对纤维的生产有不利影响。
(2)纺丝溶剂的影响:溶剂对甲壳素的溶解度较高时,它们之间存在强相互作用,凝固浴中的凝固剂难以扩散到形成纤维的中心区域中使纤维固化速率降低,同时分子量发生膨胀增强了分子间的相互作用,导致形成孔隙率较高的松散纤维[31-32]。
(3)凝固浴的影响:凝固浴的组成,浓度和温度也是湿法纺丝过程中的重要工艺参数,对湿法纺丝最终制备的纤维性能有显著影响。当溶剂与非溶剂之间有较强的亲和力,扩散趋势较强时,它们的混溶性高,交换速率高[33]。因此,凝固浴中的凝固速率较高和溶剂与非溶剂之间的亲和力强是湿法纺丝中纤维形成大孔隙的一个重要原因。
(4)温度的影响:当生产温度升高,溶液的粘度降低,非溶剂更易渗透到甲壳素中,形成纤维时发生相分离,在纤维表面出现大孔隙,纤维的机械性能降低。因此纤维的温度与孔隙率通常是负相关的[34]。
(5)牵伸的影响:在湿法纺丝中拉伸过程可以显著增强纤维的机械性能[35]。初生纤维经过牵伸后不仅能减少甚至消除纤维中的微孔、缝隙等缺陷,而且能显著提高纤维取向度,有利于纤维力学性能的增强。
2.2静电纺丝
静电纺丝是对高分子溶液或熔体施加高电压,溶液在强电场作用下的液体会形成泰勒锥,在静电场的作用下泰勒锥的尖端会拉伸成纳米级细长的纤维[36]。甲壳素静电纺丝制备甲壳素纤维的过程包括以下几个步骤:(1)溶液制备:将甲壳素溶解在合适的有机溶剂中,形成聚合物的溶液。静电纺甲壳素通常选用HFIP作为溶剂,因为其具有优异的挥发性,这有利于在纺丝过程中溶剂挥发而形成甲壳素纳米纤维膜。(2)纺丝过程:将溶液通过喷嘴或旋转壳体进行加工,形成纤维状的物料。(3)溶剂挥发成型:在纺丝后,溶剂会逐渐挥发,使得纤维逐渐凝固和形成。
静电纺丝虽然步骤相对简易但制备的纤维仍受多种因素的影响,主要包括溶液性质(纺丝液浓度、粘度、导电性等)、工艺条件(收集距离、挤出速率、电压大小等)和环境参数(环境温度和湿度)。然而,静电纺丝的制备效率相对较低,且 HFIP的高毒性和高价格也严重限制了甲壳素纳米纤维膜的开发应用[35]。
2.3发酵
甲壳素广泛存在于真菌类生物的细胞壁中,将甲壳素废弃物进行预处理,如去除杂质、粉碎和清洗。在一定发酵条件(酶解等)下,部分丝状真菌在增殖后可生产出大量高甲壳素含量的短纤维,经简单处理可加工成纸、非织造布等新产品。这种发酵工艺与传统湿法纺丝相比,制备效率高、工艺流程短,是制备甲壳素纤维的一种新方法[37]。
采用发酵法制备甲壳素纤维的影响因素包括:(1)酶种类和用量:不同酶对甲壳素的酶解效果不同,酶的添加用量也会影响纤维的质量和产量。(2)发酵条件:包括温度、pH值、氧气供应等发酵条件会影响酶解效率和纤维素产量。(3)甲壳素废弃物预处理:包括去除杂质、粉碎和清洗等预处理工艺对后续发酵的影响。(4)发酵时间:发酵时间会影响酶解程度和纤维素产量。
3甲壳素应用
甲壳素具有来源广泛、储量丰富、优异的机械性能、抑菌性、生物相容性、低细胞毒性以及可生物降解等特性,这些特性使得甲壳素纤维可以应用于诸多领域,比如医用材料、功能性纺织品、食品领域等。
3.1食品工程
甲壳素从虾、蟹等海洋生物甲壳中提取甲壳素,是一种不溶性膳食纤维,故被作为食品添加剂添加到食物中优化食品的风味,补充微量元素食品,改善食品的流动性或促进胃肠蠕动提高人体免疫力等。用甲壳质水刺非织造布制成的食品保鲜盖布,具有良好的杀菌、防腐、保鲜功能。 ZHAN[38]制备了一种用于改进抗菌和食品包装的 MoS2QDs/甲壳素纳米纤维复合材料。二硫化钼量子点(MoS2QDs)通过水热反应均匀地键合在部分去乙酰化的甲壳素纳米纤维(DEChNs)上。 DEChN和MoS2QDs的组合具有接近中性条件的抗菌活性,抑菌率>90%。MoS2QDs/ DEChN 组装薄膜可用于延缓变质的肉类保鲜。
3.2生物组织工程
由于甲壳素具有很好的生物相容性、生物活性和可降解性,可以作为仿生皮肤、生物组织支架[39-40]、医用敷料的原料[41]以及作为辅料制成微粒、微囊、粉剂及栓剂等用于生物制药等,在医学领域发挥重要作用。临床应用证实,使用甲壳素水刺非织造布用于皮肤的创面修复,可缩短皮肤愈合时间。甲壳素水刺非织造布对创面粘附牢固,使用时无须多次换药,可简化治疗过程,节约医疗费用。ZHONG等[42]使用NaOH/尿素溶剂体系,通过湿法纺丝制备纤维甲壳素敷料(FCD),保留了天然α-甲壳素的结构和优良的生物活性。使用大鼠和小鼠全层皮肤创伤模型证实了FCD 敷料促进创面聚合的性能。用FCD覆盖的大鼠中的伤口显示出比用纱布覆盖的大鼠更快的胶原(尤其是I型胶原)生长和更快的愈合(12天对比16天)。显著缩短了大鼠和WT小鼠模型中全层伤口的愈合时间。通过MyD-88依赖性途径和随后的TGF-β/Smad途径刺激成纤维细胞的细胞膜。不仅证明了甲壳素衍生敷料的优异的伤口愈合效果,而且首次提供了潜在的分子机制,进一步确立了甲壳素作为潜在临床应用的重要生物医学材料。
雖然甲壳素纤维是一种非常理想的组织工程材料,但目前关于医用领域的开发仍存在一定问题。首先,甲壳素纤维力学性能相对较弱,且刚性大,这容易导致其在使用过程中发生破裂或损坏,从而造成负面的治疗效果;此外,甲壳素上大量的亲水基团表明其具有优异的亲水性。这导致甲壳素纤维在使用时与组织液接触后很容易吸收大量组织液二发生膨胀或力学性能降低,这也为其在组织工程领域的开发利用带来了新的挑战。
3.3功能紡织品
甲壳素纤维仍保留甲壳素原有的优异物理和化学性能,因此甲壳素纤维可作为制作纺织品的绝佳材料(图3)。然而目前甲壳素纤维的生产线规模仍然较小,这是因为其生产成本较高,纤维强度低,工艺不稳定,且存在环境污染问题,因此,大量研究通过甲壳素纤维与其他纤维进行混纺去优化和规避这些缺点,从而提高其产量和性能[43-44]。通过多种形式的加工,甲壳素纤维可以制备成贴身服装、床上用品、阻隔紫外产品[45]、智能服装[46]、军工用品以及面膜等,有利于拓宽甲壳素纤维的应用价值和应用前景。
4总结与展望
对甲壳素纤维纺丝相关研究仍在持续探索中,甲壳素纺丝方法仍存在一些需要解决的问题:(1)就目前制备的甲壳素纤维力学强度较低,需要通过部分手段例如与其他材料复合、混纺等来增强甲壳素纤维的力学性能以满足其应用需要;(2)甲壳素在常规溶剂中溶解度较低,并且现有用来溶解甲壳素的溶解体系各有优缺点,并未开发出一种具有较大优势的溶解体系来取代其他溶解体系并应用于工业生产当中。
因此,未来对甲壳素纤维的开发利用应集中在以下几方面:(1)需对现有溶解体系进行改良或开发一种经济,绿色,高效的甲壳素溶解体系来溶解甲壳素;(2)可以通过对湿法纺丝过程生产工艺进行进一步调整和优化,以得到期望的甲壳素纤维。可以开发制备甲壳素的新型湿法纺丝工艺,例如计算机辅助湿法纺丝、旋转湿法纺丝和基于通道的湿法纺丝技术,来简化甲壳素纤维生产流程和赋予纤维更优异的力学性能和其他特性。(3)甲壳素仍然是一个集生物相容性、生物降解性、无毒性、抗菌活性和低免疫原性等多方面优势的生物材料原料,随着新兴科技的进步与发展,未来可以考虑与更加智能的科技相结合开发和改进甲壳素纤维,进一步推动其在各个领域的应用深度拓展,如智能响应可检测布贴等。
参考文献:
[1]YAN N, CHEN X. Sustainability: Don't waste sea- food waste[J]. Nature, 2015, 524(7564):155-157.
[2]RINAUDO M. Chitin and chitosan: Properties and applications[J]. Progress in Polymer Science, 2006, 31(7):603-632.
[3]NOISHIKI Y, TAKAMI H, NISHIYAMA Y, et al. Alkali-induced conversion of β-chitin to α-chitin [J]. Biomacromolecules, 2003, 4(4):896-899.
[4]刘婉.甲壳素纤维及其应用[J].纺织科技进展, 2015(3):4-7.
LIU Wan.Chitin fiber and its application[J].Textile science and technology progress, 2015(3):4-7.
[5]ROHANI SHIRVAN A, NOURI A, SUTTI A. A perspective on the wet spinning process and itsad- vancements in biomedical sciences[J]. European Polymer Journal, 2022, 181:111681.
[6]PINKERT A, MARSH K N, PANG S, et al. Ionic liquids and their interaction with cellulose[J]. Chem Rev, 2009, 109(12):6712-28.
[7]WU Y, SASAKI T, IRIE S, et al. A novel biomass- ionic liquid platform for the utilization of native chitin[J]. Polymer, 2008, 49(9):2321-2327.
[8]BARBER P S, GRIGGS C S, BONNER J R, et al. Electrospinning of chitin nanofibers directly from an ionic liquid extract of shrimp shells[J]. Green Chemistry, 2013, 15(3):601-607.
[9]KADOKAWA J I. Dissolution, gelation, function- alization, and material preparation of chitin using ionic liquids[J]. Pure and Applied Chemistry,2016, 88:621-629.
[10]KADOKAWA J- I. Ionic liquid as useful media for dissolution, derivatization, and nanomaterial processing of chitin[J]. Green and Sustainable Chemistry, 2013, 3:19-25.
[11]KUZNIK I, KRUPPKE I, CHERIF C. Pure chito- san-based fibers manufactured by a wet spinning lab- scale process using ionic liquids[J]. Poly- mers, 2022, 14(3):477.
[12]QIN Y, LU X, SUN N, et al. Dissolution or ex- traction of crustacean shells using ionic liquids to obtain high molecular weight purified chitin and direct production of chitin films and fibers[J]. Green Chemistry, 2010, 12(6):968-971.
[13]VINCENDON M.1H NMR study of the chitin dissolution mechanism[J]. MacromolecularChemistry and Physics, 1985, 186:1787-1795.
[14]HE C, MA B, SUN J. The preparation and prop-erties of cellulose/chitin blend filaments[J]. Jour- nal of Applied Polymer Science, 2009, 113:2777-2784.
[15]TAMURA H, NAGAHAMA H, TOKURA S. Preparation of chitin hydrogel under mild condi- tions[J]. Cellulose, 2006, 13(4):357-364.
[16]TAMURA H, SAWADA M, NAGAHAMA H, et al. Influence of amide content on the crystal structure of chitin[J]. Holzforschung, 2006, 60(5):480-484.
[17]SIRVI? J A, VISANKO M, LIIMATAINEN H. Deep eutectic solvent system based on choline chloride-urea as a pre-treatment for nanofibrilla- tion of wood cellulose[J]. Green Chemistry, 2015, 17(6):3401-3406.
[18]MUKESH C, MONDAL D, SHARMA M, et al. Choline chloride – thiourea, a deep eutectic sol- vent for the production of chitin nanofibers[J].Carbohydrate Polymers, 2014, 103:466-471.
[19]SHARMA M, MUKESH C, MONDAL D, et al.Dissolution of“-chitin in deep eutectic solvents [J]. RSC Advances, 2013, 3(39):18149-18155.
[20]ROLANDIM, ROLANDI R. Self-assembled chi- tin nanofibers and applications[J]. Advances in Colloid and Interface Science, 2014, 207:216-222.
[21]LUO X, ZHANG L. New solvents and functional materials prepared from cellulose solutions in al- kali/urea aqueous system[J]. Food Research Inter- national, 2013, 52(1):387-400.
[22]HU X, DU Y, TANG Y, et al. Solubility and prop- erty of chitin in NaOH/urea aqueous solution[J]. Carbohydrate Polymers, 2007, 70(4):451-458.
[23]FENG F, LIU Y, HU K. Influence of alkali-freez- ing treatment on the solid state structure of chitin [J]. Carbohydrate Research, 2004, 339(13):2321-2324.
[24]HE M, WANG Z, CAO Y, et al. Construction of chitin/pva composite hydrogels with jellyfish gel- like structure and their biocompatibility[J]. Bio- macromolecules, 2014, 15(9):3358-3365.
[25]DING B, CAI J, HUANG J, et al. Facile prepara- tion of robust and biocompatible chitin aerogels [J]. Journal of Materials Chemistry, 2012, 22(12):5801-5809.
[26]DUAN B, LIU F, HE M, et al. Ag – Fe3O4 nano- composites@chitin microspheres constructed by in situ one-pot synthesis for rapid hydrogenation catalysis[J]. Green Chemistry, 2014, 16(5):2835-2845.
[27]CHANG C, CHEN S, ZHANG L. Novel hydro- gels prepared via direct dissolution of chitin at low temperature: Structure and biocompatibility [J]. Journal of Materials Chemistry, 2011, 21(11):3865-3871.
[28]YI H, WU L-Q, BENTLEY W E, et al. Biofabri- cation with chitosan[J]. Biomacromolecules, 2005, 6(6):2881-2894.
[29]JUNCHAO H, ZHONG Y, ZHANG X, et al. Continuous pilot-scale wet-spinning of biocom- patible chitin/chitosan multifilaments from an aqueous KOH/urea solution[J]. Macromolecular Rapid Communications, 2021, 42:2100252.
[30]BENTLEY F E, PASSIEUX R, DAVID L, et al. Pure chitosan biomedical textile fibers from mix- tures of low- and high- molecular weight bidis- perse polymer solutions: Processing and under- standing of microstructure–mechanicalproperties relationship[J]. International Journal of Molecular Sciences, 2022, 23(9):4767.
[31]KHAYET M, FENG C Y, KHULBE K C, et al. Study on the effect of a non-solvent additive on the morphology and performance of ultrafiltra- tion hollow- fiber membranes[J]. Desalination, 2002, 148:321-327.
[32]ILLANGAKOON U E, MAHALINGAM S, MATHARU R K, et al. Evolution of surface nanopores in pressurised gyrospun polymeric mi- crofibers[J]. Polymers, 2017, 9(10):508.
[33]JAMI'AN W N R, HASBULLAH H, MO- HAMED F, et al. Effect of evaporation time on cellulose acetate membrane for gas separation[J]. IOP Conference Series: Earth and EnvironmentalScience, 2016, 36(1):12008.
[34]SOBHANIPOUR P, CHERAGHI R, VOLIN-SKY A A. Thermoporometry study of coagula- tion bath temperature effect on polyacrylonitrile fibers morphology[J]. Thermochimica Acta, 2011, 518(1):101-106.
[35]DESORME M, MONTEMBAULT A, LUCAS J- M, et al. Spinning of hydroalcoholic chitosan so- lutions[J]. Carbohydrate Polymers, 2013, 98(1):50-63.
[36]YIHUN F A. Nanochitin preparation and its ap- plication in polymer nanocomposites: A review [J]. Emergent Materials, 2022, 5(6):2031-2060.
[37]王琪鑫.生物發酵法制备甲壳素的研究[D].青岛:青岛科技大学, 2021.
WANG Qixin.Study on the preparation of chitin by biological fermentation [ D ].Qingdao: Qingd-ao University of Science and Technology, 2021.
[38]ZHANG S, CHEN H, MA H, et al. A MoS2QDS/chitin nanofiber composite for improved antibac- terial and food packaging[J]. International Jour- nal of Biological Macromolecules, 2022, 209:737-746.
[39]MEHRABANI M G, KARIMIAN R, RAKH- SHAEI R, et al. Chitin/silk fibroin/TiO2 bio-nano- composite as a biocompatible wound dressing bandage with strong antimicrobial activity[J]. In-ternational Journal of Biological Macromole- cules, 2018, 116:966-976.
[40]SADHASIVAM B, RAMAMOORTHY D, DHAMODHARAN R. Scale- up of non- toxic poly(butylene adipate- co- terephthalate)- chitin based nanocomposite articles by injection mould- ing and 3d printing[J]. International Journal of Biological Macromolecules, 2020, 165:3145-3155.
[41]WATTHANAPHANIT A, RUJIRAVANIT R. Ser- icin-binded-deprotenized natural rubber film con- taining chitin whiskers as elasto-gel dressing[J]. International Journal of Biological Macromole- cules, 2017, 101:417-426.
[42]ZHONG Z, HUANG Y, HU Q, et al. Elucidation of molecular pathways responsible for the accel- erated wound healing induced by a novel fibrous chitin dressing[J]. Biomaterials Science, 2019, 7(12):5247-5257.
[43]王秀彥.健康环保的甲壳素服装面料[J].合成纤维, 2005(1):23-24,46.
WANG Xiuyan. Healthy and environmentally friendly chitin fabric [J].Synthetic Fiber, 2005(1):23-24,46.
[44]胡家军,陆必泰,赖红敏.绿色环保新型纤维的开发利用[J].广西纺织科技, 2010(3):24-27.
HU Jiajun, LU Bitai, LAI Hongmin. Develop- ment and utilization of new green environmental protection fiber[J].Guangxi Textile Technology, 2010(3):24-27.
[45]ZHONG T, WANG J. Developing highly trans- parent yet ultraviolet blocking fully biocompos- ite films based on chitin and lignin using ethanol/ water as processing solvents[J]. International Journal of Biological Macromolecules, 2022, 201:308-317.
[46]SALA DE MEDEIROS M, GOSWAMI D, CHANCI D, et al. Washable, breathable, and stretchable e-textiles wirelessly powered by om- niphobic silk-based coils[J]. Nano Energy, 2021, 87:106155.
(责任编辑:胥朝阳)
