利用低生物背景SERS适配体传感器快速检测恩诺沙星的研究
2024-05-23李岑王盼雪王丽邢招娣李国梁
李岑 王盼雪 王丽 邢招娣 李国梁
文章编号:2096-398X2024)03-0083-08
(1.陕西科技大学 食品科学与工程学院, 陕西 西安 710021; 2.谱尼测试集团陕西有限公司, 陕西 西安 710018)
摘 要:利用表面增强拉曼光谱(Surface Enhanced Raman Spectroscopy,SERS)技术检测抗生素残留操作简便、用时短,但易受样品基质的干扰.本研究选用特征信号位于生物样品拉曼信号沉默区的报告物4-MBN作为信号分子,构建SERS探针,以适配体(Aptamer,Apt)功能化的Fe3O4纳米颗粒作为捕获探针,通过SERS探针中的互补DNA(complementary DNA, cDNA)和捕获探针中的Apt互补杂交,构建复合探针.当恩诺沙星存在时,复合探针中的适配体与其特异性结合,释放出SERS探针.SERS探针上4-MBN位于2 227 cm-1拉曼位移处的特征SERS信号的强度与恩诺沙星浓度的对数值在1~500 nM范围内具有良好的线性相关关系,决定系数为0.99,检出限为0.07 nM.该传感器检测鱼肉和猪肉中恩诺沙星的回收率为84.0%~109.0%,相对标准偏差为0.2%~0.8%.研究结果为复杂基质中恩诺沙星的快速检测提供了一种新方法.
关键词:恩诺沙星; 快速检测; 表面增强拉曼光谱; 低生物背景; 适配体
中图分类号:TS207.3 文献标志码: A
Study on rapid detection of enrofloxacin using lowbiological background SERS aptasensor
LI Cen1, WANG Pan-xue1*, WANG Li1, XING hao-di2, LI Guo-liang1
1.School of Food Science and Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.Pini Testing Group Shaanxi Co., Ltd., Xi′an 710018, China)
Abstract:Determination of antibiotic residues using surface enhanced Raman spectroscopy SERS) based methods is simple to operate and time-efficient,but susceptible to the interference of the sample matrix.In this study,4-MBN which has characteristic signal in the biological samples Raman signal silent region is used as the signal molecule to construct the SERS probe.Fe3O4 nanoparticles functionalized with aptamer Apt) are used as the capture probe.And the SERS probe and the capture probe are used to assemble a composite probe through the hybridization of the complementary DNA cDNA) in the SERS probe and Apt in the capture probe.In the presence of enrofloxacin,the aptamer in the composite probe binds specifically to enrofloxacin,leading to the release of the SERS probe.The intensity of the characteristic SERS signal of 4-MBN at the Raman shift of 2 227 cm-1 shows a good linear correlation with the logarithm value of enrofloxacin concentration in the range of 1~500 nM,with a determination coefficient of 0.99 and a detection limit of 0.07 nM.The recovery rate of enrofloxacin detection in fish and pork is between 84.0%~109.0%,and the relative standard deviation is varied in 0.2%~0.8%.The results provide a new method for the rapid detection of enrofloxacin in complex matrices.
Key words:enrofloxacin; rapid detection; surface enhanced Raman spectroscopy; low biological background; aptamer
0 引言
恩諾沙星(Enrofloxacin,ENR)是一种第三代氟喹诺酮类抗生素,通过与细菌的DNA结合来抑制细菌的生长繁殖[1,2].由于恩诺沙星具有高生物利用度和低毒性的优点,现已作为动物专用的广谱抗生素,被广泛用于规模化、集约化的牲畜和水产养殖中[3,4].然而,养殖业中对恩诺沙星的误用和滥用,导致其在动物源食品中的残留量超标[5].研究发现,人体长期摄入恩诺沙星残留超标的食物,轻则引起消化系统功能紊乱,产生过敏反应;重则造成肝、肾功能性损伤.此外,恩诺沙星也容易诱导细菌耐药性的产生,进而影响氟喹诺酮类药物对人类疾病的治疗效果[6-8].
目前,我国检测食品中恩诺沙星的标准方法为高效液相色谱法.该方法需先将样品破碎、均质,经提取和脱脂后,利用C18固相萃取柱进行高效液相色谱检测[9].该方法检测结果准确,但耗时较长、有机试剂用量大,需要进行复杂的样品预处理过程,难以实现快速现场检测[10-12].SERS技术具有操作简便、响应速度、灵敏度高、可以用于现场检测等优点,在抗生素残留的检测中受到了广泛的关注[13,14].然而,现有的恩诺沙星SERS检测方法易受样品基质的干扰,难以实现复杂基质中恩诺沙星残留量的准确、灵敏检测[15,16].因此,本研究利用适配体修饰的磁性纳米颗粒和低生物背景SERS探针建立了一种灵敏、快速的恩诺沙星SERS适配体传感器.该传感器利用拉曼信号分子4-MBN位于生物样品拉曼信号沉默区的特征SERS信号可以实现复杂基质中恩诺沙星的快速灵敏检测和定量分析.研究结果为复杂基质中抗生素残留的快速检测提供了新思路.
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂
四水合氯金酸(HAuCl4·4H2O)购自上海源叶生物科技有限公司;4-巯基苯甲腈(C7H5NS)、恩诺沙星(C19H22FN3O3)、正丁醇(C4H10O)购自阿拉丁生物科技有限公司;三(2-甲酰乙基)膦盐酸盐(C9H15O6P·HCl)、柠檬酸钠(C6H5Na3O7·2H2O)、氯化钠(NaCl)、氢氧化钠(NaOH)购自国药集团化学试剂有限公司;上述化学试剂均为分析纯.
磁性纳米粒子(Fe3O4 NPs)、适配体(Apt)、互补DNA(cDNA)购自上海生工生物工程技术有限公司.Apt序列:5′-NH2C6-CCC ATC AGG GGG CTA GGC TAA CAC GGT TCG GCT CTC TGA GCC CGG GTT ATT TCA GGG GGA-3′;cDNA序列:5′-HSC6-TCC CCC TGA AAT AAC CCG-3′.
1.1.2 主要仪器
便携式拉曼光谱仪(BWS465-785):美国 B&W Tek.Inc.公司;紫外可见分光光度计(Evolution 201):赛默飞世尔科技有限公司;纳米粒度及eta电位分析仪(安东帕 Litesizer 500):奥地利 Anton Paar公司;恒温磁力搅拌器(MYP11-2A):上海梅颖浦仪器仪表制造有限公司;超声清洗器(H5200DE):昆山禾创超声仪器有限公司;恒温振荡器(TH-98A):上海一恒科学仪器有限公司.
1.2 实验方法
1.2.1 捕获探针的制备
采用Yang等[17]报道的方法制备捕获探针Fe3O4 NPs@Apt.首先,取40 μL 5 mg/mL Fe3O4 NPs用PBS 10 mM,PH=7.4) 缓冲液清洗三次并分散在100 μL PBS缓冲液中.然后,分别加入30 μL 40 mM 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)和30 μL 100 mM N-羟基丁二酰亚胺(NHS),涡旋混匀后在室温下静置30 min,以激活Fe3O4 NPs表面羧基,磁选收集活化的Fe3O4 NPs.接着,加入40 μL PBS重悬Fe3O4 NPs,并加入1 μL 100 μM适配体,37 ℃振荡孵育3 h.随后,用100 μL PBS洗涤Fe3O4 NPs@Apt三次,除去未结合的适配体.最后,将磁选后的捕获探针重新分散在100 μL Tris-HCl 10 mM Tris-HCl,1 mM EDTA,pH 7.4) 中,4 ℃保存备用.
1.2.2 SERS探针的制备
根据Wang等[18]报道的方法制備Au NPs溶胶.简而言之,在100 mL锥形瓶中加入30 mL去离子水和300 μL HAuCl4·4H2O1%,w/v),置于磁力搅拌器上以1 400 rpm的速度搅拌并快速加热至沸腾.溶液沸腾后,立即加入180 μL 1%,w/v) 柠檬酸钠溶液并继续加热和搅拌,直至胶体颜色变为酒红色后停止加热和搅拌.制备的Au NPs溶胶在室温下冷却,4 ℃保存备用.
利用丁醇瞬间脱水法制备SERS探针Au NPs@4-MBN/cDNA[19].首先,将8 μL 100 μM cDNA溶液与10 μL 100 mM三(2-羧乙基)膦(TCEP)室温下混合孵育30 min以激活二硫键.然后,取85 μL Au NPs溶胶与1 μL 50 μM cDNA溶液混合,室温下孵育20 min后,向混合物中添加4 μL 150 mM NaCl和10 μL 10 μM 4-MBN.室温静置5 min后,向混合液中加入900 μL正丁醇并用涡旋混合器混合均匀.接着,向上述混合液中加入200 μL 0.5×TBE 45 mM Tris-硼酸 1 mM EDTA,pH 8.0) 缓冲液,继续涡旋混合数秒以促进相分离.最后,将混合液在6 500 rpm下离心5 min,除去上清液后沉淀物用去离子水重复清洗三次,4 ℃下保存备用.
1.2.3 SERS检测
首先,取40 μL捕获探针Fe3O4 NPs@Apt加入70 μL SERS探针Au NPs@4-MBN/cDNA中,涡旋混匀,在37 ℃孵育1 h.反应完成后,磁选分离制备好的复合探针,用去离子水清洗三次.最后,加入70 μL Tris-HCl缓冲液重悬复合探针,4 ℃保存备用.
检测恩诺沙星时,首先,取30 μL样品加入70 μL复合探针,涡旋混匀,37 ℃下孵育1 h.然后,在外源磁场作用下,将上清液转入新的1.5 mL离心管中,6 500 rpm离心5 min,收集SERS探针并加入10 μL去离子水重悬.最后,取5 μL重悬的SERS探针滴在锡箔包裹的玻璃片上,室温下干燥后采集SERS光谱.光谱采集条件为:激发波长785 nm,激光功率320 mW,积分时间10 s,积分次数2次,每个样品采集5条代表性SERS光谱.
1.2.4 加标回收试验
首先,取70.0 g肉样使用绞肉机充分绞碎.然后,分别称取5 g肉样,加入适量恩诺沙星储备液,使样品中恩诺沙星的浓度分别为0.015 μg/g、0.15 μg/g和0.75 μg/g.为避免肉样杂质的干扰,加入20 mL Tris-HCl缓冲溶液,涡旋混匀,并超声处理30 min.随后,10 000 rpm离心5min,使提取液充分澄清,便于收集上清液.最后,取30 μL上清液进行SERS检测.
2 结果与讨论
2.1 检测原理
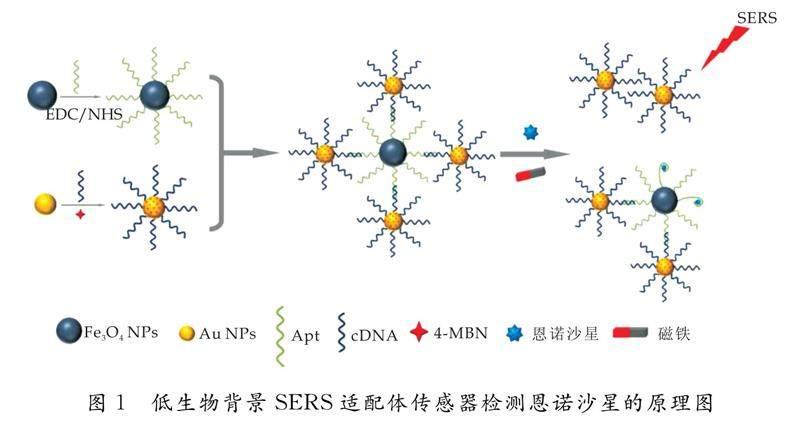
SERS适配体传感器检测恩诺沙星的原理图如图1所示.以适配体功能化的磁性纳米颗粒作为捕获探针,以4-MBN和cDNA修饰的Au NPs作为SERS探针,利用适配体与cDNA互补杂交制备复合探针.当恩诺沙星存在时,捕获探针表面的适配体特异性捕获恩诺沙星,并释放出SERS探针.通过检测上清液中SERS探针上拉曼报告分子4-MBN的SERS信号,实现恩诺沙星的检测.
2.2 材料表征
利用eta电位仪、粒度分析仪及便携式拉曼光谱仪表征制备的探针,结果如图2所示.图2 a) 是捕获探针的eta电位图,从图中可以看出,Fe3O4 NPs的eta电位为-2.24 mV,经过适配体功能化后,eta电位升高至0.45 mV.该结果表明Fe3O4 NPs表面成功连接了适配体.SERS探针的表征结果如图2b)、c)所示.由图2b)DLS表征结果可知,Au NPs的粒径为55 nm,修饰4-MBN和cDNA后,粒径增至65 nm.此外,Au NPs和Au NPs@4-MBN/cDNA的eta电位测量结果如图2c)所示.Au NPs修饰4-MBN和cDNA后,eta电位从-0.07 mV变为-0.42 mV.图2d)给出了复合探针的SERS表征结果.从图中可以看出,复合探针在1 074 cm-1、1 176 cm-1、1 581 cm-1和2 227 cm-1拉曼位移处有明显的特征信号峰.其中,1 074 cm-1处的特征峰归属于4-MBN的苯环C-S伸缩;1 176 cm-1处的特征峰归属于4-MBN的C-H弯曲振动;1 581 cm-1处的特征峰归属于4-MBN的苯环呼吸振动;2 227 cm-1处的特征峰归属于4-MBN的C≡N伸缩.以上结果表明,复合探针的构建成功.
2.3 实验条件优化
2.3.1 cDNA浓度的优化
为了验证SERS探针上cDNA的最佳负载量,分别使用20 μM、30 μM、40 μM、50 μM、60 μM、70 μM的cDNA制备SERS探针,并通过cDNA溶液与Au NPs孵育前后UV-Vis吸收值的变化确定SERS探针上cDNA的最佳负载量.从图3可以看出,cDNA溶液与Au NPs孵育前后溶液在260 nm处吸光度的差值随着cDNA初始浓度的升高先升高后基本不变.cDNA初始浓度在20~50 μM范围内,孵育前后溶液吸光值的差值随着初始浓度的升高而增加,当cDNA初始浓度超过50 μM时,随着cDNA浓度继续增大时,孵育前后溶液吸光值的差值基本不变.该结果表明,选用50 μM cDNA修饰Au NPs即可实现最大负载量.因此,选择cDNA的浓度为50 μM制备SERS探针.
2.3.2 4-MBN添加量的优化
拉曼报告物4-MBN的添加量直接影响SERS检测的灵敏度.4-MBN在2 227 cm-1拉曼位移处的C≡N的信号峰位于生物样品拉曼沉默区,能够避免生物基质的干扰,以此特征峰的强度变化可以实现恩诺沙星的无生物背景干扰分析[20].研究中比较了8 μL、10 μL、12 μL、14 μL、16 μL、18 μL、20 μL 1 mM 4-MBN与70 μL Au NPs@cDNA反应制备的SERS探针的信号强度,结果如图4所示.
从图4 a) SERS探针的SERS光谱图中可以观察到,拉曼位移2 227 cm-1处的SERS信号强度随着4-MBN添加量的变化而变化.从图4 b) 可以看出,4-MBN的添加量在8~16 μL范围内,拉曼位移2 227 cm-1处的SERS信号强度随着4-MBN添加量的增加而增加.这主要是因为4-MBN添加量升高导致Au NPs表面吸附的4-MBN增多.当4-MBN添加量超过16 μL时,其SERS信号强度基本不再发生变化,表明Au NPs吸附的4-MBN已达到饱和.因此,在后续实验中,选择添加16 μL 4-MBN作为最佳添加量制备SERS探针.
2.3.3 捕获探针添加量的优化
向70 μL SERS探针中分别添加0~70 μL捕获探针并混合均匀后在37 ℃充分孵育1.5 h.反应完成后,在外部磁铁的辅助下分离制备好的复合探针,对上清中剩余的SERS探针进行SERS分析,结果如图5所示.从图5 a) 可以看出,捕获探针的添加量对上清中SERS探针的SERS信号强度产生了较大的影响.在10~40 μL添加量的范围内,随着捕获探针添加量的增大,SERS探针的SERS信号强度明显下降,当捕获探针的添加量超过40 μL后,上清液中SERS探针的SERS信号强度很低,表明40 μL捕获探针可以与70 μL SERS探针充分结合形成复合探针.因此,捕获探针的最佳添加量为40 μL.
2.3.4 样品与复合探针体积比的优化
为了提高SERS适配体传感器的灵敏度,优化了样品与复合探针的体积比.实验中采集了样品溶液与复合探针的体积比为1∶9、1∶4、3∶7、2∶3、1∶1、3∶2时反应后上清液的SERS光谱,结果如图6所示.从图6 a) 可以看出,SERS探针上4-MBN在拉曼位移2 227 cm-1处的SERS信号强度随着样品添加量的变化而变化.从图6 b) 可以看出,样品溶液与复合探针的体积比在1∶9~3∶7之间时,4-MBN在拉曼位移2 227 cm-1处的SERS信号强度随着样品添加量的增加而增加.在3∶7~3∶2范围内,4-MBN的SERS信号强度基本不再发生变化.因此,选择样品与复合探针体积比为3∶7.研究中对照组样品也检测到了较弱的SERS信号,这可能是由于体系中存在SERS探针与捕获探针非特异性结合和SERS探针在磁分離和离心过程中的非竞争性脱落.该现象对检测的影响可以通过扣除空白对照组的信号强度进行控制.
2.4 利用建立的低生物背景SERS適配体传感器检测恩诺沙星
为了研究所构建的SERS适配体传感器检测恩诺沙星的灵敏度和定量性能,在最优条件下,采集了不同浓度的恩诺沙星标准溶液(0.5、1、5、10、50、100、500、1 μM)与复合探针反应后上清液中SERS探针的SERS光谱,结果如图7所示.从图7 a) 可以看出,上清液中SERS探针的SERS信号强度随恩诺沙星浓度的升高先升高后趋于稳定.根据4-MBN在拉曼位移2 227 cm-1处的SERS信号强度,建立了恩诺沙星浓度的对数值与对应的上清液的SERS信号强度关系曲线,如图7 b) 所示.
从图7 b) 可以观察到,在1 nM-500 nM的范围内,SERS探针在拉曼位移2 227 cm-1处的SERS信号强度与恩诺沙星浓度的对数值之间存在良好的线性关系,线性回归方程为:y=1 898.159 93x+2 952.219 14,决定系数R2=0.992 48.利用最低检出限(LOD)的计算公式LOD=3SD/k计算的LOD为0.07 nM.将所开发的SERS适配体传感器与之前报道到的恩诺沙星的检测方法进行了比较,结果如表1所示.通过比较发现,所开发的SERS适配体传感器操作简便、响应速度快、特征信号位于生物样品的拉曼信号沉默区有效地避免了食品基质的干扰、具有较高的灵敏度.因此,本研究开发的SERS适配体传感器为复杂基质中恩诺沙星的快速检测提供了一种新方法.
2.5 特异性分析
以氧氟沙星、达氟沙星、氟罗沙星、环丙沙星4种氟喹诺酮类抗生素作为待测物,探究了SERS适配体传感器对于恩诺沙星检测的特异性(图8).
由图8可知,在5种氟喹诺酮类抗生素的浓度均为1 μM的情况下,相比空白对照,建立的SERS适配体传感器对恩诺沙星的响应信号强度最高,对其他4种同类抗生素的响应信号与对照组无显著[HJ1.7mm]差异.结果表明,所开发的SERS适配体传感器对恩诺沙星具有良好的特异性.
2.6 重现性分析
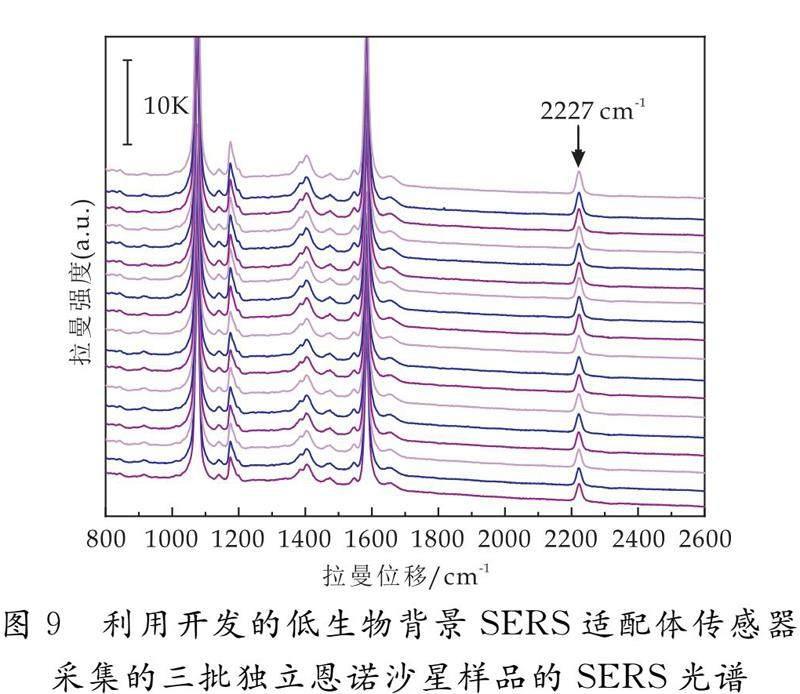
利用所建立的SERS适配体传感器在最优的条件下分别检测三批独立的恩诺沙星样品溶液,结果如图9所示.从图9可以观察到,采集的不同批次样品的SERS光谱的峰形和特征SERS信号的强度均没有明显差异.结果表明,所建立的SERS适配体传感器具有良好的重现性.
2.7 加标回收试验结果
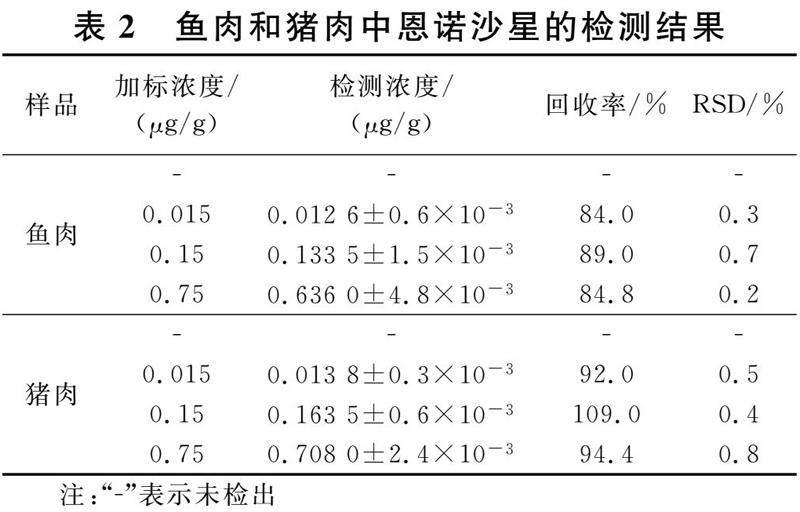
为了验证所建立的SERS适配体传感器在实际样品分析中的实用性,利用所研制的SERS适配体传感器对购买的新鲜鱼肉和猪肉样品进行了加标回收试验.样品中添加恩诺沙星的终浓度分别为0.015 μg/g、0.15 μg/g、0.75 μg/g.表2给出了鱼肉和猪肉样品的加标回收试验检测结果.从表2可以看出,未加标的鱼肉和猪肉样品中未检出恩诺沙星,而加标样品中恩诺沙星的回收率为84.0%~109.0%,RSD为0.2%~0.8%(n=3).该结果表明,建立的SERS适配体传感器对于肉类样品中恩诺沙星的检测具有良好的准确性和稳定性.
3 结论
本研究通过适配体和其cDNA杂交将磁性捕获探针和低生物背景SERS探针组装为复合探针,结合SERS技术,建立了一种恩诺沙星的低生物背景SERS适配体传感器.当恩诺沙星存在时,复合探针中的适配体与其特异性结合,释放出SERS探针.当恩诺沙星的浓度在1~500 nM范围内时,SERS探针位于2 227 cm-1拉曼位移处的特征SERS信号强度与恩诺沙星浓度的对数值呈现良好的线性相关关系,R2为0.99.该方法的LOD为0.07 nM,检测肉类样品中恩诺沙星的回收率在84.0%~109.0%之间,RSD为0.2%~0.8%.因此,本研究开发的SERS适配体传感器在恩诺沙星的检测中具有较高的灵敏度和特异性,为复杂样品中抗生素的快速检测提供了新思路.
参考文献
[1] Chen J,Huang M,ong L.Flexible Ag/nanocellulose fibers SERS substrate and its applications for in-situ hazardous residues detection on food.Applied Surface Science,2020,533:147 454.
[2] Lv L,hang B,Tian P,et al.A ″signal off″ aptasensor based on AuNPs/Ni-MOF substrate-free catalyzed for detection enrofloxacin.Journal of Electroanalytical Chemistry,2022,911:116 251.
[3] hang B,Lv L,Ma X,et al.Au@ nNi-MOF labeled electrochemical aptasensor for detection of enrofloxacin based on AuPt@ h-CeO2/MoS2 and DNAzyme-driven DNA walker triple amplification signal strategy.Biosensors Bioelectronics,2022,210:114 296.
[4] Pugajeva I,Avsejenko J,Judjallo E,et al.High occurrence rates of enrofloxacin and ciprofloxacin residues in retail poultry meat revealed by an ultra-sensitive mass-spectrometric method,and antimicrobial resistance to fluoroquinolones in campylobacter spp.Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2018,356):1 107-1 115.
[5] 席 峰,颜立立,潘春霖,等.鱼类恩诺沙星药物残留风险、成因与消减技术研究进展.食品安全质量检测学报,2023,145):155-163.
[6] 赵军杰,陈可心,栾业辉,等.恩诺沙星与磺胺二甲嘧啶联合毒性探究.中国畜牧兽医,2021,4810):3 872-3 879.
[7] 靳雨婷,陈金嫒,任涛涛,等.食品中恩诺沙星残留检测方法研究进展.食品科学,2022,439):293-299.
[8] 李 丰,郝燕娟,叶竹林,等.猪肉中氟喹诺酮类药物残留检测国标方法的改进.广东化工,2015,426):169-170,167.
[9] GB/T 21312-2007,动物源性食品中14种喹诺酮药物残留检测方法 液相色谱-质谱/质谱法[S].
[10] Speltini A,Maraschi F,Govoni R,et al.Facile and fast preparation of low-cost silica-supported graphitic carbon nitride for solid-phase extraction of fluoroquinolone drugs from environmental waters.J.Chromatogr A,2017,1489:9-17.
[11] Wang Q,hao W M.Optical methods of antibiotic residues detections:A comprehensive review.Sensors Actuators B:Chemical,2018,269:238-256.
[12] Shao H,hou H,hang T,et al.Preparation of molecularly imprinted hybrid monoliths for the selective detection of fluoroquinolones in infant formula powders.J.Chromatogr A,2019,1588:33-40.
[13] Rojas L M,Qu Y,He L.A facile solvent extraction method facilitating surface-enhanced Raman spectroscopic detection of ochratoxin A in wine and wheat.Talanta,2021,224:121 792.
[14] Shan J,Ren T,Li X,et al.Study of microplastics as sorbents for rapid detection of multiple antibiotics in water based on SERS technology.Spectrochimica Acta Part A:Molecular Biomolecular Spectroscopy,2023,284:121 779.
[15] Lin ,He L.Recent advance in SERS techniques for food safety and quality analysis:A brief review.Current Opinion in Food Science,2019,28:82-87.
[16] 李春颖,王红义,陈高乐,等.表面增强拉曼光谱法在动物源性食品安全检测中的应用.食品工业科技,2023,4416):434-443.
[17] Yang Y,Su ,Wu D,et al.Low background interference SERS aptasensor for highly sensitive multiplex mycotoxin detection based on polystyrene microspheres-mediated controlled release of raman reporters.Analytica Chimica Acta,2022,1218:340 000.
[18] Wang P,Sun Y,Li X,et al.One-step chemical reaction triggered surface enhanced Raman scattering signal conversion strategy for highly sensitive detection of nitrite.Vibrational Spectroscopy,2021,113:103 221.
[19] Hao Y,Li Y,Song L,et al.Flash synthesis of spherical nucleic acids with record DNA density.J.Am.Chem.Soc.,2021,1438):3 065-3 069.
[20] GB 31656.3-2021,食品安全国家标准 水产品中诺氟沙星、环丙沙星、恩诺沙星、氧氟沙星、噁喹酸、氟甲喹残留量的测定 高效液相色谱法[S].
[21] Chen S,Lv M,Fan J,et al.Bioorthogonal surface-enhanced Raman scattering flower-like nanoprobe with embedded standards for accurate cancer cell imaging.Analytica Chimica Acta,2023,1246:340 895.
[22] Guo X,hang L,Wang ,et al.Fluorescent carbon dots based sensing system for detection of enrofloxacin in water solutions.Spectrochim Acta A Mol Biomol Spectrosc,2019,219:15-22.
[23] umar J,El Bahy S M,Azab I H E,et al.3D prickle-like hierarchical NiO nanostructures with oxygen vacancies for electrochemical detection of enrofloxacin antibiotics.Applied Physics A,2022,1288):693.
[24] Wang P,Wang L,Li C,et al.Reliable and rapid detection and quantification of enrofloxacin using a ratiometric SERS aptasensor.Molecules,2022,2724):8 764.
[25] Wang ,Guo ,Li Y,et al.Few-layer NbTe2 nanosheets as substrates for surface-enhanced Raman scattering analysis.ACS Applied Nano Materials,2020,311):11 363-11 371.
【責任编辑:蒋亚儒】
基金项目:国家自然科学基金项目32102063); 陕西科技大学高水平博士人才科研启动基金项目2017BJ-51); 陕西省大学生创新创业训练计划项目(S20210708054)
作者简介:李 岑(2001—),男,四川广安人,在读硕士研究生,研究方向:食品质量与安全检测
通讯作者:王盼雪(1988—),女,河北邯郸人,副教授,博士,研究方向:食品质量与安全检测,wangpanxue@sust.edu.cn
