红曲霉强化发酵对黄豆酱风味物质及菌群结构的影响
2024-05-20蒋四强李雄波王泽亮范智义张其圣邓维琴
蒋四强,陈 功,李雄波,王泽亮,范智义,李 婷,李 恒,张其圣,邓维琴,*
(1.四川省食品发酵工业研究设计院有限公司,四川 成都 611130;2.成都大学食品与生物工程学院,四川 成都 610106;3.四川东坡中国泡菜产业技术研究院,四川 眉山 620030)
黄豆酱是我国著名传统发酵调味品之一,主要由米曲霉制成的黄豆曲与一定比例盐水均匀混合后长期发酵制得,具有酱香醇厚、酯香浓郁、咸甜适中的特点[1]。黄豆酱的发酵过程主要由制曲过程中微生物主导,其中以米曲霉为主,微生物通过代谢产生的多种酶系在一系列生化作用下生成多种挥发性风味物质[2]。米曲霉具有较强产淀粉酶及蛋白酶的能力,在发酵过程中能充分将原料中的淀粉和蛋白质等物质进行分解,利于风味物质的生成,因此广泛应用于豆瓣、酱油、豆豉等传统发酵豆制品中。但由于米曲霉单菌制得的黄豆曲中微生物种类较少,导致曲中酶系单一,不利于挥发性风味物质的产生。混菌强化发酵是改善黄豆酱风味品质的有效方法,其可丰富发酵微生物的种类,产生更多酶系分解原料,进一步促进风味物质的形成。红曲霉具有较强的糖化力和酯化力,而米曲霉相应能力较弱,红曲霉制曲后混合发酵丰富了体系中微生物和酶系种类,不仅利于原料的分解利用[3],还能够加快发酵速率,有助于提升产品的色泽、香气和口感。
红曲霉因具有较强的糖化力、酯化力和产红色素能力,在酒类发酵中应用比较广泛,Zhao Chi等[4]利用红曲霉发酵糯米酒,研究发现红曲霉在发酵早期占主导地位,并与酯类和醇类等风味物质具有较强的相关性,糯米酒颜色也得到明显改善;同时,在酒类酿造前期加入红曲对酒体品质影响最显著。除此之外,Li Meng等[5]在运用红曲霉和米曲霉混合发酵苦荞的研究中发现2-庚酮、3-甲基-1-丁醇、1-丁醇、2-甲基-1-丙醇等主要挥发性香气成分显著增加。有学者在发酵酱油的研究中发现,相较于单菌发酵,先单菌制曲、再混合的成曲中各酶活力更佳,使发酵酱油中醇类、酚类以及杂环类风味化合物含量得到显著提升,并且在发酵后期通过加入红曲米进行强化发酵,使特征风味化合物含量增加1 倍[6]。Chen Zhiyao等[7]发现酯类、醛类、吡嗪类、含硫化合物等是红曲霉混合强化发酵酱油中含量增加明显的风味化合物,且强化发酵后酱油的花香、焦香、果味和焦糖香得到显著提升。
由此可见,通过红曲霉强化发酵可以有效改善发酵豆制品的风味品质,可使主要特征香气物质含量得到显著提升。但目前红曲霉强化发酵工艺广泛应用于酱油和酒类等发酵制品中,在黄豆酱中应用较少。因此,本研究通过改变黄豆酱发酵所用黄豆曲种类,利用红曲霉制成黄豆曲与米曲霉黄豆曲进行混合强化发酵,探究红曲霉强化发酵对黄豆酱挥发性风味物质以及菌群结构的影响,以期为黄豆酱品质优化提供理论支撑和方法指导。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
黄豆、面粉和食盐均购自农贸市场。米曲霉(郫酿M003)和红曲霉(PM001)由四川省食品发酵工业研究设计院有限公司泡菜调味品与功能微生物研究中心进行筛选和鉴定,并均保藏于广东微生物菌种保藏中心,保藏号分别为60927和60615。
1.1.2 曲精(郫酿M003)
将麸皮、豆粉和水按照一定比例均匀混合后,平铺于培养筛上,放入自主研发的种曲机中,灭菌之后,接入种曲,进行扩大培养,经干燥、真空上料、筛分和旋风分离后得到曲精M003。
1.1.3 主要培养基和试剂
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基 北京奥博星生物技术有限责任公司;4-甲基-2-戊醇(色谱纯)阿法埃莎(中国)化学有限公司;无水乙醇、乳酸(均为分析纯)成都科隆化学品有限公司。
1.2 仪器与设备
GCMS-TQ8040三重四极杆气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪 日本岛津仪器公司;多功能自动进样器 德国哲思泰公司;DB-WAX色谱柱(60 m×0.25 mm,0.25 μm)美国安捷伦公司;15 mL顶空进样瓶、固相微萃取(solid phase microextraction,SPME)装置(50/30 μm,DVB/CAR/PDMS萃取头)美国Supelco公司;ESJ200-4A型分析天平 沈阳龙腾电子有限公司;台式高速离心机 德国Sorval公司;VORTEX-2型旋涡混合器 美国Genentech公司。
1.3 方法
1.3.1 红曲霉的活化
将红曲霉接种于含10%(体积分数,下同)乙醇和2%乳酸的PDA平板上,于30 ℃培养箱中培养3~5 d,直到长出肉眼可见的红色菌落。通过平板划线将红色菌落重新接种于含醇和酸的PDA平板上,重复划线2 次,最后将红曲霉单菌落接种于PDA斜面,30 ℃培养长出明显红色菌落后于4 ℃保存,供后续使用。
1.3.2 黄豆曲及黄豆酱的制作
1.3.2.1 红曲霉黄豆曲的制作
称取黄豆200 g置于70 ℃左右的温水中浸泡4 h,沥干后装于2 L锥形瓶中,用8 层纱布封口后于121 ℃灭菌20 min;灭菌后将锥形瓶放入55~60 ℃烘箱中,将纱布烘干后取出,待黄豆温度冷却至常温;向黄豆中加入15%的灭菌面粉(以黄豆干质量计);每个红曲霉斜面中加入4 mL无菌水制成悬液,待面粉和黄豆均匀混合后加入红曲霉悬液(每100 g黄豆加1 mL悬液),均匀混合,置于30 ℃培养箱制曲72 h后取出,置于无菌采样袋中,于4 ℃短期保存,供后续使用。
1.3.2.2 米曲霉黄豆曲的制作
采用红曲霉黄豆曲相同的前处理,将冷却好的黄豆与15%的面粉和0.03%曲精M003均匀混合(以干黄豆质量计,曲精与面粉提前混匀),平铺于培养筛上,置于30 ℃培养箱制曲48 h后取出备用。
1.3.2.3 不同比例成曲黄豆酱的制作
分别称取一定质量黄豆曲,按照m(成曲)∶m(水)∶m(盐)=1∶1∶0.24均匀混合后,装入发酵罐于40 ℃恒温发酵40 d,每2 d搅拌1 次,并在0、2、4、6、8、10、20、40 d采样,-20 ℃贮存,用于后续测定。样品编号A0、A2、A4、A8、A10、A20、A40分别表示发酵0、2、4、6、8、10、20、40 d的黄豆酱A,其他黄豆酱编号以此类推。强化发酵黄豆酱质量比例如表1所示。
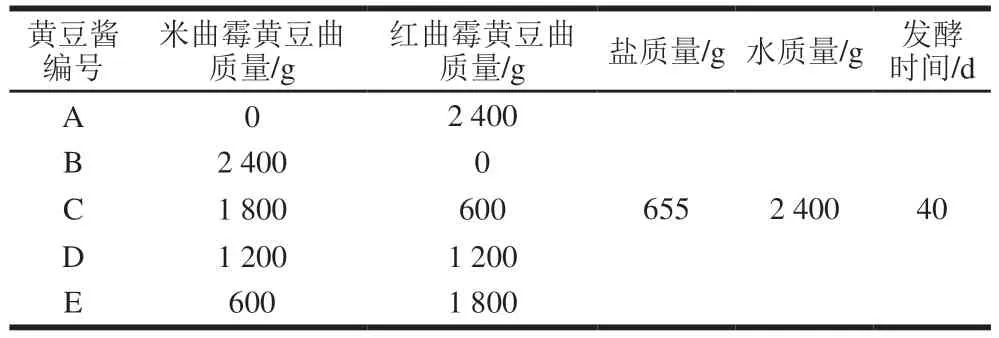
表1 黄豆曲混合发酵条件Table 1 Conditions for pure and mixed culture fermentation of soybean koji
1.3.2.4 高通量测序
菌体富集:称取30 g黄豆酱于200 mL烧杯中,用300 mL无菌水分批次稀释黄豆酱,并用玻璃棒充分搅拌,将水层倒入已灭菌的50 mL离心管中,2 500 r/min低速离心2 min,去除大分子杂质,然后80 000 r/min离心10 min,倒掉水层,收集离心管底部菌体。
测序:将收集到的菌体送至上海派森诺生物医药科技有限公司,提取总DNA后,使用引物338F(5’-3’:ACTCCTACGGGAGGCAGCA)和806R(5’-3’:GGACTACHVGGGTWTCTAAT)对细菌16S rRNA基因的V3~V4结构区域进行扩增。真菌使用内转录间隔区引物ITS5(5’-3’:GGAAGTAAAAGTCGTAACAAGG)和ITS1(5’-3’:GCTGCGTTCTTCATCGATGC)扩增。将扩增产物回收纯化,进行荧光定量处理,使用Illumina MiSeq进行高通量测序。
1.3.3 挥发性风味物质分析
1.3.3.1 挥发性风味物质含量测定
参照李雄波[8]的方法进行测定。样品前处理:精确称取粉碎后的样品2.000 g于固相萃取瓶中,加入2 mL饱和氯化钠溶液,最后加入10 μL 0.5 μg/mL内标溶液(4-甲基-2-戊醇)并混匀。利用NIST 17数据库(相似度大于80%)和人工图谱共同对挥发性风味物质进行鉴定,采用内标进行半定量分析,挥发性风味物质的含量按式(1)计算:
式中:A1为目标物质峰面积;ρ为内标质量浓度/(μg/mL);V为内标添加体积/mL;A2为内标峰面积;m为样品质量/g。
1.3.3.2 香气活力值(odor activity value,OAV)
OAV参照秦炳伟等[9]的方法测定,按式(2)计算:
式中:Mi为i化合物的含量/(mg/kg);Ci为i化合物在水中嗅觉阈值/(mg/kg)。
风味阈值采用水相中风味物质的气味阈值进行计算。
1.4 数据处理与分析
每个样品进行3 次重复实验,在派森诺基因云平台(https://www.genescloud.cn)完成对高通量数据的分析,运用Excel 2019、Origin 2021和SIMCA 14.1软件对风味数据进行处理和作图。
2 结果与分析
2.1 红曲霉强化发酵对黄豆酱中挥发性风味物质含量的影响
由图1可知,单菌制曲发酵及混合强化发酵黄豆酱中挥发性风味物质组成和含量有明显差异,黄豆酱A、B、C、D、E中挥发性风味物质含量分别为32.87、8.67、13.39、17.89、14.00 μg/g。米曲霉单菌制曲发酵黄豆酱B挥发性风味物质含量均低于其他4 种黄豆酱。
由表2可知,黄豆酱中包含35 种含量较高的关键风味物质,主要包括芳香化合物1 种、醇类10 种、酚类2 种、醚类2 种、酸类3 种、醛酮类13 种、烯类1 种以及酯类3 种。红曲霉单菌制曲发酵及其强化发酵的黄豆酱以醇类、芳香物质、醛酮类为主,其中醇类物质含量远高于米曲霉单菌制曲发酵的黄豆酱B,与张晓等[10]的研究结果相符。OAV表征某物质对整体香气的作用程度,一般认为OAV大于1,表示该物质对香味有较大贡献。由表3可知,黄豆酱中一共检出39 种对香味具有重要作用的风味化合物,主要为芳香族化合物、醇类、酚类、酸类、醛酮类以及酯类化合物。

表2 黄豆酱主要挥发性风味物质测定结果Table 2 Content of major volatile flavor substances of soybean paste

表3 黄豆酱主要呈香挥发性风味物质OAVTable 3 OAVs of main aromatic volatile flavor substances in soybean paste
醇类化合物是黄豆酱中含量较高的化合物,可赋予黄豆酱一定的花香和果香,同时也是酯化反应的重要前体物质[11]。1-辛烯-3-醇、芳樟醇、苯乙醇、异戊醇是主要醇类物质,其中苯乙醇被鉴定为黄豆酱中的关键风味化合物[12],而1-辛烯-3-醇为脂肪族不饱和醇,具有蘑菇、薰衣草、玫瑰和干草香,是一种天然香料[13],使黄豆酱的口感更加柔和,两者在红曲霉单菌制曲发酵黄豆酱A中含量较高,其次为混合强化发酵的黄豆酱D、E、C,在米曲霉单菌制曲发酵黄豆酱B中含量最低。
酸类物质是黄豆酱风味的重要组成成分,适宜的酸类物质可以使黄豆酱香气更协调,并且可通过酯化反应促进酯类物质的生成,但过多的酸类物质则会使黄豆酱出现酸腐味,影响黄豆酱的品质[14]。混合强化发酵黄豆酱C中酸类物质含量最高(1.39 μg/g),米曲霉单菌制曲发酵黄豆酱B中酸类化合物含量最低,仅为0.41 μg/g。乙酸、异丁酸和异戊酸是主要的酸类化合物,在混合强化发酵黄豆酱C中含量较高,分别为0.48、0.12、0.74 μg/g,与蒲静等[15]的研究结果一致。通过分析OAV可知异戊酸和异丁酸对黄豆酱整体香气有重要作用,因此混合强化发酵黄豆酱C风味丰富度及协调性可能优于其他黄豆酱。
醛酮类化合物赋予黄豆酱青草气味、果实气味、坚果气味及脂肪气味,香气浓烈,对甜瓣子风味有较大影响[16]。4-甲基-2-戊酮、二异丁基酮和异戊醛是黄豆酱中含量较高醛酮类物质,红曲霉单菌制曲发酵黄豆酱A和混合强化发酵黄豆酱C、D、E的醛酮类化合物含量均高于米曲霉单菌制曲发酵的黄豆酱B,且对黄豆酱的整体香气的构成有一定作用。此外,3-辛酮、4-壬酮、壬醛等物质对香气组成作用明显,但上述醛酮类化合物对米曲霉单菌制曲发酵黄豆酱B整体香气的作用较小。
酯类化合物是形成黄豆酱风味的重要组成成分,赋予黄豆酱独特的酯香。米曲霉单菌制曲发酵黄豆酱B中酯类化合物含量最高(1.79 μg/g),而红曲霉单菌制曲发酵黄豆酱A和混合强化发酵黄豆酱C、D、E中酯类化合物含量较低,其中苯甲酸甲酯具有浓郁的冬青油香,对整体香气具有重要作用,这与于茜雅等[17]的研究结果相符。由于酯类化合物可通过酯化反应产生,反应过程中会消耗酸类及醇类化合物,这可能是导致米曲霉单菌制曲发酵黄豆酱B中醇类和酸类含量较低的原因之一。
黄豆酱中的芳香烃主要为对异丙基甲苯,虽然含量较低,但对黄豆酱香气仍具有一定的贡献。愈创木酚具有水果香、烟熏香,在米曲霉单菌制曲发酵黄豆酱B中含量较高,该物质对发酵豆制品酱香的形成具有重要作用[18]。
综上所述,米曲霉单菌制曲发酵黄豆酱B的酯香较其他黄豆酱更浓郁,但其他风味化合物含量较低,风味特征不明显。通过使用红曲霉强化发酵,黄豆酱中芳香烃、醇类、醛酮类以及酸类物质含量较米曲霉单菌制曲发酵(黄豆酱B)得到显著提升。其中红曲霉单菌制曲发酵黄豆酱A和混合强化发酵黄豆酱C、D、E含有较高的醇类、醛酮类和酸类物质,但混合强化发酵黄豆酱C较其他强化发酵黄豆酱的酸类和酯类物质含量更高,因此,混合强化发酵黄豆酱C可能风味更协调,具有较好的风味品质。
2.2 黄豆酱中挥发性风味物质的主成分分析(principal component analysis,PCA)
为了进一步了解红曲霉强化发酵对黄豆酱挥发性风味物质的影响,对39 种主要呈香风味化合物进行PCA,如图2A所示。PC1和PC2累计贡献率达到84.6%,可代表大部分风味物质的信息。黄豆酱A、B、C、D、E分布在4 个不同象限,说明5 种黄豆酱中风味化合物存在较大差异。结合图2B可知,异戊醇、正己醇、1-辛烯-3-醇、芳樟醇、2,3-丁二醇、苯乙醇、2-乙基己醇、2-壬醇、苯酚、壬醛、桧烯等与PC1具有较高的正相关性,是红曲霉单菌制曲发酵黄豆酱A中主要差异化合物;糠醇、3-甲硫基丙醇、2-甲基苯酚、辛醇以及2-辛烯-1-醇与PC1具有较高的负相关性,是混合强化发酵黄豆酱C中的主要差异化合物;而反-2-辛烯醛、1-辛烯-3-酮、2-己酮和麦芽醇、苯甲酸甲酯异戊醛等分别为米曲霉单菌制曲发酵黄豆酱B和混合强化发酵黄豆酱D中的主要差异化合物。强化发酵黄豆酱E中的差异化合物主要为4-壬酮、2-壬酮。

图2 PCA的得分图(A)和载荷图(B)Fig.2 Score (A) and loading (B) plots of PCA
2.3 黄豆酱发酵过程中微生物多样性分析
Chao1和Shannon指数分别代表微生物物种的丰富度和多样性,物种群落越丰富,Chao1指数越大;物种群落多样性越高,Shannon指数越大。如表4所示,所有黄豆酱样本中覆盖率均在0.999以上,表明在此测序深度下所得的基因序列可基本覆盖样本中所有的微生物物种,所得数据可较为真实地反映样本中微生物群落的组成情况。黄豆酱发酵过程中细菌的Chao1和Shannon指数分别分布在40.396~216.284和1.325 46~3.005 41;真菌的Chao1和Shannon指数分别分布在5.000~15.033和0.013 45~1.153 44。各发酵阶段不同黄豆酱中细菌Chao1和Shannon指数均大于真菌,说明黄豆酱中细菌群落的丰富度和多样性远高于真菌群落,与任文博等[19]的研究结果一致。但不同黄豆酱在发酵过程中细菌群落的丰富度和多样性有明显区别,米曲霉单菌制曲发酵黄豆酱B的Chao1指数高于其他黄豆酱,但Shannon指数低于红曲霉单菌制曲发酵黄豆酱A及混合强化发酵的黄豆酱,其中混合强化发酵黄豆酱C和D的Shannon指数最高,分别为2.783 61和3.005 41。说明米曲霉发酵黄豆酱在细菌丰富度上存在优势,但多样性不及强化发酵的黄豆酱。米曲霉单菌制曲发酵黄豆酱B真菌丰富度高于强化发酵黄豆酱,而明显低于强化发酵黄豆酱,其中混合强化发酵黄豆酱C中真菌Shannon指数达到1.153 44,高于米曲霉单菌制曲发酵黄豆酱B(1.052 64)。

表4 α多样性指数Table 4 Alpha diversity indexes
由此可见,相比于米曲霉制曲发酵,红曲霉强化发酵黄豆酱在细菌和真菌多样性方面具有较为明显的优势。Mao Jingjing等[20]研究表明,发酵过程中细菌和真菌群落与多种风味化合物之间存在着极显著的正相关关系,强化发酵黄豆酱中相对较高的细菌和真菌多样性可能会对丰富黄豆酱风味物质组成发挥一定的积极作用,这可能是导致米曲霉单菌制曲发酵黄豆酱B风味物质含量和种类不及强化发酵黄豆酱的原因之一,同时也说明红曲霉对黄豆酱的菌群结构有一定的影响。
2.4 黄豆酱发酵过程中细菌菌群结构分析
黄豆酱发酵过程中门水平细菌群落结构组成如图3A所示。厚壁菌门(Firmicutes)为黄豆酱发酵过程中绝对的优势菌门,其相对丰度在95.33%以上。在属水平上,不同黄豆酱中细菌组成相似,芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)和明串珠菌属(Leuconostoc)是主要优势菌属,但在不同黄豆酱中菌群的相对丰度存在较大差异(图3B)。在发酵初期,Bacillus是黄豆酱B发酵过程中的绝对优势菌属,其相对丰度在71.25%以上。Bacillus也是红曲霉单菌制曲发酵黄豆酱A和混合强化发酵黄豆酱C、D、E发酵前期的优势菌属;但随着发酵的进行,Staphylococcus相对丰度逐渐上升,在发酵中后期成为优势菌属,在发酵40 d的红曲霉单菌制曲发酵黄豆酱A中其相对丰度达到93.08%。在传统豆酱[21]和酱渣[22]中,Staphylococcus也是发酵后期的优势细菌属。有研究发现,Staphylococcus可以有效促进氨基酸代谢类风味物质的产生,同时可以降低脂质氧化类的形成速率[23]。红曲霉单菌发酵黄豆酱A和混合强化发酵黄豆酱C、D、E中存在较低相对丰度的Leuconostoc(0.90%~8.65%),且贯穿整个发酵过程。Wang Dahong等[24]发现Leuconostoc在豆制品发酵中有利于酯类、酮类以及酸类等风味化合物的生成,对提升黄豆酱的风味品质有一定作用。但随着Staphylococcus相对丰度的上升,Leuconostoc相对丰度逐渐下降,推测两者之间可能存在竞争关系。由此可见,用红曲霉制曲强化发酵对黄豆酱中的细菌多样性及相对丰度有一定的影响,从而影响黄豆酱的品质。
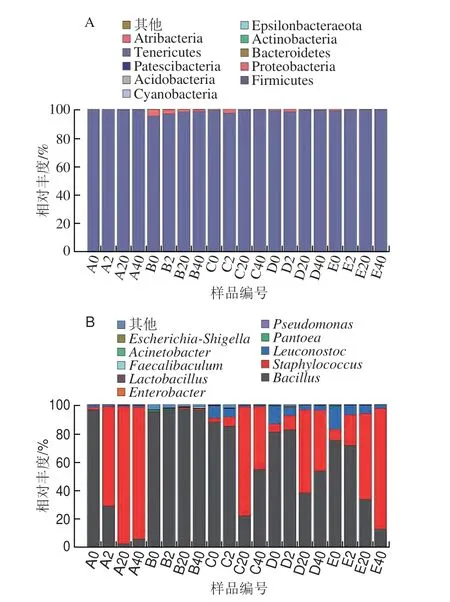
图3 黄豆酱发酵过程中门水平(A)及属水平(B)细菌菌群结构变化Fig.3 Changes in bacterial floral structure at the phylum (A) and genus level (B) during the fermentation process of soybean paste
2.5 黄豆酱发酵过程中真菌菌群结构分析
由图4可知,子囊菌门(Asomycota)为绝对的优势真菌菌门,相对丰度在99.78%以上。在属水平上,不同黄豆酱中真菌组成相似,但相对丰度差异较大(图4B)。红曲属(Monascus)、米勒酵母属(Millerozyma)和曲霉属(Aspergillus)是主要优势菌属,其中Monascus出现在红曲霉单菌制曲发酵黄豆酱A和混合强化发酵黄豆酱的发酵前期,Monascus在红曲霉单菌制曲发酵黄豆酱A中相对丰度达到99.71%,在混合强化发酵黄豆酱C、D、E中其相对丰度分别为28.37%、48.58%和70.30%。发酵第2天,Monascus相对丰度开始下降,说明Monascus主要在发酵前期起作用。Monascus属于好氧菌,对盐不耐受,黄豆酱在含有12%盐分的密闭条件下进行发酵,受氧气含量[25]和盐[26]的影响,Monascus的生长代谢减缓,导致相对丰度在发酵前期开始下降。Millerozyma在红曲霉单菌制曲发酵黄豆酱A发酵2 d开始出现,到了发酵后期,Millerozyma取代Monascus成为优势菌属,相对丰度为99.86%,混合强化发酵黄豆酱C、D、E中其相对丰度分别为41.40%、50.22%和39.78%,这与蔡琪琪等[27]的研究结果一致。同时,Millerozyma对黄豆酱发酵过程中挥发性风味物质的形成具有积极作用[28],其相对丰度不同可能是导致不同黄豆酱中醇类物质含量差异较大的主要原因之一。Millerozyma属于兼性厌氧菌,能很好地适应发酵罐中的缺氧条件,且有研究发现,Millerozyma在含盐量为11%~14%的豆瓣酱中也是优势菌属,说明Millerozyma具有一定的耐盐性,这可能是Millerozyma在发酵中后期成为优势菌属的主要原因。Aspergillus是米曲霉单菌制曲发酵黄豆酱B和混合强化发酵黄豆酱C、D、E中的优势菌属之一,在发酵后期其相对丰度分别为53.21%、58.48%、49.74%和60.13%。研究表明,Aspergillus和Millerozyma共存时有利于风味物质的形成[29]。
图4 黄豆酱发酵过程中门水平(A)及属水平(B)真菌菌群结构变化Fig.4 Changes in the structure of fungal flora at the phylum (A) and genus level (B) during the fermentation process of soybean paste
2.6 微生物与风味物质生成的相关性分析
为了进一步了解黄豆酱发酵过程中微生物与挥发性风味物质之间的关系,通过对优势微生物和挥发性风味物质数据进行同理化处理和相关性分析,结果如图5所示。Aspergillus和Bacillus是米曲霉单菌制曲发酵黄豆酱B中的主要优势菌属,其中Bacillus与大多数醇类和酚类物质呈显著负相关(0.85<|r|<0.96),而与辛酸辛酯、γ-硬脂酸内酯具有较强的正相关性(0.56<r<0.84),研究证明,在酱类食品的发酵过程中,Bacillus的代谢是影响豆酱发酵后期挥发性酯类含量的重要因素[29]。而Bacillus在米曲霉单菌制曲发酵黄豆酱B的发酵过程中相对丰度较高,这可能是导致其酯类化合物含量高于其他黄豆酱的原因。Aspergillus与4-甲基-2-庚酮、2-甲基-3-己酮和反-2-辛烯醛呈显著或极显著正相关(0.86<|r|<0.97)。Staphylococcus、Leuconostoc和Monascus是混合强化发酵组与米曲霉单菌制曲发酵黄豆酱B的主要差异微生物,其中Staphylococcus与黄豆酱中1-辛烯-3-醇、2,7-二甲基-4,5-辛二醇、邻苯二甲醚、3-羟基-2-丁酮及1-甲氧基-4-[(Z)-1-丙烯基]苯呈显著或极显著正相关(r>0.90),这与赵改名等[30]的研究结果一致。Leuconostoc与4-甲基-2-戊酮呈显著正相关(r>0.90),4-甲基-2-戊酮具有相对较低的风味阈值和较为突出的草木味和果香味。Monascus则与1-辛烯-3-醇、(2R,3R)-2,3-丁二醇、芳樟醇、苯乙醇、愈创木酚、3-羟基-2-丁酮、邻苯二甲醚、2,7-二甲基-4,5-辛二醇、1-甲氧基-4-[(Z)-1-丙烯基]苯等物质呈显著或极显著正相关(r>0.85),其在红曲霉发酵的米酒中也有相似发现[31],具有青草味、花香味、玫瑰味、草木香等气味,这表明Monascus对黄豆酱中花草香气的形成具有贡献作用。由此可以看出,由差异微生物代谢产生的化合物对黄豆酱整体风味具有较大的作用,而这些化合物可能是区别于米曲霉单菌制曲发酵黄豆酱B风味的关键风味物质。Millerozyma主要与异戊醇呈显著正相关(r=0.92),与2.5节分析结果一致,虽然Millerozyma在米曲霉单菌制曲发酵黄豆酱B发酵后期具有较高的相对丰度,但在发酵过程中产生以异戊醇为主的醇类化合物较少,因此,混合强化发酵的黄豆酱和米曲霉单菌制曲发酵的黄豆酱B在醇类风味上有较大的区别。Faecalibaculum则主要与1-辛烯-3-醇、(2R,3R)-2,3-丁二醇、芳樟醇、苯乙醇、愈创木酚、邻苯二甲醚等物质呈显著负相关(0.85<|r|<0.95),说明Bacillus和Faecalibaculum不利于黄豆酱中花草香气的形成。

图5 微生物与挥发性风味物质的相关性分析Fig.5 Correlation analysis between microorganisms and volatile flavor substances
3 结论
本研究将米曲霉和红曲霉分别制成黄豆曲,以米曲霉单菌制曲发酵黄豆酱作为对照,将两种黄豆曲混合进行强化发酵黄豆酱,研究红曲霉强化发酵对黄豆酱风味化合物以及菌群结构的影响。结果表明,红曲霉单菌制曲发酵黄豆酱和混合强化发酵的黄豆酱中醇类、芳香类、醛酮类以及酸类挥发性风味物质含量远高于米曲霉单菌制曲发酵的黄豆酱。混合强化发酵黄豆酱微生物多样性远高于米曲霉单菌制曲发酵的黄豆酱。混合强化发酵黄豆酱中Monascus、Millerozyma、Staphylococcus和Leuconostoc相对丰度显著高于米曲霉单菌制曲发酵的黄豆酱,且这些差异微生物与醇类、芳香类、醛酮类风味物质具有较强的正相关性。综上所述,红曲霉混合强化发酵通过影响菌群结构进一步影响风味化合物的形成,使风味化合物的种类及含量相较于米曲霉单菌制曲发酵黄豆酱更加丰富,其中米曲霉黄豆曲和红曲霉黄豆曲按照3∶1质量比混合强化发酵黄豆酱风味更协调,具有更好的风味品质。因此,在黄豆酱的实际生产中,可以通过加入红曲霉强化发酵提升黄豆酱的风味品质,达到改善黄豆酱品质的目的。
