放疗联合PD-1抑制剂及酪氨酸激酶抑制剂治疗MSS型结直肠癌肝转移疗效及安全性
2024-05-18丁宇轩郭沥泞沈佳怡王丽君
丁宇轩 郭沥泞 沈佳怡 王丽君,2
1南京医科大学附属肿瘤医院 (南京 210009);2南京医科大学附属肿瘤医院,江苏省肿瘤医院放疗科,江苏省肿瘤防治研究所 (南京 210009)
结直肠癌(colorectal cancer, CRC)是全球范围内排名第三常见的恶性肿瘤,也是癌症相关的第二大致死原因[1]。近10年,我国结直肠癌新发和死亡病例均约占全球的30%,带来巨大的经济健康负担[2]。远处转移是患者死亡的主要原因之一,其中肝脏是结直肠癌最容易通过血行转移的靶器官,结直肠癌肝转移(colorectal cancer liver metastases,CCLM)患者如果能接受完全切除术,5 年生存率在30% ~ 57%[3]。然而,大约有80% ~ 90%的患者的肿瘤病灶无法切除,这部分患者的5 年生存率不足5%[4]。近年来研究者发现,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs),例如程序死亡受体-1(programmed death receptor-1, PD-1)抑制剂,在高度微卫星不稳定(high micro-satellite instability, MSI-H)型或错配修复缺陷(mismatch repair defects, dMMR)型患者的疾病控制率方面有出色表现,然而对于95%的微卫星稳定(microsatellite stable, MSS)型或错配修复正常(mismatch repair proficient, pMMR)的患者,免疫治疗效果并不理想,可能原因是该型患者肿瘤突变减少以及免疫抑制途径增加。如何增强MSS 型患者免疫治疗效果,是临床研究的热点问题。研究发现,放疗可以导致炎症细胞因子级联反应和免疫效应细胞激活,增强树突状细胞摄取处理肿瘤抗原,并激活CD8+T 淋巴细胞[5-6]。另外,小分子酪氨酸酶抑制剂(tyrosine kinase inhibitors, TKI)除了抗血管生成作用外,还可以通过调节巨噬细胞极化、抑制免疫抑制分子表达等机制,重新编程肿瘤免疫微环境[7]。但是目前三者联合治疗效果,在多项治疗进展的晚期MSS 型CCLM 患者中没有得到实践,疗效尚不可知。基于此,本项回顾性研究拟分析真实世界下放疗联合免疫检查点抑制剂及TKI 的疗效和安全性。
1 资料与方法
1.1 一般资料 本研究经江苏省肿瘤医院伦理委员会批准(伦理批号2023-046),患者或其家属签署了知情同意书。收集2021年4月至2023年8月在江苏省肿瘤医院收治的MSS 型转移性结直肠癌患者25 例,其中观察组12 例,对照组13 例。观察组使用放疗联合PD-1 抑制剂及TKI,对照组单独使用TKI 药物。入组标准:(1)年龄18 ~ 75 岁;(2)经病理证实为CCLM,伴或不伴其他脏器转移;(3)经PCR 检测或免疫组化检测MMR 的蛋白表达,或者二代测序法(NGS)证实是MSS 型;(4)既往接受过至少两线标准治疗方案后病情进展;(5)影像学明确有至少一个可测量病灶;(6)有足够的器官功能能够耐受放疗(包括:白细胞数≥ 2.5 × 109·L-1,血小板 > 50 × 109·L-1,胆红素不超过正常上限的1.5 倍;肝功能谷丙转氨酶、谷草转氨酶不超过正常上限的2.5 倍;肾功能肌酐不超过正常上限的1.5 倍);(7)美国东部肿瘤协作组体能状态(Eastern Collaborative Oncology Group Performance Status, ECOG PS)评分≤ 3分,预期寿命≥ 3个月。排除标准:(1)最近5 年有其他恶性疾病史者;(2)患者对PD-1 抑制剂及TKI 药物过敏;(3)患者有自身免疫性疾病;(4)有严重器官功能障碍或严重活动性感染;(5)治疗6 个月内患有心肌梗死、严重或不稳定性心绞痛、NYHA 2 级以上新功能不全、充血性心力衰竭、脑血管意外;(6)影像学及血液学检查资料缺失。
1.2 治疗方案 观察组采用放疗联合PD-1 抑制剂及TKI,对照组单独使用TKI 类药物。
1.2.1 放疗 针对不同部位的转移瘤,采取合适的定位方式,依据CT、MRI 确定靶区范围。观察组7 例采用SBRT 技术,单次放疗剂量在4 ~6 Gy 之间,总放疗次数为7 ~ 10 次。另外5 例采用IMRT 技术时单次剂量为1.8 ~ 2.3 Gy,放疗总次数12 ~ 28 次,放疗处方剂量根据病灶位置适当调整。
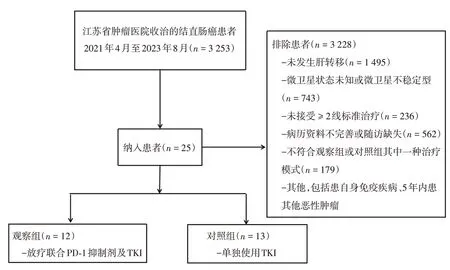
图1 患者的入组流程图Fig.1 Flow diagram of study cohort selection.
1.2.2 PD-1 抑制剂及TKI 药物 PD-1 抑制剂包括替雷丽珠单抗200 mg/信迪利单抗200 mg/赛帕利单抗240 mg/帕博丽珠单抗200 mg,第1天,每3周重复,纳武利尤单抗注射液240 mg,第1 天,每2 周重复。TKI 药物包括呋喹替尼3 ~ 5 mg 和瑞戈非尼120 mg,每天吃药1次,口服2周停1周,每3周为1个给药周期。直至病情进展或毒性不可耐受。
1.3 数据收集及随访 通过医院的电子病历系统收集患者的基线及治疗后的血液学和影像学检查结果。利用门诊或电话的方式对患者进行随访,获得患者的生存情况及不良反应。本研究的最后一次随访时间为2023 年12 月20 日。
1.4 观察指标
1.4.1 疗效观察 治疗前进行CT 或MRI 检查,治疗后每2 个周期复查1 次。根据RECIST1.1 标准进行疗效评估,将患者分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)和疾病进展(progressive disease, PD)[8]。CR 需要病灶消失并保持4 周以上;所有目标病灶最大径之和减少30%并持续4 周以上为PR;SD 指病灶介于PR 与PD 之间;PD 是指出现新病灶或最大径之和增加20%。(CR+PR+SD)/总例数×100%=疾病控制率(disease control rate,DCR)。记录无进展生存时间(progression-free survival, PFS),定义为从治疗开始到疾病进展或任何原因死亡时间。
1.4.2 不良反应 根据美国国立癌症研究所通用毒性标准4.0 版进行不良反应评估,包括放疗相关不良反应(皮肤黏膜损伤、骨髓抑制等)、PD-1 抑制剂相关不良反应(甲状腺功能改变、免疫相关性肺炎、肝炎、皮肤反应等)、TKI 的不良反应(皮疹、腹泻、恶心呕吐、高血压、血尿、肝肾功能损害、消化道溃疡或出血等)。
1.5 统计学方法 采用SPSS 25.0 软件进行数据分析。分类变量用数量和百分比表示,用Fisher精确概率检验。采用Kaplan-Meier 法绘制生存曲线,log-rank 检验进行生存分析。以P< 0.05 为差异有统计学意义。
2 结果
2.1 一般资料比较 收集的25 例MSS 型CCLM 患者的基线资料见表1,其中男17 例,女8 例,所有患者的中位年龄为58 岁。观察组12 例患者中有3 例分别使用替雷丽珠单抗、纳武力尤单抗和赛帕利单抗,2 例使用特瑞普利单抗,3 例使用帕博丽珠单抗,4 例使用信迪利单抗。观察组中2 例TKI 采用瑞戈非尼,其余为呋喹替尼。一共放疗15 个部位,其中肝脏照射次数最多,共5 次,其余为肺、淋巴结及软组织。对照组有5例使用瑞戈非尼,其余患者使用呋喹替尼。两组患者基线资料差异无统计学意义(P> 0.05),见表1。
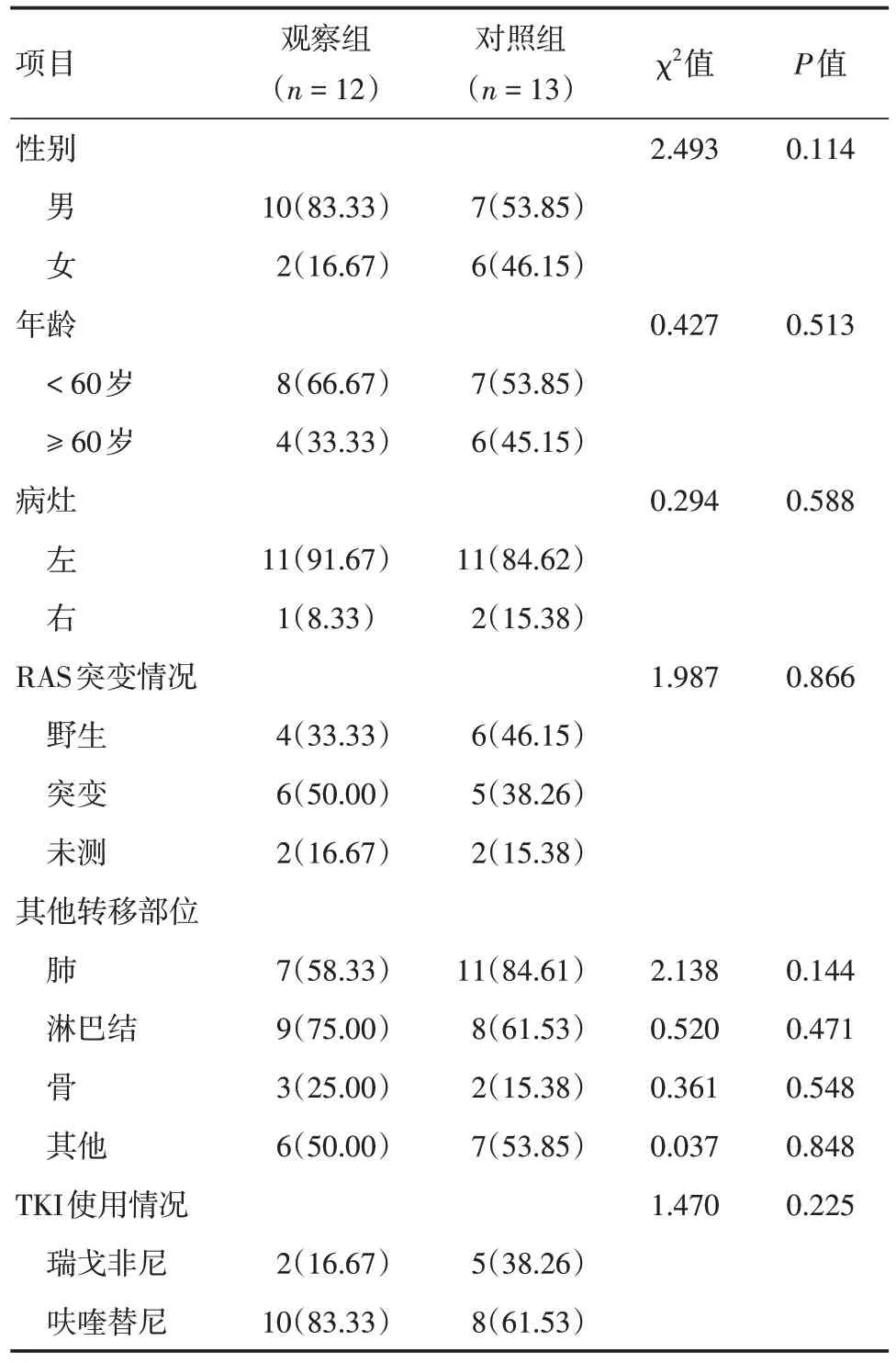
表1 两组患者的基线资料Tab.1 Comparison of baseline characteristics between two groups例(%)
2.2 两组治疗效果 两组治疗的有效率差异无统计学意义(P> 0.05),观察组的疾病控制率高于对照组,差异有统计学意义(P< 0.05),见表2。
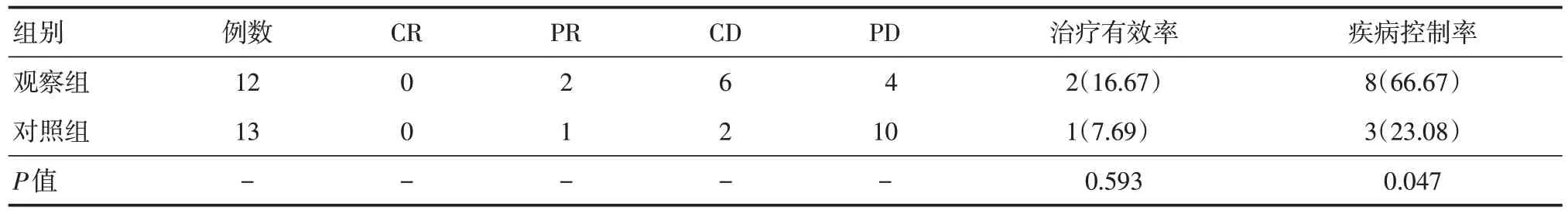
表2 两组治疗有效率与疾病控制率分析Tab.2 Analysis of treatment efficiency and disease control rate in two groups 例(%)
2.3 生存曲线 对照组的中位PFS 为5 个月,观察组的中位PFS 为4 个月,对照组长于观察组,但差异无统计学意义(χ2= 3.378,P= 0.066),见图2。
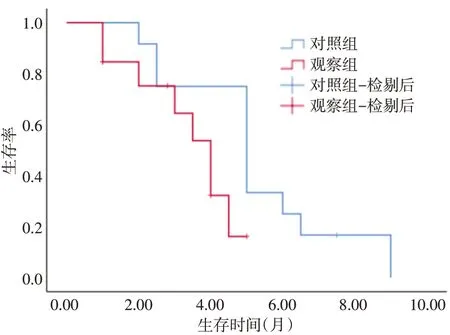
图2 两组患者中位PFS Kaplan Meier 曲线Fig.2 Kaplan-Meier curves of progression-free survival in two groups
2.4 治疗相关不良反应 两组患者治疗过程中的不良反应多为1 ~ 2 级,主要包括骨髓抑制、肝功能异常、恶心呕吐、腹泻、甲状腺功能异常、皮疹、低钙血症等。≥ 3 级不良反应少见,主要为骨髓抑制和肝功能异常。所有患者经过治疗后均好转,治疗过程中未出现4 级不良反应和死亡事件。两组不良反应发生差异无统计学意义(P> 0.05),见表3。
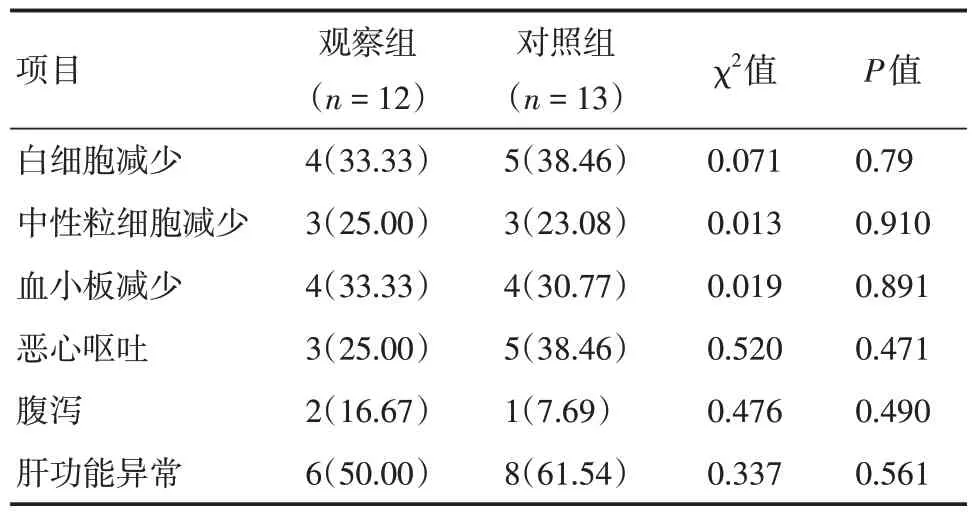
表3 两组治疗相关不良反应对比Tab.3 Comparison of treatment-related adverse effects between the two groups例(%)
3 讨论
肝脏是结直肠癌最容易通过血行转移的靶器官,大约20%的患者一经诊断就已经合并肝转移,另有15% ~ 25%的患者在结直肠癌原发灶根治术后发生肝转移[9-10]。已有研究表明对于dMMR/MSI-H 的患者,免疫检查点抑制剂无论在转化治疗中提高疾病控制率和转化率,还是在姑息治疗的二线治疗中控制病情进展都有出色的效果。但是对于95%的属于pMMR/MSS的患者,免疫检查点抑制剂效果并不理想,分析原因可能由于pMMR/MSS CCLM 患者缺乏强烈的肿瘤免疫性抗原激活免疫细胞,以及抗原呈递机制存在缺陷。因此,如何提高PD-1 抑制剂在MSS 型结直肠癌患者中的治疗效果,是目前研究的热点。
呋喹替尼和瑞戈非尼是TKI,Ⅲ期临床试验CONCUR 和FRESCO 研究分别证实了瑞戈非尼和呋喹替尼在三线结直肠癌的治疗效果[11-12]。目前在一些动物实验中,人们发现TKI 与PD-1 抑制剂联用可以起到正反馈的促进作用,大大促进免疫治疗效果[13]。可能的机制包括抗血管生成药物改善血管的结构和功能,调节肿瘤微环境,有利于组织灌注以及免疫细胞浸润。另一方面,PD-L1通过激活T 淋巴细胞分泌IFN-γ,反过来减轻局部缺氧,促进肿瘤血管正常化[14-15]。这种相辅相成的作用在多项临床研究中也初步得到证实,ZHANG等[16]的单臂回顾性研究显示,联合使用呋喹替尼和PD-1 抑制剂治疗mCRC 的总缓解率为11.8%,疾病控制率为70.0%,中位PFS为5.4个月。日本的REGONIVO 研究首次显示瑞戈非尼联合纳武利尤单抗有令人鼓舞的疗效,24例pMMR/MSS mCRC 患者的客观反应率(ORR)为33%,mPFS 为7.9 个月,然而后续分析提示肝转移是患者对治疗无反应的重要因素[17]。如何进一步提高CCLM 人群的生存率,临床需要继续调整治疗策略。
以往人们认为放疗作为局部治疗手段,其通过介导DNA 损伤阻止有丝分裂及诱导凋亡杀伤肿瘤。但近期越来越多的研究发现,放疗可以大大增强免疫治疗效果,一方面死亡的肿瘤细胞释放双链DNA 和核糖核酸(ribonucleic acid, RNA),激活干扰素基因刺激因子(stimulator of interferon genes, STING)信号通路,从而募集树突状细胞、诱导CD8+T细胞[18]。另一方面,放疗上调癌细胞表面MHC-I分子的表达,从而增强抗原递呈细胞对肿瘤的识别。辐射还可以改变肿瘤细胞周围微环境,包括骨髓来源的细胞和淋巴细胞的功能和数量以及细胞因子的水平,重新编程和调整肿瘤微环境的免疫状态[19-21]。在许多临床前研究中,放疗和免疫检查点抑制剂联合运用还可以使远处病灶消退,产生“远隔效应”。临床研究也在不断证实放免联合的优秀治疗效果,一项单臂、Ⅰ期临床研究证实了放免联合治疗4 期胶质瘤患者的有效性及安全性[22]。KEYNOTE-001 研究发现,免疫治疗前接受过放疗的NSCLC 患者的PFS 和OS 都优于仅接受免疫治疗的患者[23]。同样有研究(NCT04109755、NCT04017455、NCT03104439)证实,放免联合对于MSS 型转移性结肠癌是有效的。
研究结果表明联合治疗人群的疾病控制率要优于单独治疗的患者(P< 0.05),在生存时间方面,单独治疗人群PFS 长于联合治疗,但是差异无统计学意义。另外两组的不良反应差异无统计学意义,增加了治疗不会导致更多的不良反应。
综上所述,该联合治疗可以使得MSS 型CCLM患者生存获益,且不增加治疗风险。该研究属于小样本的回顾性研究,患者使用的PD-1 抑制剂、放疗方法并不统一,但这不能否定该联合治疗的潜在前景,另外,我们没有对联合治疗获益人群进行进一步分析,未来需要更多研究探讨该联合治疗的可能预测指标。
【Author contributions】DING Yuxuan performed the conceptualization and wrote the article. GUO Lining had the acquisition and formal analysis. SHEN Jiayi recorded data and follows up with patients. WANG Lijun revised the manuscript critically for important intellectual content.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
