未足月胎膜早破孕妇血清中miR-223-3p的表达水平及临床意义
2024-05-18胡玉莹朱锦明刘洁潘亚文张倩冯锦秋
胡玉莹 朱锦明 刘洁 潘亚文 张倩 冯锦秋
1徐州医科大学(江苏徐州 221006);2徐州医科大学附属徐州妇幼保健院(江苏徐州 221009)
孕妇分娩前发生的胎膜的自发性破裂即胎膜早破(premature rupture of membranes, PROM),根据破膜时间可分为足月胎膜早破(time-premature rupture of fetal membranes, TPROM)和未足月胎膜早破(pre-premature rupture of fetal membranes,PPROM)[1]。PROM 发生的原因有很多,其中与感染有关的胎膜早破占60%以上[2]。病原体感染胎盘的绒毛膜羊膜导致的炎症性疾病即绒毛膜羊膜炎(chorioamnionitis, CA),是临床胎膜早破、早产及母儿围生期感染的重要病因,可分为组织学绒毛膜羊膜炎(his-tological chorioamnionitis, HCA)及临床绒毛膜羊膜炎,HCA 是一种发病隐匿的炎症,往往导致新生儿发病率和病死率的增加[3-4]。研究[5]表明未足月胎膜早破感染率明显高于足月胎膜早破,母婴结局明显较足月胎膜早破差。因此,寻找一个与炎症有关可用于预测组织学绒毛膜羊膜炎的指标尤为重要。
微小RNAs(miRNA)是一类新发现的非编码RNA,在人类基因组中占比甚少,但可调控多达60%的蛋白质基因编码[6],参与细胞生物学过程,调控炎症反应[7]。miRNA 可在多种标本(如血液 、汗液和尿液等)中被检测到,可抑制转录后基因的表达或靶向促进mRNA 的降解,已广泛应用于多种感染/炎症性疾病中[8]。在这些miRNA 中,miRNA-223(miR-223)在炎症过程中的作用尤为突出[9]。目前,miR-223-3p 在孕妇血清中的表达情况研究较少。本研究旨在探讨miR-223-3p 在PPROM孕妇血清中的表达水平,并分析其与炎症因子白细胞介素(IL)-1β、IL-6、IL-8、肿瘤坏死因子-α(TNF-α)的相关性,以明确miR-223-3p 在未足月胎膜早破发生发展中的作用。
1 资料与方法
1.1 一般资料 选取2023 年4~9 月徐州医科大学附属徐州妇幼保健院产科收治的无临床CA、行剖宫产术终止妊娠的孕妇60 例作为观察组,根据胎膜病理检查结果分为两组:未足月胎膜早破(PPROM)未合并HCA 组(PPROM 组,n= 37);PPROM 合并HCA 组(PPROM + HCA 组,n= 23),选取同期足月正常剖宫产孕妇31 例作为正常组。三组孕妇的年龄、孕次、产次比较,差异均无统计学意义(P> 0.05),PPROM+HCA组中性粒细胞计数(NEU)较PPROM 组及正常组显著升高(P< 0.05),见表1。排除标准:妊娠< 28 周或≥ 37 周;非单胎妊娠;有全身感染的临床征象;存在羊水过多、多胎妊娠等可能导致胎膜早破的机械性因素;患有妊娠合并症或并发症;随访资料不完整或中途退出。本研究经徐州医科大学附属徐州妇幼保健院医学伦理委员会讨论并同意,批准号:徐州市妇幼保健院[2023]伦审第(21)号。
表1 各组孕妇一般资料比较Tab.1 Comprision of general information of pregnant women in each group ±s
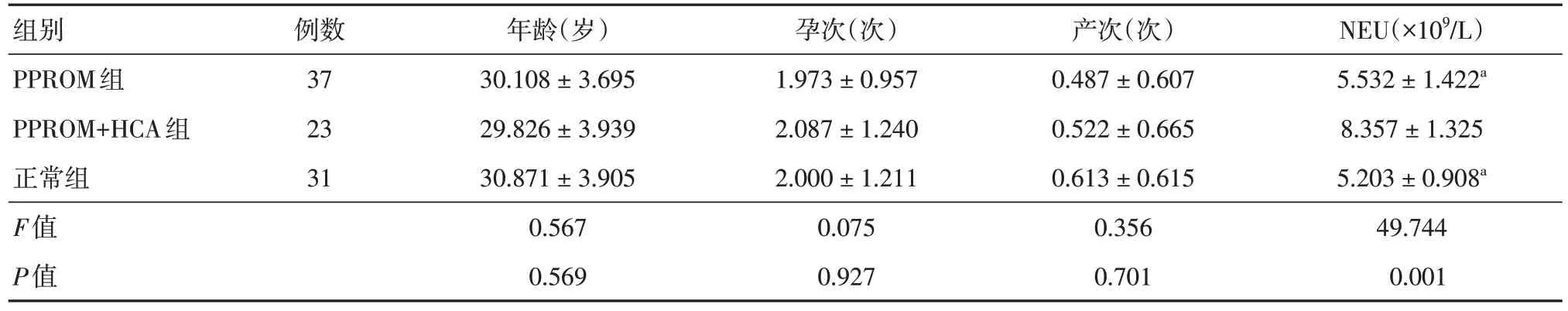
表1 各组孕妇一般资料比较Tab.1 Comprision of general information of pregnant women in each group ±s
注:与PPROM+HCA组相比,aP < 0.05
组别PPROM组PPROM+HCA组正常组F值P值例数37 23 31年龄(岁)30.108 ± 3.695 29.826 ± 3.939 30.871 ± 3.905 0.567 0.569孕次(次)1.973 ± 0.957 2.087 ± 1.240 2.000 ± 1.211 0.075 0.927产次(次)0.487 ± 0.607 0.522 ± 0.665 0.613 ± 0.615 0.356 0.701 NEU(×109/L)5.532 ± 1.422a 8.357 ± 1.325 5.203 ± 0.908a 49.744 0.001
1.2 诊断标准 PROM 的诊断标准参考第9 版《妇产科学》[10]。HCA 诊断标准参考《妇产科病理学》[11]。
1.3 方法
1.3.1 胎膜收集 在剖宫产术中胎盘娩出后取自胎膜破裂口处2.0 cm × 2.0 cm 大小胎膜,经DEPC水冲洗后放置-80 ℃冰箱保存,然后送病理检查,根据HCA 诊断标准将观察组分为两组。
1.3.2 酶联免疫吸附(ELISA)法检测血清中miR-223-3p 的表达水平 收集孕妇入院后治疗前肘静脉血5 mL,静置冰箱4 ℃过夜,然后12 000 r/min离心5 min,取上清液存放-80 ℃冰箱保存。通过酶联免疫吸附法测定血清中 IL-1β、IL-6、IL-8、TNF-α 等炎症因子表达水平,酶标仪在450 nm 波长下测定吸光度(OD值),根据标准曲线得出各样品对应浓度值。试剂盒均选择武汉新启迪生物科技有限公司产品。
1.3.3 实时荧光定量PCR 测定血清miR-223-3p的表达水平 采用Trizol 法处理血清样品,提取总RNA 逆转录为cDNA,进行聚合酶链式反应(PCR)扩增,目的基因miR-223-3p 的引物序列,上游:5′-ACACTCCAGCTGGGTGTCAGTTTGTCAAAT-3′,下游:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTGGGGTAT-3′,目的基因扩增40 个循环,以U6 作为内参对照,上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACGAATTTGCGT-3′,计算相对含量。最后通过2-ΔΔCT法计算各组表达水平的倍数差异。
1.4 统计学方法 使用SPSS 26.0软件进行数据分析,计量资料用均数±标准差表示。多个样本均数之间的比较采用方差分析,多重比较采用SNK-q检验;绘制受试者临床特征(ROC)曲线分析miR-223-3p 对PPROM 的诊断价值。miR-223-3p 与炎症因子之间的相关性分析用线性相关(Pearson 相关系数)表示。以P< 0.05为差异有统计学意义。
2 结果
2.1 各组受试者血清中miR-223-3p 水平的比较PPROM+HCA 组孕妇血清中miR-223-3p 含量较PPROM 组、正常组显著增加(P< 0.05),PPROM 组与正常组相比差异无统计学意义(P> 0.05),见表2。
表2 3 组孕妇血清中miR-223-3p 的表达量Tab.2 Expression levels of miR-223-3p in serum of three groups of pregnant women ±s

表2 3 组孕妇血清中miR-223-3p 的表达量Tab.2 Expression levels of miR-223-3p in serum of three groups of pregnant women ±s
注:与PPROM+HCA组相比,#P < 0.05
组别PPROM组PPROM+HCA组正常组F值P值例数37 23 31 miR-223-3p 0.372 ± 0.114#1.002 ± 0.341 0.277 ± 0.121#100.724 0.001
2.2 血清miR-223-3p 水平对PPROM 疾病的诊断价值 ROC 结果显示,miR-223-3p 对PROM 疾病诊断的AUC为0.823(95%CI:0.739 ~ 0.907,P< 0.05),miR-223-3p ≥ 0.325 诊断PROM 疾病的敏感度为80%,特异度为71%,见图1。
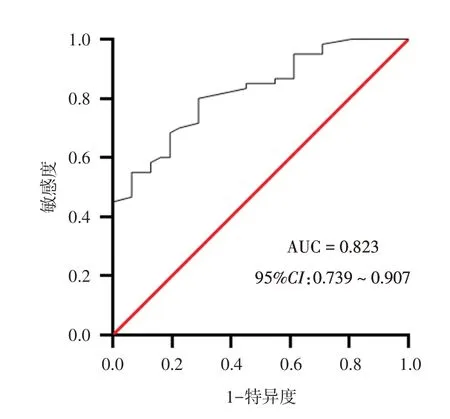
图1 孕妇血清中miR-223-3p 水平诊断PPROM 疾病的ROC 曲线Fig.1 The ROC curve of serum miR-223-3p levels in pregnant women with PPROM disease
2.3 各组受试者血清炎症因子比较 PPROM +HCA 组孕妇血清中IL-6、IL-8、IL-1β、TNF-α 表达水平较PPROM 组、正常组显著增加(P< 0.05),与正常组比较,PPROM 组孕妇血清中IL-6、IL-8、IL-1β、TNF-α 表达水平显著增加(P< 0.05),见表3。
表3 3 组孕妇血清中IL-6、IL-8、IL-1β、TNF-α 的表达水平比较Tab.3 Comparison of the expression levels of IL-6, IL-8, IL-1β, and TNF-α in the serum of three groups of pregnant women ±s

表3 3 组孕妇血清中IL-6、IL-8、IL-1β、TNF-α 的表达水平比较Tab.3 Comparison of the expression levels of IL-6, IL-8, IL-1β, and TNF-α in the serum of three groups of pregnant women ±s
注:与PPROM组、正常组相比,*P < 0.05;与正常组相比,#P < 0.05
组别PPROM组PPROM+HCA组正常组F值P值例数37 23 31 IL-6 203.486 ± 18.746#224.121 ± 23.825*96.304 ± 17.634 353.329 0.001 IL-8 136.453 ± 12.000#147.743 ± 16.746*61.289 ± 11.100 383.094 0.001 IL-1β 93.756 ± 10.149#107.726 ± 8.174*43.310 ± 6.836 444.129 0.001 TNF-α 95.773 ± 10.324#107.387 ± 12.225*48.814 ± 13.122 200.247 0.001
2.4 PPROM+HCA 组孕妇血清miR-223-3p 水平与炎症因子水平的相关性 PPROM + HCA 组孕妇血清miR-223-3p 与炎症因子IL-6、IL-8、IL-1β、TNF-α 表达水平呈正相关,差异有统计学意义(P< 0.05),见表4。

表4 PPROM+HCA 组孕妇血清中miR-223-3p 与炎症因子水平的相关性分析Tab.4 Analysis of the Correlation between miR-223-3p and inflammatory factor levels in the serum of PPROM +HCA group
3 讨论
胎膜早破极易引起胎儿窒息、窘迫、早产以及难产等,影响母婴结局,具有发病率高及病情危害大的特征。胎膜早破和感染之间互为因果,一方面,胎膜早破可能是宫内感染的一种表现形式;另一方面,胎膜早破为病原菌入侵提供了机会从而造成宫内感染[12-13]。miR-223 最先在造血系统中被发现与细胞增殖分化有关,序列非常保守[14]。miR-223 的生物学靶标包括胰岛素样生长因子-1受体(IGF-1R),单核细胞增强因子2C,stathmin1和FOXOIA等[15-16],证明miR-223可参与调节机体免疫反应及多种炎症过程[17]。近年来,其在妊娠相关疾病中的作用越来越被人们关注[18]。miR-223由miR-223-3p 和miR-223-5p 组成,可调节下游促炎细胞因子如IL-6 和IL-1β 等的表达,进一步促进相关疾病的发生、发展[19]。
本研究发现,PPROM+HCA 组血清miR-223-3p表达水平显著高于PPROM 组及正常组,PPROM组miR-223-3p 的表达水平稍高于正常组,但差异无统计学意义,这表明miR-223-3p 在未足月胎膜早破孕妇中呈上调趋势,当炎症反应越明显时,其表达水平越高。ROC 曲线分析发现,血清miR-223-3p 对PROM 疾病诊断的AUC 为0.823,表明检测血清miR-223-3p 水平可有效区分PPROM 孕妇和正常妊娠孕妇,miR-223-3p 在PPROM 合并HCA的发生发展中具有重要作用,可能成为预防胎膜早破的新的治疗靶点。
急性绒毛膜羊膜炎的存在是母体和胎儿对妊娠囊内细菌感染的急性炎症反应[20-21]。研究[22]表明,孕期绒毛膜羊膜炎的发生风险和母婴不良结局的危险性与血清炎症细胞因子水平有关。临床上常用中性粒细胞计数、IL-6 等炎症性指标对HCA 进行预测[23]。孙广等[24]研究证明在miR-223在类风湿关节炎(RA)患者血清外泌体中显著升高,且与RA 患者血清TNF-α、IL-6、IL-17、IL-1β 水平呈正相关。
IL-6 可增强中性粒细胞和巨噬细胞的吞噬和杀伤能力[25]。IL-1β 可增强黏膜屏障功能,从而发挥抗感染作用[26]。既往研究[27]表明miR-223可从中性粒细胞转移至肺上皮细胞从而抑制急性肺损伤。本研究发现NEU 水平、炎症因子及miR-223-3p 表达水平在PPROM+HCA 组中均高于PPROM 组及正常组,且在PPROM+HCA 组中,miR-223-3p 与炎症因子呈正相关,表明miR-223-3p 是一个与炎症相关的miRNA,其参与炎症反应的机制可能与中性粒细胞有关。
本研究只研究了miR-223-3p 在PPROM 中的表达情况,还需探究在TPROM 组及合并HCA 的TPROM 组和PPROM 组之间的炎症机制是否相同。未来可以在扩大样本量的基础上,利用动物模型进行体内试验,进一步说明miR-223-3p 在预测羊膜腔感染的作用。既往研究[28]表明,miR-223通过调控RHOB 蛋白表达可能对TLR4/NF-κB 通路激活产生影响,从而改善肺部损伤。未来可从miR-223-3p 的机制通路进行研究,寻找miR-223-3p 的拮抗剂,从而减少炎症反应,降低胎膜早破的发生。
综上所述,miR-223-3p 参与了未足月胎膜早破发生,miR-223-3p ≥ 0.325 可作为PPROM 的早期预测指标,对预防未足月胎膜早破的发生具有重要的指导意义。
【Author contributions】HU Yuying performed the experiments,wrote the article and collected specimens. ZHU Jinming instructed the experiments and the paper writing. LIU Jie and FENG Jinqiu revised the article. PAN Yawen and ZHANG Qian collected the specimens.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
