赤拟谷盗与杂拟谷盗侵染对小麦粉挥发性物质的GC-IMS分析
2024-05-18张宇张莉睿贺艳萍戴煌张威舒在习毕洁
张宇,张莉睿,贺艳萍,戴煌,张威,舒在习,毕洁
赤拟谷盗与杂拟谷盗侵染对小麦粉挥发性物质的GC-IMS分析
张宇,张莉睿,贺艳萍,戴煌,张威,舒在习,毕洁*
(武汉轻工大学 食品科学与工程学院,武汉 430023)
本研究旨在探究赤拟谷盗()与杂拟谷盗()侵染对小麦粉中挥发性物质的种类、含量和成分的影响。采用气相色谱-离子迁移谱技术(Gas Chromatography-Ion Mobility Spectrometry,GC-IMS),对正常小麦粉、受赤拟谷盗与杂拟谷盗侵染的小麦粉进行定性定量测定。在3种小麦粉中共检测到了50个峰,鉴定出了41种挥发性物质。赤拟谷盗侵染后,小麦粉中含有高浓度的己醛、2-乙基己醇、壬醛、2,6-双甲基吡啶、()-2-庚烯醛、1-辛烯-3-酮、二甲基三硫化合物、庚醛、糠醛。而杂拟谷侵染后小麦粉中则含有高浓度的1-戊烯-3-醇、己醇、2-庚酮、戊醇、3-甲基丁醇。与对照组相比,受两试虫侵染后,小麦粉中的醛类与醇类含量显著增加。通过对小麦粉中挥发性物质的分析,并结合气相色谱-离子迁移谱、指纹图谱和主成分分析揭示了正常小麦粉与经过赤拟谷盗与杂拟谷盗侵染的小麦粉中挥发性成分的差异,该研究结果为预测小麦粉储存过程中早期害虫发生提供了参考依据。
赤拟谷盗;杂拟谷盗;小麦粉;挥发性成分;气相色谱-离子迁移谱(GC-IMS)
小麦在储藏期间易受到虫害的污染,造成品质劣变。经相关调查结果显示,全国每年因储粮害虫的影响而导致粮食损失大约为总产量的5%[1]。赤拟谷盗与杂拟谷盗经常出现在小麦和稻谷的储藏和加工场所,它们的幼虫会取食并破坏粮粒,幼虫长大后爬到小麦粉表面形成蛹[2]。目前,它们是世界范围内侵染储粮最严重的害虫,以储粮为食,不受天气的影响,并且这些害虫能在相当长的时间内持续存活[3]。在有利的生长条件下,赤拟谷盗与杂拟谷盗的繁殖速率非常快,且对粮食的危害极大,不仅会使粮食品质下降,并且还容易滋生病菌、螨等有害物质[4]。此外,赤拟谷盗与杂拟谷的排泄物、尸体等长时间积累存在粮食中,会不断对粮食造成污染,并散发出恶臭,严重影响人们的消费欲望。因此,在贮藏期间,及时检测出害虫,对降低贮藏期间品质与产量的损失具有重要意义[5-6]。由于农药的长期使用,导致储粮害虫对其有了一定的抗性,致使很多地方的粮库都无法进行磷化氢熏蒸。仓储行业通常在粮食入库和储藏环节采用人工过筛、探针诱捕和形态学观察等方法进行害虫检测和筛查[7]。但在实际应用中,这种方法的效果尚未达到预期水平。因此,寻找准确、快速且无损的储粮害虫检测技术具有重要意义,可以帮助控制储粮品质和保障安全生产。目前,基于虫害和谷物特有气味的快速检测技术受到越来越多的关注,这些技术可用于早期发现害虫的存在、确定储藏年限以及鉴别粮食品种等方面的应用。
当前,被害虫侵染小麦粉中特征性挥发物检测主要采用现代分析仪器,如气相色谱、气相色谱-质谱联用、电子鼻、顶空固相微萃取气相色谱质谱联用等[8]。韩少云等[9]采用顶空固相微萃取气相色谱质谱(Headspace Solid Phase Microextraction Gas Chromatography Mass Spectrometry,HS-SPME-GC-MS)试验来获取赤拟谷盗的主要特定挥发性有机化合物,从饲养过赤拟谷盗的小麦粉中检测出主要挥发物质为1-十五烯、2-甲基对苯醌和2-乙基对苯醌,其结果与大部分学者研究结果一致。吕建华等[10]采用顶空固相微萃取结合气质联用技术研究发现,初始虫密度相同的赤拟谷盗成虫侵染小麦粉后的挥发物主要包括烃类、醇类、醛类及酸类等物质。此外,侵染后小麦粉中挥发物的总含量与时间正比,随时间的延长挥发物总含量逐渐递增。高富强[11]将小麦粉挥发性物质经气相色谱和质谱联用仪(Gas Chromatograph-Mass Spectrometer,GC-MS)经过分离和鉴定实验后,发现在特定的温度和湿度条件下,判断小麦粉被赤拟谷盗侵染,可关注是否含有正己醇、苯甲醛及2-正戊基呋喃3种挥发性物质。研究者普遍采用顶空固相微萃取(HS-SPME)结合气相色谱-质谱技术(GC-MS)检测谷物和粮虫的挥发性有机化合物[12-14]。气相色谱离子迁移谱(Gas Chromatography-Ion Mobility Spectrometry,GC-IMS)技术能在较短的时间内迅速地获得样品的香气特性及特定的组分。该方法具有灵敏度高、稳定性好、速度快、操作简便,不需要对样品进行前处理,还能进行微量检测[15-16]。近几年,学者们大多是对赤拟谷盗侵染小麦粉后的特征性挥发物进行探究,关于杂拟谷盗侵染后其特征性挥发物报道甚少[17-18]。
本研究采用GC-IMS技术探讨赤拟谷盗与杂拟谷盗的侵染对小麦粉中挥发性物质的种类、成分和含量的影响。通过比较小麦粉在赤拟谷盗与杂拟谷盗侵害后产生的特征性挥发物的差异,为小麦粉储藏过程中害虫的早期发生提供了参考。
1 材料与方法
1.1 试虫培养
实验所用赤拟谷盗和杂拟谷盗,于武汉轻工大学食品科学与工程学院储藏物害虫培养室中饲养。将赤拟谷盗与杂拟谷盗成虫分别置于装有新鲜小麦粉的2 L广口玻璃瓶中,瓶口贴9 mm滤纸密封。整个饲养过程保持在(28±1)℃和(70±5)%的相对湿度中。取人工饲喂2代以上且羽化2周龄内的成虫供实验所用。
1.2 实验材料
主要材料:选用新收获的健康小麦,除杂、洗净后干燥至含水率(10±0.5)%,经粉碎机加工成全麦面粉,过100目谷物分离筛,置于−20 ℃冷冻柜中保存备用;使用全麦面粉加酵母粉(质量比19∶1)作饲料。
A组:对照组,即未经任何处理的正常小麦粉。B组:赤拟谷盗成虫侵染的小麦粉,即取500 g饲料装入2 L的广口瓶中,并投入羽化2周龄的赤拟谷盗成虫,瓶口贴9 mm滤纸密封,置于温度为(28±1)℃,相对湿度为(70±5)%条件下培养30 d后清除所有试虫并过筛后的小麦粉。C组:杂拟谷盗侵染的小麦粉处理方式同B组。
1.3 仪器与设备
主要仪器与设备:FlavourSpec®气相离子迁移谱,德国G.A.S.公司;CTC-PAL 3静态顶空自动进样装置,瑞士CTC Analytics AG公司;VOCal 数据处理软件(0.4.03),德国G.A.S.公司。
1.4 GC-IMS分析
将3 g小麦粉置于20 mL顶空进样瓶中,80 ℃条件下在搅拌器中孵化,时间15 min后进样500 µL。
分析条件:色谱柱类型WAX (30 m×0.53 mm× 1 μm);柱温为60 ℃;载气高纯氮(纯度≥99.999 %);分析时间为30 min;IMS温度为45 ℃。
自动顶空进样,进样体积为500 µL,孵化时间为15 min,温度为80 ℃,进样针温度为85 ℃,孵化转速为500 r/min。气相色谱条件见表1。
表1 气相色谱条件
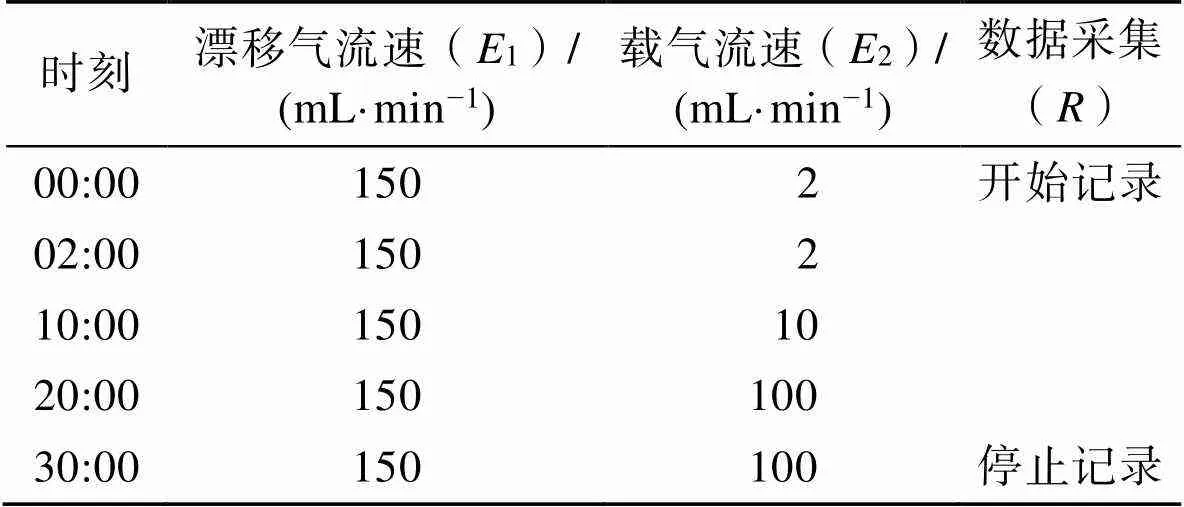
Tab.1 Gas chromatographic conditions
1.5 数据处理
利用VOCal软件构建的GC保留率(NIST2020)数据库,结合IMS迁移时间数据库,对候选化合物进行定性分析,并通过Reporter、Gallery Plot和Dynamic PCA等插件,生成挥发性成分的三维谱图、二维谱图、差异谱图、指纹图谱及PCA图,用于样品间挥发性有机物的对比分析。
2 结果与分析
2.1 经3种不同处理的小麦粉GC-IMS图谱分析
采用GC-IMS分析方法对正常小麦粉、赤拟谷盗与杂拟谷盗侵染的小麦粉中的挥发性物质进行检测分析,结果见图1和图2。图1中,横坐标为离子漂移时间,纵坐标为气相色谱的保留时间;峰高表示气体分子从气相到液相所发生的位移量。浓度高的挥发性物质在气相色谱图上会形成峰,峰的高度可以反映其浓度的强度。在峰的两侧,每个点则代表着一个特定的物质,这些物质可以通过质谱仪进行鉴定和定量分析。通过测量垂直线的高度和分析峰两侧的点,可以了解到样品中不同物质的存在和浓度情况。小麦粉中每一种挥发性物质的相对含量可以通过峰的颜色来展示,颜色的深浅与挥发性物质的相对含量成正比。
图2为图1的二维俯视图;从图2中能够直观地观察到3组小麦粉样品的挥发性物质含量的差异,依图2中红色框所示。依图2中黄色框所示,同种物质的相对含量也呈现出明显区别。
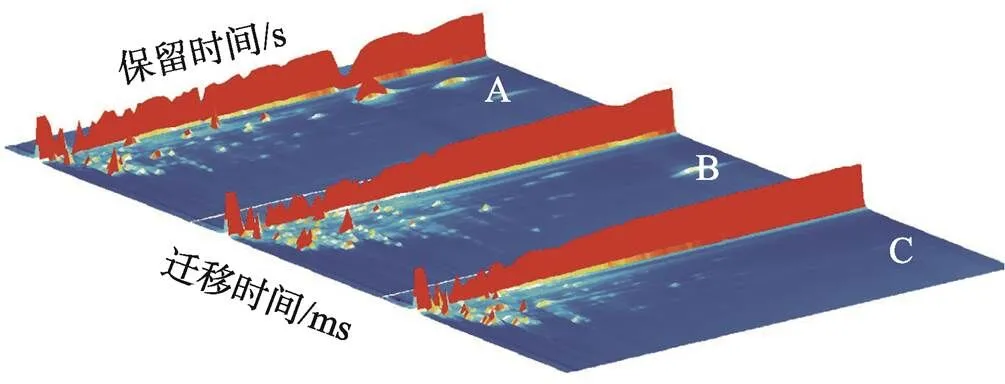
图1 3组小麦粉样品的挥发性物质三维谱图
注:A为正常小麦粉,B为赤拟谷盗侵染的小麦粉, C为杂拟谷盗侵染的小麦粉。
2.2 赤拟谷盗与杂拟谷盗侵染后的小麦粉中挥发性成分差异分析
由于各个样品中特有的挥发性化合物保留时间与迁移时间不同,从中获得各种挥发性化合物保留指数。通过与数据库进行对比,而后对挥发性物质进行定性研究。在某些单一化合物中发现了因浓度不同而生成多种二聚体信号的现象。采用峰面积归一法,将3种小麦粉样中的挥发性成分进行了定量,并用离子峰面积作为参照,求出了各组分的相对含量平均值。
如图3所示,从样品中共检测到50种挥发性成分,其中9种尚未定性。这些已定性的41种化合物详细列于表2中,包括14种醛类、11种醇类、5种酮类、3种杂环类、2种酯类、2种酸类、2种酚类以及2种其他化合物。
2.3 赤拟谷盗与杂拟谷盗侵染后小麦粉中挥发性成分指纹图谱分析
为直观对比样品间挥发性化合物的差别,对3组小麦粉样品挥发性化合物指纹图谱进行分析。依图4所示,横轴为检测出特征性挥发性成分的名称,而数字代表尚未定性的挥成分。纵轴表示小麦粉样品,每一行对应一个样品的指纹图谱,每个样品均进行了3次独立的测定。图4中每个圆点的颜色深浅和面积大小,反映了该物质相对含量的多少[19]。
从3组小麦粉样品中共检测出50种挥发性物质,除9种未能定性外,共鉴定出41种挥发性物质。图4中红色框中,苯甲醛、辛内酯、苯甲酸、丁二酸二乙酯、苯乙醛、间甲酚、3-甲基丁醛、2-甲基丁醛、2-丁酮、2-甲基丁酸、麦芽酚、二氢-5-丙基-2-(3H)-呋喃酮、2-乙基-己醇及其未定性成分1、2、4、5在正常小麦粉中表现出最强的信号强度;在黄色区域中,己醛、2-乙基己醇、壬醛、2,6-双甲基吡啶、(Z)-2-庚烯醛、1-辛烯-3-酮、二甲基三硫化合物、庚醛、糠醛在赤拟谷盗侵染的小麦粉中含量较高。绿色框代表1-戊烯-3-醇、己醇、2-庚酮、戊醇、3-甲基丁醇在杂拟谷盗侵染的小麦粉样品中含量较高。从指纹图谱可以看出,3组小麦粉样品中的挥发性特征化合物可以根据信号差异准确识别。
在赤拟谷盗与杂拟谷盗侵染的小麦粉中,一些脂类化合物显著降低,如:辛内酯、苯甲酸、丁二酸二乙酯、间甲酚(图4粉色区域)。研究表明[20-21],挥发物在仓储昆虫及微生物生长过程中存在着某种联系,其主要来源为不饱和脂肪酸被氧化。在图4中可以明显看出赤拟谷盗与杂拟谷盗侵染的小麦粉中醇类与醛类含量显著增加。分析是由于赤拟谷盗与杂拟谷盗侵染的小麦粉中发生了脂类变化,造成脂类化合物的减少,醇类与醛类含量的增加。

图2 3组小麦粉样品的挥发性物质二维谱图
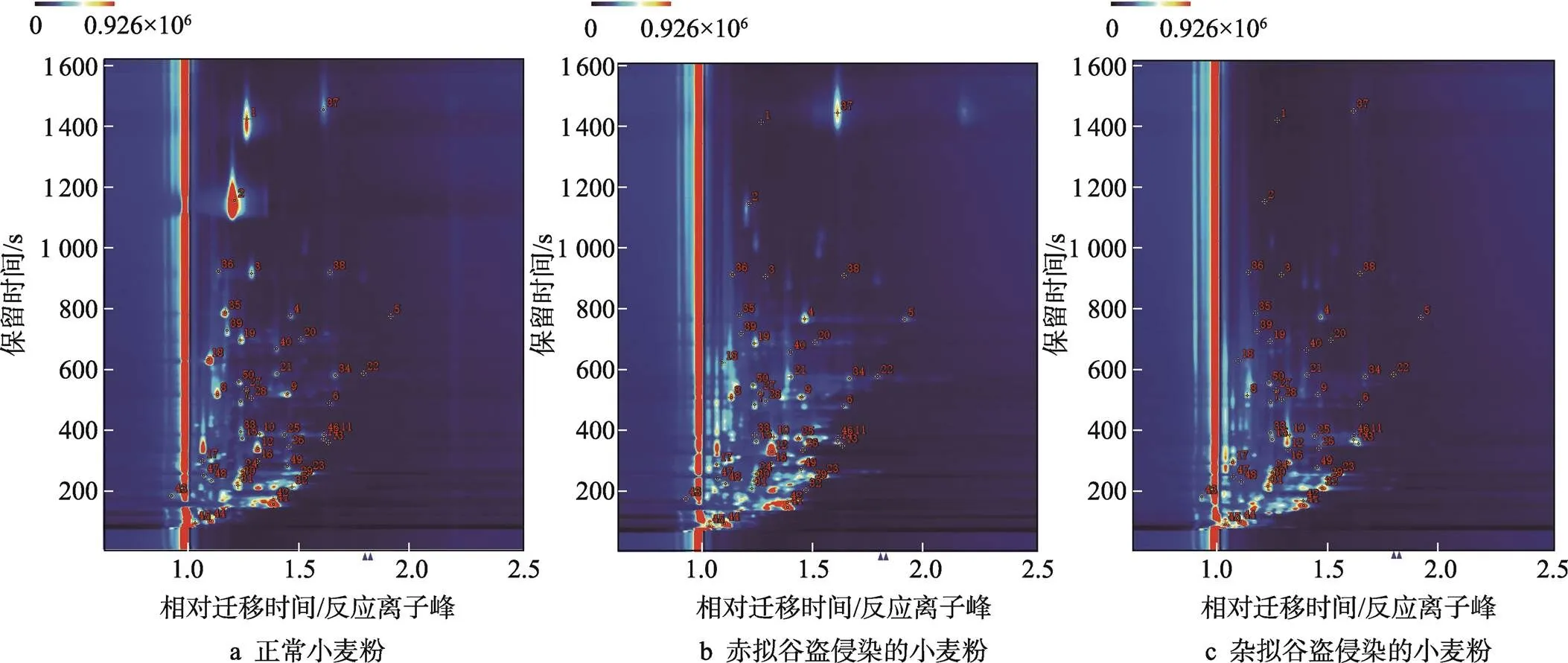
图3 3组小麦粉样品的挥发性成分定性
表2 经3种不同处理小麦粉挥发性物质的GC-IMS定性化合物列表(与上图3中序号对应)
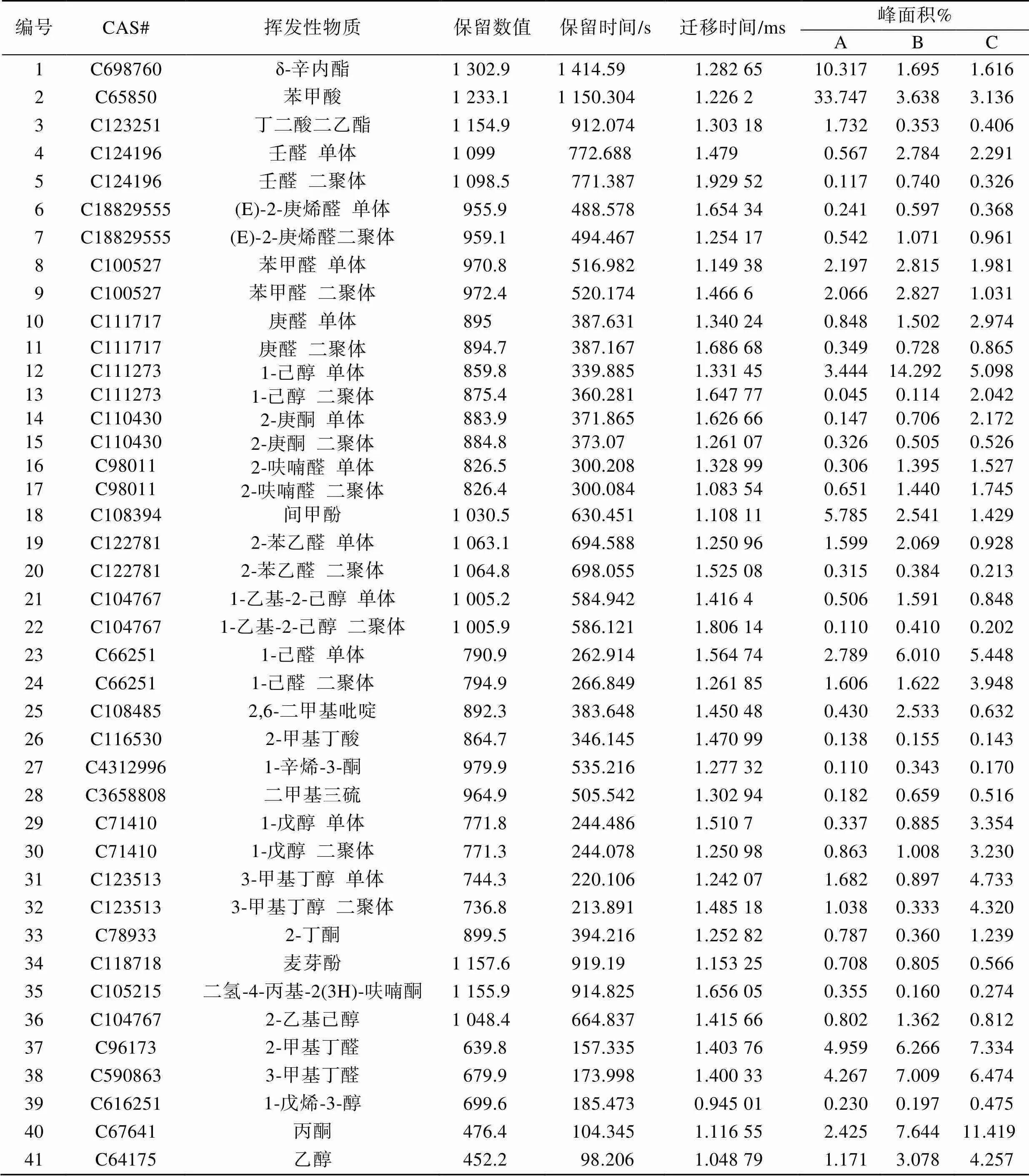
Tab.2 List of GC-IMS qualitative compounds of volatile substances in wheat flour treated with three different treatments (corresponding to the serial number in Fig.3 above )
2.4 赤拟谷盗与杂拟谷盗侵染后的小麦粉中特征挥发性物质PCA分析
主成分分析(PCA)是评估主成分因子对样本的贡献程度的一种数学统计学方法,旨在揭示样本之间的规律性和差异性,从而更直观地展示样本间的差异[22]。图5展示了对3组样品进行的PCA分析结果,包括主成分特征值和相应的贡献率。图中显示PC_1的贡献率为49.9%,PC_2的贡献率为43.5%,PC_3的贡献率为3.9%。三者的总和为97.3%(高于85%),这可以很好地反映3组样品的绝大部分信息。根据得分点的聚合程度来观察,可以看出杂拟谷盗组得分点最为分散,组内差异明显。而赤拟谷盗的挥发物得分点则更为紧凑,数据之间的拟合性较高。3组样品的得分点之间互不交叉重叠,表明挥发物成分在组间具有明显的差异。
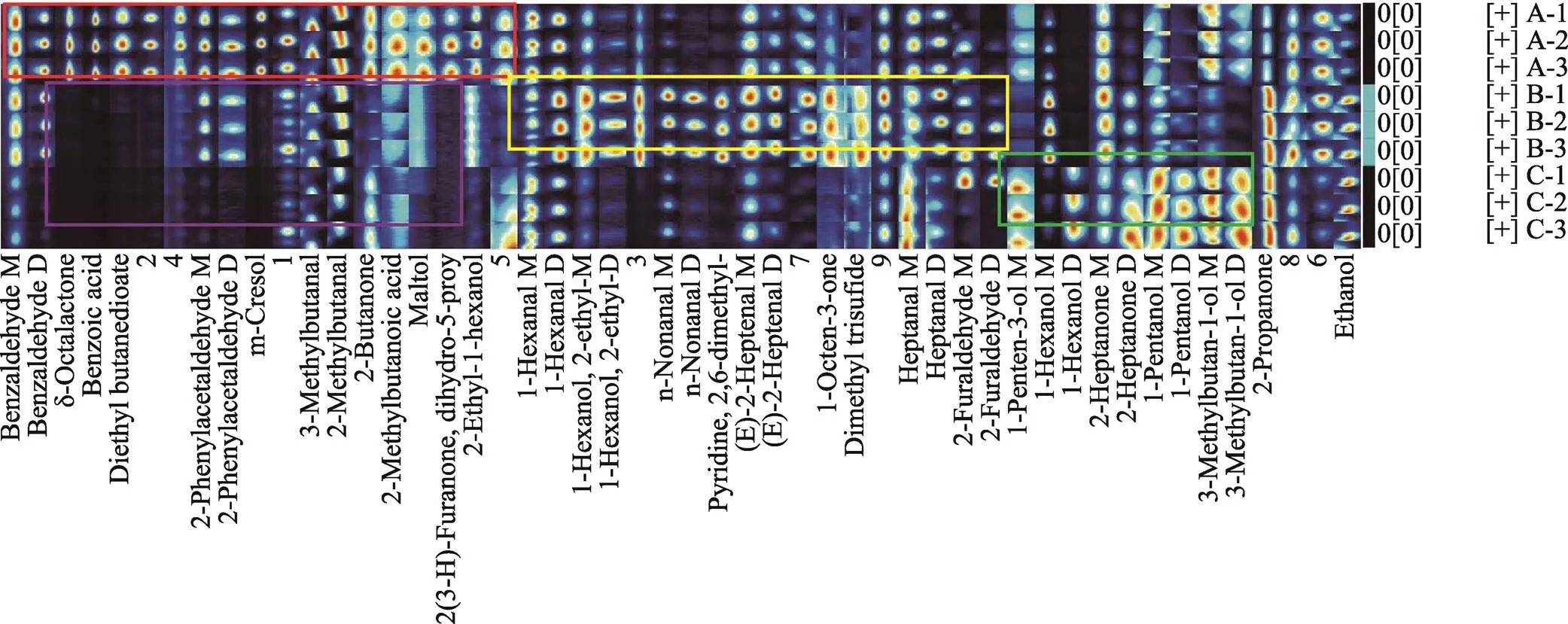
图4 3组小麦粉样品中挥发性成分的指纹图谱
注:A为正常小麦粉,B为赤拟谷盗侵染的小麦粉,C为杂拟谷盗侵染的小麦粉。

图5 3组小麦粉样品中挥发性成分的PCA得分图
3 讨论
赤拟谷盗与杂拟谷盗是小麦粉中常见的害虫,侵染小麦粉后会产生一些特殊的挥发性物质,从而导致小麦粉的品质下降。这些挥发性物质主要划分为2个类别,第1类是只能在被侵染后的小麦粉中产生并检测到的新物质[23]。它们可能是由虫口分泌物、虫粪、虫卵等害虫活动产生的代谢产物所致。这些新物质的出现可以作为判断小麦粉是否受到赤拟谷盗或杂拟谷盗侵染的指标[24]。第2类是受害虫侵染后挥发性物质的规律性变化。这些物质在感染前后出现数量或比例上的变化,可能与害虫的代谢过程有关。通过监测这些规律性变化的物质,可以追踪和监测赤拟谷盗或杂拟谷盗的存在和活动程度[25-26]。本文以正常小麦粉、赤拟谷盗与杂拟谷盗侵染的小麦粉作为研究对象,通过GC-IMS技术来比较3组小麦粉的挥发性成分差异。在此基础上,建立了3种小麦粉样品中的主要特征性挥发物质的指纹图谱。研究结果表明,总共检测到了50种化合物,其中包括41种已定性的化合物。这些化合物涵盖了14种醛类、11种醇类、5种酮类、3种杂环类、2种酯类、2种酸类、2种酚类以及其他2种化合物。Zhang等[27]采用GC-IMS技术检测不同处理下绿麦中的挥发性物质,发现检测出最多的化合物类别是醇类、醛类及酮类,在样品中发现了1-辛烯-3-醇、2-丙醇、1-戊醇、2-庚酮等物质,与本实验结果一致。张玉荣等[28]研究发现,小麦样品经米象、玉米象和谷蠹的侵害时,会释放出一些挥发性成分;成分主要包括醇类、醛类、酮类和酯类化合物,与本文研究结果相似。此外,在遭受赤拟谷盗与杂拟谷盗侵染的小麦粉中,一些挥发性物质的含量经历了显著的变化,主要体现为酯类物质的降低,同时醛类与醇类物质显著增加。有学者研究表明,酮类物质含量显著增加与脂质物质的氧化过程密切相关[29]。据报道,小麦粉中挥发物主要由脂类的氧化和水解产生[30],脂质经历水解反应时,脂肪酸的含量会显著上升,同时醛类物质与同类物质含量也会显著升高。
采用降维数学统计方法建立了3组小麦粉样品中挥发性成分的特征指纹图谱,并对数据进行PCA分析。结果表明,前3个主成分的贡献率总和达到97.3%,综合分析发现醛类、醇类、酮类化合物是赤拟谷盗与杂拟谷盗侵染的小麦粉中主要的挥发性物质。
本研究分别取用赤拟谷盗、杂拟谷盗侵染30 d后的小麦粉,共检测到50种挥发性成分,其中定性的化合物有41种,主要包括醛类、醇类、酮类、杂环类、酯类、酸类等。有学者研究表明[23],赤拟谷盗成虫在对小麦侵染初期,会释放出烃类、醇类、醛类、酸类、酯类以及其他物质的挥发性物质。在侵染20 d后,才会出现少量酮类物质,与本研究结果相似。Niu等[31]研究发现赤拟谷盗与杂拟谷盗侵染小麦粉1 d后,2-乙基-2,5-环己二烯-1,4-二酮可作为标志性化合物,判定小麦粉是否被侵染。韩少云等[9]利用电子鼻技术,研究不同密度赤拟谷盗侵染新鲜小麦粉后的挥发性物质,通过PLSR分析结果表明,当赤拟谷盗数量在5~50只时呈现了较好的线性关系,即能检测出面粉已被赤拟谷盗侵染。由此看来,不论侵染时间长短,在被侵染的小麦粉中都能检测出特征性挥发物,而挥发物的种类会随时间的增加而增加。
4 结语
本文仅对正常小麦粉、赤拟谷盗及杂拟谷盗侵染的小麦粉中特征挥发性成分的变化情况进行了探究,找到了储藏小麦粉被赤拟谷盗与杂拟谷盗侵染的差异挥发性物质。除此之外,目前在杂拟谷盗侵染的小麦粉在挥发性物质方面的研究较少,还需了解储粮害虫的行为特征和适应能力,以便制定更有效的防控措施。同时,利用新兴的绿色技术方法来控制储粮害虫,以减少对农作物和粮食储藏期的损害,保障粮食安全。
[1] 张生芳, 周玉香. 拟谷盗属重要种的分布、寄主及鉴别[J]. 植物检疫, 2002, 16(6): 349-351.
ZHANG S F, ZHOU Y X. Distribution, Hosts and Identification of Important Species of the Genus Crotalaria[J]. Plant Quarantine, 2002, 16(6): 349-351.
[2] 郝佳容, 黎天天, 陈鑫, 等. 锈赤扁谷盗侵染后小麦自身挥发性化合物动态变化研究[J]. 中国粮油学报, 2021, 36(7): 129-137.
HAO J R, LI T T, CHEN X, et al. Dynamic Changes of Volatile Compounds in Wheat After Being Infected by the Rusty Grain Beetle[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(7): 129-137.
[3] THINZAR A, RAM B K, SUNGMI K, et al. Comparative Volatiles Amino Acids, and Phenolic Compounds and Characteristics of Roasted Germinated Wheat (L.) During Beverage Preparation[J]. LWT, 2023(173): 114412.
[4] NEGI A, PARE A, MANICKAM L, et al. Effects of Defect Action Level of(Herbst) (Coleoptera: Tenebrionidae) Fragments on Quality of Wheat Flour[J].Journal of the Science of Food and Agriculture, 2022, 102(1): 223-232.
[5] VILLAVERDE M L, JUAREZ M P, MIJAILOBSKY S. Detection of(Herbst) Volatile Defensive Secretions by Solid Phase Microextraction- Capillary Gas Chromatography (SPME-CGC)[J]. Journal Of Stored Products Research, 2007, 43(4): 540-545.
[6] SAMIR T, FOUZIA D T, AYA D, et al. Insecticidal Efficacy and Physiological Effects of Eucalyptus Globulus Essential Oil and Its Constituent, 1,8-Cineole Against(Jacquelin du Val, 1868) (Coleoptera, Tenebrionidae)[J]. J Plant Dis Prot, 2023, 130(4): 769-780.
[7] ASLAM M F A, SULTANA S, DAS R S, et alDNA Barcoding to Resolve the Confusion in Identifyingand[J]. Bangladesh Journal of Zoology, 2019, 47(2): 333-342.
[8] 陆赛丽, 李慧. 小麦感染赤拟谷盗后的气味物质差异性及测定方法设计研究[J]. 质量安全与检验检测, 2020(4): 120-124.
LU S L, LI H. Study on the Differences of Odor Substances in Wheat Infected with Red Pseudomonas and the Design of Measurement Methods[J]. Quality Safety Inspection and Testing, 2020(4): 120-124.
[9] 韩少云, 董晓光, 熊黎剑, 等. 基于GC-MS和电子鼻的面粉中粮虫快速检测方法[J]. 农业机械学报, 2023, 54(S1): 358-365.
HAN S Y, DONG X G, XIONG L J. Rapid Detection of Stored Grain Pests in Flour Based on GC-MS and E-Nose[J]. Transactions of the Chinese Society for Agricultural Machinery, 2023, 54(S1): 358-365.
[10] 吕建华, 黄宗文, 许俊亚. 赤拟谷盗成虫为害对小麦挥发性物质的影响[J]. 河南工业学学学报(自然科学版), 2022, 43(4): 106-111.
LYU J H, HUANG Z W, XU J Y. Effect ofAdults Infestation on Volatile Compounds from Stored Wheat[J]. Journal of Henan University of Technology (Natural Science Edition), 2022, 43(4): 106-111.
[11] 高富强. 小麦粉中赤拟谷盗生态学特性与防治技术研究[D]. 镇江: 江苏大学, 2022.
GAO F Q. Study on Ecological Characteristics and Control Techniques of Tribolium Castaneum in Wheat Flour[D]. Zhenjiang: Jiangsu University, 2022.
[12] LYNDA K, SYLVIA A, DIMITRI B, et al. Fumigant Toxicity of Some Essential Oils and Eucalyptol on Different Life Stages of(Coleoptera: Tenebrionidae)[J]. Bot Lett, 2023, 170(1): 3-14.
[13] GALECKI R, BAKULA T, WOJTACKI M, et alSusceptibility of Ancient Wheat Species to Storage Pestsand[J]. Journal of Stored Products Research, 2019, 83: 117-122.
[14] 赵莹, 任芳, 李振华, 等. 利用气相离子迁移谱对小麦与小麦粉挥发性物质研究[J]. 粮油食品科技, 2020, 28(4): 145-151.
ZHAO Y, REN F, LI Z H, et al. Study on the Volatile Matter of Wheat and Wheat Flour Using GC-IMS[J]. Sci Technol Cereals Oils Foods, 2020, 28(4): 145-151.
[15] 张蓝月. 小麦储藏期间指标、气味成分及谷蠹培养气味成分变化的研究[D]. 南京: 南京财经大学, 2016.
ZHANG L Y. Study on the Changes of Indexes, Odor Components and Odor Components of Rhizopertha Dominica during Storage[D]. Nanjing: Nanjing University of Finance & Economics, 2016.
[16] XU J T, ZHANG W B, ADHIKARI K, et al. Determination of Volatile Compounds in Heat-Treated Straight-Grade Flours from Normal and Waxy Wheats [J]. Journal of Cereal Science, 2017, 75(2): 77-83.
[17] JULIUSZ P, MARIAN W, MACIEJ B et al. Fusarium Toxins and Total Fungal Biomass Indicators in Naturally Contaminated Wheat Samples from North-Eastern Poland in 2003[J]. Food Additives and Contaminants, 2007, 24(11): 1292-1298.
[18] 严松, 林颢. 基于嗅觉可视化技术和气相色谱-质谱联用鉴别霉变小麦[J]. 食品科学, 2019, 40(2): 275-280.
YAN S, LIN H. GC-MS of Volatile Organic Compounds for Identification of Moldy Wheat Based on Olfactory Visualization[J]. Food Science, 2019, 40(2): 275-280.
[19] 杨松, 郭家刚, 伍玉菡, 等. 基于气相离子迁移谱技术分析太和香椿的挥发性成分[J]. 食品与发酵工业, 2022, 48(14): 272-277.
YANG S, GUO J G, WU Y H, et al. Analysis of Volatile Compounds of TaiheBased on Gas Chromatography-Ion Mobility Spectroscopy[J]. Food and Fermentation Industries, 2022, 48(14): 272-277.
[20] BUTTER R G, XU C J, LING L C. Volatile Components of Wheat Leaves and Stem: Possible Insect Attractants[J]. Journal Of Agricultural And Food Chemistry, 1985, 33(1): 115-117.
[21] 付强, 鞠兴荣, 高瑀珑, 等. 不同储藏条件下小麦粉挥发物与理化指标相关性分析[J]. 粮食储藏, 2012, 41(1): 42-46.
FU Q, JU X R, GAO Y L, et alRelationship Between Volatile Components of Wheat Flour and Biochemical Indexes in Different Stored Conditions[J]. Grain Storage, 2012, 41(1): 42-46.
[22] LI M Q, YANG R W, ZHANG H, et al. Development of a Flavor Fingerprint by HS-GC-IMS with PCA for Volatile Compounds ofSinger[J]. Food Chemistry, 2019, 290: 32-39.
[23] 黄宗文, 吕建华, 许俊亚. 不同初始虫口密度赤拟谷盗成虫危害对小麦粉挥发性物质的影响研究[J]. 中国粮油学报, 2022, 37(6): 29-35.
HUANG Z W, LYU J H, XU J Y. Effects of Different Initial Densities of Insect Pests on Volatile Compounds from Wheat Flour[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(6): 29-35.
[24] 莫圣书, 赵冬香, 陈青. 植物挥发物与昆虫行为关系研究进展[J]. 热带农业科学, 2006, 26(6): 84-89.
MO S S, ZHAO D X, CHEN Q. Advances on Relationships between Plant Volatiles and Insect Behavior[J]. Chinese Journal of Tropical Agriculture, 2006, 26(6): 84-89.
[25] 张梦祺. 不同小麦籽粒挥发物的差异特征及与品质性状的关系[D]. 合肥: 安徽农业大学, 2021.
ZHANG M Q. Differential Characteristics of Grain Volatiles in Different Wheat and their Relationship with Quality Characters[D]. Hefei: Anhui Agricultural University, 2021.
[26] 吕建华, 黄宗文, 王殿轩, 等. 储粮害虫检测方法研究进展[J]. 中国粮油学报, 2020, 35(11): 194-202.
LYU J H, HUANG Z W, WANG D X, et al. Advances in Detection Methods of Stored Grain Insects[J]. Journal of the Chinese Cereals and Oils Association, 2020, 35(11): 194-202.
[27] ZHANG K Y, ZHANG C, GAO L L, et alAnalysis of Volatile Flavor Compounds of Green Wheat under Different Treatments by GC-MS and GC-IMS[J]. Journal Of Food Biochemistry, 2021, 46(6): 1-17.
[28] 张玉荣, 邵帅, 于英威, 等. 蛀蚀性害虫生长繁殖对小麦挥发性成分的影响[J]. 河南工业大学学报(自然科学版), 2019, 40(2): 85-94.
ZHANG Y R, SHAO S, YU Y W, et al. Effects of Growth and Reproduction of Boring Pests on Volatile Components of Wheat[J]. Journal of Henan University of Technology(Natural Science Edition), 2019, 40(2): 85-94.
[29] 孙兴荣, 卞景阳, 刘琳帅, 等. 基于顶空-气相色谱-离子迁移谱技术分析蒸煮前后不同颜色稻米的挥发性化合物[J]. 食品科学, 2023, 44(10): 332-340.
SUN X R, BIAN J Y, LIU L S, et al. Characterization of Volatile Compounds in Different Colored Rices before and after Cooking by Headspace-Gas Chromatography-Ion Mobility Spectrometry[J]. Food Science, 2023, 44(10): 332-340.
[30] WANG S Q, CHEN H T, SUN B G. Recent Progress in Food Flavor Analysis Using Gas Chromatography-Ion Mobility Spectrometry (GC-IMS)[J]. Food Chemistry, 2020, 315: 126-158.
[31] NIU Y, HARDY G, AGARWAL M, et al. Characterization of volatiles(H.) in Flour Using Solid Phase Microextraction Gas Chromatography-Mass Spectrometry (SPME-GCMS)[J]. Food Science and Human Wellness on SciVerse ScienceDirect, 2016, 5(1): 24-29.
GC-IMS Analysis of Volatile Substances in Wheat Flour Infested byand
ZHANG Yu, ZHANG Lirui, HE Yanping, DAI Huang, ZHANG Wei, SHU Zaixi, BI Jie*
(School of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
The work aims to investigate the effect of infestation ofandon the type, content and composition of volatile substances in wheat flour. Gas Chromatography-Ion Mobility Spectrometry (GC-IMS) was used for the qualitative and quantitative determination of the normal wheat flour and the wheat flour infested withand. A total of 50 peaks were detected in the three kinds of wheat flour and 41 volatile substances were identified. Wheat flour infested with thecontained high concentrations of hexanal, 2-ethylhexanol, nonanal, 2,6-dimethylpyridine, (E)-2-heptenal, 1-octen-3-one, dimethyl trisulfide compounds, heptanal, and furfural. In contrast, wheat flour infested withcontained high concentrations of 1-penten-3-ol, hexanol, 2-heptanone, pentanol, and 3-methyl butanol aldehydes. Compared to the control group, the contents of aldehydes and alcohols significantly increased in the wheat flour infested by two kinds of test pests. By analyzing the volatile substances in wheat flour and combining gas chromatography-ion mobility spectrometry, fingerprinting and principal component analysis, the differences in volatile components between normal wheat flour and wheat flour infested withandare revealed. The results of this study provide a reference basis for predicting the occurrence of early pests during wheat flour storage.
;; wheat flour; volatile components; Gas Chromatography-Ion Mobility Spectrometry (GC-IMS)
TB487;TS206
A
1001-3563(2024)09-0062-08
10.19554/j.cnki.1001-3563.2024.09.008
2023-12-24
国家自然科学基金(32102198);武汉轻工大学大宗粮油精深加工教育部重点实验室开放课题(2019GYBQGDKFB07,2020JYBQGDKFA01);中央引导地方科技发展专项项目(2022BGE247)
