黄瓜种子低温收缩变形行为研究
2024-05-18王克计宏伟张晓川刘玉江
王克,计宏伟,张晓川,刘玉江
黄瓜种子低温收缩变形行为研究
王克,计宏伟*,张晓川,刘玉江
(天津商业大学 机械工程学院,天津 300134)
明确降温过程中黄瓜种子种皮和子叶的变形行为。搭建低温变形测试系统,在27 ℃至−18 ℃的降温过程中,利用数字图像相关(Digital Image Correlation,DIC)方法,分别对黄瓜种子种皮和子叶的低温变形行为进行测试分析。在种子长轴和短轴方向,种皮平均压应变量恒大于子叶,长轴方向的平均压应变量大于短轴方向。在降温过程中,种皮2个方向的平均压应变量先增加,后趋于平稳;子叶2个方向的平均压应变量随温度降低逐渐增加。种皮和子叶的变形行为具有较大差异,低温保存时,由于两者收缩变形不协调,可能引起失配应力从而造成种子破坏。
黄瓜种子;数字图像相关(DIC);低温;变形
种质资源库是重要的种质资源保存设施,对种质资源进行低温保存可以降低细胞代谢活性[1],延长种质资源保存年限,最高可达50年以上[2]。长期种质库的环境温度一般稳定在−18 ℃,保存对象为含水量在5%~8%的种子[3],保存期间大部分种子发芽率都未明显下降。低温保存是目前种子的主要保存途径之一。在种子低温保存过程中,种子会因低温产生收缩变形,低温应力及应变的产生会对种子活力产生影响[4]。明确低温环境下种子的变形行为对合理调控种质库环境温度、进一步延长种子保存时间具有重要意义。
国内外学者就低温保存对农作物及种子的性能影响进行了深入研究。王晨[5]研究了不同低温保存条件对汉麻种子活力的影响;侯俊铭等[6]设置单因素实验,采用实验与仿真结合的方式研究了2种花生种子的脱壳特性。结果表明诸多因素对花生破壳力的影响显著,其中含水率分别与破壳力、变形量呈正相关关系;张哲等[7]探究了真空冷冻干燥技术对玉米种子的影响,预冻阶段在−25 ℃低温环境下冻结玉米种子1 h。结果表明种子含水率随预冻阶段温度下降而略有升高,环境温度与种子含水率密切相关。低温保存过程中的温度变化可能会使种子产生变形,长时间的保存可能破坏种子结构;Zadorozhna等[8]对含水量5%~7%的冬黑麦种子在不同环境温度下的寿命、萌发和作物结构进行了研究。结果表明,从4 ℃和−20 ℃温度下保存42个月的种子中获得的植株高度存在差异;Gupta等[9]从水平及垂直2个方向对不同含水量下的向日葵种子的抗压强度进行了测量。实验结果表明,在外力作用下种子抗压强度随含水率增大而逐渐减小,种皮在长轴方向上的抗压强度更大,而子叶在短轴方向上的抗压强度更大;Rafaelle等[10]分别以−5 ℃冷冻及−196 ℃冷冻2种低温保存策略对濒临灭绝的20种凤梨科植物种子性能进行对比评估,设置1、7、30、180 d及450 d 5个保存时长。研究表明,低温保存是保存干燥至含水量约为7%种子的有效策略。当前,对农作物及其种质低温保存进行研究的有关文献大多集中于低温保存对种子活力等生物学指标的影响,而从低温环境下温变对种子力学性能影响角度所进行的研究较少。
种子尺寸普遍偏小,无法粘贴应变片,其他接触测量方法也会对种子造成损伤。数字图像相关(Digital Image Correlation,DIC)方法作为一种非接触式的光学全场测量方法[11],在多种类[12-13]、多尺度[14-16]、广温度范围[17]下的材料参数测量场合中得到了广泛应用。而在种子低温保存领域,DIC的应用还相对较少。本文以黄瓜种子为研究对象,搭建低温变形测试系统并运用DIC技术,分析种皮和子叶在低温环境下降温过程中的变形行为,以便进一步深入研究低温环境下温变引起的种皮和子叶变形行为和相互作用机制。
1 实验
1.1 选种与试件制备
选用唐山新马种业有限公司的“翠冠翠玉”干燥黄瓜种子进行实验,含水率不高于8.0%。种子主要由种皮和子叶两部分组成,对两部分热变形分别进行分析。在对种皮和子叶进行磨制、喷斑、裁件3步处理后获得实验用试件。种子、种皮试件及子叶试件分别如图1a、图1b和图1c所示。黄瓜种子形貌近似于椭圆形,种子长轴方向即为水平方向,短轴方向为垂直方向。取5粒无褶皱、无裂纹、籽粒饱满的正常黄瓜种子,分别制备5组种皮试件及5组子叶试件。种皮试件规格为6 mm×2 mm×0.16 mm,子叶试件规格为6 mm×2 mm×1 mm。

图1 黄瓜种子形貌及试件
1.2 实验系统
实验系统如图2所示,主要由冷热台、温度控制器、冷热台电脑、液氮容器、双远心镜头、电荷耦合元件(Charge Coupled Device,CCD)相机、DIC电脑、三脚架、环形光源构成。冷热台型号为Linkam TST350,双远心镜头型号为Schneider Xenoplan Telecentric 1∶1。

图2 实验系统
1.3 实验方案及数据处理
将种皮和子叶试件分别放置于冷热台上进行热变形实验,实验起始温度为27 ℃,终止温度为−18 ℃,降温速率为6 ℃/min,每下降3 ℃保温3 min并采集图像。从视野中央选取尺寸为840像素×210像素(4 mm× 1 mm)的感兴趣区域(Region of Interest,ROI),如图3所示。所选子区大小为41像素×41像素,步长为7像素。分别用径向位移场和全场平均应变分析试件表面的位移和应变在不同温度下的变化,并对种皮与子叶间的热变形行为进行对比分析。
用Vic 2D 6对不同温度下的黄瓜种子图像进行DIC分析,并获得种子不同方向应变场云图及各计算点位移量、应变量等相关数据,用Matlab2021根据位移量对种皮及子叶的合位移进行分析,用Origin2021根据所得数据分析温度与应变之间的关系并作图。

图3 感兴趣区域选取
2 结果与讨论
2.1 位移场分析
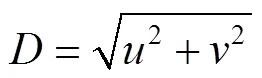
在径向位移场中,位移值等值线呈弧状向外辐射分布,而并非以同心圆均匀分布,表明种皮和子叶在降温过程中发生了不均匀的热变形[16]。在图4c与图4f中,与短轴方向相比,长轴方向上白色箭头长度变化更为明显。从ROI两侧至中央,径向位移量逐渐减小,长轴方向试件两侧收缩行为更明显。对比图4a与图4b,种皮场变化范围为−23.81~28.57 μm,场的变化范围是−7.14~14.29 μm,种皮在长轴方向的位移变化范围大于短轴方向,且max>max。子叶与种皮有相似规律,种皮与子叶在长轴方向与短轴方向的收缩行为不一致,长轴方向的收缩行为更为明显。对比图4c与图5c,种皮最大位移量为28.57 μm,子叶最大位移量为21.43 μm,种皮与子叶间的收缩不同步,在降温过程中种皮与子叶的收缩行为存在差异。
2.2 应变场分析
分别对5组种皮试件与5组子叶试件的应变云图进行对比分析,取典型试件分析共同规律。不同温度下种皮的长轴方向应变云图如图5所示,图5a、图5b所对应的环境温度分别为24 ℃和−18 ℃。种皮长轴方向ROI全场产生压应变,随着温度下降,种皮长轴方向产生的应变量逐渐增大。从应变分布来看,种皮ROI中央产生的压应变量较小,收缩程度轻;从ROI中央到两侧,种皮产生的压应变量显著增加。在实际低温保存环境下,种皮两侧会产生更大的收缩变形。
24 ℃和−18 ℃环境下种皮的短轴方向应变云图分别如图5c、图5d所示。随着温度下降,种皮短轴方向产生的压应变量显著增大。对比图5b与图5d可知,环境温度为−18 ℃时,种皮长轴方向产生的压应变最大值与均值均大于短轴方向,种皮在长轴方向上收缩程度更大。
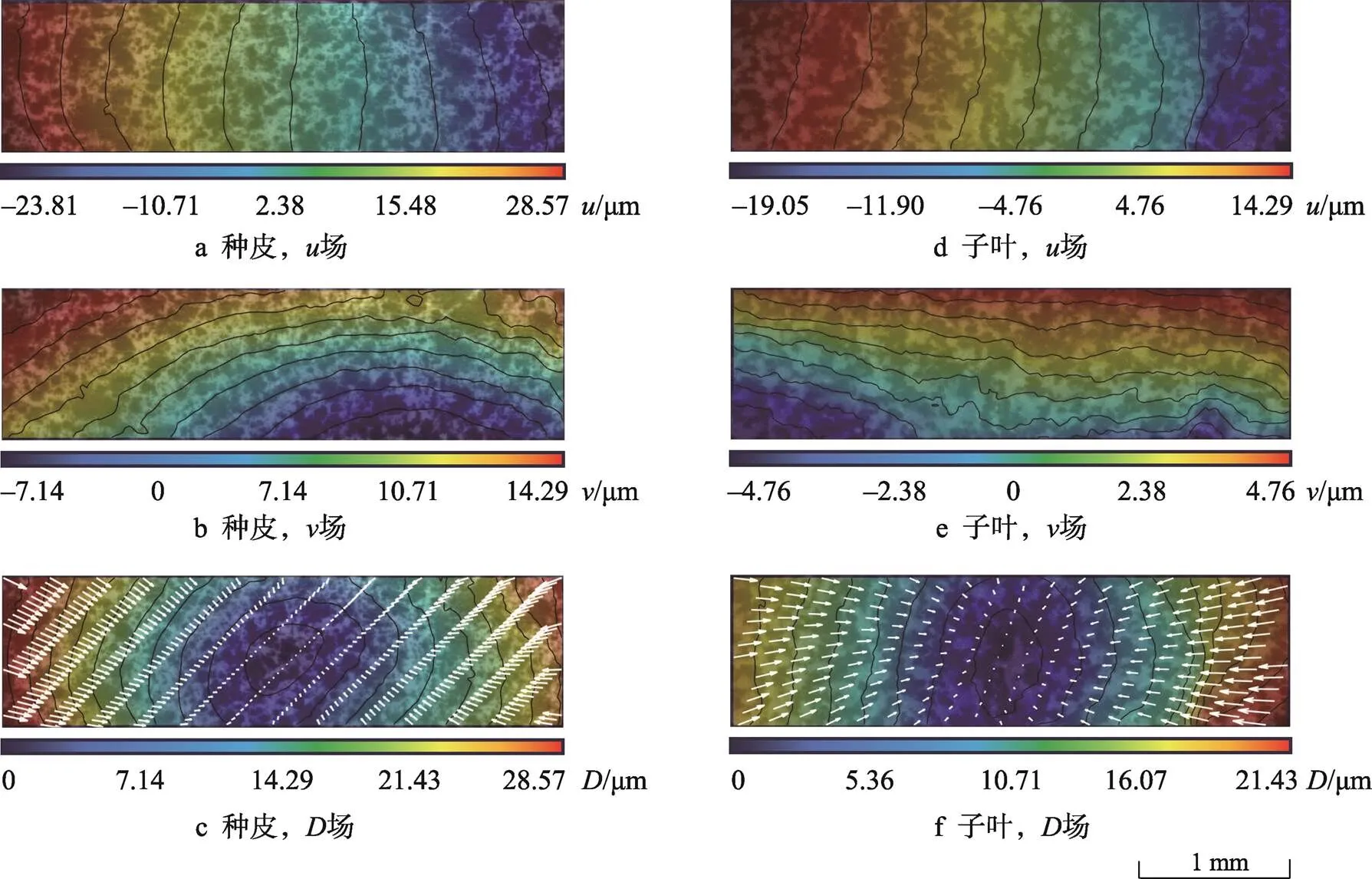
图4 −18 ℃的位移场

图5 种皮应变云图
24 ℃和−18 ℃环境下子叶的长轴方向应变云图分别如图6a、图6b所示。随着温度下降,长轴方向ROI全场产生压应变,应变量逐渐增大。从云图上看,长轴方向上子叶应变分布无明显变化,应变量较大区域分布分散。24 ℃和−18 ℃环境下子叶的短轴方向应变云图分别如图6c、图6d所示。随着温度下降,子叶短轴方向产生的压应变量显著增大。对比图6b与图6d,环境温度为−18 ℃时,子叶长轴方向产生的压应变最大值与均值均大于短轴方向,子叶在长轴方向上收缩程度更高。分别对比图5b与图6b、图5d与图6d可得,在环境温度为−18 ℃时,种皮在长轴与短轴方向产生的压应变最大值与均值均大于子叶的,种皮与子叶收缩不同步,种皮在长轴与短轴方向上收缩程度更高。
2.3 温度-平均压应变曲线分析
种皮长轴及短轴方向温度-平均压应变曲线如图7a所示,种皮长轴方向平均应变恒大于短轴方向平均应变。降温开始时,种皮遇冷迅速收缩,产生压应变,应变量随温度降低急剧增大。温度低于18 ℃后,随着温度的进一步降低,应变量增大,而应变量增加速度减小,曲线趋于平缓。−18 ℃时,种皮长轴方向与短轴方向的应变均值分别为−0.012 4、−0.008 3。
子叶水平及短轴方向温度-平均压应变曲线如图7b所示,在降温过程中,子叶在水平及短轴方向都产生压应变,长轴方向压应变大于短轴方向压应变,长轴方向收缩情况更为严重。−18 ℃时子叶长轴方向与短轴方向的应变均值分别为−0.007 3、−0.005 0。
种皮与子叶试件在长轴方向及短轴方向温度-平均压应变曲线及温度-应变差值曲线分别如图8a、图8b所示。图8中红色曲线为种皮及子叶在不同方向上的应变差值,黑色曲线为各种皮试件应变均值在水平及短轴方向上的平均水平,蓝色曲线为各子叶试件应变均值在水平及短轴方向上的平均水平。降温过程中,在长轴及短轴方向上,种皮与子叶之间的应变差值在降温期间一直存在。种皮在降温期间产生的应变量恒大于子叶,长轴方向应变差值范围大于短轴方向。在降温过程中,种皮与子叶的在长轴与短轴方向上的应变差值先急剧增大,后缓慢减小。

图6 子叶应变云图
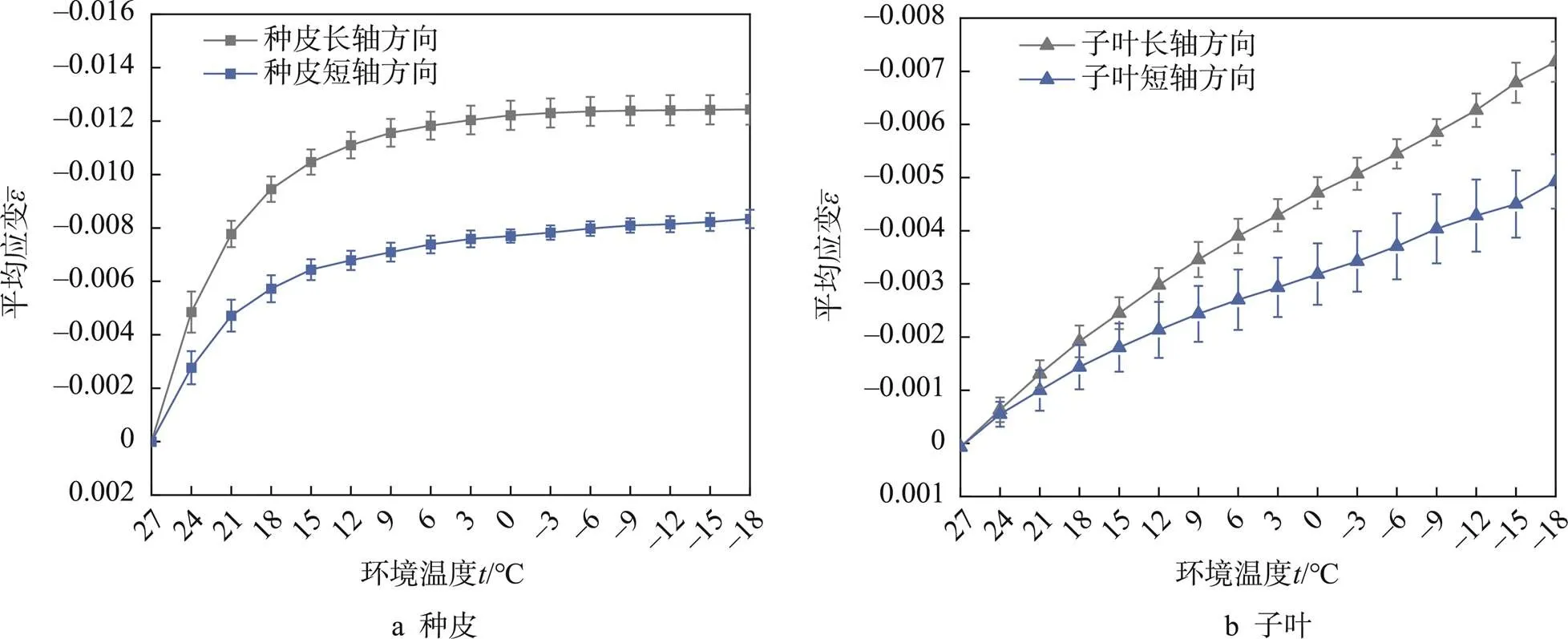
图7 温度-平均压应变曲线
图8 温度-平均压应变曲线及温度-应变差值曲线
在18~27 ℃内,种皮所产生的压应变急剧增大。在同一温度下,种皮收缩情况更为严重。对籽粒饱满的正常黄瓜种子而言,在降温之初,种皮和子叶变形不协调,可能相互挤压。种皮和子叶在18 ℃时的长轴方向应变云图分别如图9a、9b所示。在ROI内,种皮长轴方向应变均值为−0.010 2,子叶应变均值为−0.002 4,种皮产生的压应变远大于子叶。在12~18 ℃内,种皮所产生的压应变继续增大,而温度-应变曲线增长趋势逐渐放缓,在12 ℃时种皮和子叶的温度-应变曲线切线斜率接近相等。
种皮和子叶在12 ℃时的长轴方向应变云图分别如图9c、9d所示。在ROI内,种皮长轴方向应变均值为−0.011 8,子叶应变均值为−0.003 5。种皮与子叶之间应变差值在12 ℃达到最大。随着温度的进一步降低,种皮和子叶长轴方向应变差值逐渐减小。在−18~12 ℃内,种皮产生的压应变量逐渐趋于平缓,逐渐稳定于−0.012 0水平。子叶的长轴方向应变持续下降,−18 ℃时子叶长轴方向应变量约为−0.008。
种皮和子叶在18 ℃时的短轴方向应变云图分别如图10a、10b所示,在12 ℃时的短轴方向应变云图分别如图10c、图10d所示。在18~27 ℃内,种皮产生的短轴方向应变增大,种皮温度-应变曲线切线斜率大于子叶。降温之初,种皮会在短轴方向上对子叶产生挤压变形;在12~18 ℃内,种皮对子叶的挤压程度进一步加深;在−18~12 ℃内,在此温度下保存,可能导致种皮对子叶的挤压作用逐渐减小。
黄瓜种子种皮的主要功能是保护种子免受外部环境的损害,从结构上看,成熟黄瓜种子的种皮分内外2层,分别由外层的厚壁组织和内层的薄壁组织构成[20]。厚壁组织的细胞具有坚硬的次生壁[21],质厚坚韧。黄瓜属于无胚乳的双子叶植物,因而子叶肥厚。作为种胚的一部分,子叶贮藏物质以油脂为主,并以甘油三酯的形式储存于脂体中[22],同时贮藏着淀粉、蛋白质等丰富的营养物质[23]。除具备营养贮藏功能外,子叶还具备光合作用和胁迫防御的功能[23]。作为一种混合物,甘油三酯熔点范围为40~55 ℃[24],常温下为固态,因而黄瓜种子子叶质地比较柔软。

图9 长轴方向温度-应变差值曲线与应变云图
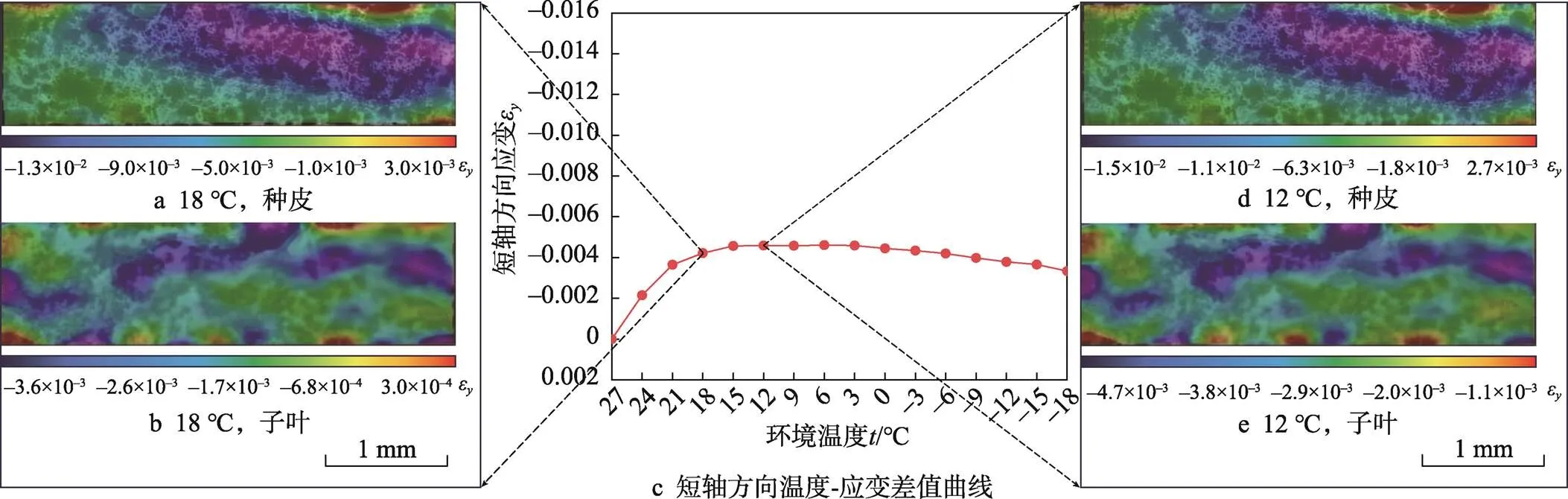
图10 短轴方向温度-应变差值曲线与应变云图
黄瓜种子的种皮与子叶在材质、组成成分、功能等方面存在较大差异,这是两者在同一环境条件下位移与应变变化情况存在差异的重要原因。随着温度降低,种皮和子叶会产生不同程度的收缩。不同性质的材料具有不同的收缩性能,在同一环境条件下会显示出不同的收缩程度,因而种皮和子叶在降温过程中位移场和应变场产生较大差异,在低温保存过程中可能因变形不同步而产生失配应力。
3 结语
利用DIC方法测量了低温环境内不同温度下黄瓜种子种皮和子叶的应变场和位移场,从而分析了黄瓜种子的热变形行为。在降温过程中,种皮和子叶在长轴方向及短轴方向均产生不均匀的收缩变形,种子两侧的位移量大于中央区域,种皮产生的位移量大于子叶。
降温过程中,种皮及子叶在长轴和短轴方向上均产生压应变。同一温度下,种皮长轴方向产生的压应变量均值大于短轴方向,种皮两侧应变量大于中央区域,种皮产生的压应变量大于子叶。
温度下降过程中,种皮产生的应变量先急剧增大,从12 ℃开始逐渐趋于稳定。子叶在2个方向上的应变量随温度降低而逐渐增大。在降温过程中,种皮和子叶之间在长轴方向和短轴方向的应变差值先显著增大,后缓慢减小。在低温环境下,种皮和子叶收缩不协调,可能引起失配应力,从而改变种子形态。
[1] KULUS D. Managing Plant Genetic Resources Using Low and Ultra-Low Temperature Storage: A Case Study of Tomato[J]. Biodiversity and Conservation, 2019, 28(5): 1003-1027.
[2] 孔宪琴, 张小惠, 李春生, 等. 水稻等重要作物种子的保存与管理体系探究[J]. 中国稻米, 2018, 24(4): 91-95.
KONG X Q, ZHANG X H, LI C S, et al. Conservation and Management System of Rice and other Important Crop Seeds[J]. China Rice, 2018, 24(4): 91-95.
[3] 刘庞源, 何伟明, 张宝海. 北京蔬菜种质资源保存现状与展望[C]// 2017第二届农业科学与生物技术国际会议. 苏州: 出版者不详, 2017: 32-35.
LIU P Y, HE W M, ZHANG B H. The Current Situation and Expectation of Beijing Vegetable Germplasm Resources[C]// ICASE2017. Suzhou: [s.n.], 2017: 32-35.
[4] DU Y D, DUAN S P, CHEN X G, et al. Effects of Low Temperature Stress on Germination of Tomato Seeds[J]. Chinese Journal of Ecology, 2010, 29(6): 1109-1113.
[5] 王晨. 低温保存条件对汉麻种子活力及相关代谢物成分的影响[D]. 大庆: 黑龙江八一农垦大学, 2022: 1-10.
WANG C. Effects of Low Temperature Preservation Conditions on Seed Vigor and Related Metabolites of Hemp[D]. Daqing: Heilongjiang Bayi Agricultural University, 2022: 1-10.
[6] 侯俊铭, 杨勇, 董帅, 等. 典型花生种子脱壳特性试验及有限元仿真研究[J]. 东北农业大学学报, 2017, 48(11): 74-85.
HOU J M, YANG Y, DONG S, et al. Experimental and Finite Element Simulation of Typical Peanut Seeds Shelling Characteristics[J]. Journal of Northeast Agricultural University, 2017, 48(11): 74-85.
[7] 张哲, 张智弘, 张靖含, 等. 玉米种子真空冷冻干燥微观实验研究及模型分析[J]. 包装工程, 2024, 45(3): 72-80.
ZHANG Z, ZHANG Z H, ZHANG J H, et al. Experimental Study and Model Analysis of Vacuum Freeze- Drying of Corn Seed[J]. Packaging Engineering, 2024, 45(3): 72-80.
[8] ZADOROZHNA O A, YEHOROV D K. Influence of Low-Temperature Modes of Winter Rye Seed Storage on Its Yield-Related Traits[J]. Probl Cryobiol Cryomed, 2022, 32(2): 111-120.
[9] GUPTA R K, DAS S K. Fracture Resistance of Sunflower Seed and Kernel to Compressive Loading[J]. Journal of Food Engineering, 2000, 46(1): 1-8.
[10] RAFAELLE S D O, FERNANDA V D S, IASMIN L D S, et al. Cryopreservation and Low-Temperature Storage of Seeds of Tillandsia Species (Bromeliaceae) with Ornamental Potential[J]. 3 Biotech, 2021, 11(4): 186.
[11] 杜鉴昕, 赵加清, 王海涛, 等. 针对裂尖变形场测量的包络单元局部数字图像相关方法[J]. 光学学报, 2022, 42(1): 147-154.
DU J X, ZHAO J Q, WANG H T, et al. Envelope Element Local Digital Image Correlation Method for Crack Tip Deformation Field Measurement[J]. Acta Optica Sinica, 2022, 42(1): 0112003.
[12] JAISWAL P R, KUMAR R I, TRUMPER R, et al. DIC Based Strain and Damage Analysis of Large Scale Steel to Composite Adhesive Joints Subjected to Tension and Compression Loading[J]. China Ocean Engineering, 2023, 37(4): 588-597.
[13] KANZENBACH L, LEHMANN T, IHLEMANN J. Digital Image Correlation Based Characterization of Rubber Material at Large Shear Deformations in an Extended Temperature Range[J]. GAMM-Mitteilungen, 2022, 45(3/4):1-14
[14] BRECHTL J, FENG R, LIAW P K, et al. Mesoscopic-Scale Complexity in Macroscopically-Uniform Plastic Flow of an Al0.3CoCrFeNi High-Entropy Alloy[J]. Acta Materialia, 2023, 242: 1-14.
[15] MARCHENKO E, KLOPOTOV A, USTINOV A, et al. Study of Macroplastic Flow in Surface Layers of Porous Titanium Nickelide by Digital Image Correlation[J]. AIP Conference Proceedings, 2022, 2509(1): 6-10.
[16] GANG H, JIHYE K, JONGUN M, et al. Determination of Damage Model Parameters Using Nano and Bulk-Scale Digital Image Correlation and the Finite Element Method[J]. Journal of Materials Research and Technology, 2022, 17: 392-403.
[17] SHI J, ZHAO Y, BAI J, et al. Research on the Bending Damage of Concrete In Areas with Large Temperature Differences Based on 3D‐Digital Image Correlation[J]. Structural Concrete, 2022, 23: 3497-3510.
[18] 刘玉江, 王莎莎, 贾涵, 等. 含铁素体/珠光体带状组织管线钢热变形行为研究[J]. 钢管, 2021, 50(2): 30-33.
LIU Y J, WANG S S, JIA H, et al. Research on Thermal Deformation Behavior of Pipeline Steel with Ferrite/Pearlite Banded Structure[J]. Steel Pipe, 2021, 50(2): 30-33.
[19] 俞立平, 潘兵. 单相机高温三维数字图像相关方法[J]. 航空学报, 2022, 43(6): 285-296.
YU L P, PAN B. Single-Camera High-Temperature Three-Dimensional Digital Image Correlation Method[J]. Acta Aeronautica et Astronautica Sinica, 2022, 43(6): 285-296.
[20] 张红生, 胡晋. 种子学[M]. 2版. 北京: 科学出版社, 2015: 16-17.
ZHANG H S, HU J. Seed Science[M]. 2nd ed. Beijing: Science Press, 2015: 16-17.
[21] 姚振生, 葛菲. 植物厚壁组织及其在生药学上的应用[J]. 江西中医学院学报, 1992(1): 56-57.
YAO Z S, GE F. Plant Thick Walled Tissue and Its Application in Pharmacognosy[J]. Journal of Jiangxi College of Traditional Chinese Medicine, 1992, 4(1):56-57.
[22] BIERMANN U, FRIEDT W, LANG S, et al. New Syntheses with Oils and Fats as Renewable Raw Materials for the Chemical Industry[J]. Angewandte Chemie International Edition, 2000, 39(13): 2206-2224.
[23] 王英男, 彭晓媛, 华晓雨, 等. 植物子叶生理功能的研究进展[J]. 草业科学, 2018, 35(12): 2988-2997.
WANG Y N, PENG X Y, HUA X Y, et al. Research Progress on the Physiological Function of Plant Cotyledons[J]. Pratacultural Science, 2018, 35(12): 2988-2997.
[24] TERESIA T. Identification of Triacylglycerol Profile, Solid Fat Content, and Slip Melting Point of Cocoa Butter Like Fat from Chocolate Bar Products In Indonesian Market[D]. Bogor: Bogor Agricultural University, 2009: 19-21.
Low Temperature Shrinkage Deformation Behavior of Cucumber Seeds
WANG Ke, JI Hongwei*, ZHANG Xiaochuan, LIU Yujiang
(School of Mechanical Engineering, Tianjin University of Commerce, Tianjin 300134, China)
The work aims to clarify the deformation behavior of cucumber seed coats and cotyledons during the cooling process. A low-temperature deformation test system was built. During the cooling process from 27 ℃ to −18 ℃, the low-temperature deformation behavior of cucumber seed coats and cotyledons was analyzed through the digital image correlation (DIC) method. The results showed that the mean pressure strain of seed coats was constant greater than that of cotyledons in the direction of long axis and short axis, the average compressive strain in the long axis direction was greater than that in the short axis direction. During the cooling process, the average pressure strain of seed coats in both directions increased first, and then tended to be stable; The mean pressure strain in both directions of cotyledons increased gradually with the decrease of temperature. The deformation behaviors of seed coats and cotyledons are quite different. When stored at low temperature, the mismatch stress may be caused due to the incongruous shrinkage of seed coats and cotyledons, which may cause the seed damage.
cucumber seed; digital image correlation(DIC); low temperature; deformation
TB322
A
1001-3563(2024)09-0045-08
10.19554/j.cnki.1001-3563.2024.09.006
2024-01-23
国家自然科学基金面上项目(12172254)
