亮菌多糖体外模拟消化-酵解特性及其益生作用探究
2024-05-17张煜琛杜敏如赵洪玥杨舒郁连玲丹王杰
张煜琛,杜敏如,赵洪玥,杨舒郁,连玲丹,王杰
(华南农业大学 食品学院 食品功能微生物实验室,广东 广州,510642)
多糖作为天然高分子聚合物在自然界中广泛存在,其活性功能逐渐被证实,包括但不限于抗氧化、抗肿瘤、抗衰老等。研究表明,非淀粉类天然多糖并不易被哺乳动物唾液降解,在小鼠实验中,发现仅有少数种类多糖会在胃肠消化液作用下降解,且程度较低[1]。深入研究发现,几乎所有多糖在抵达大肠时,可被共生细菌发酵利用,并产生大量小分子物质,被宿主吸收影响健康。LAGAMM等[2]研究证实,短链脂肪酸(short-chain fatty acids, SCFAs)在人体内发挥重要作用,不仅是肠道上皮细胞生长的物质能量,还可以维持电解质平衡,同时还具有抗炎、预防肥胖等作用,这也为临床治疗提供重要解决思路。
亮菌(Armillariellatabescens)作为传统食药用真菌同样具有极高的活性利用价值,如其抗肿瘤生物功能被多位研究人员证实[3-6]。故探究高活性亮菌多糖在消化进程中的活性变化及对机体潜在的作用方式尤为重要。体外模拟消化及酵解具有操作便捷快速的特点,已成为近年来辅助研判食品或药品体内消化吸收过程的常用手段。
因此,本研究将探究在体外模拟消化及酵解过程中,亮菌多糖的变化轨迹以及生物活性改变情况,为探究亮菌多糖在体内可能发生的活性改变进行初步验证,同时为亮菌多糖作为益生元类产品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
亮菌,中国林业微生物保藏管理中心(CFCC 872604);双歧杆菌、植物乳杆菌、干酪乳杆菌、大肠杆菌,均由华南农业大学食品学院食品功能微生物团队保藏。大孔树脂25A-210,西安蓝晓科技新材料股份有限公司;胃蛋白酶、胰蛋白酶、乙酸、丙酸、丁酸,上海麦克林生化科技有限公司;ABTS试剂盒,索莱宝生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase, POD)试剂盒,南京建成生物工程研究所。其他试剂均为国产分析纯。
1.2 仪器与设备
R-1001VN型旋转蒸发仪,郑州长城科工贸有限公司;UV-1100紫外光分光光度计,上海美浦达仪器有限公司;Agilent 7890A/5975c型气-质联用分析仪,安捷伦(科技)中国有限公司。
1.3 实验方法
1.3.1 亮菌胞外多糖(Armillariellatabescensextracellular polysaccharide, ATEP)提取与纯化
PDA培养基180 r/min,25 ℃发酵亮菌12 d。浓缩发酵液后1∶4(体积比)混合95%(体积分数)乙醇。4 000 r/min离心20 min,收集沉淀。大孔树脂浸润活化[7],冲洗ATEP,收集洗液。Sevag法[8]除蛋白,移出上层溶液-80 ℃真空冷冻干燥保存。多糖得率为ATEP醇沉质量与发酵上清液的比值。
1.3.2 ATEP理化分析
1.3.2.1 分子质量
样品和标准品并配制成5 mg/mL溶液,12 000 r/min离心10 min,0.22 μm滤膜过滤后进行高效凝胶渗透色谱(high-performance gel permeation chromatography,HPGPC)分析。色谱条件:BRT105-104-102凝胶柱(8 mm×300 mm);流动相0.05 mol/L NaCl溶液;流速0.6 mL/min,柱温40 ℃;进样量20 μL。
1.3.2.2 单糖组成
5 mg样品加入2 mL 3 mol/L三氟乙酸溶液,120 ℃水解3 h。吸取酸液,N2吹干,加入5 mL H2O混匀,吸50 μL加入950 μL水,12 000 r/min,5 min。上清液进行离子色谱(ion chromatography,IC)分析。
色谱条件:Dionex CarbopacTMPA20 (3 mm×150 mm);流动相:A:H2O;B:15 mmol/L NaOHC溶液:15 mmol/L NaOH和100 mmol/L NaOAC溶液;流速0.3 mL/min;进样量5 μL;柱温30 ℃;电化学检测器。
1.3.2.3 ATEP主要组成成分
参照YANG等[4]苯酚硫酸法检测总糖含量,KASIRG等[9]二硝基水杨酸法检测还原糖,SAEED等[10]福林酚法检测总酚,ZAMEER等[11]Na2NO2-Al(NO3)3-NaOH比色法检测类黄酮,分别测定490、540、510、760 nm处吸光值,绘制标曲(图1),配制100 mg/mL ATEP检测后代入方程计算,所得含量与多糖溶液浓度之比即为质量百分比。
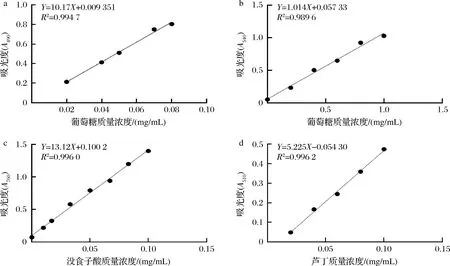
a-总糖;b-还原糖;c-总酚;d-总黄酮
1.3.3 体外抗氧化活力
SOD、CAT、POD及ABTS按照试剂盒说明书操作。DPPH参照[12]方法检测。配制浓度梯度维生素C标准液,反应后在517 nm处测定吸光度,计算如公式(1)所示。

(1)
式中:A1,实验组测得的吸光值;A0,对照组测得的吸光值;A2,空白组测得的吸光值,同时维生素C作为阳性对照。
总还原力参照CHEN等[13]的方法。样品中加入磷酸盐缓冲液(pH 6.6)、5%(质量分数)K3[Fe(CN)6],10%(质量分数)的三氯乙酸溶液,等体积H2O和0.1% FeCl3混匀,振荡后静置,700 nm处测吸光度,实验组与对照组差值即为还原力。
1.3.4 “唾-胃-肠”体外模拟消化[14]
经口消化:收集志愿者唾液(9男,16女;3个月内未服用任何药物与酒精饮料),4 ℃离心15 min,上清液与10 mL ATEP等量混合,37 ℃水浴20 min后灭活;其余消化产物调节pH值为1.3±0.1,备用。经胃消化:将模拟经口消化产物1∶1(体积比)混合模拟胃液,37 ℃水浴3 h后灭活。其余消化产物加入NaOH调节pH值为6.8±0.1,备用。经肠消化:将模拟经胃消化产物3∶1(体积比)混合模拟人工肠液,37 ℃水浴4 h后灭活待测。
1.3.5 益生菌活化及生长曲线测定
参照ZHANG等[15]方法,受试菌种接种于添加有10%(体积分数)1 mg/mL ATEP溶液的MRS培养基,37 ℃恒温厌氧培养0、2、6、12、24、48 h测定OD600与pH值,绘制生长曲线。
1.3.6 体外模拟酵解
收集4名志愿者(2男,2女,3个月内未服用任何药物)新鲜粪便,等量混匀,厌氧条件1∶10(体积比)加入无菌生理盐水(含 0.5 g/L的L-盐酸半胱氨酸溶液),0.8 μm过滤杂质。10%比例接种至酵解培养基[16],终质量浓度为10 mg/mL的ATEP溶液,培养24 h和48 h后,立即冷冻离心(10 000×g,10 min),上清液用于分析pH值与SCFAs含量。
1.3.7 SCFAs含量[17]
取酵解产物加入等量乙酸乙酯,涡旋2 min,离心15 min,取600 μL上层液上机。
GC-MS条件:Agilent DB-WAX毛细管柱(30 m×0.25 mmID×0.25 μm),初始温度90 ℃,10 ℃/min上升到 120 ℃,5 ℃/min上升到150 ℃,25 ℃/min上升到250 ℃保持2 min,He载气,流速1.0 mL/min,分流比10∶1。绘制标准曲线(表3),计算ATEP中含量。
1.3.8 数据统计与分析
试验与检测重复3次。SPSS 25.0进行比较平均值单因素ANOVA检验进行差异显著性分析,数据结果用平均值±标准差表示,采用GraphPad Prism 8.0绘图。
2 结果与分析
2.1 ATEP得率与理化性质
ATEP胞外多糖含量为724.8 mg/100 mL,提取后ATEP得率为9.03%,其中总糖占43.52%质量分数,还原糖为0.76%,总酚为0.23%,总黄酮为0.96%。如图2所示ATEP由两组分组成,分子质量分别为27.0 kDa和8.9 kDa。ATEP的单糖分析显示(表1),由岩藻糖、盐酸氨基葡萄糖、半乳糖、葡萄糖、木糖、甘露糖构成,摩尔比为0.036∶0.008∶0.315∶0.522∶0.019∶0.099。
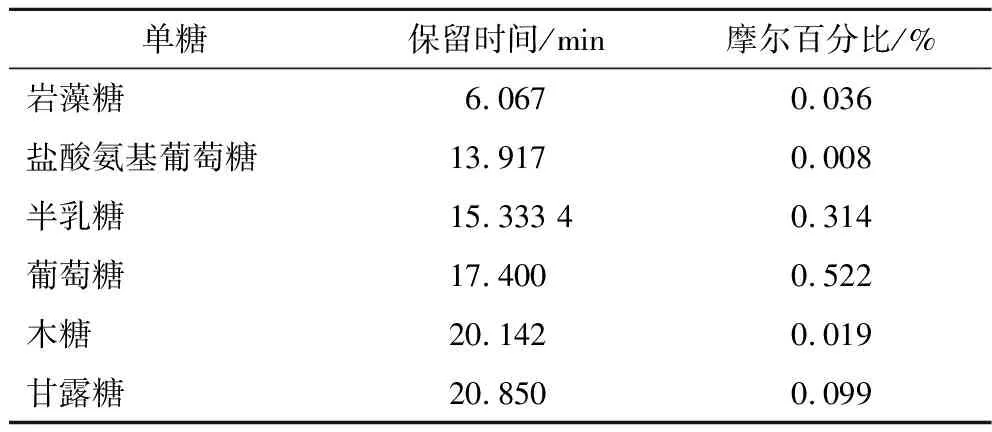
表1 ATEP单糖组成分析结果Table 1 Monosaccharide compositions of ATEP
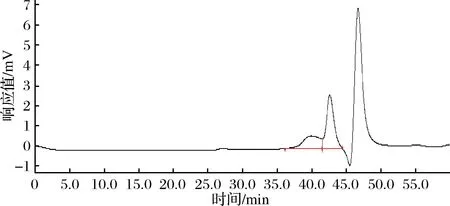
图2 ATEP分子质量HPGPC法分析结果Fig.2 Analysis results of ATEP molecular weight by HPGPC
2.2 ATEP模拟消化过程营养成分变化规律
如图3所示,ATEP的总糖、还原糖、总酚、总黄酮在依次经历模拟经口、经胃、经肠消化后,变化量不同。其中总糖和还原糖消化前、消化中、消化后含量未发生显著改变(P>0.05)。推测多糖分子无法被人体自泌消化酶降解,经口食入至离开小肠时几乎未变化,糖苷键未发生明显断裂[18]。而总酚含量模拟经胃后得到显著提高(P<0.05)。总黄酮仅在模拟经肠后含量显著升高(P<0.05),可能由于胃液与肠液可少量作用ATEP分子;另外,也可能与ATEP所含杂质有关,杂质被胃肠消化系统改造,并提升了产物总酚与总黄酮量。
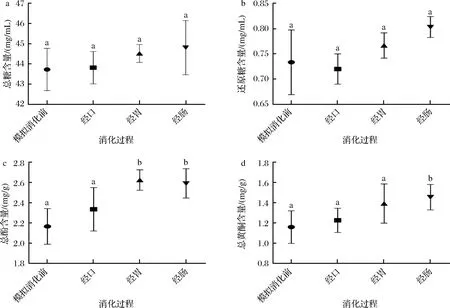
a-总糖;b-还原糖;c-总酚;d-总黄酮
2.3 ATEP消化产物抗氧化力的变化
由图4可知,在经历了模拟“唾-胃-肠”作用后,产物抗氧化力出现增强效果。与ATEP对照相比,模拟消化后产物,ABTS和DPPH清除率,抗氧化酶活力显著升高(P<0.05),总还原力消化后极显著增强(P<0.001)。
2.4 体外酵解过程中产物变化规律
体外模拟酵解反应是补充人体内消化道大肠段消化过程,该路径为宿主肠道细菌的主要聚居地,随消化向下行径,微生物数量和种类的丰富程度陡增。根据图5可知,在48 h的模拟酵解过程中,ATEP作为重要碳源,随着时间的延长被微生物持续酵解,碳水化合物消耗量不断上升(图5-a)。在此发酵过程中,以看到还原糖含量在前12 h表现出持续上升积累,但随后急速下降,分析在此过程中,多糖糖苷键被破坏,降解为小分子糖类,如还原糖;随后,还原糖又会成为下游细菌的能量来源代谢并转换成其他小分子物质,如短链脂肪酸等。与此同时,酵解的进行使微环境酸度上升,酵解前pH 8.2,酵解中pH不断下降至终止时为5.1。

a-碳水化合物消耗量;b-还原糖含量;c-pH
2.5 ATEP促进益生菌增殖
如图6-a~图6-d所示,ATEP表现出对双歧杆菌、植物乳杆菌、干酪乳杆菌及大肠杆菌均有促生长促增殖的作用。添加ATEP后,4种菌在培养48 h时密度均大于对照组。其中,双歧杆菌和植物乳杆菌在培养12 h后,这种促生长作用表现出来,而干酪乳杆菌和大肠杆菌则在培养6 h就有体现。培养环境pH的变化不断下降,从8.1下降至5.6(图6-e~图6-h)。相同培养时长下,ATEP对pH影响轻微。
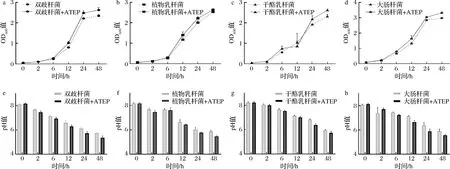
a-双歧杆菌OD值;b-植物乳杆菌OD值;c-干酪乳杆菌OD值;d-大肠杆菌OD值;e-双歧杆菌pH;f-植物乳杆菌pH;g-干酪乳杆菌pH;h-大肠杆菌pH
2.6 ATEP对SCFAs发酵产量的影响
标准物质曲线回归方程见表2。如图7所示,ATEP对SCFAs促进影响极显著(乙酸P<0.001;丙酸、丁酸P<0.005)。与对照相比,酵解结束后乙酸含量增长13倍,增幅1 200%,丙酸和丁酸含量增加2倍。

表2 三种SCFA标准物质GC-MS分析结果Table 2 GC-MS analysis results of three SCFAs reference materials

图7 经模拟酵解后发酵物SCFAs产量Fig.7 Production of SCFAs after simulated fermentation
3 讨论
天然多糖根据其单糖、糖苷键类型的多样而表现出不同活性。灵芝中提取的D-葡聚糖具有较高抗氧化力[19],杏鲍菇多糖主要由葡萄糖组成,比例可达78.32%,因而表现出较好的胰岛素耐受力[20]。体外模拟消化基于减少伤害实验动物,可重复等优点,近年来被研究者们广泛使用。梁美香等[21]对柑橘果胶进行体外模拟消化后,其产物抗氧化活性提高,对4种益生菌具有较好的促进增殖作用。本文中ATEP经“唾-胃-肠”模拟消化后并没有显著提高产物抗氧化活性,与YUAN等[22]对马尾藻多糖处理后自由基清除力降低类似,但相同处理后,马齿苋抗氧化活性得到增强[23]。
在体内消化系统中,α多糖(如淀粉)可被自身消化酶水解,同时受胆盐等化合物影响,α多糖理化性质容易被改变,进而被人体利用[24]。但天然多糖,特别是具有药用价值的活性多糖,其支链的β多糖并不能直接利用[25],而是在细菌的作用下逐渐水解为小分子物质方可被吸收,如短链脂肪酸。本研究中ATEP经模拟酵解可增加SCFAs,特别是乙酸含量,且对双歧杆菌、干酪乳杆菌具有促进增殖的益生作用。XIE等[26]认为,体外发酵可表征人类肠道微环境代谢各类食物的能力,并据此设计和制造有针对性的功能食品。
4 结论
本研究中ATEP总糖质量占比43.52%,在抗氧化方面,自由基清除率与抗氧化酶系均有较强作用。体外模拟消化显示,人体自有消化酶几乎不能对ATEP进行降解,但人体寄生细菌却对ATEP表现出较高喜好与利用率。ATEP在肠道微生物作用下发生不同程度水解,一方面为微生物生长提供能量物质来源,一方面经其代谢可转换为对人体有用的小分子短链脂肪酸。本试验选用的4种益生菌在无氧条件下的生长同样表现出对ATEP的依赖。这些说明ATEP作为天然来源真菌多糖,通过肠道微生物利用,产生了多种代谢产物,并对人类健康有重要意义。
