苦参碱调节Notch信号通路对高糖诱导的滋养层细胞增殖和凋亡的影响
2024-05-16李艳蓉邹余粮
李艳蓉 邹余粮
妊娠期糖尿病(gestational diabetes mellitus,GDM)会导致胎盘异常,严重者会导致妊娠受损以及新生儿出生缺陷[1]。而近几年GDM的发病率逐渐升高,也大幅增加了儿童在生命早期患肥胖、代谢综合征等疾病的几率[2-3]。研究显示,苦参的干燥根用于痢疾和湿疹等,在临床上应用广泛[4]。苦参中的主要活性成分就是苦参碱(C15H24N2O),具有治疗癌症、抗炎、抗糖尿病、改善心血管疾病等双重药理活性[5-6]。此外,Notch信号通路在胚胎和器官发育以及调控细胞生长方面具有重要作用,包括细胞增殖和凋亡;例如有研究显示Notch通路参与肝脏生长发育以及病理变化过程,可以抑制肝脏纤维化[7-8]。随后发现Notch信号通路诱导会导致细胞死亡并损伤组织,而且Notch通路被证明对糖尿病造成的肾损伤有关,通过抑制Notch通路可以有效缓解[9]。而笔者发现对于苦参碱能否通过调控Notch信号通路对高糖诱导的人滋养层细胞的增殖和凋亡产生的影响研究较少。本文探究苦参碱对高糖诱导的人绒毛膜滋养层细胞HTR-8/SVneo的增殖和凋亡的影响。
1 材料与方法
1.1 实验细胞 人绒毛膜滋养层细胞HTR-8/SVneo来自上海雅吉生物科技有限公司。
1.2 主要试剂 苦参碱来自成都普思生物科技股份有限公司;RPMI-1640细胞培养液购自上海浩洋生物科技有限公司;细胞计数试剂盒购自北京奥秘佳得医药科技有限公司;凋亡试剂盒、兔源一抗Notch1、PCNA、β-Tubulin购自爱必信(上海)生物科技有限公司;胎牛血清购自成都化夏化学试剂有限公司;Notch通路激活剂Jagged1购自上海研卉生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自上海一研生物科技有限公司;丙二醛(malondialdehyde,MDA)试剂盒购自上海研卉生物科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒来自上海康朗生物科技有限公司;兔源一抗BAX、Bcl-2购自上海钰博生物科技有限公司;辣根过氧化物酶标记的山羊抗兔二抗购自上海莼试生物技术有限公司。
1.3 细胞培养 将HTR-8/SVneo细胞在RPMI-1640培养基中培养,培养基补充添加10%FBS和1%的青霉素-链霉素。然后将细胞维持在37℃和5% CO2/95%空气的湿润培养箱中培养。
1.4 CCK-8法检测苦参碱对高糖诱导损伤的HTR-8/SVneo的活性影响及分组
1.4.1 细胞处理:将对数期生长的HTR-8/SVneo细胞消化、计数,以4×105个/mL的细胞密度接种在96孔板中。然后用25 mmol/L高糖诱导损伤[10],再用不同剂量的苦参碱(0.50、1.00、1.50、2.00 mmol/L)处理细胞[11],对照组(苦参碱0.00 mmol/L)不进行其他特殊处理。培养48 h后,每孔加入10 μL CCK-8试剂,然后将细胞继续培养2 h后,用多功能酶标仪检测细胞在450 nm处的吸光度值计算细胞的存活率。
1.4.2 细胞分组:取对数期的HTR-8/SVneo细胞,分为ctrl组、HG组、低浓度苦参碱组、高浓度苦参碱组、高浓度苦参碱+Jagged1组。除ctrl组用正常5 mmol/L葡萄糖培养,其余组均用25 mmol/L高糖浓度培养以诱导损伤。HG组细胞不再作其他特殊处理,根据上述CCK-8实验结果将其他组则分别再用1.00 μmol/L苦参碱、1.50 μmol/L高浓度苦参碱处理,而高浓度苦参碱+Jagged1组则在用1.5 μmol/L苦参碱处理的基础上,再加入500 μg/L Jagged1处理[12]。上述5组细胞置于培养箱中继续培养,以供后续实验使用。
1.5 CCK-8试剂盒检测HTR-8/SVneo细胞增殖能力 将5组HTR-8/SVneo以4×105个细胞/mL的浓度接种到96孔板中,根据1.4中相似的操作步骤孵育细胞,最后使用多功能酶标仪在450 nm处监测光密度值,处理计算5组细胞存活率。
1.6 流式细胞术检测HTR-8/SVneo细胞凋亡 将5组细胞消化处理、计数,先用ArmexinV-FITC避光孵育,然后加入碘化丙啶(PI)避光孵育。离心、PBS洗涤并混匀,在流式细胞仪(BD FACSCalibur)中检测细胞凋亡并处理分析细胞凋亡率。
1.7 5组HTR-8/SVneo细胞氧化应激指标检测 将5组细胞培养消化处理,然后裂解细胞,离心,取细胞上清液按照试剂盒说明书分别检测HTR-8/SVneo细胞中SOD、MDA水平。
1.8 Western blot检测5组HTR-8/SVneo细胞中Notch1、PCNA、BAX、Bcl-2蛋白表达 向收集处理的5组HTR-8/SVneo细胞中加入RIPA蛋白裂解缓冲液,再加入蛋白酶抑制剂,提取细胞总蛋白。将蛋白质用BCA检测试剂盒进行定量、凝胶电泳,转移到硝酸纤维素膜上、用5%的脱脂乳室温封闭,加入一抗Notch1(1∶1 000)、PCNA(1∶1 000)、Bcl-2(1∶1 000)、BAX(1∶1 000)、β-Tubulin(1∶1 000),4℃下孵育过夜,漂洗,然后将膜中加入二抗室温孵育2 h。漂洗并加入ECL显色试剂观察免疫反应蛋白,在成像仪中检测,最后使用Image Lab软件分析目标蛋白的表达。
2 结果
2.1 苦参碱对HG诱导损伤的HTR-8/SVneo细胞活性影响 随着苦参碱浓度的增加,与0.00 mmol/L苦参碱组比较,其他不同浓度苦参碱处理的HG损伤细胞的存活率不断升高(P<0.05)。因此在后续实验中选定1.50 mmol/L作为高浓度苦参碱组,而低浓度苦参碱组则为1.00 mmol/L。见表1。

表1 苦参碱对HG诱导的HTR-8/SVneo细胞活性影响 n=5,%,
2.2 5组HTR-8/SVneo细胞增殖能力比较 HG组比ctrl组细胞存活率明显下降(P<0.05);低浓度苦参碱组、高浓度苦参碱组与HG组比较,细胞存活率上升(P<0.05);高浓度苦参碱组与低浓度苦参碱比较,细胞存活率有更加明显的上升(P>0.05);高浓度苦参碱+Jagged1组与高浓度苦参碱组比较,细胞存活率下降(P>0.05)。见表2。

表2 5组HTR-8/SVneo细胞存活率、凋亡率比较 n=5,%,
2.3 5组HTR-8/SVneo细胞凋亡率比较 采用流式细胞术检测细胞凋亡情况。HG组HTR-8/SVneo细胞凋亡率与ctrl组比较明显升高(P<0.05);低浓度苦参碱组、高浓度苦参碱组与HG组比较,HTR-8/SVneo细胞凋亡率降低(P<0.05);高浓度苦参碱组与低浓度苦参碱比较,细胞凋亡率进一步降低(P<0.05);而高浓度苦参碱+Jagged1组与高浓度苦参碱组比较,细胞凋亡率上升,差异均有统计学意义(P<0.05)。见表2,图1。

图1 流式细胞术检测5组HTR-8/SVneo细胞凋亡水平
2.4 5组HTR-8/SVneo细胞中氧化应激指标SOD、MDA比较 与ctrl组比较,HG组SOD水平降低,MDA水平升高(P<0.05);与HG组比较,低剂量苦参碱组、高剂量苦参碱组SOD水平升高,MDA水平降低(P<0.05);与低剂量苦参碱组比较,高剂量苦参碱组SOD水平升高,MDA水平降低(P<0.05);与高剂量苦参碱组比较,高剂量苦参碱+MSU组SOD水平降低,MDA水平升高(P<0.05)。见表3。

表3 5组HTR-8/SVneo细胞中SOD、MDA水平比较 n=5,
2.5 5组HTR-8/SVneo细胞中Notch1、PCNA、BAX、Bcl-2相关蛋白表达比较 与ctrl组比较,HG组PCNA、Bcl-2蛋白表达降低,Notch1、BAX蛋白表达升高(P<0.05);与HG组比较,低浓度苦参碱组、高浓度苦参碱组的PCNA、Bcl-2蛋白表达升高,Notch1、BAX蛋白表达降低(P<0.05);与低浓度苦参碱组比较,高浓度苦参碱组PCNA、Bcl-2蛋白表达进一步升高,Notch1、BAX蛋白表达则更低(P<0.05);与高浓度苦参碱组比较,高浓度苦参碱+Jagged1组PCNA、Bcl-2蛋白表达出现降低现象,而Notch1、BAX蛋白表达则升高(P<0.05)。见图2,表4。
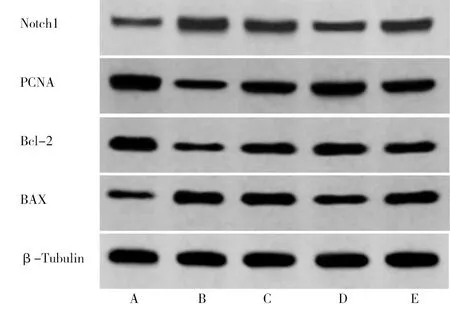
图2 Western blot检测HTR-8/SVneo细胞中Notch1、PCNA、BAX、Bcl-2蛋白表达;A ctrl组;B HG组;C 低浓度苦参碱组;D 高浓度苦参碱组;E 高浓度苦参碱+Jagged1组

表4 5组HTR-8/SVneo细胞中Notch、PCNA、BAX、Bcl-2蛋白表达比较 n=5,
3 讨论
妊娠期很容易发生糖尿病而导致GDM,使GDM的发病几率较高。而且GDM会使胎儿健康受到威胁[13]。胎盘作为母体与胎儿之间联系的重要器官,GDM的发生会使胎盘受到影响,使其形态以及功能都发生异常。胎盘中的绒毛滋养层细胞是重要的母胎交换屏障细胞,影响营养物质的交换,GDM发生时会导致绒毛滋养层细胞发生变化[14-15]。因此本文以高糖诱导人绒毛膜滋养层细胞HTR-8/SVneo,造成细胞损伤进行后续研究,期望改善高糖对滋养层细胞的损伤,为临床GDM治疗提供基础。结果显示,与ctrl组比较,HG组细胞多项实验结果异常,表明用高糖诱导的HTR-8/SVneo受到损伤,细胞增殖减少,凋亡增强。以上证实高糖诱导的HTR-8/SVneo细胞损伤可用作研究GDM的细胞模型。
苦参碱是天然的喹啉类生物碱,具有抗炎、镇痛、抗病毒等多种生物学作用,相关研究表明苦参碱可以减轻异丙肾上腺素诱导的大鼠心脏毒性;减轻阿霉素治疗引起的肾病;可作用于大鼠关节炎降低关节炎指数等,表明苦参碱是应用潜力很大的药物[16]。许多研究显示,苦参碱可以通过PI3K/AKT/mTOR通路诱导肺癌细胞凋亡;抑制NF-κB信号通路抑制乳腺癌细胞增殖等,参与细胞的增殖、凋亡、分化等过程[17]。所以本研究选取苦参碱探究其在除了抗肿瘤以外的作用,期望能扩大苦参碱的临床应用。本研究结果显示,不同浓度的苦参碱可以改善高糖诱导损伤的HTR-8/SVneo的活性,而且可以减轻HTR-8/SVneo的损伤,且随着苦参碱浓度升高,其效用也在逐渐增高。表明苦参碱可以增强高糖诱导的滋养层细胞的活性并抑制HTR-8/SVneo细胞的凋亡,从而发挥药物治疗作用。
Notch信号通路的关键部分包括Notch受体(Notch1、2、3)和Notch配体以及靶基因[18]。Notch受体与配体的结合使Notch发挥调节细胞生长的作用,这一作用在胎盘血管系统以及胎盘形成中至关重要;有报道显示,Notch信号通路在缺氧导致的滋养层迁移和侵袭过程有重要意义,会对先兆子痫的发生与发展有一定的促进作用[19-20]。本研究中通过对Notch信号通路的研究发现,高糖诱导的HTR-8/SVneo细胞中,HG组PCNA、Bcl-2蛋白表达降低,Notch1、BAX蛋白表达升高;低、高浓度苦参碱处理组均可改善高糖诱导的HTR-8/SVneo中以上蛋白的表达,并且苦参碱浓度越高,对上述蛋白的影响越明显。推测苦参碱可能通过抑制Notch信号通路降低对高糖诱导损伤的HTR-8/SVneo的凋亡,增加其细胞活性。为了验证该猜想,本研究利用Notch通路激活剂Jagged1来干预高浓度苦参碱处理的高糖诱导的HTR-8/SVneo细胞,结果提示,Jagged1减弱了高浓度苦参碱对高糖诱导的HTR-8/SVneo的损伤的影响,证实了苦参碱可能通过抑制Notch信号通路改善高糖诱导HTR-8/SVneo细胞造成的损伤,进而可能对GDM发挥一定的治疗作用。
综上所述,苦参碱可能通过抑制Notch信号通路抑制高糖诱导的HTR-8/SVneo细胞凋亡并提高细胞活性。该研究为扩大苦参碱的临床应用以及针对GDM的新型治疗方法治疗提供了理论基础。但是本研究尚存在不足之处,因为本文中对于苦参碱以及Notch通路的研究仅在细胞层面,而未进行体内研究,所以有待后续进行体内深入实验,进一步探究苦参碱的作用。
