亚临界萃取琥珀精油工艺优化及活性分析
2024-05-16杨媛媛唐语谦杨继国
杨媛媛,唐语谦,2,杨继国,2*
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.岭南现代农业科学与技术广东省实验室河源分中心,广东河源 517000)
琥珀是松柏科、云实科、南洋杉科等植物的树脂,经地质作用而形成的有机混合物[1],我国琥珀主要分布在辽宁、河南、广西等地,在世界主要分布在波罗的海沿海国家。琥珀中主要含树脂和挥发油[2],加热可散发出芳香的松香气味。远古时代就有记载,琥珀可用作中药材,治疗偏头痛、失眠、气喘、高血压、肿瘤等疾病,具有镇惊安神、散瘀止血、利水通淋的作用[1,3,4]。现代医学中,琥珀因其抗氧化功能和美白功能被广泛添加到药品化妆品中[5]。但对琥珀精油的提取及活性研究一直鲜有报道。
精油是植物代谢过程中产生的次生代谢物,被称为挥发油,具有强烈的感官特性和挥发性[6]。它们是从植物中提炼出的易挥发的油状液体,可以来自植物的不同部位,如根、茎、叶、花、果实和种子等[7]。植物精油具有浓郁的香气,并且具有抗氧化[8,9]、消炎、抑菌[10,11]和抗病毒[12]等多种功效,被广泛应用于食品、医学、美容、调香等领域,具有一定的研究价值[9,13]。随着人们对健康、安全和天然产物的重视,科研人员也在积极研究更安全健康的天然产物。传统的植物精油提取方法包括水蒸气蒸馏、溶剂浸提和压榨法[14],常规方法操作简单、成本低,但提取时间长且精油活性低,还容易残留有机试剂。此外,它也会破坏精油中的活性成分,对精油的开发利用带来不好的影响。近年来,超临界流体萃取[15]和亚临界流体萃取技术被广泛应用于植物精油的提取,展现出了其独特的优点[16]。超临界流体萃取是利用超临界状态下的流体作为溶剂进行物质提取,常用的超临界流体是二氧化碳(CO2),萃取时需在超高温和超高压的条件下进行,增加了设备成本和操作复杂性。超临界CO2在一定条件下具有较低的选择性,难以实现对复杂混合物中特定成分的高效分离,其溶解性受温度的影响较大,温度的变化会对提取效果产生较大影响[17]。亚临界流体萃取是一种利用处于亚临界状态的流体进行物质提取的方法,与超临界流体萃取法相比,亚临界流体萃取具有温和的操作条件、更好的选择性和提取效率以及低能耗等优势。亚临界流体萃取法还可以选择更广泛的溶剂,如丁烷、丙烷、二甲醚等,相比于CO2,这些有机溶剂操作条件温和,且具有更高的溶解性,能够更好的分离精油[18]。
本研究采用亚临界流体萃取法来提取琥珀精油,以琥珀精油得率为指标,考察不同萃取条件对得率的影响,以期获得亚临界流体萃取法提取琥珀精油最佳工艺。同时通过GC-MS 技术分析琥珀精油的化学成分,并以 DPPH 自由基和ABTS+自由基的清除试验评价琥珀精油的抗氧化活性,以抑制酪氨酸酶活性的试验评价琥珀精油的美白功效,为琥珀精油的合理开发利用提供可靠的理论基础。
1 材料与方法
1.1 实验原料
波罗的海琥珀粉;无水乙醇(AR)、过硫酸钾(AR)、正己烷(BR):购自上海麦克林生化科技有限公司;酪氨酸酶(≥500 U/mg)、L-DOPA(≥99%)、熊果苷、DPPH(≥98%)、ABTS(≥98%):购自上海源叶生物科技有限公司。
1.2 主要仪器设备
CBE-100L 型亚临界萃取设备,河南亚临界萃取技术有限公司;GCMS-QP2020 型气相色谱质谱联用仪,日本岛津公司;SpectraMax ix3 型多功能酶标仪,美国 Molecular Devices 公司;BSA124S 型电子天平,塞利多斯公司。
1.3 实验方法
1.3.1 亚临界流体萃取琥珀精油
称取琥珀粉末样品置于亚临界萃取罐中,关闭进料口,打开真空泵使萃取罐内压力低于0.1 MPa,随后通入亚临界状态下的丁烷进行萃取,液料比为2:1(mL:g),在50 ℃、8.5 MPa 下萃取40 min,重复萃取2 次。萃取完毕后,精油和萃取剂一起进入分离罐减压气化,气化后的丁烷被压缩液化供循环使用,精油则脱溶排出。
根据琥珀精油的质量和琥珀粉末总质量之比,计算琥珀精油得率。计算公式如下:
式中:
Y——琥珀精油得率,%;
m精油——琥珀精油的质量,g;
m总——琥珀粉末总质量,g。
1.3.2 亚临界萃取琥珀精油工艺优化
1.3.2.1 单因素试验设计
(1)液料比对琥珀精油得率的影响
称取1 kg 琥珀粉末,通入液化的丁烷作萃取剂,液料比设定1:1、1.5:1、2:1、2.5:1、3:1(mL:g)5个水平,在8.5 MPa、50 ℃条件下萃取40 min,萃取2 次,计算琥珀精油得率,确定最佳液料比。
(2)萃取温度对琥珀精油得率的影响
称取1 kg 琥珀粉末,通入液化的丁烷作萃取剂,液料比为2:1(mL:g),萃取温度分别设定为40、50、60、70、80 ℃,在8.5 MPa 下萃取40 min,萃取2 次,计算琥珀精油得率,确定最佳萃取温度。
(3)萃取时间对琥珀精油得率的影响
称取1 kg 琥珀粉末,通入液化的丁烷作萃取剂,液料比为2:1(mL:g),在8.5 MPa、50 ℃条件下分别萃取20、30、40、50、60 min,萃取2 次,计算琥珀精油得率,确定最佳萃取时间。
1.3.2.2 响应面试验设计
在单因素试验基础上,根据Box-Behnken 中心组合试验设计原则,选取液料比(A)、萃取温度(B)、萃取时间(C)作为变量,得率(Y)为响应值,设计响应面试验,具体试验因素和水平设计见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface methodology
1.3.3 琥珀精油化学成分分析
(1)样品制备
参照 Qader 等[19]的方法制备样品:称取0.1 g 琥珀精油,用适量正己烷溶解并定容至100 mL,制备成1 mg/mL 的溶液,过膜备用。
(2)GC-MS 分析条件
色谱条件:色谱柱为 SH-Rxi-5Sil-MS(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱。升温程序:柱温 50 ℃,以 5 ℃/min 升温至 310 ℃,保持10 min。汽化室温度 250 ℃;载气为高纯He(99.999%);载气流量1.0 mL/min;不分流进样;溶剂延迟时间 3.0 min。
质谱条件:电子能量 70 eV 的 EI 离子源;离子源温度 230 ℃;四极杆温度150 ℃;接口温度 280 ℃;扫描范围 40~800m/z。
(3)质谱分析
通过气相色谱-质谱分析,结合 NIST 14s.lib谱库检索,利用保留指数对琥珀精油中的主要组分进行定性分析,并通过色谱峰面积归一化法对其中的主要组分进行相对定量。
1.3.4 抗氧化能力测定
1.3.4.1 琥珀精油对DPPH自由基清除能力的测定
参照崔歆卬等[20]的方法,并加以改进:准确称取3.94 mg DPPH 粉末溶于无水乙醇,配置成0.1 mmol/L的DPPH 溶液,避光保存备用。将琥珀精油配制成质量浓度分别为2、4、6、8、10、12、14、16、18、20 mg/mL 的琥珀精油乙醇溶液,另配制2、4、6、8、10、12、14、16、18、20 μg/mL 的Vc 乙醇溶液作阳性对照,以无水乙醇做阴性对照。
准确吸取待测样品100 μL 于96 孔板中,迅速加入100 μL DPPH 溶液混合均匀,25 ℃避光反应30 min 后,于波长517 nm 处测量吸光度,平行三次试验取平均值。计算DPPH 自由基清除率和半数抑制浓度IC50:
式中,
E——DPPH 自由基清除率,%;
As——样品反应液的吸光度值;
As′——精油样品与无水乙醇混合后的吸光度值;
Ac——无水乙醇与DPPH 溶液混合后的吸光度值。
1.3.4.2 琥珀精油对ABTS+自由基清除能力的测定
参照贾盟盟[21]等的方法,并加以改进:配制7 mmol/L ABTS 溶液和4.9 mmol/L K2S2O8溶液,二者等体积混合,置于暗处12~16 h 即配置成ABTS储备液,然后用无水乙醇稀释,在734 nm 波长下调整ABTS 反应液的吸光度为0.70±0.02。将琥珀精油配制成浓度分别为2、4、6、8、10、12、14、16、18、20 mg/mL 的琥珀精油乙醇溶液,另配制2、4、6、8、10、12、14、16、18、20 μg/mL 的Vc 乙醇溶液作阳性对照,以无水乙醇做阴性对照。
准确吸取待测样品100 μL 于96 孔板中,迅速加入200 μL ABTS 溶液混合均匀,25℃避光反应6 min 后,于波长734 nm 处测量吸光度,平行三次试验取平均值。计算ABTS+自由基清除率和和半数抑制浓度IC50:
式中,
H——ABTS+自由基清除率,%;
As——样品反应液的吸光度值;
As′——精油样品与无水乙醇混合后的吸光度值;
Ac——无水乙醇与ABTS 反应液混合后的吸光度值。
1.3.5 琥珀精油抑制酪氨酸酶活性的测定
1.3.5.1 酪氨酸酶的抑制率
参照董雪等[22]的方法,并加以改进:用DMSO稀释琥珀精油,使其质量浓度为0.5、1.0、1.5、2.0、2.5 mg/mL,备用。准确称取酪氨酸酶和L-DOPA,用pH 值6.8 的磷酸缓冲溶液溶解并配置成50 U/mL 的酪氨酸酶溶液和1.5 g/L 的L-DOPA 溶液,以L-DOPA为底物。
在96 孔板中加入50 μL 精油样品和50 μL 浓度为50 U/mL 的酪氨酸酶溶液,同时加入100 μL 的磷酸缓冲溶液(pH 值6.8),将 96 孔板置于孔板振荡器中震荡均匀,并于37℃下保温10 min。随后在每孔中加入质量浓度为1.5 g/L 的L-DOPA 溶液,再次置于孔板振荡器中震荡均匀,并于37℃下保温30 min,用酶标仪测定每个孔在475 nm 处的吸光度。同时以磷酸缓冲溶液(pH值6.8)做空白对照,以熊果苷做阳性对照。平行三次试验,取平均值。根据公式计算琥珀精油样品对酪氨酸酶活性的抑制率:
式中,
R——酪氨酸酶抑制率,%;
A——PBS+酪氨酸酶+精油+L-DOPA 的吸光度值;B——PBS+精油+L-DOPA 的吸光度值;
C——PBS+酪氨酸酶+L-DOPA 的吸光度值;
D——PBS+L-DOPA 的吸光度值。
1.3.5.2 酪氨酸酶的抑制类型
在上述测定体系中,将酪氨酸酶的活性固定为50 U/mL,改变底物L-DOPA 的浓度,依次为 0.5、1、1.5、2 mmol/L。分别测定酪氨酸酶在质量浓度为0、500、1 000、1 500 μg/mL 的琥珀精油下的酶反应速率。根据米氏方程[23],以Lineweaver-Burk 双倒数作图法来获得酶抑制动力学参数,从而判断琥珀精油对酪氨酸酶的抑制类型。米氏方程公式为:
式中,
Km——米氏常数;
[S]——底物浓度;
Vm——最大反应速率。
1.3.6 数据分析
采用 SPSS Statistics 26 对实验数据进行统计学分析,并用 Origin 2023 进行处理,每组实验设 3 个平行组。响应面试验选用 Design-Expert 10.0.6 软件中的 Box-Behnken 法进行分析。气相色谱-质谱结合 NIST 14s.lib 谱库检索,结合保留指数对主要组分进行定性分析,采用归一法进行相对定量分析,结果用 Microsoft Excel 汇总。
2 结果与讨论
2.1 单因素试验结果与分析
(1)液料比
从图1 可以看出,随着丁烷添加量的增大,琥珀精油的得率也逐渐增加。当液料比在1:1~2:1(mL:g)范围内增大时,琥珀精油的得率增速较快;液料比在2:1(mL:g)时,琥珀精油得率达到1.28%,此时继续增加丁烷的添加量,琥珀精油得率仍逐渐增加,但增幅却大大减小。当液料比为 2.5:1(mL:g)和 3:1(mL:g),琥珀精油得率分别为 1.31% 和1.32%,与液料比为 2:1(mL:g)的得率无明显提高。一般来说,溶剂用量越大,提取物质的得率越大,但当溶剂用量达到一定值后,精油已基本提取完全,此时继续增加溶剂量,不会提高得率,并且浪费溶剂和能源[24]。综合考虑精油得率和萃取剂的回收问题,选择2:1(mL:g)的液料比最为合适。

图1 液料比对琥珀精油得率的影响Fig.1 Effect of liquid-solid ratio on amber essential oil yield
(2)萃取温度
萃取温度对琥珀精油得率的影响如图2 所示,当温度在40~60 ℃内升高时,琥珀精油得率随之呈现上升趋势;萃取温度为60 ℃时,精油得率最高,达到1.45%。这是因为提高萃取温度能促进分子的运动加快,增加溶质的挥发和扩散,从而提高萃取的效率。但是温度从60 ℃增加到80℃时,精油得率反而随着温度的升高而降低,这可能是因为过高的温度造成一些热敏成分被分解破坏,使萃取率出现降低的情况[25]。因此综合考虑生产能耗问题,将琥珀精油的亚临界流体萃取温度确定为60 ℃。

图2 萃取温度对琥珀精油得率的影响Fig.2 Effect of extraction temperature on amber essential oil yield
(3)萃取时间
由图3 可知,随着萃取时间的增长,萃取率整体呈现上升趋势。当萃取时间从30 min 增加到50 min 时,琥珀精油得率随之显著提高,从0.78%提高至1.28%;当萃取时间在50 min 后,琥珀精油得率基本保持不变,不再有显著变化;萃取60 min 后,精油萃取率出现一定的下降趋势,聂韡等[26]在研究萃取时间对亚临界萃取紫茉莉籽油的影响也出现相同趋势,在60 min 后得率增速减缓,趋于平衡。这是因为油脂在萃取剂中达到平衡需要一定的时间[27],继续延长萃取时间不能明显提高精油得率,还会造成能耗增加,延长工序,因此最佳萃取时间选择为50 min。

图3 萃取时间对琥珀精油得率的影响Fig.3 Effect of extraction time on amber essential oil yield
(4)萃取次数
由图4 可以看出,随着萃取次数的增加,琥珀精油提取率呈现先上升后趋于平缓的趋势。当萃取次数在1~3 次时,琥珀精油提取率随萃取次数增加而显著上升;3 次之后,继续增加萃取次数,提取率增幅大大减小,几乎保持不变。因此,综合考虑生产成本和经济效益,最终选择3 次为最佳萃取次数。

图4 萃取次数对琥珀精油得率的影响Fig.4 Effect of extraction times on amber essential oil yield
2.2 亚临界流体萃取琥珀精油响应面试验结果
2.2.1 响应面试验设计及结果
根据单因素试验结果和Box-Behnken 的中心组合设计原则,设计了三因素三水平试验方案。响应变量Y 为得率,响应因素A 为液料比,B 为萃取温度,C 为萃取时间,结果见表2。
2.2.2 建立回归模型及方差分析
根据表2 的结果,利用Design-Expert 13 软件对试验结果进行回归拟合,所得回归方程为:Y=1.60+0.039 4A-0.016 5B+0.038 1C-0.038 3AB+0.006 5AC-0.041 7BC-0.166 4A2-0.077 2B2-0.227 9C2。
由表3 中得结果可知,回归模型P值< 0.000 1,达到极显著水平,失拟项P=0.732 5,表现为不显著,说明回归模型良好。另外得出模型的决定系数R2=0.993 1,调整后决定系数RAdj2=0.984 2,表示回归模型与预测值之间的拟合度好,在试验条件范围内能明确反映琥珀精油得率的变化,因此可以利用上述方程模型对亚临界最优萃取工艺进行分析和预测。一次项中A、C,交互项中AB、BC 以及二次项中A2、B2、C2均表现出极显著差异 (P< 0.01),由F值大小可判断出3 个单因素对琥珀精油得率的影响顺序为A(液料比)>C(萃取时间)>B(萃取温度);交互项影响大小为BC>AB>AC;二次项影响大小为C2>A2>B2。

表3 响应面模型的方差分析Table 3 The variance analysis for Response surface model
2.2.3 两因子交互作用
等高线图和响应面图是两种用于分析两个因素之间交互作用对响应值影响的方法。在等高线图中,如果两个因素之间的交互作用较弱,则等高线更接近圆形;如果交互作用较强,则等高线更接近椭圆形。在响应面图中,如果曲面较陡峭,则响应值的变化幅度较大,表明两个因素之间的交互作用较强[28]。对比图5 至图7 可以看出,液料比(A)与萃取时间(B)交互作用的等高图接近圆形,而液料比(A)与萃取温度(C)、萃取时间(B)与萃取温度(C)的等高图呈椭圆形,说明三个因素之间的交互作用对亚临界流体萃取琥珀精油得率的影响程度依次为:BC>AB>AC。
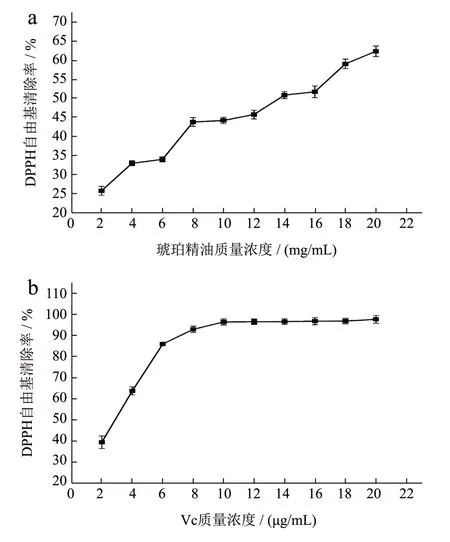
图5 不同质量浓度琥珀精油 (a) 和Vc (b) 对DPPH自由基的清除能力Fig.5 Concentration effects of antioxidant-DPPH radical reactions for amber essential oil (a) and Vc (b)

图5 琥珀精油挥发性化学成分的总离子流图Fig 5 Total ion chromatogram of the volatile chemical components of amber essential oil

图5 液料比与萃取温度交互作用的响应面图和等高图Fig.5 Response surface and contour diagrams of the interaction of solid-liquid ratio and extraction temperature
2.2.4 最优组合和验证试验
通过模型预测,得到亚临界流体萃取琥珀精油的最佳工艺条件为液料比2.07(mL/g)、萃取温度58.33 ℃、萃取时间50.97 min,在此工艺条件下琥珀精油的提取率为1.61%。结合实际操作情况,将最优方案调整为液料比2.1(mL/g)、萃取温度58 ℃、萃取时间51 min,在上述条件组合下平行三次试验,得到琥珀精油的得率为1.62%,与预测值相近,表明该模型达到预期效果,具有可行性。
2.3 琥珀精油化学成分分析
从图5 中可以看出,亚临界流体萃取得的琥珀精油挥发性成分GC-MS 分析总离子流色谱图共检测出40 个峰,经谱库对比分析后,共有30 种有效成分被确认。为了更准确地分析琥珀精油挥发性成分,采用面积归一法进行定量处理,所得各成分的结果详见表4。

表4 琥珀精油成分分析表Table 4 Component analysis of amber essential oil
从亚临界萃取的琥珀精油中共鉴定出30 种化学物质,大多数为萜类化合物,包括倍单萜类12种、半萜类9 种、二萜类3 种,其相对百分含量分别为74.45%、7.38%、4.93%。单萜类物质主要包括对伞花烃(29.39%)、左旋龙脑(18.02%)、葑醇(8.46%)、左旋樟脑(7.12%)、桉叶油醇(6.40%);倍半萜类化合物主要包括反-菖蒲烯(1.11%)、喇叭茶醇(2.38%);二萜类化合物主要为脱氢松香醇(2.52%)、西松烯(1.95%)。其他萜类化合物相对百分含量均小于1%。除了萜类化合物,亚临界流体萃取的琥珀精油中还有一小部分芳香类、醛类和酮类物质,主要有1,1,-(1,10-癸烷二基)二(十氢萘)(2.76%)、α-紫罗兰酮(2.02%)、13-异丙基罗汉松-8,11,13-三烯-19-醛(1.56%),其余化合物的相对百分含量均小于1%。程松等[29]研究结果表明,采用水蒸气蒸馏法制取的琥珀挥发油中主要化学成分是倍半萜类化合物及其衍生物,包括斯巴醇(16.635%)、氧化石竹烯(12.927%)、咕巴烯(7.858%)、马兜铃烯环氧化物(5.819%)、榄香烯(5.710%)和石柱烯(4.203%)等,经对比发现,亚临界流体萃取所得琥珀精油的高沸点组分及其含量明显高于水蒸气蒸馏法制取的琥珀精油,如左旋龙脑、葑醇、桉叶油醇等物质。导致琥珀精油化学成分产生差异可能是因为提取方法不同,也可能因为是琥珀产地不同。总之,琥珀精油成分的复杂性为琥珀资源的进一步合理开发利用带来了一定的优势。还有研究表明[30],植物树脂的化学成分以单萜、倍半萜、二萜、三萜等多种萜类化合物为特征。单萜和倍半萜类化合物大部分为挥发性和芳香性化合物,从而形成精油组分。从成分分析结果来看,亚临界萃取琥珀精油中单萜类物质的相对百分含量最高,说明琥珀精油的香气成分主要来源于单萜类化合物。
2.4 琥珀精油抗氧化能力分析
2.4.1 琥珀精油对DPPH自由基的清除能力
1,1-二苯基-2-苦基肼(DPPH)自由基极其稳定,在波长515 nm 处有强吸收峰,可用来评估抗氧化物的供氢能力[31]。当抗氧化剂与稳定的DPPH自由基发生反应,其颜色从深紫色变为浅黄色,褪色的强度表明了游离抗氧化剂的自由基清除活性。因此可以通过定量测定反应前后溶液在515 nm 处的吸光度大小,进而评价其抗氧化活性。由图5 可见,琥珀精油和Vc 都具有清除DPPH 自由基的能力。在精油质量浓度为2~20 mg/mL 范围内,随着琥珀精油浓度的增大,DPPH 自由基的清除率逐渐上升,呈现出良好的剂量关系;在Vc 质量浓度为2~20 μg/mL 内,其对DPPH 自由基的清除率则呈现先上升后平稳的趋势。根据IC50计算,琥珀精油和Vc 清除 DPPH 自由基的 IC50值分别为12.66 mg/mL和 2.51 μg/mL。结果表明,在一定浓度下,琥珀精油具有较强的 DPPH 自由基清除能力,但是与阳性对照Vc 对比仍有一定差距。
Chi 等[32]指出抗氧化活性化合物单萜(莰酮γ-松油烯)、芳樟醇和石竹烯被证明是精油具有抗氧化能力的主要原因。也有研究报道[33]了在DPPH 自由基清除实验中,三种萜类化合物由强至弱的顺序为柠檬烯、α-松油醇、γ-萜品烯。结合琥珀精油化学成分分析,琥珀精油中的萜类化合物是其清除DPPH 自由基能力的主要原因,萜类、芳香类、醛类等化合物的共同作用也对其抗氧化活性做出贡献。
2.4.2 琥珀精油对ABTS+自由基的清除能力
ABTS+自由基,即2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐,如果与过二硫酸钾反应,可以生成稳定的蓝绿色ABTS+.,该自由基在734 nm有最大吸收峰[34]。若反应体系的吸光度降低,则说明该物质具有自由基清除活性,因此可以通过测定反应体系的紫外吸光度大小变化,来反映物质的抗氧化能力。
由图6 可以看出,在精油质量浓度为2~10 mg/mL范围内,随着琥珀精油质量浓度的增大,ABTS+自由基清除率逐渐增大;精油质量浓度大于10 mg/mL 时,ABTS+自由基清除率达到94.7%以上,随后变化则趋于平缓;Vc 对ABTS+自由基的清除率也是随着质量浓度增大呈现先上升后平缓的趋势,在其质量浓度为8 μg/mL 是,清除率达到97.36%。根据IC50计算,琥珀精油和 Vc 清除 ABTS+自由基的 IC50值分别为2.91 mg/mL 和 2.06 μg/mL。上述结果表明,在一定质量浓度范围内琥珀精油对ABTS+自由基具有较强的清除能力,且但仍弱于Vc 的清除能力。

图6 不同质量浓度琥珀精油 (a) 和Vc (b) 对ABTS+自由基的清除能力Fig.6 Concentration effects of antioxidant-ABTS+ radical reactions for amber essential oil (a) and Vc (b)

图6 液料比与萃取时间交互作用的响应面图和等高图Fig.6 Response surface and contour diagrams of the interaction of solid-liquid ratio and extraction time
2.5 琥珀精油抑制酪氨酸酶活性的测定
2.5.1 酪氨酸酶的抑制率
黑色素是由多种酶共同作用形成的,其中酪氨酸酶占主导作用[35]。酪氨酸酶可以将L-酪氨酸羟基化为3,4-二羟基苯基-L-丙氨酸(L-DOPA),并进一步将L-DOPA 氧化为多巴醌,多巴醌容易聚合并与胞内蛋白作用,从而生成黑色素物质[36]。因此,可以通过测定样品对酪氨酸酶的抑制率来判断其美白活性[37,38]。
琥珀精油对酪氨酸酶的抑制率如图7 所示。随着质量浓度在0.5~2.5 mg/mL 内逐渐增大,琥珀精油和熊果苷对酪氨酸酶的抑制率也逐渐增大,呈现较好的剂量关系。在质量浓度为2.5 mg/mL 时,琥珀精油和熊果苷对酪氨酸酶的抑制率分别达到了68.6%和79.8%,均表现出较强的抑制能力。从图中可以看出,同等质量浓度下,琥珀精油对酪氨酸酶活性的抑制能力强于熊果苷。因此,琥珀精油作为天然美白成分值得进一步开发研究。
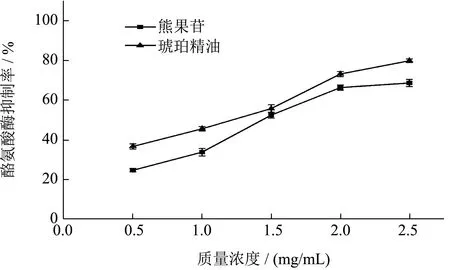
图7 琥珀精油对酪氨酸酶的抑制率Fig.7 Inhibition rate of amber essential oils on tyrosinase

图7 萃取温度与萃取时间交互作用的响应面图和等高图Fig.7 Response surface and contour diagrams of the interaction of extraction temperature and extraction time
2.5.2 酪氨酸酶的抑制类型
琥珀精油对酪氨酸酶活性的抑制动力学分析如图8 所示,不同浓度琥珀精油的曲线相交于第二象限x 轴上的一点,随着精油浓度的逐渐增大,横截距不变,纵截距随之增大,符合非竞争性抑制的特征。因此判断琥珀精油对酪氨酸酶的抑制类型为非竞争性抑制,即在酶反应过程中,琥珀精油可能与酪氨酸酶的非活性部位结合来抑制其活性,或是与底物结合成络合物进行作用,精油和底物之间并不存在竞争作用。根据米氏方程式可以算出,在不同浓度的琥珀精油下,Km的值保持不变为 0.281。

图8 琥珀精油对酪氨酸酶的抑制类型Fig.8 Types of inhibition of tyrosinase by amber essential oil
3 结论
本文探究了亚临界萃取琥珀精油的工艺条件、成分分析以及抗氧化活性。以琥珀精油得率为指标,在单因素试验的基础上进行响应面优化,得出最佳的提取条件为:液料比为2.1(mL/g)、萃取温度为58 ℃、萃取时间为51 min、萃取次数为3 次,在此条件下,琥珀精油的得率为1.62%。通过GC-MS分析,亚临界萃取的琥珀精油共鉴定出30 种化合物成分,可以分为单萜类、倍半萜类、二萜类、芳香类、酮类和醛类化合物,其中伞花烃(29.39%)和左旋龙脑(18.02%)的含量最高,这两种化合物可能是琥珀精油香气成分的主要来源。琥珀精油对DPPH 自由基和ABTS+自由基有较强的清除作用,IC50值分别为12.66 mg/mL 和2.91 mg/mL。酪氨酸酶活性抑制试验结果表明,琥珀精油对酪氨酸酶的抑制属于非竞争性抑制,IC50值为1.13 mg/mL,其美白活性高于同等浓度的熊果苷。相关研究表明[39],植物精油的化学组成被认为是其抗氧化能力的重要组成部分。因此琥珀精油的功能活性可能主要与其含量较高的萜类化合物有关,也是萜类、酯类、醇类等多种化学成分共同作用的结果。
本试验首次采用亚临界流体萃取技术提取琥珀精油,并采用GC-MS 联用技术对其化学成分进行了分析,并研究了其抗氧化活性和美白活性,为琥珀资源的进一步开发利用提供科学依据,可以用作抗氧化剂和天然美白剂应用于食品、日化和医药领域。
