聚乙二醇干扰素α-2b联合替诺福韦对乙型肝炎患者肝功能及安全性的影响
2024-05-14王芳芳
王芳芳
南阳医学高等专科学校第一附属医院感染性疾病科,河南 南阳 473000
乙型肝炎病毒(HBV)是一种DNA 病毒,属于嗜肝DNA 病毒科,主要流行于亚洲地区,发病率在国内也逐年上升,临床主要表现有乏力、肝区疼痛等症状,严重时甚至伴有慢性肝病面容、肝功能持续异常等,若不及时进行治疗,最后可能转化为肝硬化、肝癌等,给患者造成巨大痛苦,严重威胁人们生命安全[1-2]。目前临床主要通过消除HBV 或抑制病毒复制的方法进行治疗,其中核苷(酸)类似物和干扰素应用最为广泛,为主要使用的两大抗病毒药物[3]。替诺福韦是一种常用核苷酸(类)抗病毒药物,可以通过抑制病毒DNA链延长,将其复制路径阻断,从而对HBV 进行抑制,控制病情向肝硬化、肝癌发展[4]。干扰素α 可直接抑制病毒复制,增强机体抗病毒能力,具有乙型肝炎病毒核心抗原(HBcAg)血清学转换率高、疗效确切等优点,有效改善患者临床症状,为乙肝主要治疗药物之一[5]。干扰素α-2b 具有广谱抗病毒、抗肿瘤、抑制细胞增殖等作用,可以提高患者免疫功能[6]。本研究比较替诺福韦联合干扰素α-2b 对乙型肝炎患者肝功能及安全性的影响。现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2018 年10 月—2020 年8 月南阳医学高等专科学校第一附属医院收治的96 例乙型肝炎患者作为研究对象,采用乱数表法分为A 组和B 组,每组各48 例。A 组男26例,女22 例;年龄23~66 岁,平均年龄(46.18±11.05)岁;B 组男24 例,女24 例;年龄22~64 岁,平均年龄(45.28±10.64)岁。两组患者基线资料具有可比性(P>0.05)。本研究经医院医学伦理委员会审批。
1.2 入选标准
纳入标准:符合《慢性乙型肝炎防治指南(2015 年版)》[7]相关诊断标准,研究开始前3 个月未服用抗病毒药物,患者及家属均已知情同意。
排除标准:重度认知障碍或依从性不良,伴有其他肝炎病毒感染,对本研究中药物过敏,合并脑、心、肾等严重功能异常。
1.3 方法
A 组采用替诺福韦酯片(成都倍特药业有限公司,国药准字H20163436,规格:300 mg/片)治疗,1片/d。B组在A 组用药基础上给予聚乙二醇干扰素α-2b(厦门特宝,国药准字S20160001,规格:180 μg)180 μg 皮下注射,每周1次。两组患者治疗时间均为24周。
1.4 观察指标
(1)肝功能指标:分别于治疗前后取患者空腹静脉血5 mL,3 000 r/min 离心15 min,取上清液待检,采用全自动血液分析仪(武汉科尔达医疗科技有限公司,型号BC-5100CRP)检测血清中总胆红素(TBIL)、白蛋白(ALB)、天门冬氨酸氨基转移酶(AST)和谷丙转氨酶(ALT)水平[8]。(2)Th1/Th2 细胞因子水平:治疗前后分别采用酶联免疫吸附测定干扰素-γ(IFN-γ)、白介素-10(IL-10)、白介素-4(IL-4)和白介素-2(IL-2)水平[9]。(3)抗病毒情况:采用酶联免疫吸附测定法检测患者治疗前以及治疗后的乙型肝炎e 抗原(HBeAg) 和ALT 水平,计算HBV-DNA 转阴率、HBeAg转阴率、转换率和ALT复常率。计算方式:HBeAg转阴率=HBeAg消失例数/总例数×100%,HBeAg 转换率=HBeAg 消失并产生乙型肝炎e 抗体(HBe-Ab)例数/总例数×100%,HBV-DNA 转阴率=HBV-DNA 转阴例数/总例数×100%,100 IU/mL 为HBV-DNA 检测下限值,ALT 复常率=ALT 复常例数/总例数×100%[10]。(4)临床 疗 效:治 疗24 周 后 评 价 疗 效[11]。HBV-DNA 转 阴、HBeAg 血清学转换,肝功能指标(ALT)水平恢复正常,症状及体征完全消失为显效;症状及体征明显改善为有效;各项指标未改变或加重、症状或体征未改变或加重为无效。治疗有效率=显效率+有效率。(5)不良反应:对两组患者治疗期间出现的不良反应进行记录,当症状较为严重时立即停药。
1.5 统计学方法
采用SPSS 24.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后肝功能指标情况
治疗后,两组患者TBIL、AST 与ALT 水平均下降且B组下降幅度大于A 组,两组患者ALB 水平均升高且B 组升高幅度大于A组,差异有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后肝功能指标情况(±s)
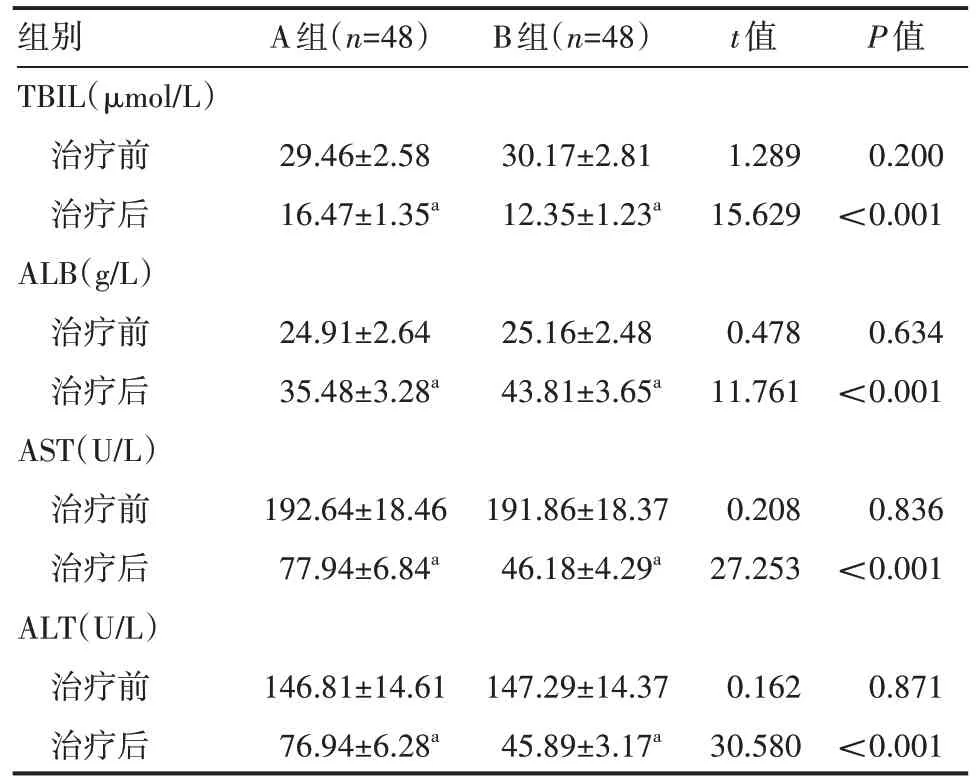
表1 两组患者治疗前后肝功能指标情况(±s)
a表示与同组治疗前相比,P<0.05。
组别TBIL(μmol/L)治疗前治疗后ALB(g/L)治疗前治疗后AST(U/L)治疗前治疗后ALT(U/L)治疗前治疗后A组(n=48)B组(n=48)t值P值29.46±2.58 16.47±1.35a 30.17±2.81 12.35±1.23a 1.289 15.629 0.200<0.001 24.91±2.64 35.48±3.28a 25.16±2.48 43.81±3.65a 0.478 11.761 0.634<0.001 192.64±18.46 77.94±6.84a 191.86±18.37 46.18±4.29a 0.208 27.253 0.836<0.001 0.871<0.001 146.81±14.61 76.94±6.28a 147.29±14.37 45.89±3.17a 0.162 30.580
2.2 两组患者治疗前后Th1/Th2细胞因子水平情况
治疗后,两组患者IFN-γ 和IL-2 水平均升高且B 组升高幅度大于A 组,IL-10 和IL-4 水平均降低且B 组降低幅度大于A组,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后Th1/Th2细胞因子水平情况(±s) ng/L

表2 两组患者治疗前后Th1/Th2细胞因子水平情况(±s) ng/L
a表示与同组治疗前相比,P<0.05。
组别IFN-γ治疗前治疗后IL-10治疗前治疗后IL-4治疗前治疗后IL-2治疗前治疗后A组(n=48)B组(n=48)t值P值30.25±1.35 37.61±1.54a 30.46±1.28 45.59±2.17a 0.782 20.777 0.436<0.001 16.67±1.26 10.59±0.59a 16.24±1.14 7.47±0.65a 1.753 24.624 0.083<0.001 50.49±3.59 39.76±5.48a 51.64±3.41 28.49±5.16a 1.609 10.373 0.111<0.001 0.803<0.001 30.58±10.46 46.48±6.49a 29.92±11.08 57.64±7.81a 0.250 7.614
2.3 两组患者抗病毒指标情况
B 组HBV-DNA 转阴率、ALT 复常率、HBeAg 转阴率、HBeAg 转换率均高于A 组,差异有统计学意义(P<0.05),见表3。

表3 两组患者抗病毒指标情况 例(%)
2.4 两组患者临床疗效情况
B组治疗总有效率高于A组,差异有统计学意义(P<0.05),见表4。

表4 两组患者临床疗效情况 例(%)
2.5 两组患者不良反应发生情况
两组患者不良反应发生率比较,差异无统计学意义(P>0.05),见表5。

表5 两组患者不良反应发生情况 例(%)
3 讨论
HBV 感染现已成为我国最严重的公共卫生问题之一,越来越多的患者接受核苷(酸)类药物治疗,但乙肝患者服药周期较长,随着抗病毒药物长期使用,耐药性、药物不良反应等问题日益突出,因此,探索新型治疗药物已成为研究热点。HBV-DNA 主要以共价闭合环状DNA 形式存在于宿主细胞核内,是HBV原始复制模板,由于其长期存在于细胞核内,多数药物难以将其彻底清除,而替诺福韦可以通过抑制HBV-DNA 逆转录酶发挥作用,对HBV 抑制率较高。但口服抗病毒类药物均需通过肝脏代谢,随着用药时间延长,乳酸酸中毒、血磷降低、急性肾衰竭等不良事件时有发生,需在用药过程中密切关注患者肾功能,及时做出调整[12]。聚乙二醇干扰素α-2b 也是一类广谱抗病毒药物,主要通过抑制病毒复制和细胞增殖发挥作用,还可以通过增强淋巴细胞对靶细胞毒性对机体免疫进行调控[13]。本研究探讨聚乙二醇干扰素α-2b 和替诺福韦联用对乙型肝炎患者肝功能和安全性的影响。
ALT 和AST 存在于肝细胞中,肝功能正常时水平较低,只有微量被释放进入血液,当肝脏功能受损,ALT 和AST被大量释放入血液,水平显著升高[14]。当肝细胞出现功能障碍时,对游离胆红素的结合和摄取出现障碍,血清TBIL水平将会升高。ALB主要作用是稳定血浆渗透压,为物质和信息交流提供保障,使组织液间和细胞内外液间实现正常交流,每天可由肝脏定量合成。但当肝细胞功能受损,导致ALB 水平降低,机体营养和免疫防御功能将失去稳定[15]。本研究结果显示,治疗后,两组患者TBIL、AST与ALT 水平均下降,且B 组水平下降较为明显,两组患者ALB 水平较治疗前均升高且B 组高于A 组,表明聚乙二醇干扰素α-2b 联合替诺福韦可有效抑制HBV 复制,改善肝功能的作用。IFN-γ 和IL-2 由Th1 细胞分泌,可以促进巨噬细胞、自然杀伤细胞的分化和增殖,参与抗病毒和抗炎;IL-10 和IL-4 由Th2 细胞分泌,主要功能是刺激B 细胞增殖,参与体液免疫。正常情况下,机体内Th1/Th2 处于平衡状态,乙肝患者体内存在Th1/Th2 失衡,随着患者病情好转,Th1/Th2 恢复平衡,保持机体正常功能状态[16]。本研究中,治疗后的两组患者IFN-γ 和IL-2 水平均升高且B组高于A 组,IL-10 和IL-4 水平均降低且B 组低于A 组,表明聚乙二醇干扰素α-2b 和替诺福韦联用可通过调节Th1/Th2 平衡,改善免疫功能。分析可能是与聚乙二醇干扰素α-2b 清除宿主病毒免疫功能有关。血清转换是提示其停药敏感指标,若患者在发病初期就出现HBeAg 血清转换,将有利于提高治疗效率。本研究中,通过与A 组相比,B 组HBV-DNA 转阴率、ALT 复常率、HBeAg 转阴率、HBeAg 转换率、治疗总有效率均更高,且两组不良反应发生率无明显差异,结果表明,联合用药不仅能有效提高临床疗效,还具有良好的安全性。患者服用替诺福韦酯能较快被肠道吸收,生成替诺福韦双磷酸盐,从而进一步发挥抗病毒作用。聚乙二醇干扰素α-2b 可通过结合细胞膜特异性受体,直接抑制病毒复制,同时还可改善肝功能,且耐药屏障较佳,两者联和用药可进一步发挥疗效。
综上所述,聚乙二醇干扰素α-2b 和替诺福韦联合用药可显著改善患者肝功能,调节免疫系统功能,疗效更高且安全可靠,值得临床推广使用。但本研究仍存在不足之处,本研究样本量较少,且为单中心样本,可能会导致实验结果出现一定偏差,未来需扩大样本量及纳入范围以进一步验证结论准确性。
