介入治疗策略对冠状动脉搭桥术后急性心肌梗死患者预后的影响观察
2024-05-14李海蓬
李海蓬,张 健
泰达国际心血管病医院心内科,天津 300457
冠状动脉搭桥术(CABG)术后的患者常合并多重心血管危险因素,临床合并症多,心脏代偿功能差,若发生急性心肌梗死,往往预后不良。介入治疗是CABG 术后血运重建的主要方式。CABG 术后需血运重建患者的原位冠状动脉介入治疗效果优于桥血管介入治疗效果,而对CABG 术后桥血管急性病变所致的心肌梗死患者是否也适用,目前研究并不多。基于此,本研究观察严重心血管不良事件发生情况,分析不同介入策略对CABG 术后再发生急性心肌梗死患者预后的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2017 年6 月—2020 年6 月泰达国际心血管病医院的CABG 术后超过1 个月的70 例急性心肌梗死患者作为研究对象,将其分为原位冠状动脉治疗组40例和桥血管治疗组30例。所有患者住院期间均完成冠脉及桥血管造影,并进行介入治疗。其中,男60例,女10例,年龄60~84岁,平均年龄(68.30±6.88)岁,发生心肌梗死时间术后4个月~17年,非ST段抬高型心肌梗死(NSTEMI)55例、ST段抬高型心肌梗死(STEMI)15例(前壁2例、侧壁1例、下壁9 例、后壁3 例)。排除标准:(1)CABG 术后不足1 个月,无法完成冠脉造影。(2)因其他疾病预期寿命<1年。
1.2 研究方法
1.2.1 临床资料收集 查阅患者病历,收集性别、年龄、既往病史(高血压病史、糖尿病病史、陈旧性心肌梗死病史、介入治疗史、脑血管病史及外周动脉病史)、吸烟史等基线资料,辅助检查资料包括相关化验(血脂水平、肾功能指标、肌钙蛋白峰值及BNP 峰值等)、心脏超声指标(左室舒张末期直径、左室射血分数)。调阅影像数据,记录冠脉桥血管病变及介入治疗情况。
1.2.2 随访 自患者心肌梗死发病起随访2 年,收集患者出院后用药情况、主要心血管不良事件(心源性死亡、再次心肌梗死、靶血管血运重建、因心力衰竭入院)发生情况及发生时间。发生多次事件时,以首发事件为准。
1.3 统计学意义
采用SPSS 27.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2或Fisher精确检验。使用Log-rank 检验方法进行比较,使用Cox 回归调整可能的影响因素,检验不同靶血管介入治疗对患者预后的影响。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料情况
两组患者的年龄、性别、高血压病史、糖尿病病史、陈旧性心肌梗死病史、经皮冠状动脉介入治疗(PCI)史、脑血管病史、外周动脉病史、血脂水平、肾功能指标(肌酐水平、尿酸水平)、心脏超声指标(左室舒张末期直径、左室射血分数)及出院后用药情况等一般资料比较,差异无统计学意义(P>0.05),见表1。
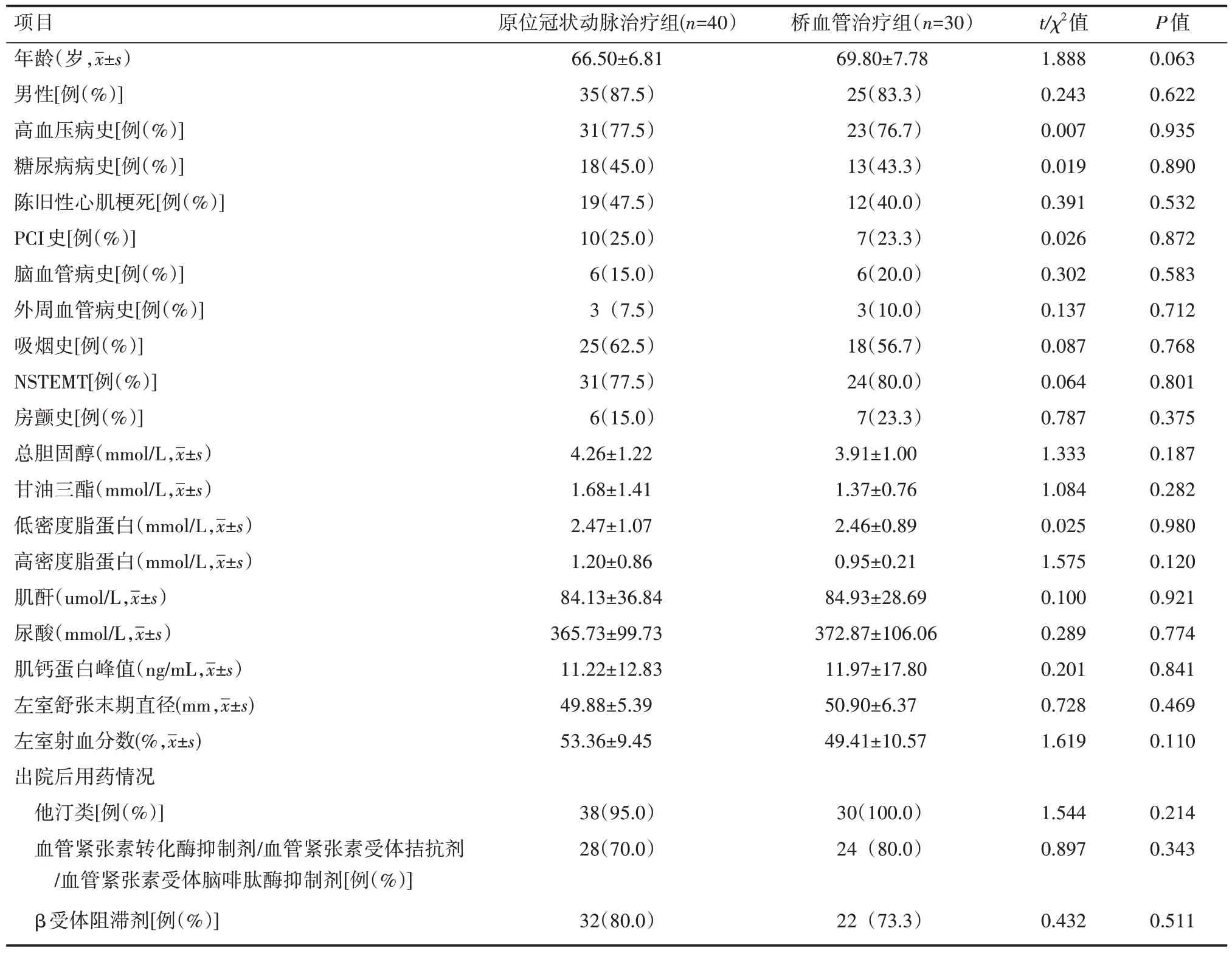
表1 两组患者一般资料情况
2.2 两组患者血管病变及介入治疗情况
原位冠状动脉治疗组患者的CABG 术后时间短于桥血管治疗组患者,差异有统计学意义(P<0.05),两组患者总桥数量、闭塞桥数量、残存桥数量、有通畅左乳内动脉(LIMA)桥、梗死相关血管、桥血管口部病变、吻合口病变、植入支架、支架总长度比较,差异无统计学意义(P>0.05),见表2。
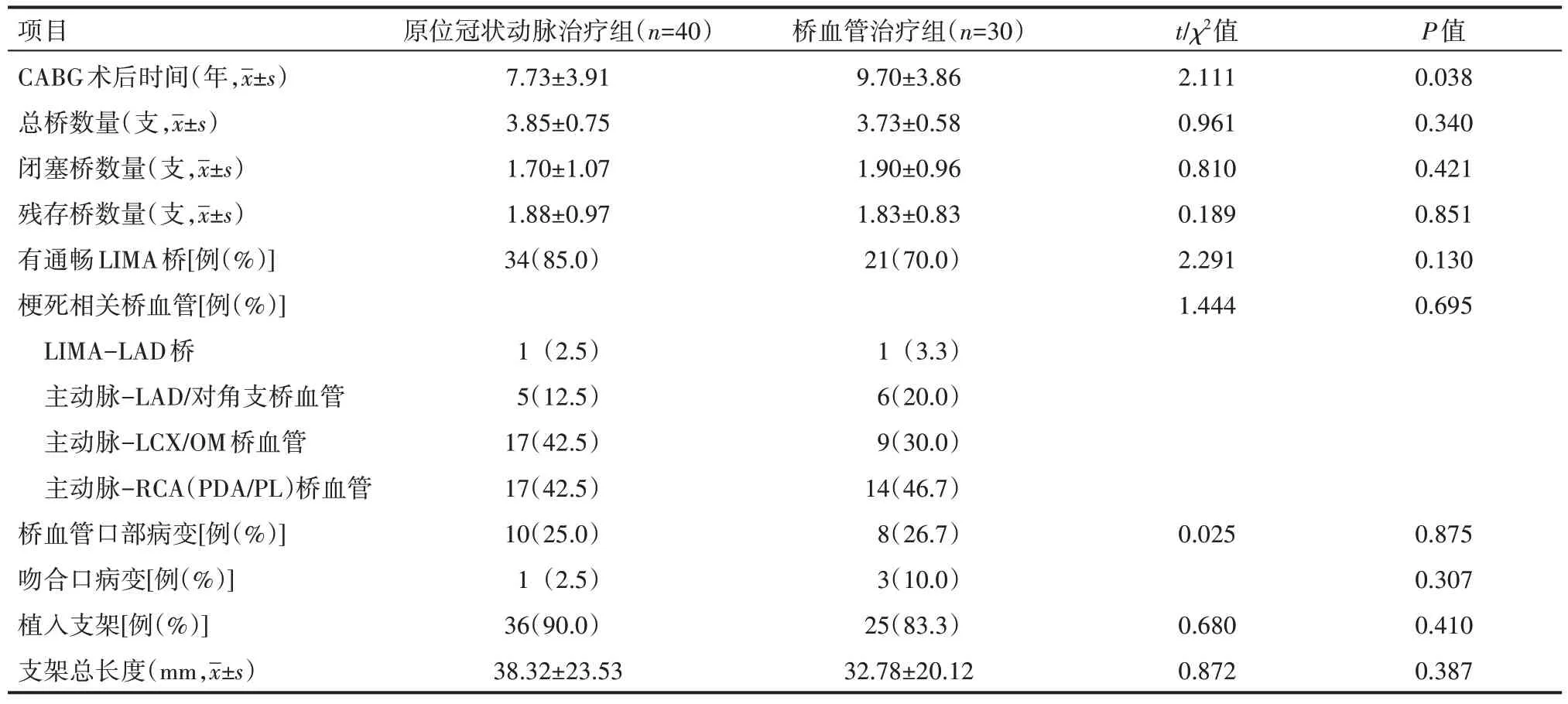
表2 两组患者血管病变及介入治疗情况
2.3 随访及心血管事件分析结果
随访2 年内有31 例(44.3%)患者发生心血管事件,以首发事件为准,其中,猝死2 例,因心力衰竭入院16例,再次心肌梗死10 例,再次靶血管重建3 例。经Logrank 检验,原位冠脉治疗组患者事件发生率低于桥血管治疗组患者,差异有统计学意义(P<0.05)。
2.4 Cox回归分析结果
调整年龄、性别、高血压、糖尿病、吸烟及CABG 术后时间的可能影响因素后,使用Cox 回归分析结果显示,采用原位冠状动脉介入治疗较桥血管介入治疗可降低2 年心血管事件发生率(HR=0.350,95%CI:0.167~0.733,P<0.05),改善预后。
3 讨论
目前,对既往行CABG患者出现急性心肌梗死的预后研究有限。在急性心肌梗死患者中,3.4%~7.2%的患者既往有过CABG 病史[1-2]。虽然CABG 术后的5年内仅有约2.2%的患者发生急性心肌梗死[3],但这类人群合并高血压、糖尿病等因素的比例高,长期预后差。对于此类高危患者的血运重建方式,既往研究主要在CABG术后冠脉造影发现桥血管病变的稳定性心绞痛患者,而对于桥血管急性病变引起急性心肌梗死的患者,受发病率所限,研究较少。
血管重塑是静脉桥血管在CABG 术后的必然过程。它需要形成由血管平滑肌细胞组成的新生内膜,以应对动脉系统血流所产生的剪切力。所以术后新生内膜的形成和再内皮化的重塑过程是保持静脉桥血管通畅的关键因素,在这一过程中的细胞因子和局部介质会产生高度致动脉粥样硬化的基质,从而促进血管粥样硬化的发展[4]。静脉桥血管术后病变率很高,3%~12%在出院前发生闭塞,8%~25%则在1 年内发生闭塞,只有50%~60%在10 年后仍保持通畅。病变形成过程中有3 个病理生理过程:血栓形成和技术原因是术后第1周至第1个月的主要机制,是1个月至1 年的血管内膜增生,1 年以上则粥样硬化是主要原因。静脉桥血管粥样硬化的进展速度比原位冠状动脉粥样硬化要快,并且病变更不稳定[5]。
既往有CABG 史的患者行PCI 的预后比无CABG 的患者差,但是能接受再次CABG 治疗的患者仍很少。再次行CABG 可能比桥血管PCI的预后好,但和原位冠状动脉PCI的预后无明显差异[6]。2018年《欧洲心胸外科协会血运重建指南》以及2020年《血管重建失败后治疗管理欧洲专家共识》均建议CABG 术后晚期(CABG 术后>1个月)桥血管失败需血运重建时,首选PCI 治疗[7-8]。静脉桥血管的粥样硬化斑块脆弱进行PCI 治疗时,易出现远端血管栓塞,表现为心肌梗塞溶栓治疗(TIMI)血流<3 级的慢血流或无复流。CABG术后行静脉桥血管PCI与2年不良缺血性事件的发生风险显著升高相关[9]。研究[10-12]显示,使用原位冠状动脉PCI的短期和长期结果较好。
但以上研究多针对稳定性心绞痛或桥血管慢性病变患者。对于CABG 术后再发心肌梗死患者,3 年心血管事件发生率高于原位冠状动脉[13]。目前,对于PCI目标血管选择仍需讨论。原位冠脉PCI 并不总是可行的或者是容易完成的,需要行CABG 的患者,原位冠状动脉病变往往是比较复杂的,常会出现慢性全闭塞(CTO)病变和严重钙化病变。其可能的原因在于,CABG 术后固有冠状动脉粥样硬化加速以及竞争血流促进了原位冠状动脉的闭塞,这类病变的干预通畅需要丰富的经验和专门的设备,在高危的急性心肌梗死患者手术时,为保证患者安全,尽快完成手术可能更为重要。因此,在静脉桥急性病变导致心肌梗死的情况下,对原位冠状动脉病变进行PCI 并不总是最佳选择。而此时对于静脉桥血管的介入治疗则可能较快取得效果,改善血流及心肌灌注。静脉桥血管介入治疗易发生慢血流及无复流[14]。同时,冠脉弥漫长病变介入治疗也易出现相似情况,术后若TIMI血流不能达到3级,预示着预后不良[15]。因此,需采取积极措施预防,以改善无复流情况。本研究中有30 例患者采取了介入治疗桥血管的方式,比较发现,桥血管治疗组的CABG 术后时间长于原位冠脉治疗组,说明随着时间延长,原位冠脉病变愈加严重,促使术者选择桥血管治疗。在处理静脉桥血管病变时使用血栓保护装置的效果仍不明确[16],本研究中所有患者均未使用此装置,更多的是采用直接支架置入,减少高压后扩张及相关药物,预防和逆转无复流。虽然对靶血管的选择很大程度上取决于患者的生命体征及冠脉病变情况,但是采取原位冠状动脉治疗的患者心血管事件预后好于桥血管治疗的患者,本研究的分析结果支持这个建议。因此,对于此类高危患者,介入原位冠脉仍是首选。
综上所述,对CABG 术后急性心肌梗死患者采用原位冠状动脉介入治疗较桥血管介入治疗可减少心血管事件的发生,改善预后。但本研究不足之处在于,其为单中心的回顾性研究,受发病率所限,样本量较小,今后仍需继续随访,持续关注CABG 术后心肌梗死患者的治疗进展,为这一高危患者群体的治疗提供更好的建议。
