血细胞参数在评估原发性高血压患者并发颈动脉粥样硬化中的价值
2024-05-14钱禹林沈国飞
钱禹林,沈国飞
1.苏州市吴江区中医医院心内科,江苏 苏州 215221;2.苏州市吴江区中医医院内分泌科,江苏 苏州 215221
原发性高血压与动脉粥样硬化互为因果,互相促进,因此,对原发性高血压动脉粥样硬化的监测十分必要。越来越多的研究显示,血细胞及其相关参数如中性粒细胞、淋巴细胞、中性粒细胞与淋巴细胞比值(NLR)等与动脉粥样硬化有关。本研究通过分析血细胞参数与原发性高血压患者并发颈动脉粥样硬化(CAS)的关系,为临床早期识别及动态评估原发性高血压患者并发CAS 提供数据支持及预测模型,现将研究结果报告如下。
1 资料与方法
1.1 一般资料
选取2021 年1 月—2022 年6 月经苏州市吴江区中医医院心血管内科第一诊断为原发性高血压的123 例患者作为研究对象,将颈动脉正常的患者列为对照组(60 例),合并CAS 的患者列为观察组(63 例)。纳入标准:所有患者均符合原发性高血压诊断标准[1],未使用降压药物的情况下,非同日3 次测量血压,收缩压≥140 mmHg(1 mmHg=0.133 kPa)和/或舒张压≥90 mmHg;或既往有高血压史,目前正在使用降压药物。排除标准:继发性高血压,感染性疾病,血液系统疾病,免疫性疾病,恶性肿瘤,其他慢性消耗性疾病,严重肝肾功能异常,2 周内未服用影响血细胞生成和功能的药物,资料不全。本研究经医院医学伦理委员会审批通过。
1.2 方法
1.2.1 病史采集及体格检查 病史采集包括年龄、性别、既往史、服药史等。体格检查包括身高、体重、血压、体重指数(BMI)。将中华人民共和国卫生行业标准《成人体重判定》(WS/T 428—2013)作为成人超重和肥胖的判定依据[2]。超重:24.0 kg/m2≤BMI<28.0 kg/m2;肥胖:BMI≥28.0 kg/m2。血压测量使用鱼跃牌台式汞柱血压计(苏械注准20152070945),以患者安静休息15 min 后3 次测量的收缩压和舒张压的平均值为记录值。
1.2.2 颈动脉粥样硬化的测定及判定标准 使用PhilipsIU22 彩色多普勒超声诊断仪,测定颈动脉各段内膜中层厚度,取平均值为内膜中层厚度(IMT),观察患者有无粥样斑块。颈动脉粥样硬化的判定标准:IMT>0.9 mm或发现动脉粥样斑块[1]。
1.2.3 血细胞参数的测定 采集患者静脉血3 mL,使用Sysmex 2100 型血细胞分析仪,测定白细胞、中性粒细胞、淋巴细胞、嗜酸性粒细胞、单核细胞、红细胞、血红蛋白、红细胞平均体积、平均血红蛋白量、平均血红蛋白浓度、红细胞分布宽度、血小板、平均血小板体积、血小板压积、血小板分布宽度、大型血小板比率。
1.2.4 实验室生化指标的测定 采集患者静脉血3 mL,使用HITACHI7600-020 自动生化分析仪,测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿酸(UA)、肌酐(CRE)、葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDLC)水平。
1.3 统计学方法
采用SPSS 26.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。采用多因素logistic 回归分析,经单因素分析筛选(P<0.1)自变量,以是否并发CAS 作为因变量,进行向前似然比法(Forword∶LR)回归分析,建立logistic 回归模型(纳入标准P<0.05,排除标准P>0.1),对回归参数估计值采用Waldχ2检验;ROC 曲线评价建立各模型的预测能力, 计算曲线下面积(AUC),AUC>0.5 表示具有预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料
两组患者年龄、收缩压比较,差异有统计学意义(P<0.05),见表1。
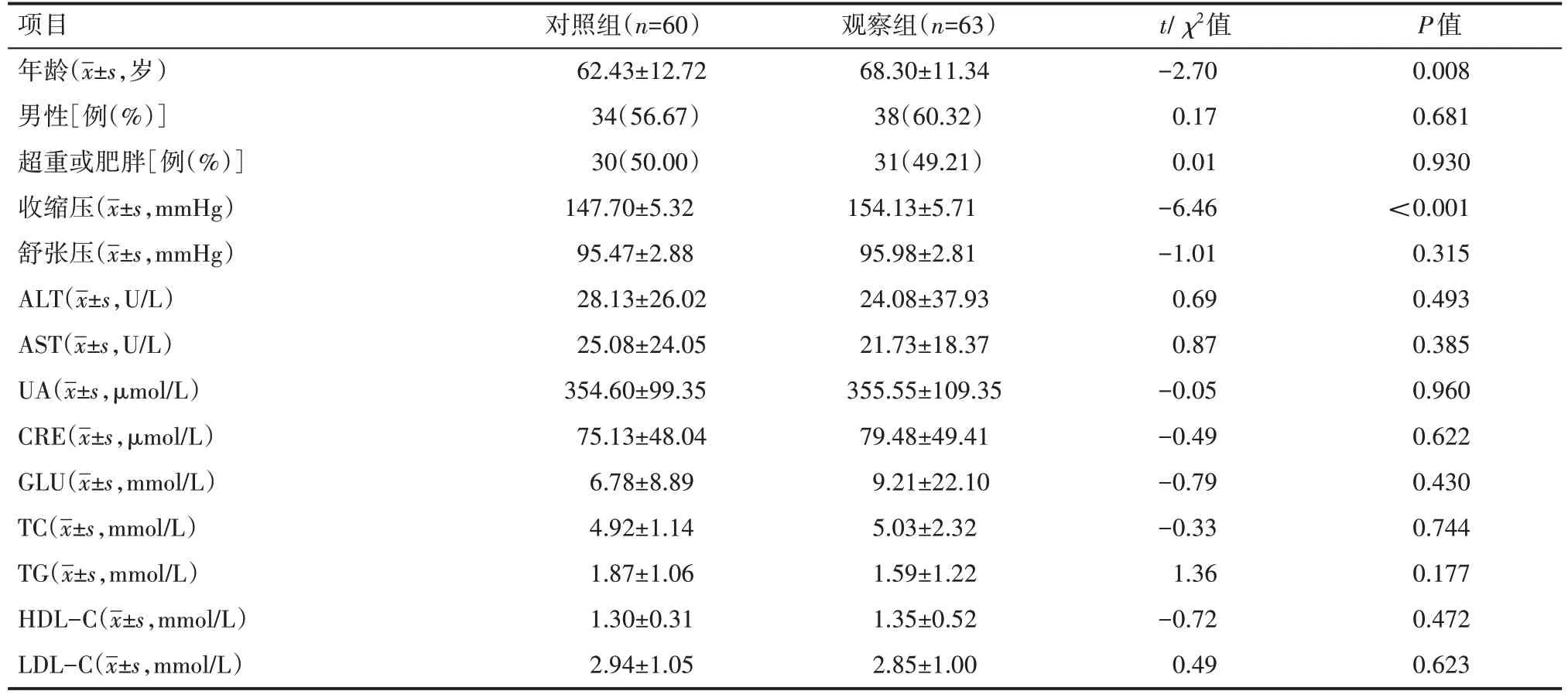
表1 两组患者一般资料
2.2 两组患者血细胞参数情况
两组患者白细胞、中性粒细胞、单核细胞、淋巴细胞比较,差异有统计学意义(P<0.05);两组患者其他血细胞参数比较;差异无统计学意义(P>0.05),见表2。
表2 两组患者血细胞参数情况(±s)

表2 两组患者血细胞参数情况(±s)
项目白细胞(×109/L)中性粒细胞(×109/L)淋巴细胞(×109/L)嗜酸性粒细胞(×109/L)单核细胞(×109/L)红细胞(×1012/L)血红蛋白(g/L)红细胞平均体积(fL)平均血红蛋白量(pg)平均血红蛋白浓度(g/L)红细胞分布宽度(fL)血小板(×109/L)平均血小板体积(fL)血小板压积(%)血小板分布宽度(fL)大型血小板比率(%)对照组(n=60)6.47±1.71 4.08±1.32 1.85±0.54 0.10±0.08 0.41±0.17 4.66±0.49 141.10±16.59 90.71±4.26 30.73±1.36 338.93±10.26 42.42±3.38 213.00±47.87 10.29±1.03 0.22±0.05 14.30±2.18 28.02±7.46观察组(n=63)7.44±1.98 5.25±1.82 1.57±0.59 0.12±0.12 0.48±0.16 4.55±0.62 143.33±10.89 89.68±6.16 30.15±2.40 336.08±13.03 42.70±3.45 219.03±72.28 10.44±1.20 0.23±0.07 14.42±2.21 28.95±8.58 t值-2.92-4.08 2.70-1.29-1.29 1.09-0.88 1.07 1.66 1.35-0.46-0.55-0.76-0.77-0.28-0.64 P值0.004<0.001 0.008 0.201 0.028 0.280 0.382 0.288 0.100 0.181 0.647 0.585 0.448 0.441 0.777 0.524
2.3 原发性高血压患者并发CAS的多因素logistic回归分析
经单因素分析筛选,纳入原发性高血压患者并发CAS的多因素logistic 回归的自变量有年龄、收缩压、白细胞、中性粒细胞、淋巴细胞、单核细胞。多因素logistic 回归分析结果显示,收缩压、中性粒细胞、淋巴细胞是原发性高血压并发CAS 的独立预测因子。差异有统计学意义(P<0.05),见表3。
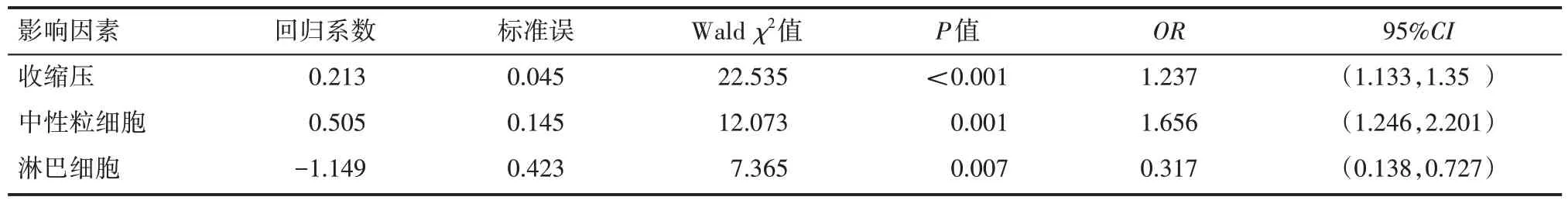
表3 原发性高血压患者并发CAS的多因素logistic回归分析结果
2.4 各检验变量ROC曲线相关参数情况
根据NLR=中性粒细胞(×109/L)/淋巴细胞(×109/L)计算NLR。以收缩压、NLR 建立logistic 回归模型,形成P-NLR 联合SBP 预测模型,P-NLR 联合SBP 预测模型=[1+e-(-35.624+0.220×收缩压+0.880×NLR)]-1。以收缩压、中性粒细胞及淋巴细胞建立logistic 回归模型,形成P-logistic 预测模型,P-logistic预 测 模 型 =[1+e-(-32.382+0.213×收缩压+0.505×中性粒细胞-1.149×淋巴细胞)]-1。以NLR 建立logistic 回归模型,形成P-NLR 预测模型,P-NLR 预测模型=[1+e-(-2.575+0.920×NLR)]-1。以中性细胞数建立logistic 回归模型, 形 成P-N 预 测 模 型, P-N 预 测 模 型= [1+e-(-2.221+0.494×中性粒细胞)]-1。以淋巴细胞数建立logistic 回归模型,P-L 预测模型=[1+e-(1.568-0.892×淋巴细胞)]-1。以P-logistic 预测模型、P-NLR 联合SBP 预测模型、P-NLR 预测模型、P-N 预测模型、P-L 预测模型为检验变量,以原发性高血压患者并发CAS为状态变量作ROC曲线评价,结果显示,预测能力以P-NLR联合SBP预测模型最优。见表4。
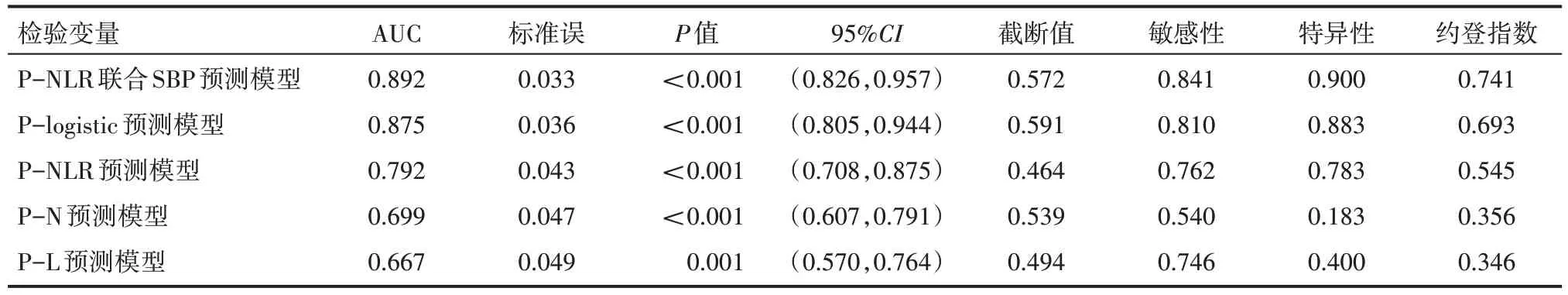
表4 各检验变量ROC曲线相关参数情况
3 讨论
近20年来,我国三次高血压流行病学调查显示高血压患病率呈上升趋势[3]。高血压常隐匿发生,有时在发现时已出现了动脉粥样硬化,甚至发展到冠心病、脑卒中和外周血管疾病等严重程度[4]。因此,及早发现以及动态评估原发性高血压患者动脉粥样硬化情况非常重要。颈动脉多普勒血管超声因其对CAS 的敏感和非侵入的特点常作为全身动脉粥样硬化筛查和复查的选择,但颈动脉多普勒血管超声目前在基层医院的全面普及仍不具备条件。而基层医院迫切希望获得简便、稳定、具有高敏感性和特异性的生物学标志物来评价(颈)动脉粥样硬化情况。
血细胞在临床上多用于评估人体的整体健康情况。中性粒细胞作为数量占比最多的白细胞,有较强的趋化和吞噬作用,广泛参与体内炎症和免疫反应。有研究[5-6]发现,中性粒细胞在动脉粥样硬化的各个阶段发挥重要作用。中性粒细胞在动脉粥样硬化早期通过聚集加速内皮细胞损伤和功能失调;后期通过释放活性物质,激活巨噬细胞[7],促进泡沫细胞生成并形成斑块以及触发斑块的不稳定和血栓形成[8-9]。淋巴细胞是体积最小的白细胞,是免疫反应的核心。有研究[10]显示,淋巴细胞凋亡可导致动脉粥样斑块的形成、生长以及斑块破裂和血栓形成。同时淋巴细胞的减少导致抗炎细胞因子分泌减少,间接影响动脉粥样硬化进程。单核细胞作为体积最大的白细胞,占白细胞总数的3%~8%,是启动免疫反应的主要成分。近期研究[11]发现,单核细胞计数和动脉粥样硬化的严重程度密切相关,与参与内源性炎症反应有关[12]。本研究发现观察组患者,白细胞、中性粒细胞、单核细胞较对照组升高,淋巴细胞较对照组减少。多因素logistic 回归分析结果显示,中性粒细胞、淋巴细胞是原发性高血压并发CAS 的独立预测因子。中性粒细胞与淋巴细胞对原发性高血压并发CAS具有相反的贡献作用,与既往研究结果一致。
原发性高血压患者(颈)动脉粥样硬化目前认为是一种炎症性疾病[13],呈现出慢性炎症细胞浸润的特征。中性粒细胞反映了非特异性炎症反应,淋巴细胞反映了免疫调控。NLR 因综合了细胞与体液免疫两部分信息,且不受血液浓缩或稀释的影响,成为一种新的具有可及性、可靠性的炎症标志物,有助于提高临床评估及预测。相关研究[14]发现,NLR 与颈动脉粥样患病率相关。刘建峰等[15]研究证实,在高血压患者中NLR水平与颈动脉内膜厚度呈正相关。本研究建立P-NLR 联合SBP 预测模型、P-logistic预测模型、P-NLR 预测模型、P-N 预测模型、P-l 预测模型,通过ROC 曲线评价各模型的预测能力,得到的AUC分别为0.892,0.875,0.792,0.699,0.667,表明P-NLR联合SBP 预测模型诊断效能最优。同时可以看到以收缩压、NLR构建的P-NLR 联合SBP预测模型诊断效能优于以收缩压、中性粒细胞、淋巴细胞构建的P-logistic 预测模型,以NLR 构建的P-NLR 预测模型诊断效能优于以中性粒细胞构建的P-N 预测模型和以淋巴细胞构建的P-L 预测模型,说明构建的模型中NLR比中性粒细胞、淋巴细胞无论单独或联合的情况下在诊断或预测方面价值更有优势。因此,原发性高血压患者在积极控制已知危险因素的情况下,对NLR 监测有助于提高对原发性高血压患者并发CAS的预测和评估。
综上所述,血细胞中,中性粒细胞、淋巴细胞与原发性高血压并发CAS 密切相关。原发性高血压患者中,中性粒细胞水平升高并发CAS 风险越高,淋巴细胞水平越低并发CAS风险越高。对NLR测定有助于对原发性高血压患者并发CAS 的早期筛查、动态评估的开展。但需要指出的是,目前研究发现NLR还与多种疾病的严重情况有关。同时考虑到本研究属于回顾性研究,不能完全排除混杂因素的影响,可能存在偏倚。
