乳酸菌与酵母菌联合发酵对芥菜理化性质及保藏期品质的影响
2024-05-12陈骏飞杨海泉杨峻松周于莹刘毕琴
唐 蓉,陈骏飞,杨海泉,杨峻松,周于莹,刘毕琴,史 巧,*,李 宏
(1.云南省农业科学研究院农产品加工研究所,云南昆明 650223;2.云南易门山里香食品有限责任公司,云南玉溪 651109;3.云南农业大学食品科学技术学院,云南昆明 650201)
乳酸菌与酵母菌是传统发酵食品中常见的微生物群,以酵母菌或乳酸菌单一菌种发酵的产品感官特性较为单一,限制了产品的个性化及竞争性[1-2]。通过乳酸菌和酵母菌联合作用能够获得更为丰富的代谢产物并提高发酵效率,共同作用赋予传统发酵食品独特的风味、色泽和质地[3]。酵母菌与乳酸菌组合发酵食品简单且高效,也越来越受到市场的青睐[4]。目前,泡菜发酵菌剂的研究已经取得了较好进展,但相关研究多以乳酸菌发酵为主,运用乳酸菌和酵母菌共发酵的研究相对较少,陈安特等[5]在萝卜泡菜中加入酿酒酵母明显提高了泡菜风味。陈偲等[6]在发酵白菜中添加酿酒酵母提高了食用安全性。所以开发有效的乳酸菌和酵母菌共发酵菌剂对于提升泡菜的品质和风味至关重要。
受冷藏、冷链条件及消费水平等因素的限制,传统泡菜在常温贮藏、流通和销售过程中质量不稳定,容易发生褐变、质地变软和风味下降等问题,严重影响产品品质[7-8]。目前工业生产中多采用巴氏杀菌和添加防腐剂的方法来延长泡菜货架期,但可能导致泡菜营养及风味损失严重,且长期摄入防腐剂存在健康隐患[9-10]。开发优质泡菜发酵菌剂以延长零添加泡菜货架期、提高泡菜安全性是泡菜发展的必然趋势。在泡菜发酵时加入酵母菌不仅可以提升酸菜的风味,且在成品的储存过程中也起着关键的作用,酵母菌对糖的利用率最高可达99%以上,可充分利用蔬菜原料中可发酵的糖,与腐败菌和乳酸菌形成竞争,还能将乳酸作为碳源消耗掉,可防止泡菜腐败和过酸,有利于延长产品的保藏期[11-13]。利用生物拮抗来延长食品保质期不仅可以保障食品安全,对食物的口感以及风味影响也较小[14]。因此,为了提升低盐低酸泡菜产品的风味品质,本实验室前期对不同泡菜来源的乳酸菌和酵母菌分离株进行耐受性及发酵性能的筛选,并考察乳酸菌和不同酵母菌的组合对泡菜品质的影响,发现运用肠膜明串珠菌菌株L5 和少孢哈萨克斯坦酵母菌菌株M1 的组合相较于L5 和其他酵母菌的组合发酵的低酸泡菜风味更好,安全性更高。
本研究基于前期结果,进一步对比双菌共发酵,乳酸菌单独发酵及自然发酵条件下芥菜及成品加速保藏期间的理化指标变化,探究添加特定酵母菌对泡菜发酵过程和保藏期品质的影响,给泡菜工业化生产菌剂提供更多的选择,为延长低添加泡菜保质期提供新思路。
1 材料与方法
1.1 材料与仪器
新鲜芥菜 购自云南昆明菜市场;菌株样品分离自云南不同来源的发酵蔬菜,于-80 ℃保存;少孢哈萨克斯坦酵母(Kazachstania exigua)M5保藏于广东省微生物菌种保藏中心,保藏编号为GDMCCNo62817;MRS 培养基、孟加拉红培养基、酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD)青岛海博生物技术有限公司;盐酸、乳酸、氢氧化钠、乙酸锌、硫酸锌、酚酞、亚铁氰化钾 天津市致远化学试剂有限公司;所有化学试剂均为国产分析纯。
DW-86L500 超低温冰箱(-80 ℃)山东澳柯玛有限公司;CJ-2S 超净工作台、WPL-125BE 电热恒温培养箱 天津市泰斯特仪器有限公司产品;HR/T20MM 冷冻离心机 湖南赫西仪器装备有限公司;ZQZY-88AV 全温振荡培养箱 上海知楚仪器有限公司;Multiskan GO 酶标仪 美国Thermo 公司;YXQ-75SL 高压蒸汽灭菌锅 上海博讯实业有限公司;S210 pH 计 梅特勒托利多科技(中国)有限公司;TMS-Touch 质构仪 美国FTC 公司;CM-5 台式色差仪 日本美能达公司。
1.2 实验方法
1.2.1 芥菜发酵及保藏 发酵剂制备:-80 ℃冰箱中取出菌株,乳酸菌于MRS 液体培养基37 ℃静置培养;酵母菌于YPD 液体培养基30 ℃、225 r/min摇床培养,均活化两代,待生长到对数生长期使用。将活化好的菌液于4 ℃,6000 r/min 离心10 min,弃去上清液,用无菌生理盐水重复洗菌体3 次,收集菌体。最后悬浮于与培养液同体积的无菌生理盐水中,制成菌悬液作为母发酵剂。
芥菜发酵:新鲜芥菜整棵清洗并用75%食品级酒精浸泡10 min 进行减菌处理后入坛,按泡菜水体积加入2%白砂糖和3%盐(菜水比,2:3),接菌量为泡菜水体积的2%(L5+M1 组接种乳酸菌和酵母菌、L5 组只接种乳酸菌、CK 组不接菌),使泡菜水中乳酸菌终浓度大于106CFU/g 泡菜,酵母菌终浓度大于105CFU/g 泡菜,混合1 min 后置于30 ℃恒温培养箱。每个样品3 个平行。
加速保藏:取经理化分析和感官评定的发酵成熟泡菜直接真空包装(不添加防腐剂和不经巴氏杀菌处理),置于37 ℃恒温箱中,保藏75 d 后进行理化性质和感官评定(恒温加速时间参考胡晓军等[15]的方法进行试验确定)。每个样品3 个平行。
1.2.2 pH、总酸和活菌数测定 pH 测定:参考陈偲等[6]的方法,取泡菜发酵液用pH 计直接测定,每个样品测定3 个平行。总酸测定:参照国标GB 12456-2021《食品安全国家标准 食品中总酸的测定》第一法酸碱指示剂滴定法[6]。活菌数测定[16]:取泡菜汁液稀释涂布于MRS 固体培养基,37 ℃恒温培养2 d 后进行乳酸菌计数;取泡菜汁液稀释涂布于孟加拉红固体培养基,30 ℃恒温培养2 d 后进行酵母菌计数。
1.2.3 亚硝酸盐测定 参照国标GB 5009.33-2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》第二法分光光度法[6]。
1.2.4 总酯含量测定 参照张鹏[17]的方法改进后测定。吸取50 mL 发酵液置入250 mL 回流瓶中,加2 滴酚酞指示剂,用0.1 mol/L 的NaOH 标准溶液滴定至微红色,再准确加入25 mL 0.1 mol/L 的NaOH标准溶液。装上回流冷凝器,于沸水浴中回流皂化0.5 h,取下冷却,立即用0.1 mol/L 的硫酸标准溶液滴定至红色刚好消失为终点,记下消耗硫酸标准溶液的体积。空白试验组用无酯乙醇替代样品。计算公式:
式中:X 表示样品中的总酯含量(以乙酸乙酯计),g/L;c 表示硫酸标准液浓度,mol/L;V0表示空白试验组消耗的硫酸体积,mL;V1表示样品组消耗的硫酸体积,mL。
1.2.5 感官评定 由12 人分别对发酵芥菜的色泽、质地、香气和滋味进行评分,采取盲评模式,满分为100 分,去除最高分和最低分后,取平均分为发酵芥菜最后的得分。具体评分标准见表1[18]。

表1 感官评分标准Table 1 Standard of sensory score
1.2.6 质构特性测定 参考汪姣玲等[19]的方法改进后测定,用质构仪通过质地剖面分析法(TPA)对菜梗进行测定。取菜梗,将菜梗切成大小1 cm×1 cm,厚4~6 mm,用于指标测定。每个样品至少检测10 个重复。测试条件为:圆盘直径7.5 cm,探头P/36R,最大力为500 N,起始力0.75 N,试样受压形变30%,探头回升高度为15 mm,检测速度60 mm/min。
1.2.7 色差测定 用色差仪测量菜表面的色值,测量前用美能达标准白色反射镜校准。每个样本在5 个随机位置进行测量,且重复3 次。色差(ΔE)计算如下:
式中:ΔE表示色差变化值;L*代表明暗度,L0代表明暗度初始值;a*代表红绿色,a0代表红绿色初始值;b*代表黄蓝色,b0代表黄蓝色初始值。
1.3 数据处理
实验数据通过Graphpad Prism8.2.1 软件进行计算绘图,并使用IBM SPSS Statistics26 进行显著性检验,P<0.05 表示有显著性差异,P<0.01 表示有极显著差异,结果以平均值±标准差()表示。
2 结果与分析
2.1 芥菜发酵期间pH 和总酸的变化
泡菜的理化指标对泡菜品质具有重要影响,由图1A 可知,各组pH 在0~3 d 之间均急速下降,第12 d 开始趋于稳定;发酵结束时L5 单独发酵组的pH 最低,自然发酵组的pH 最高。发酵前期各组的乳酸菌迅速生长产酸较多,pH 下降较快,随着泡菜汁液中的营养元素逐渐消耗,后期乳酸菌生长缓慢则pH 下降缓慢。由图1B 可知,各组的总酸含量在整个发酵过程中均逐渐增加,其中L5 单独发酵组的总酸含量在整个发酵过程中均处于较高状态,至发酵结束时达到3.50±0.02 g/kg,而L5+M1 共发酵组从发酵9 d 开始增加缓慢,在发酵结束时稳定在2.46±0.01 g/kg,且显著低于其他两组(P<0.05)。特定酵母菌可能对乳酸菌构成一定拮抗作用,抑制其生长产酸的同时还可以消耗乳酸,在发酵过程中产生的醇类物质可与有机酸反应产生酯类芳香成分,所以添加酵母菌会降低泡菜中总酸含量[13,20]。陈安特等[5]的研究中接种酿酒酵母也可以提高pH,降低泡菜发酵后期总酸含量。

图1 泡菜发酵过程中的pH 和总酸变化Fig.1 Changes of pH and total acid during paocai fermentation
2.2 芥菜发酵期间乳酸菌和酵母菌活菌数的变化
发酵过程的活菌数变化如图2 所示,经过减菌处理有效减少了蔬菜本底细菌和酵母菌,各组乳酸菌活菌数均先增加后降低,第6 d 的活菌数最多,L5 单独发酵组高达8.94±0.03(lg CFU/mL);发酵结束时各组均降至较低水平,且共发酵组的乳酸菌活菌数显著低于其他两组(P<0.05)。自然发酵组和L5 单独发酵组在发酵过程中未检测到酵母菌,L5+M1 共发酵组在发酵过程中的酵母菌活菌数逐渐降低,但发酵结束时仍有3.48±0.02(lg CFU/mL)。发酵过程中乳酸菌数量的增加导致pH 降低和总酸含量增加,同时乳酸菌自身的生长随着产酸量的增加而受到抑制[21]。与乳酸菌相比,酵母菌受酸度的影响更大,大多数真菌的耐酸性较差,所以酵母菌活菌数随着总酸含量的增加而降低得较明显[22]。此外,酵母菌在无氧环境下生长代谢会与乳酸菌竞争利用还原糖,将糖类分解为乙醇,抑制发酵环境中腐败菌生长繁殖的同时还能一定程度上抑制乳酸菌生长[23]。
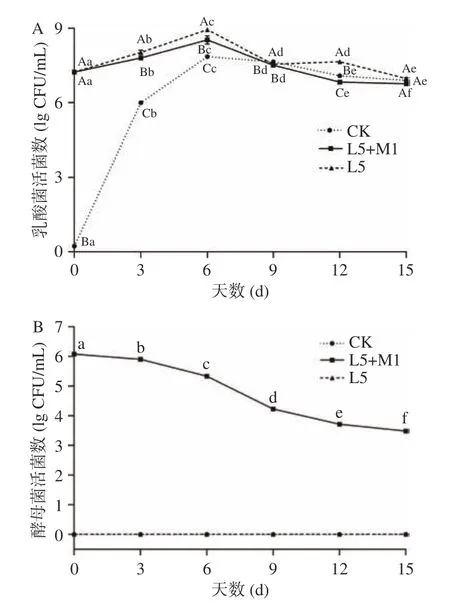
图2 泡菜发酵过程中乳酸菌和酵母菌活菌数变化Fig.2 Changes of lactic acid bacteria and yeast count during paocai fermentation
2.3 芥菜发酵期间总酯含量的变化
如图3 所示,L5+M1 共发酵组的总酯含量在整个发酵过程中均处于较高状态,在第3 d 达到峰值,随后开始逐渐降低,但在发酵结束时总酯含量仍有3.79±0.05 g/kg,自然发酵组的总酯含量在整个发酵过程中逐渐增加,但均低于L5+M1 共发酵组,L5 单独发酵组的总酯含量在整个发酵过程中均较低。You 等[24]的研究中少孢哈萨克斯坦酵母(Kazachstania exigua)生长代谢与异戊醇、正己醇和β-苯乙醇等调味高级醇的产生具有很大的相关性,也是产生己酸乙酯、丁酸乙酯和乙酸乙酯等风味物质或促进其形成的最重要的微生物。李默等[25]从自然发酵锦州小菜中分离出的优良酵母菌也具有较好的产酯能力。
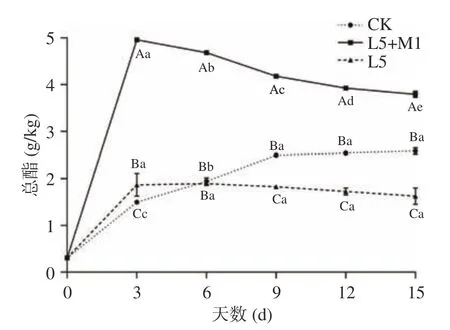
图3 泡菜发酵过程中总酯含量的变化Fig.3 Changes of total ester content during paocai fermentation
2.4 芥菜发酵期间亚硝酸盐含量的变化
由图4 可知,各组的“亚硝峰”均出现在发酵第3 d,随后逐渐下降,但均未超过《食品中污染物限量国家标准》的规定含量(20 mg/kg)[26]。其中自然发酵组峰值最高为8.30±0.04 mg/kg,L5+M1 共发酵组峰值最低为2.26±0.04 mg/kg,发酵第15 d,所有组别中亚硝酸盐含量都下降到3 mg/kg 以下,远低于标准限量值。接菌发酵组泡菜发酵前期亚硝酸盐含量远低于自然发酵组可能是因为乳酸菌生长旺盛使泡菜快速酸化,在酸性条件下亚硝酸根离子可与氢离子结合形成亚硝酸,发生自身歧化反应生成二氧化氮和一氧化氮,从而使亚硝酸盐含量逐渐降低[27]。在整个发酵过程中接菌发酵组亚硝酸盐含量均低于自然发酵组,与任亭等[28]的研究结果一致。
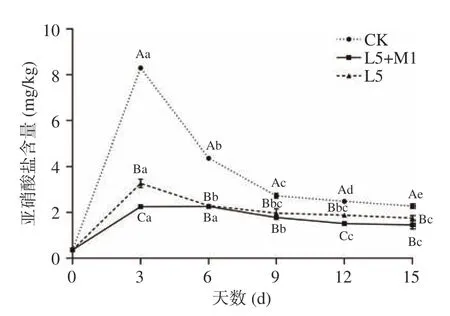
图4 泡菜发酵过程中亚硝酸盐含量的变化Fig.4 Changes of nitrite content during paocai fermentation
2.5 发酵芥菜保藏期理化性质的变化
低酸低盐泡菜在保藏期间可能会出现过度酸化、变色等现象,导致其口感变差、货架期缩短[29]。保藏期内理化指标测定结果如表2 所示,自然发酵组和L5 单独发酵组的pH 极显著下降(P<0.01),L5+M1 共发酵组显著下降(P<0.05);总酸含量均极显著增加(P<0.01),但L5+M1 共发酵组仍维持相对较低状态;L5 单独发酵组的总酯含量显著增加(P<0.05),L5+M1 共发酵组总酯含量极显著增加(P<0.01),且高于L5 单独发酵组49.76%;自然发酵组和L5 单独发酵组的亚硝酸盐含量均极显著降低(P<0.01),L5+M1 共发酵组亚硝酸盐含量显著降低(P<0.05);自然发酵组和L5 单独发酵组出现异味,感官总分也均极显著下降(P<0.01),但L5+M1 共发酵组仍维持较好的口感和风味,感官总分显著高于其他两组(P<0.05),三组泡菜均未胀袋。带入包装的微生物组成、数量和初始理化性质是影响保藏期品质的主要因素。总体上,L5+M1 共发酵组在保藏期内能维持较低的酸度和亚硝酸盐含量以及较高的总酯含量和感官评分,可能是因为带入酵母菌产生的醇类物质与部分有机酸发生酯化反应生成芳香族化合物,增加香味的同时也防止了泡菜过酸[23,30-31]。(P<0.01)。

表2 泡菜保藏期内理化性质的变化Table 2 Changes of physical and chemical properties during paocai storage
2.6 发酵芥菜保藏期质构特性的变化
质地是影响消费者接受度的重要因素,对芥菜发酵和保藏过程中的硬度、弹性和咀嚼性进行了分析(图5)。与新鲜芥菜相比,各组芥菜在发酵后和保藏期内硬度、弹性和咀嚼性均显著降低(P<0.05)。不同组在发酵结束时的质构也有差异,自然发酵组的硬度显著高于其他两组(P<0.05);自然发酵组和L5+M1 共发酵组的弹性和咀嚼性没有显著差异(P>0.05),但均显著高于L5 单独发酵组(P<0.05)。保藏期内自然发酵组和L5 单独发酵组出现软化,但L5+M1 共发酵组的硬度、弹性和咀嚼性均显著高于其他两组(P<0.05),在保藏期间能够维持较好的质地。

图5 泡菜保藏期内质构的变化Fig.5 Changes of texture during paocai storage period
硬度与细胞膨压和细胞壁结构有关,发酵过程中原果胶被果胶酶水解生成可溶性果胶或进一步水解成果胶酸,会使细胞之间粘结性降低,硬度下降,且酸性环境有利于促进原料中的果胶水解为果胶酸[5,32-33]。本研究中共发酵组保藏期内硬度高于其他两组可能是因为总酸含量较低,一定程度上抑制了原果胶的水解。与本研究结果一致,四川泡菜[34]在发酵过程中硬度和嚼劲也有所下降,腌制大白菜[8]在贮藏过程中硬度逐渐降低。
2.7 发酵芥菜保藏期色泽的变化
良好的色泽可以增加泡菜的感官品质,增强视觉吸引力,对其品质的提升有积极影响,样品总色差值可以评判样品外观颜色变化程度。新鲜芥菜、发酵结束和保藏期间可以观察到明显的颜色差异(图6),发酵结束各组的亮度值L*没有显著差异(P>0.05),自然发酵组的红绿值a*和黄蓝值b*显著低于其他两组(P<0.05),L5+M1 共发酵组的b*值最大,黄色度较高;但与新鲜芥菜相比各组由绿色变为黄色,L*值均显著降低(P<0.05),a*和b*值均显著升高(P<0.05)。保藏期内自然发酵组与L5 单独发酵组发生褐变,颜色变暗,L*和b*值显著降低(P<0.05),色差变化值ΔE也较大;L5+M1 共发酵组的L*、b*值最大,颜色较亮、较黄,且与发酵结束时无显著差异(P>0.05),色差变化值ΔE也显著低于其他两组(P<0.05),色泽最接近发酵结束时。

图6 泡菜保藏期内色差的变化Fig.6 Changes in color during paocai storage period
乳酸菌和酵母菌等发酵产生酶、有机酸和色素等代谢产物影响发酵蔬菜最终色泽的形成,发酵过程中一些微生物产生的酶可水解蔬菜中的类黄酮和类胡萝卜素等天然色素,产生的功能代谢物能减少氧化等对色泽的影响[35-37]。除此之外,叶绿素、类胡萝卜素等维持泡菜色泽的色素受酸性环境影响较大,过酸环境中容易被降解,从而导致泡菜变色[38]。本研究添加酵母菌对维持泡菜保藏期色泽具有有益作用,可能是因为酵母菌发酵过程中缓冲了过酸环境并产生了具有护色作用的代谢物,但其护色机制还需进一步研究。
3 结论
本研究接种少孢哈萨克斯坦酵母(Kazachstania exigua)M1 与肠膜明串珠菌(Leuconostoc mesenteroides)L5 共发酵泡菜能够降低总酸和亚硝酸盐含量、增加总酯含量,获得更高的感官评分,且在保藏期内总酸含量增加较少、总酯含量增加较多、亚硝酸盐含量进一步降低,仍能维持低酸状态和较高的感官评分,可有效解决泡菜过度酸化的问题;质地和色泽也与发酵结束时更接近,能保持较高的脆度和较好的色泽。本研究结果说明通过人工接种适当的乳酸菌和酵母菌组合能提升并维持泡菜保藏期的品质,为生产低盐低酸泡菜和减少化学添加提供参考依据。后续将对特征风味物质、菌株间的相互作用等进行进一步试验。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
