基于铜死亡基因识别脑膜瘤亚型并筛选脑膜瘤免疫相关的关键基因
2024-05-11徐海彪袁光耀潘敏泓刘宁
徐海彪 袁光耀 潘敏泓 刘宁


【摘要】目的篩选铜死亡相关的脑膜瘤亚型并识别与疾病免疫相关的关键基因。方法利用公共数据库中脑膜瘤相关的基因表达数据筛选差异表达的铜死亡基因,并基于其在肿瘤样本中的表达值识别脑膜瘤亚型。分析亚型间的差异表达基因以及亚型与肿瘤免疫微环境的关联。以亚型间显著差异的免疫细胞为表型,利用加权基因共表达网络分析(WGCNA)筛选疾病免疫相关的模块并提取模块基因。通过交集分析筛选出差异表达的疾病免疫相关基因,进行后续蛋白蛋白相互作用(PPI)网络分析、功能富集分析、Friends分析、基因表达验证以及关键基因与临床因素关联分析。结果在脑膜瘤和正常样本中检测到6个铜死亡基因的差异表达,如CDKN2A和GLS,并鉴定了2个相关的铜死亡亚型。两个亚型间涵盖397个差异表达基因,包括8种免疫细胞,其浸润丰度在亚型间存在显著差异。通过WGCNA筛选到282个疾病免疫相关基因,交集分析得到74个差异表达的疾病免疫相关基因。PPI和Friends分析最终确认了5个关键基因,包括LTBP1、LTBP2和MFAP5等。其中,LTBP2和MFAP5在脑膜瘤不同级别中表达存在显著差异。Western Blot和免疫组化实验证实,MFAP5在WHO Ⅰ级和WHO Ⅲ级之间以及WHO Ⅰ级和WHO Ⅱ级之间存在显著差异。结论本研究筛选到2个铜死亡相关的脑膜瘤亚型,这两个亚型在免疫细胞浸润和免疫反应方面存在差异。两个亚型间的免疫相关关键基因,如LTBP2和MFAP5,可能是铜死亡调控脑膜瘤发生和发展的关键机制,有望成为脑膜瘤诊断生物标志物或免疫治疗靶点。
【关键词】脑膜瘤;铜死亡;肿瘤分型;免疫微环境
【中图分类号】R739.41【文献标志码】A【文章编号】16727770(2024)02016210
Identification of meningioma subtypes and screening of meningiomaimmune related hubgenes based on cuproptosis gene XU Haibiao, YUAN Guangyao, PAN Minhong, et al. Nanjing Medical University, Nanjing 210029, China
Corresponding author: LIU Ning
Abstract: ObjectiveTo identify copper induced deathrelated subtypes of meningiomas and recognize key genes associated with diseaseimmune interactions. MethodsUtilizing publicly available gene expression data related to meningiomas, differentially expressed acproptosis genes were screened. Subsequently, meningioma subtypes based on the expression values of these genes in tumor samples were identified. The differentially expressed genes between subtypes and their association with the tumor immune microenvironment were analyzed. Using immune cells with significant differences between subtypes as a phenotype, Weighted Gene Coexpression Network Analysis(WGCNA) was employed to screen diseaseimmunerelated modules and extract module genes. Through intersection analysis, differentially expressed diseaseimmunerelated genes were selected. Further analyses included proteinprotein interaction(PPI) network analysis, functional enrichment analysis, Friends analysis, gene expression validation and correlation analysis between key genes and clinical factors. ResultsDifferential expression of six copper death genes were detected, such as CDKN2A and GLS, in meningiomas compared to normal samples, identifying two associated copper induced death subtypes. These subtypes encompassed 397 differentially expressed
genes, including eight immune cell types. There were significant differences in immune cell infiltration between subtypes. WGCNA identified 282 diseaseimmunerelated genes, and intersection analysis revealed 74 differentially expressed diseaseimmunerelated genes. PPI and Friends analyses ultimately confirmed five key genes: LTBP1, LTBP2, and MFAP5, etc. Among these, LTBP2 and MFAP5 exhibited significant expression differences in meningioma grades. Western blot and immunohistochemistry validation demonstrated significant differences in MFAP5 expression between WHO Grade Ⅰ and WHO Grade Ⅲ, as well as WHO Grade Ⅰ and WHO Grade Ⅱ. ConclusionsThis study identifies two copper deathrelated meningioma subtypes characterized by differences in immune cell infiltration and immune responses. Key immunerelated genes between these subtypes, such as LTBP2 and MFAP5, may represent critical mechanisms in the regulation of copper death in the occurrence and development of meningiomas, potentially serving as diagnostic biomarkers or immunotherapeutic targets for meningiomas.
Key words: meningioma; cuproptosis; tumor staging; immune microenvironment
脑膜瘤是颅内肿瘤中最为常见的原发性肿瘤,占中枢神经系统肿瘤的39%[1]。在根据最新的世界卫生组织(World Health Organization,WHO)2021年中枢神经肿瘤分类,脑膜瘤根据其组织病理学特征和遗传特征被划分为中枢神经系统(central nervous system,CNS)WHO ⅠⅢ级[2]。CNS WHO Ⅰ级脑膜瘤生长缓慢,且界限清晰,而CNS WHO Ⅱ级(非典型)或CNS WHO Ⅲ级(间变性)脑膜瘤可能表现出恶性特征,在切除后具有较高的复发率[3]。尽管CNS WHO Ⅱ级和Ⅲ级脑膜瘤病例相对较少(仅占4%~28%和1%~3%)[4],但复发性或进展性肿瘤病例会导致总体生存率下降,因此需要进一步调整和改进治疗方法。由于脑膜瘤在组织学特征和生物学行为上的多样性,即使在给定的WHO分级内,也需要调整治疗方法以改善预后[5]。因此,对脑膜瘤进行亚型分析和探索相应的分子调控机制对于患者风险分层、筛选特异性的诊断生物标志物和潜在治疗靶点,以及改善预后具有重要意义。
铜是一种常见的金属元素,与多种蛋白质或酶结合,参与能量代谢、线粒体呼吸、抗氧化等多种生理过程的调节。铜离子含量的动态平衡是维持正常功能的关键,其不平衡可能导致氧化应激和异常自噬[6],进而诱发多种与铜或铜离子相关的疾病。Tsvetkov等[7]首次提出了一种依赖铜的新型细胞死亡形式,称之为铜死亡。铜死亡是一种依赖于铜的、可调节的细胞死亡方式,与线粒体呼吸密切相关。其发生通过脂酰化的蛋白质聚集实现,铜离子与线粒体呼吸过程中三羧酸循环的脂酰化组分直接结合,导致铁硫聚簇蛋白被抑制,引发蛋白质毒性应激和线粒体代谢功能障碍,最终导致铜死亡。多项研究发现,铜死亡与多种癌症相关,且铜死亡相关基因在预测肿瘤预后及免疫治疗敏感性方面具有较高的价值[8]。然而,脑膜瘤中铜死亡相关基因的潜在生物学作用及其与免疫相关性尚不清楚。
本研究利用公共数据库中脑膜瘤相关的基因表达数据,筛选差异表达的铜死亡基因,并基于这些基因在肿瘤样本中的表达值,进一步识别脑膜瘤的亚型。随后,分析了亚型间的差异表达基因以及亚型与肿瘤免疫微环境的关联。通过将亚型间显著差异的免疫细胞作为表型性状,运用加权基因共表达网络分析(Weighted Gene Coexpression Network Analysis,WGCNA)筛选疾病免疫相关的模块并提取模块基因。进一步筛选了WGCNA模块基因与亚型间差异表达基因的交集,将其作为差异表达的疾病免疫相关基因,进行后续的蛋白蛋白相互作用(proteinprotein interaction,PPI)网络分析、功能富集分析、Friends分析、基因表达验证以及关键基因与临床因素的关联分析。本研究旨在识别与铜死亡相关的脑膜瘤亚型,并筛选疾病免疫相关的关键基因,为深化对脑膜瘤发病机制的理解和提供新的免疫治疗策略提供支持。
1数据与方法
1.1表达谱数据的获取与预处理从美国国家生物技术信息中心(The National Center for Biotechnology Information,NCBI)高通量基因表达(Gene Expression Omnibus,GEO)数据库[9]下载了脑膜瘤相关数据集,包括GSE77259(14例脑膜瘤和3例对照)和GSE43290(47例脑膜瘤和4例对照)。GSE77259数据集使用GPL6244[HuGene1_0st] Affymetrix Human Gene 1.0 ST Array[transcript(gene) version]进行测序,而GSE43290数据集使用GPL96[HGU133A] Affymetrix Human Genome U133A Array。为消除数据集之间的批次效应,使用R软件中的sva包(version 3.34.0)[10]的ComBat函数[11]。随后,将两组数据合并为一组表达谱进行后续分析。
1.2筛选差异表达的铜死亡基因从Zhang等[12]的文獻中提取铜死亡基因,并通过与上述GEO数据集中的基因进行匹配,筛选出脑膜瘤数据集中的铜死亡基因。随后,使用t检验分析铜死亡基因在脑膜瘤和对照样本中的差异表达,并对这些差异表达的铜死亡基因进行皮尔森相关性分析。
1.3无监督聚类分析识别肿瘤亚型利用R软件(version 3.6.1)中的ConsensusClusterPlus包(version 1.58.0)[13],基于差异表达的铜死亡基因在肿瘤样本中的表达值进行一致性聚类分析。采用分层聚类方法,并以Spearman相关系数进行聚类,以识别不同的脑膜瘤亚型。
1.4亚型间差异表达基因分析使用limma包(version 3.42.2)进行亚型间差异表达分析,采用线性回归和经验贝叶斯方法,获得基因的P值(P.Value)和倍数变化(FC)等信息。随后,应用Benjamini & Hochberg(BH)方法进行多重检验校正,得到校正后的P值(adj.P.Value)。差异表达基因的筛选标准为:adj.P.Value<0.05和|logFC|>0.263。
1.5亚型与肿瘤免疫微环境关联基于亚型间差异表达基因的表达矩阵,运用CIBERSORT算法[14]估算了22种免疫细胞在各个样本中的相对浸润丰度。比较了不同亚型之间免疫细胞浸润比例的差异,筛选出亚型间显著差异的免疫细胞。根据表达数据,利用ESTIMATE算法[15]分别估计了肿瘤样本的基质分数和免疫分数,这两个分数分别代表基质和免疫细胞的存在。将这两个分数相加得到免疫微环境分数,可用于估计肿瘤的纯度。然后,比较了不同亚型之间的免疫分数、基质分数、免疫微环境分数以及肿瘤纯度的差异。
1.6WGCNA筛选模块基因WGCNA是一种分析多个样本基因表达模式的方法,通过聚类表达模式相似的基因,并利用模块特征值对模块进行划分,分析模块与特定性状或表型之间的关联,从而筛选出与性状高度相关的模块。从疾病亚型数据集中选择表达量中位数绝对偏差位于TOP20%的基因进行WGCNA分析,以筛选与免疫细胞相关的模块基因。使用R软件中的WGCNA包(version 1.71)[16],以亞型间显著差异的免疫细胞作为表型性状,筛选疾病免疫相关的模块基因,并提取这些模块中的基因用于后续分析。
1.7筛选差异表达疾病免疫相关基因使用R软件中的VennDetail包(version 1.2.0)对WGCNA模块基因和亚型间差异表达基因进行Venn分析,识别交集基因,即认为这些基因是差异表达的疾病免疫相关基因。
1.8PPI网络分析使用STRING数据库(version 11.5)[17]预测基因编码的蛋白之间的互作关系,构建差异表达的疾病免疫相关基因的PPI互作网络。筛选阈值为homo sapiens物种,PPI分数设定为0.4。对PPI网络中的节点进行拓扑学分析,筛选出连接度大于2的节点进行后续分析。
1.9功能富集分析使用在线工具gprofiler[18]中的Functional profiling模块,对PPI网络中节点度大于2的基因进行过表征分析(overrepresentation analysis,ORA)法。进行基因本体论(Gene Ontology,GO)功能和通路富集分析,包括生物学过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cellular component,CC),以及reactome pathway和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)human pathway。筛选标准为BH校正后的P值小于0.05。
1.10Friends分析使用R GOSemSim包(version 2.12.1)[19]对PPI网络中节点度大于2的基因进行Friends分析。重新定义这些基因,计算它们之间的语义相似度,以识别在相互作用中可能更为重要的基因。根据语义相似度评分,鉴定关键(hub)基因。
1.11分析关键基因的表达情况使用t.test对关键基因在疾病组和对照组,以及不同亚型间进行差异分析,进行关键基因的差异表达验证。
1.12关键基因与临床因素关联分析基于数据集中的样本信息,分析关键基因在不同临床因素(分级和组织学)中的表达情况,以探索关键基因与临床因素的关联。
1.13Western Blot实验和免疫组化实验采集不同WHO级别脑膜瘤患者的组织样本,经过处理和蛋白质提取后,通过电泳和Western Blot实验确定MFAP5蛋白的存在。使用验证过的MFAP5抗体(Abcam, AB203828,1∶1 000)和化学发光法评估MFAP5的表达,并将其与参考蛋白(GAPDH)标准化。实验结果以图表和照片形式呈现,并进行相应统计学分析。采集经病理确认的人脑膜瘤组织标本。使用验证过的MFAP5抗体(Abcam, AB203828,1∶600)进行免疫组化染色,根据脑膜瘤WHO级别进行分组。通过显微镜观察和数字显微镜图像采集,记录MFAP5的表达情况。使用统计工具分析数据,并以图表和照片的形式呈现实验结果,探讨MFAP5在脑膜瘤中的表达。
2结果
2.1筛选差异表达的铜死亡基因从Zhang等[12]的研究中获得19个铜死亡相关基因,通过与GEO中的脑膜瘤数据集匹配,在脑膜瘤数据集中确认了16个铜死亡基因。进行差异表达分析揭示,脑膜瘤与对照样本中,其中6个铜死亡基因表现出显著差异表达,包括CDKN2A、DBT、DLAT、GLS、LIAS和PDHA1(图1A)。差异表达的铜死亡基因之间的相关性如图1B所示,例如CDKN2A与GLS呈显著负相关,而DLAT与PDHA1呈显著正相关。
2.2亚型鉴定和亚型间差异表达基因识别基于前述的6个差异表达铜死亡基因在疾病样本中的表达值,进行了无监督的样本聚类分析,考虑K值在2~6的范围内。结果表明,选择最优的K值为2,即得到了两个不同的亚型(Cluster,图2A)。在这两个亚型之间共识别出397个差异表达基因(图2B)。
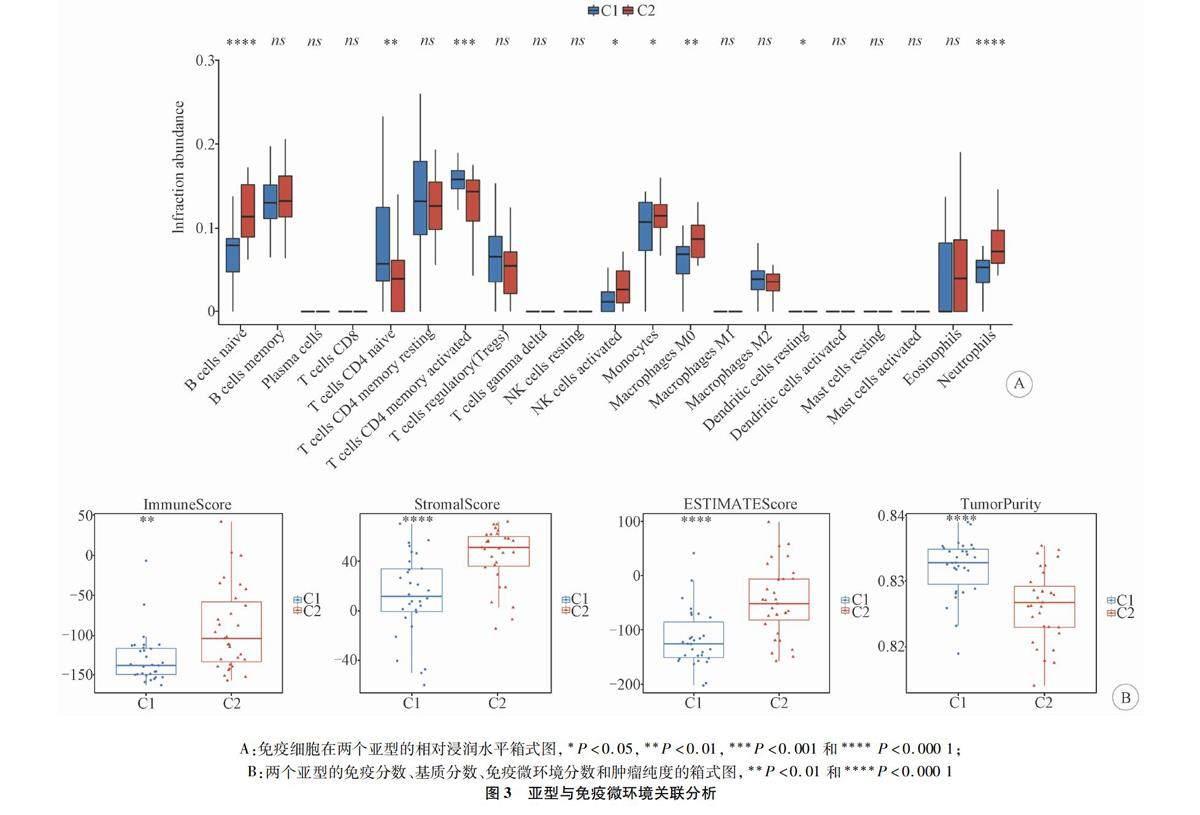
2.3亚型与免疫微环境关联利用CIBERSORT算法对所有疾病样本的表达矩阵进行了分析,估算了各个样本中免疫细胞的相对浸润丰度。在比较不同亚型中样本的免疫细胞浸润丰度时,观察到包括原始B细胞、原始CD4 T细胞、激活的记忆CD4 T细胞、活化的自然杀伤(natural killer,NK)细胞、单核细胞、巨噬细胞M0、静止状态下的树突状细胞和中性粒细胞等8种免疫细胞的浸润丰度在亚型间存在显著差异(图3A)。随后,使用ESTIMATE算法估计了亚型中肿瘤样本的基质分数、免疫分数、免疫微环境分数和肿瘤纯度。结果显示,C2的免疫、基质和免疫微环境分数显著高于C1,但肿瘤纯度显著低于C1(图3B)。
2.4WGCNA筛选疾病免疫相关基因为了筛选免疫细胞相关的关键模块及基因,从疾病亚型数据集中表达量中位数绝对偏差前20%的基因,以免疫细胞作为表型构建WGCNA网络。在软阈值(power)设为5的情况下,无标度拟合指数即signed R^2在0.85左右,表明该网络逼近无尺度分布(图4A)。邻接函数的均值也逐渐接近于0,呈现出平缓的趋势(图4B)。计算了基因间的邻接性,推导出基因间的相似性,得到基因间的系统聚类树。根据混合动态剪切树算法的标准,将每个基因模块的最小基因数设为30。结果显示,除灰色模块外,共得到15个基因共表达模块(图4C)。通过分析模块与免疫细胞浸润程度的相关性,发现MEbrown模块与免疫细胞浸润程度呈现较高的相关性(|r| > 0.6,P<0.01,图4D)。因此,选择该模块中的基因进行后续分析,该模块共包含282个基因。
2.5筛选差异表达的疾病免疫相关基因对WGCNA模块基因与亚型间差异表达基因进行了Venn图分析,发现了74个共同的差异表达的疾病免疫相关基因(图5A),为后续分析提供基础。
2.6PPI网络分析利用STRING数据库构建了包含45个基因和43个关系对的PPI网络(图5B),并对网络中的节点进行了拓扑学分析,发现了9个具有节点度大于2的蛋白,包括TGFB3、LTBP1、ITGB5、IGF1、LHCGR、PRRX1、FMOD、LTBP2和MFAP5。這些高度连接的节点可能在疾病的发生过程中发挥关键作用。
2.7功能富集分析对PPI网络中节点度大于2的基因进行功能富集分析,揭示这些基因的潜在生物学功能。结果表明,这些基因显著富集在多个GO功能和通路中,涵盖了BP、MF、CC、KEGG通路和REAC通路等多个方面。在图5C、5D中按P值排序展示了GO富集分析和通路富集分析的前5个结果。这些显著富集的GO功能包括转化生长因子受体信号通路(GO:BP)、含胶原蛋白的细胞外基质(GO:CC)和细胞外基质结构成分(GO:MF)等;通路富集结果包括TGFbeta信号通路(KEGG)和细胞外基质组织(REAC)等。
2.8Friends分析采用Friends分析重新定义了PPI网络中节点度大于2的基因,并计算了它们之间的语义相似度。最终筛选出了TOP5基因作为关键基因,包括LTBP1、LTBP2、TGFB3、IGF1和MFAP5(图6A)。
2.9关键基因的差异表达情况验证关键基因与疾病的关联,分析了5个关键基因在两个亚型之间以及在疾病和正常样本之间的差异表达情况。结果显示,在与C1相比的C2中,这5个关键基因均呈显著上调表达(图6B)。然而,仅有TGFB3和MFAP5在疾病和正常样本之间表达差异显著(图6C)。
2.10关键基因与临床因素关联分析为了研究关键基因与临床因素的关联,本研究分析了这些关键基因在不同临床因素(分级和组织学)中的表达情况。结果显示,在不同分级中,LTBP2、IGF1和MFAP5的表达存在显著差异(图7A);在不同组织学中,LTBP2和MFAP5的表达也呈现显著差异(图7B)。
2.11Western Blot 实验和免疫组化实验验证关键基因MFAP5在脑膜瘤临床样本中的表达,进行了Western Blot实验。结果显示在不同的WHO级别脑膜瘤中,MFAP5表达在WHO Ⅰ级和WHO Ⅲ级之间以及WHO Ⅰ级和WHO Ⅱ级之间存在显著差异,而在WHO Ⅱ级和WHO Ⅲ级之间未观察到显著差异(图8A、B)。免疫组织化学实验进一步验证了临床组织样本中关键基因MFAP5的表达情况。结果显示,该蛋白在不同级别脑膜瘤中表达趋势与Western Blot实验结果一致(图8C、D)。这些实验证明了MFAP5在不同脑膜瘤级别中的表达差异,为其在脑膜瘤发展中的潜在作用提供了额外支持。
3讨论
脑膜瘤是中枢神经系统原发性肿瘤,其组织学分析是当前诊断的黄金标准。然而,由于脑膜瘤的形态学特征多样,WHO组织学诊断标准的复杂性导致单独依赖组织学分析难以准确预测和区分不同分级的脑膜瘤[20]。在本研究中,通过探索铜死亡相关的脑膜瘤亚型及其亚型相关的关键基因,以拓展并完善当前的WHO分级系统,为脑膜瘤的精确诊断提供更有力的依据。研究结果表明,6个铜死亡基因(如CDKN2A和GLS)在脑膜瘤和对照样本中表达存在差异。通过对这些基因在疾病样本中的表达值进行共聚类,成功定义了2个铜死亡相关亚型,涉及397个差异表达基因,并展示了8种免疫细胞在亚型之间的显著差异。以免疫细胞作为表型,进一步筛选出与疾病免疫相关的5个关键基因,其中LTBP2和MFAP5在不同脑膜瘤等级和组织学中均表现出显著差异。这些发现揭示了脑膜瘤发展过程中铜死亡相关的关键分子机制,为实施脑膜瘤患者的分层和个性化免疫治疗提供了有益的见解。本研究为进一步探索生物标志物,深化对脑膜瘤的分子机制理解以及促进更有效治疗策略的制定奠定了基础。
已有研究表明多种细胞死亡形式,如铁死亡、焦亡和坏死性凋亡,是深入探索抗肿瘤治疗的重要方向[21]。铜死亡作为一种新颖而独特的细胞死亡形式,其发生受细胞内铜的病理性积累和线粒体呼吸的调节影响。在多种癌症中,由体内铜稳态失衡引起的细胞死亡具有重要意义,而一些与铜相关的药物,如喹啉和四硫钼酸盐,已被用于癌症治疗并展现出良好的抗癌活性[22]。这些研究强调了铜代谢和铜死亡在肿瘤进展中的重要作用,而探索肿瘤中关键的铜死亡基因则可能为肿瘤治疗提供新的见解。在本研究中,鉴别出6个在脑膜瘤和对照样本中显著差异表达的铜死亡基因,包括CDKN2A和GLS。CDKN2A(细胞周期蛋白依赖性激酶抑制剂2A)是调节细胞周期的关键基因,广泛涉及多种癌症,其中包括脑膜瘤[23]。最近的研究还提示,CDKN2A mRNA的增加可能是侵袭性脑膜瘤的潜在标志物[24]。谷氨酰胺酶(glutaminase,GLS)是谷氨酰胺转化为谷氨酸的关键酶,在多种肿瘤的发生和发展中发挥着重要作用[25]。据报道,GLS抑制剂CB839对脑膜瘤细胞具有下调谷氨酰胺代谢和抑制增殖的作用[28]。鉴于这些铜死亡基因在脑膜瘤中的关键作用,我们推测这些差异表达的铜死亡基因可能是治疗脑膜瘤的重要靶点。
脑膜瘤呈现多样的组织学特征和生物学行为,导致不同表型和不同临床结果。对于这种多表型、预后不同的癌症,采用个体化治疗策略可能取得更好的治疗效果,突显了肿瘤亚型识别的临床意义。近期,研究越来越关注铜死亡、肿瘤分型和肿瘤免疫微环境之间的关系[25]。肿瘤微环境包括非癌细胞,如免疫细胞和癌症相关成纤维细胞(cancer associated fibroblasts,CAFs)以及这些细胞产生的蛋白质和肿瘤周围环境中的细胞外基质成分。报道显示,肿瘤微环境对脑膜瘤的发生和新治疗方法的指定具有重要性[27]。本研究基于差异铜死亡基因在脑膜瘤样本中的表达值,成功共聚类得到了2个铜死亡相关亚型,并发现在亚型间存在8种免疫细胞的浸润丰度显著差异。例如,原始B细胞、活化的NK细胞、巨噬细胞M0等在C2中的浸润水平明显高于C1,而原始CD4 T细胞和激活的记忆CD4 T细胞等在C2中的浸润水平显著低于C1。既往研究表明,浸润B细胞密度与脑膜瘤复发率显著相关[28]。NK细胞作为在抗肿瘤免疫中起关键作用的淋巴细胞,其在抗脑癌免疫中的潜力已在体内和体外得到验证,可作为直接的抗肿瘤药物,也可作为刺激内源性NK细胞毒性的实验性疗法[29]。Chen等[30]证实了脑膜瘤中存在不同程度的巨噬细胞、T、NK和B细胞的浸润。此外,本研究发现C2的免疫、基质和免疫微环境分数显著高于C1,但肿瘤纯度显著低于C1,暗示C2中的样本可能比C1中样本对免疫治疗反应更为敏感。总的来说,本研究得到的两个铜死亡相关的脑膜瘤亚型在免疫细胞浸润和免疫反应方面存在差异。
WGCNA是广泛应用于识别与疾病表型相关的关键基因和机制的方法[31]。为深入探索调控两个铜死亡相关的脑膜瘤亚型不同免疫特征的关键基因及其潜在机制,首先以亚型间显著差异的免疫细胞为表型,利用WGCNA筛选疾病免疫相关的模块并提取模块基因,然后从WGCNA模块基因和亚型间差异表达基因中筛选出交集基因作为差异表达的疾病免疫相关基因,随后通过PPI和Friends分析进一步筛选出5个关键基因。在这5个基因中,LTBP2在Friends分析中排名最高。LTBP2和MFAP5在脑膜瘤不同等级和不同组织学分类中都表现出显著差异。LTBP2属于潜伏TGFβ结合蛋白(LTBP)细胞外基质蛋白家族,参与TGFβ的可用性,同时在细胞黏附中发挥作用[32]。已有报道显示,LTBP2在复发性和高级别脑膜瘤中表达下调[33]。其他研究发现,LTBP2的表达与CD4+T细胞的募集相关,并与免疫治疗反应有关[34]。MFAP5是一种细胞外间质(extracellular matrix,ECM)糖蛋白,是ECM微纤维的组成部分,在组织发育中起作用。MFAP5由间充质间质细胞分泌,在多种肿瘤中发挥作用,如膀胱癌、乳腺癌和口腔鳞状细胞癌[35]。靶向癌症相关成纤维细胞中的MFAP5通过重塑基质使胰腺癌对程序性细胞死亡1(programmed death protein 1,PD1)免疫化疗敏感[36]。蛋白组学分析提示,在颅底脑膜瘤中Notch通路蛋白MFAP2和MFAP5显著富集,MFAP5在WHO ⅡⅢ级脑膜瘤低表达,在WHO Ⅰ级中高表达[37]。基于LTBP2和MFAP5在不典型/恶性(WHO ⅡⅢ级)脑膜瘤低表达,良性(WHO Ⅰ级)高表达,并且这些基因富集到细胞外基质相关的功能和通路中,本研究推测可能存在一种潜在机制,即良性脑膜瘤的肿瘤微环境中的细胞外基质形成和复杂性构成了一个区域生态位和封闭屏障,防止肿瘤侵入周围正常组织,形成一定程度的局部免疫状态。而不典型/恶性脑膜瘤中细胞外基质相关基因的低表达可能暗示着密集的间质重塑为相对疏松状态,为肿瘤侵入正常脑组织提供结构基础,但同时有利于免疫细胞浸润以及化疗药物的渗透。尽管目前尚无铜死亡与LTBP2或MFAP5相关性的研究,本研究推测铜死亡基因可能通过调控LTBP2或MFAP5这些关键基因的表达,来影响脑膜瘤肿瘤微环境中细胞外基质的形成和作用,从而介导脑膜瘤对免疫治疗的反应。
本研究聚焦于“铜死亡基因与脑膜瘤相关基因”的富集分析,虽然与脑膜瘤的病理分型直接关系有限,但这一探索具有显著的科学意义。深入了解铜死亡基因与脑膜瘤的关系不仅为未来疾病机制研究提供关键信息,也有望揭示潜在的药物靶点,改進脑膜瘤治疗方法的可能性。然而,值得注意的是,本研究中使用的脑膜瘤公共数据库未包含患者的生存数据,因此无法对所获得的差异基因进行详细的患者预后相关性分析。尽管成功识别了一些与脑膜瘤相关的差异基因,但在缺乏生存数据的情况下,本研究难以确切说明这些基因是否与患者的预后有关。尽管当前研究离实际临床应用可能较远,但对脑膜瘤的深入研究将有助于加深对肿瘤疾病机制的理解,为未来的研究提供基础。当前的研究模式虽主要集中于富集分析,但所获得的结果可能为未来的临床研究提供宝贵线索,有助于鉴定新的治疗靶点或药物,从而改善脑膜瘤的治疗方法,为患者提供更有效的治疗方案。
总体而言,本研究共筛选到2个铜死亡相关的脑膜瘤亚型,这两个亚型呈现不同的免疫细胞浸润和免疫反应。在两个亚型之间筛选到免疫相关的关键基因,如LTBP2和MFAP5,可能是铜死亡调控脑膜瘤发生和发展的关键机制。这些基因有望成为新的脑膜瘤诊断生物标志物或者免疫治疗靶点,为脑膜瘤的免疫治疗提供了新的启示。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1]Ostrom QT,Gittleman H,Truitt G,et al.CBTRUS statistical report:primary brain and other central nervous system tumors diagnosed in the United States in 2011—2015[J].Neurooncology,2018,20(suppl_4):iv1iv86.
[2]Louis DN,Perry A,Wesseling P,et al.The 2021 WHO Classification of Tumors of the Central Nervous System:a summary[J].Neurooncology,2021,23(8):12311251.
[3]Dalle Ore CL,Magill ST,Yen AJ,et al.Meningioma metastases:incidence and proposed screening paradigm[J].J Neurosurg,2019,132(5):14471455.
[4]Lin DD,Lin JL,Deng XY,et al.Trends in intracranial meningioma incidence in the United States,2004—2015[J].Cancer Med,2019,8(14):64586467.
[5]Berghoff AS,Hielscher T,Ricken G,et al.Prognostic impact of genetic alterations and methylation classes in meningioma[J].Brain Pathol,2022,32(2):e12970.
[6]Guo HR,Wang YQ,Cui HM,et al.Copper induces spleen damage through modulation of oxidative stress,apoptosis,DNA damage,and inflammation[J].Biol Trace Elem Res,2022,200(2):669677.
[7]Tsvetkov P,Coy S,Petrova B,et al.Copper induces cell death by targeting lipoylated TCA cycle proteins[J].Science,2022,375(6586):12541261.
[8]Zhang WT,Gong YM,Zhang CY,et al.A novel cuprotosisrelated gene FDX1 signature for overall survival prediction in clear cell renal cell carcinoma patients[J].Biomed Res Int,2022,2022:9196540.
[9]Barrett T,Wilhite SE,Ledoux P,et al.NCBI GEO:archive for functional genomics data sets—update[J].Nucleic Acids Res,2013,41(Database issue):D991D995.
[10]Leek JT,Storey JD.A general framework for multiple testing dependence[J].Proc Natl Acad Sci USA,2008,105(48):1871818723.
[11]Johnson WE,Li C,Rabinovic A.Adjusting batch effects in microarray expression data using empirical Bayes methods[J].Biostatistics,2007,8(1):118127.
[12]Zhang LP,Zhang YJ,Bao JH,et al.Cuproptosis combined with lncRNAs predicts the prognosis and immune microenvironment of breast cancer[J].Comput Math Methods Med,2022,2022:5422698.
[13]Wilkerson MD,Hayes DN.ConsensusClusterPlus:a class discovery tool with confidence assessments and item tracking[J].Bioinformatics,2010,26(12):15721573.
[14]Chen BB,Khodadoust MS,Liu CL,et al.Profiling tumor infiltrating immune cells with CIBERSORT[J].Methods Mol Biol,2018,1711:243259.
[15]Yoshihara K,Shahmoradgoli M,Martínez E,et al.Inferring tumour purity and stromal and immune cell admixture from expression data[J].Nat Commun,2013,4:2612.
[16]Langfelder P,Horvath S.WGCNA:an R package for weighted correlation network analysis[J].BMC Bioinformatics,2008,9:559.
[17]Szklarczyk D,Gable AL,Lyon D,et al.STRING v11:proteinprotein association networks with increased coverage,supporting functional discovery in genomewide experimental datasets[J].Nucleic Acids Res,2019,47(D1):D607D613.
[18]Raudvere U,Kolberg L,Kuzmin I,et al.G:Profiler:a web server for functional enrichment analysis and conversions of gene lists(2019 update)[J].Nucleic Acids Res,2019,47(W1):W191W198.
[19]Yu GC,Li F,Qin YD,et al.GOSemSim:an R package for measuring semantic similarity among GO terms and gene products[J].Bioinformatics,2010,26(7):976978.
[20]Sofela AA,McGavin L,Whitfield PC,et al.Biomarkers for differentiating grade II meningiomas from grade I:a systematic review[J].Br J Neurosurg,2021,35(6):696702.
[21]DArcy MS.Cell death:a review of the major forms of apoptosis,necrosis and autophagy[J].Cell Biol Int,2019,43(6):582592.
[22]Rieber M.Cancer prooxidant therapy through copper redox cycling:Repurposing disulfiram and tetrathiomolybdate[J].Curr Pharm Des,2020,26(35):44614466.
[23]Guyot A,Duchesne M,Robert S,et al.Analysis of CDKN2A gene alterations in recurrent and nonrecurrent meningioma[J].J Neurooncol,2019,145(3):449459.
[24]Wang JZ,Patil V,Liu J,et al.Increased mRNA expression of CDKN2A is a transcriptomic marker of clinically aggressive meningiomas[J].Acta Neuropathol,2023,146(1):145162.
[25]Masisi BK,El Ansari R,Alfarsi L,et al.The role of glutaminase in cancer[J].Histopathology,2020,76(4):498508.
[26]Ijare OB,Hambarde S,Brasil da Costa FH,et al.Glutamine anaplerosis is required for amino acid biosynthesis in human meningiomas[J].Neurooncology,2022,24(4):556568.
[27]SahabNegah S,Gorji A.Meningioma tumor microenvironment[J].Adv Exp Med Biol,2020,1296:3348.
[28]Wang AZ,BowmanKirigin JA,Desai RP,et al.Singlecell profiling of human dura and meningioma reveals cellular meningeal landscape and insights into meningioma immune response[J].Genome Med,2022,14(1):49.
[29]Fares J,Davis ZB,Rechberger JS,et al.Advances in NK cell therapy for brain tumors[J].NPJ Precis Onc,2023,7:17.
[30]Chen XD,Tian F,Lun P,et al.Profiles of immune infiltration and its relevance to survival outcome in meningiomas[J].Biosci Rep,2020,40(5):BSR20200538.
[31]Li Y,Deng G,Zhang HK,et al.Weighted gene correlation network analysis identifies microenvironmentrelated genes signature as prognostic candidate for Grade II/III glioma[J].Aging,2020,12(21):2212222138.
[32]Robertson IB,Horiguchi M,Zilberberg L,et al.Latent TGFβbinding proteins[J].Matrix Biol,2015,47:4453.
[33]PérezMagán E,CamposMartín Y,Mur P,et al.Genetic alterations associated with progression and recurrence in meningiomas[J].J Neuropathol Exp Neurol,2012,71(10):882893.
[34]Zhang XW,Tian CJ,Cheng JB,et al.LTBP2 inhibits prostate cancer progression and metastasis via the PI3K/AKT signaling pathway[J].Exp Ther Med,2022,24(3):563.
[35]Wang YJ,Wang RX,Li BW,et al.Cancerassociated fibroblasts in the invasive tumour front promote the metastasis of oral squamous cell carcinoma through MFAP5 upregulation[J].Gene,2023,876:147504.
[36]Duan Y,Zhang XZ,Ying HG,et al.Targeting MFAP5 in cancerassociated fibroblasts sensitizes pancreatic cancer to PDL1based immunochemotherapy via remodeling the matrix[J].Oncogene,2023,42(25):20612073.
[37]Papaioannou MD,Djuric U,Kao J,et al.Proteomic analysis of meningiomas reveals clinically distinct molecular patterns[J].Neurooncology,2019,21(8):10281038.
