MGMT启动子甲基化在接受放化疗的新发野生型胶质母细胞瘤患者中的预后作用
2024-05-11古威芹李晨曦陈小红苏丽萍郑亚杰
古威芹 李晨曦 陈小红 苏丽萍 郑亚杰


【摘要】目的探求O6甲基鸟嘌呤DNA甲基转移酶(MGMT)启动子甲基化对新发野生型胶质母细胞瘤(GBM)患者术后预后质量的影响。方法回顾性分析2019年1月—2022年12月在新疆医科大学第一附属医院神经外科新诊断的41例异柠檬酸脱氢酶(IDH)野生型GBM患者的临床资料,通过焦磷酸测序评估GBM患者的MGMT启动子甲基化状态,同时分析与患者预后质量的相关性。结果所有患者的MGMT启动子甲基化发生率为43%。MGMT启动子甲基化的患者中位生存期明显长于未甲基化患者(P<0.05),甲基化患者的总生存期也明显长于未甲基化患者(P<0.05)。结论MGMT启动子甲基化可延长IDH野生型GBM患者术后放化疗后生存期,但未见线性关系,提示MGMT启动子甲基化对预后的影响程度可能不同。
【关键词】胶质母细胞瘤;MGMT;甲基化;烷化治疗;焦磷酸测序
【中图分类号】R739.41【文献标志码】A【文章编号】16727770(2024)02018205
Prognostic role of MGMT promoter methylation in emerging wildtype glioblastoma patients undergoing chemoradiotherapy GU Weiqin, LI Chenxi, CHEN Xiaohong, et al. Second Department of Neurosurgery, the First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, China
Corresponding author: LI Chenxi
Abstract: ObjectiveTo explore the O6methylguanine DNA methyltransferase(MGMT) promoter methylation on the quality of postoperative prognosis in patients with new wildtype glioblastoma(GBM). MethodsThe clinical data of 41 patients with wildtype GBM isocitrate dehydrogenase(IDH) newly diagnosed in Department of Neurosurgery, the First Affiliated Hospital of Xinjiang Medical University from 2019 to 2022 were analyzed retrospectively. MGMT promoter methylation status was assessed in GBM patients by pyrosequencing, while simultaneously analyzed for correlation with patient outcome quality. ResultsThe incidence of MGMT promoter methylation in all patients was 43%. Patients with MGMT methylated promoters had significantly higher median survival than unmethylated patients(P<0.05), and overall survival was significantly longer than unmethylated patients(P<0.05). ConclusionMGMT promoter methylation can prolong the survival after postoperative chemoradiotherapy in patients with IDH wildtype GBM, but no linear relationship is observed, which suggesting that the effect of MGMT promoter methylation on prognosis may be different.
Key words: glioblastoma; MGMT; methylation; alkylation therapy; pyrosequencing
基金项目:国家自然科学基金资助项目(82360256)
作者单位:830054 乌鲁木齐,新疆医科大学第一附属医院神经外二科(古威芹,陈小红),病理科(苏丽萍);新疆医科大学第一附属医院(附属口腔医院)口腔颌面肿瘤外科,新疆维吾尔自治区口腔医学研究所(李晨曦);华中科技大学同济医学院附属协和医院,口腔颌面发育与再生湖北省重点实验室(李晨曦);汉堡埃彭多夫大学医学中心肿瘤遗传学和再生医学实验室神经内科(郑亚杰)
通信作者:李晨曦
膠质母细胞瘤(glioblastoma multiforme,GBM)是最常见的原发性恶性脑肿瘤类型[1],患者一般以头痛、癫痫为首发症状,随后可出现运动和/或感觉神经功能障碍等表现。现阶段,最大程度安全手术切除以及随后同步放疗和替莫唑胺(temozolomide,TMZ)维持化疗(STUPP方案)是新诊断GBM患者标准治疗方案[2],然而临床数据显示,此类患者经治疗后中位总生存期仅为15~18个月[34],5年生存率不到7%[5]。O6甲基鸟嘌呤DNA 甲基转移酶[O6methylguanine(O6MeG)DNA methyltransferase,MGMT]是一种DNA修复蛋白,可催化甲基从O6位的鸟嘌呤DNA核苷酸转移到其自身145位的半胱氨酸残基,并发挥修复作用,在维持基因组的完整性以及修复DNA复制和转录过程中的差异和错误方面发挥着重要作用[6],同时这种修复机制防止了由于烷化剂导致的细胞死亡、基因突变和肿瘤转化。CpG岛主要位于基因的启动子和外显子区域,正常细胞的CpG岛处于非甲基化状态。MGMT启动子的甲基化导致基因沉默,降低MGMT蛋白表达和其DNA修复活性,增加肿瘤对烷化剂(如TMZ)的敏感性[78]。Hegi等[9]研究证明,MGMT启动子甲基化可以预测TMZ的疗效。研究发现,CpG 8487和89对MGMT蛋白表达的影响最大,与之相反,CpG 7381的分析与MGMT蛋白表达的相关性最好[10]。然而,CpG 7489区域的平均甲基化与GBM患者的中位生存时间显著相关[1113]。本研究回顾性分析了2019年1月—2022年12月在新疆医科大学第一附属医院神经外科新诊断的41例异柠檬酸脱氢酶isocitrate dehydrogenase,IDH)野生型GBM患者的临床资料,旨在评估MGMT启动子甲基化在接受放化疗的新诊断野生型GBM患者的预后意义及其与临床变量的关联。现报告如下。
1资料与方法
1.1一般资料共纳入41例通过焦磷酸测序(pyrosequencing,PSQ)评估MGMT启动子甲基化状态的连续IDH野生型GBM患者,其中男32例,女9例;年龄49~81岁,平均年龄(53.06±12.92)岁。PSQ方法检测了75~84个CpG位点的MGMT基因启动子。纳入标准:(1)经组织病理学证实的GBM诊断(根据WHO 2007年和2016年);(2)美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)的体力状况评分(performance status,PS)≤2后开始肿瘤治疗;(3)以TMZ作为一线治疗的放化疗。排除标准:(1)植入卡莫司汀晶片(Gliadel)的患者;(2)患有IDH 12突变肿瘤的患者,以避免干扰对该特定患者群体的结果评估。所有患者均为新诊断GBM患者,根据STUPP方案,所有患者均接受术后同步放疗和TMZ治疗,同时根据有否MGMT启动子甲基化分为甲基化组(18例)和未甲基化组(23例)。本研究已通过新疆医科大学第一附属医院伦理委员会审查批准(审批号:K2022022585)。
1.2组织样本提取每个组织样本提供10 μm的石蜡包埋肿瘤组织切片并进行处理以分离DNA。为了避免坏死组织的污染,通过显微解剖,选择至少有60%的肿瘤细胞组织样本。
1.3DNA甲基化水平检测采用PSQ方法测定GBM组织DNA样本中MGMT基因启动子甲基化的程度,其中DNA样本按照试剂说明书使用QIAamp DNA Mini Kit(Qiagen, Hilden, Germany) 提取,测序选用PyroMark Q24型(QIAGEN Lmt.Co.,Germany)焦磷酸测序仪进行分析,基本流程:组织DNA样本提取→亚硫酸氢盐处理→DNA样本纯化→聚合酶链反应(polymerase chain reaction,PCR)扩增→凝胶电泳→焦磷酸测序。使用Nanodrop机器(Thermo Scientific,Rockford,IL,USA)通过分光光度法评估DNA质量和浓度。根据试剂说明书,将250 ng的基因组DNA置于MGMT Plus亚硫酸氢盐转化试剂盒(Diatech,Iesi,Italy)中。用亚硫酸氢盐处理DNA,以确定10个CpG位点(CpG 7584)的甲基化状态。PSQ的模板通过Rotorgene 6000用针对模板链(MGMT Plus Kit,Diatech,Iesi,Italy)生物素化的引物进行扩增。然后将20 μL生物素化PCR产物固定在链霉亲和素包被的琼脂糖珠(GE Healthcare,Uppsala,Sweden)上,并使用PyroMark Q96系统(Diatech,Iesi,Italy)分析单链DNA模板。使用PyroMark Q96 配套软件对分析的10个CpG甲基化密度进行量化,并通过计算所有10个甲基化位点的平均值,获得每个样品的甲基化百分比。样品一式两份运行。
1.4PCR扩增模板选择为经甲基化处理的DNA,选用特异甲基化引物MF/MR和未甲基化引物UF/UR进行PCR扩增,见表1。扩增条件:首先95 ℃预变性10 min,95 ℃处理30 s,56 ℃退火30 s,72 ℃扩增30 s,以上条件进行35个循环,随后在72 ℃条件下延伸5 min。将扩增产物于2.5%琼脂糖凝胶进行电泳分离,采用紫外凝胶成像进行结果观察。分离条带中非甲基化条带出现扩增而甲基化条带未扩增提示甲基化阴性,反之则为甲基化阳性。
1.5手术后辅助治疗方案及随访调查新诊断GBM患者标准治疗方案即STUPP方案,包括最大程度安全手术切除及术后整个放射治疗期间使用75 mg/m2的TMZ进行化疗,每28天单独使用150~200 mg/m2的TMZ持续化疗5 d。手术后每半年进行1次随访,记录患者的生存状态,总生存期(overall survival,OS)是指从手术日期到死亡或最后一次随访的日期。
1.6统计学分析使用SPSS 25.0统计学软件进行统计分析。均数±标准差(x±s),中位数[四分位数间距(interquartile range,IQR)]分别用于描述正态分布和非正态分布的数据。使用KaplanMeier法绘制生存曲线,并應用分段分析的Logrank检验来评估生存差异。计数资料采用例数(率)进行描述,组间比较采用χ2检验,统计效应值可信度使用95%置信区间(confidence interval,CI)表示,以P<0.05被认为具有统计学意义。
2结果
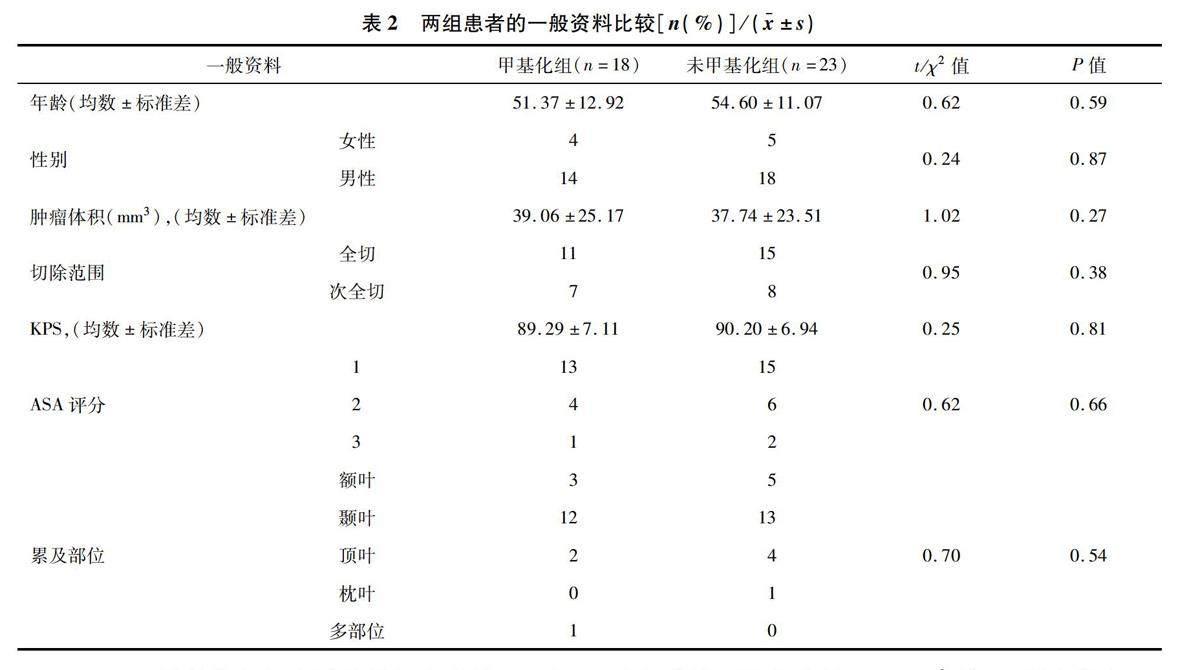
2.1两组患者的一般资料比较甲基化组与未甲基化组患者的年龄、性别、肿瘤体积、手术切除范围(全切、次全切)、术前卡氏评分(Karnofsky performance status,KPS)、美国麻醉师协会(American society of anesthesiologists,ASA)评分和累及部位(额叶、颞叶、顶叶、枕叶、多部位)等基本资料比较,差异均无统计学意义(P>0.05),见表2。
2.2MGMT甲基化组与未甲基化组患者的OS比较MGMT甲基化组患者的中位OS为504 d,未甲基化组患者的中位OS为329 d,MGMT甲基化组明显长于未甲基化组(P<0.05),见图1。
2.3GBM患者生存时间与MGMT启动子甲基化和肿瘤切除范围的相关性在接受全切术的26例患者中,11例(42.3%)发生MGMT启动子甲基化。全切术后,甲基化患者的中位OS为551 d,而未发生甲基化患者的中位OS为321 d。在接受次全切除术的患者中,有7例患者具有甲基化的MGMT启动子,中位OS为376.5 d,而8例具有未甲基化MGMT启动子的患者,中位OS为260 d,MGMT甲基化组明显长于未甲基化组(P<0.05),见图2。
2.4GBM患者生存时间与MGMT甲基化和肿瘤大小相关性肿瘤体积≤32 mm3的21例患者中,10例(47.6%)发生MGMT甲基化,11例没有甲基化。MGMT甲基化的患者具有明显更长的中位OS(560.5 d vs 329 d,P<0.05)。在肿瘤体积>32 mm3的患者中,MGMT甲基化和非甲基化患者的存活率并没有显著差异(P>0.05),见图3。
3讨论
TMZ是一种新型的口服烷化剂化疗药物,具有抗癌活性广和血脑屏障穿透力强等优势,是GBM的重要化疗药物,但临床数据显示,约有半数GBM患者对TMZ耐药,其中相关靶基因启动子甲基化修饰引起基因沉默或激活起着重要作用,同时也是提高GBM化疗疗效的新方向[1415]。MGMT基因定位于人10号染色体长臂,其功能是将鸟嘌呤O6位点的甲基转移至半胱氨酸残基来修复受损的鸟嘌呤核苷酸,实现DNA修复目的,降低烷基化剂所致基因突变、细胞死亡以及肿瘤发生风险,因此常被视作为化疗抗性因子。研究表明,MGMT基因表达调控主要以表观遗传修饰为主,表现为MGMT启动子的CpG岛甲基化修饰,而发生基因突变、缺失及重排的概率较低,启动子的甲基化可导致MGMT转录和蛋白表达沉默,影响细胞DNA修复活性从而增强烷化剂(如TMZ)敏感性。MGMT基因启动子包含98个位于转录起始位点附近的CpG位点,由2个不同的甲基化区域组成,即CpG 2550和7390[16]。CpG甲基化的情况下,基因的转录受阻导致转录和蛋白质的酶活性丧失。
正确选择分析MGMT基因启动子甲基化状态的方法对于不同CpG位点的甲基化异质性至关重要。虽然CpG 8487和89对MGMT蛋白表达的影响最大,但CpG 7381的分析与MGMT蛋白表达的相关性最好[17]。然而,也有研究表明,CpG 7489区域的甲基化与GBM患者的中位OS显著相关。而本研究中,通过分析75~84个MGMT CpG位点,结果符合之前报道的CpG最佳区域[18]。与生存相关的MGMT启动子甲基化缺失的确定一直被认为是最复杂和最有争议的方面之一。基因特征对临床预后和选择合适的治疗方案具有重要作用。在评估GBM患者的OS时,本研究考虑了MGMT启动子基因甲基化的存在、肿瘤切除的程度、患者的年龄和肿瘤的位置。本研究结果表明,具有MGMT基因启动子甲基化的GBM患者对辅助治疗的反应更有利,因此生存时间更长。具有MGMT甲基化的基线肿瘤体积≤32 mm3的患者生存时间显著延长(560.5 d vs 329 d,P< 0.05)。这可以归因于与体积较大的肿瘤相比,较小肿瘤的更易彻底切除。本研究结果还显示,具有MGMT基因启动子甲基化的GBM患者对辅助治疗的反应更有利,因此生存时间更长。大量研究表明,MGMT甲基化可预测患者较长的生存时间[1921]。Binabaj等[22]对29项报告了MGMT启动子甲基化对OS影响的研究进行了荟萃分析,在15项研究的单变量分析中,合并风险比为0.67(95%CI:0.58~0.78),在14项研究的多变量分析中,合并风险比为0.49(95%CI:0.38~0.64)[22]。另有几项试验也发现,在接受TMZ治疗的具有甲基化MGMT启动子的个体中,患者无进展生存期得到延长[23]。本研究结果与目前文献报道基本一致,提示MGMT甲基化有助于增强GBM患者化疗敏感性,延长手术后生存期。
本研究中,MGMT启动子甲基化是一个有利的预后因素,诊断时小肿瘤(≤32 mm3)和接受全切术的患者总生存期最长。由MGMT啟动子甲基化导致的DNA修复基因的表观遗传沉默与接受烷化剂治疗的GBM患者的存活时间更长有关。但仍需要更多中心研究评估MGMT启动子甲基化与MGMT表达,或MGMT基因甲基化的关系,以充分了解其预后潜力。
本研究存在一些局限性。首先,本研究是针对在单一机构接受治疗的相对较小样本量的患者群体进行的,结局指标不包括无进展生存期。其次,由于本研究随访期间没有评估IDH中的突变效应,可能夸大了MGMT启动子甲基化的预后意义。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1]Ostrom QT,Patil N,Cioffi G,et al.CBTRUS statistical report:primary brain and other central nervous system tumors diagnosed in the United States in 2013—2017[J].Neuro Oncol,2020,22(12 Suppl 2):iv1iv96.
[2]Fresnais M,Turcan S,Theile D,et al.Approaching sites of action of temozolomide for pharmacological and clinical studies in glioblastoma[J].Biomedicines,2021,10(1):1.
[3]Seyve A,LozanoSanchez F,Thomas A,et al.Initial surgical resection and long time to occurrence from initial diagnosis are independent prognostic factors in resected recurrent IDH wildtype glioblastoma[J].Clin Neurol Neurosurg,2020,196:106006.
[4]Wen PY,Weller M,Lee EQ,et al.Glioblastoma in adults:a Society for NeuroOncology(SNO) and European Society of NeuroOncology(EANO) consensus review on current management and future directions[J].Neuro Oncol,2020,22(8):10731113.
[5]Ostrom QT,Truitt G,Gittleman H,et al.Relative survival after diagnosis with a primary brain or other central nervous system tumor in the National Program of Cancer Registries,2004 to 2014[J].Neurooncol Pract,2020,7(3):306312.
[6]Von Deimling A,Korshunov A,Hartmann C.The next generation of glioma biomarkers:MGMT methylation,BRAF fusions and IDH1 mutations[J].Brain Pathol,2011,21(1):7487.
[7]Yu W,Zhang LL,Wei QC,et al.O6methylguanineDNA methyltransferase(MGMT):challenges and new opportunities in glioma chemotherapy[J].Front Oncol,2019,9:1547.
[8]Ducray F,El Hallani S,Idbaih A.Diagnostic and prognostic markers in gliomas[J].Curr Opin Oncol,2009,21(6):537542.
[9]Hegi ME,Diserens AC,Gorlia T,et al.MGMT gene silencing and benefit from temozolomide in glioblastoma[J].N Engl J Med,2005,352(10):9971003.
[10]Kurdi M,Butt NS,Baeesa S,et al.Prognostic value of TP53 expression and MGMT methylation in glioblastoma patients treated with temozolomide combined with other chemotherapies[J].J Neurooncol,2021,152(3):541549.
[11]Quillien V,Lavenu A,Sanson M,et al.Outcomebased determination of optimal pyrosequencing assay for MGMT methylation detection in glioblastoma patients[J].J Neurooncol,2014,116(3):487496.
[12]Wang J,Zhang M,Liu YF,et al.Potent predictive CpG signature for temozolomide response in nongliomaCpG island methylator phenotype glioblastomas with methylated MGMT promoter[J].Epigenomics,2022,14(20):12331247.
[13]Stegmann SK,Kuhl S,Im NG,et al.Death receptor 6 as a prognostic marker in lowgrade glioma[J].Anticancer Res,2022,42(3):12371245.
[14]Berghoff AS,Preusser M.Clinical neuropathology practice guide 062012:MGMT testing in elderly glioblastoma patients—yes,but how?[J].Clin Neuropathol,2012,31(6):405408.
[15]Zemskova OV,Kurinnyi DA,Rushkovsky SR,et al.Development of tumorinduced bystander effect and radiosensitivity in the peripheral blood lymphocytes of glioblastoma patients with different MGMT gene methylation statuses in tumor cells[J].Cytol Genet,2021,55(2):125131.
[16]Yang JY,Yu L,Gaiteri C,et al.Association of DNA methylation in the brain with age in older persons is confounded by common neuropathologies[J].Int J Biochem Cell Biol,2015,67:5864.
[17]孫亚方,王政,石祥宇,等.老年胶质母细胞瘤患者MGMT甲基化状态对放化疗及预后影响[J].中华放射肿瘤学杂志,2021,30(5):446450.
[18]Choi HJ,Choi SH,You SH,et al.MGMT promoter methylation status in initial and recurrent glioblastoma:correlation study with DWI and DSC PWI features[J].AJNR Am J Neuroradiol,2021,42(5):853860.
[19]Shu C,Wang Q,Yan XL,et al.The TERT promoter mutation status and MGMT promoter methylation status,combined with dichotomized MRIderived and clinical features,predict adult primary glioblastoma survival[J].Cancer Med,2018,7(8):37043712.
[20]Brandner S,McAleenan A,Kelly C,et al.MGMT promoter methylation testing to predict overall survival in people with glioblastoma treated with temozolomide:a comprehensive metaanalysis based on a Cochrane Systematic Review[J].Neuro Oncol,2021,23(9):14571469.
[21]Chai RC,Li GZ,Liu YQ,et al.Predictive value of MGMT promoter methylation on the survival of TMZ treated IDHmutant glioblastoma[J].Cancer Biol Med,2021,18(1):272282.
[22]Binabaj MM,Bahrami A,ShahidSales S,et al.The prognostic value of MGMT promoter methylation in glioblastoma:a metaanalysis of clinical trials[J].J Cell Physiol,2018,233(1):378386.
[23]Li JH,Liang RF,Song C,et al.Prognostic and clinicopathological significance of long noncoding RNA in glioma[J].Neurosurg Rev,2020,43(1):18.