弥漫性肺脑膜瘤样结节1例
2024-05-10冯小燕彭雅丽李燕肖永龙
冯小燕 彭雅丽 李燕 肖永龙
微小肺脑膜瘤样结节(minute pulmonary meningothelial-like nodules,MPMN)是一种组织学上罕见的病变,是一种病因不明的反应性增殖性良性肺部疾病。单个病灶被定义MPMN,而多个结节被称为弥漫性肺脑膜瘤样结节(diffuse pulmonary meningotheliomatosis,DPM)[1]。DPM极为罕见,文献报道很少。在目前所有的临床资料中,这些结节通常是无症状的。事实上,它们通常在尸检或手术标本中偶然发现,确诊依赖于组织病理学[2]。此外,这些结节的确切起源和性质至今仍有争议。随着高分辨率计算机断层扫描技术的快速发展,越来越多地使用胸部扫描技术,使得这些肺结节能够被早期发现[1]。在高分辨率CT计算机断层成像上,DPM可表现为弥漫性网状结节浸润和磨玻璃结节,可以模拟恶性或感染性病变,或弥漫性间质性肺疾病,在转移性疾病、感染性疾病或间质性疾病中均需考虑DPM可能性[2, 3]。在此,我们报告1例经病理证实的易被误诊为转移性疾病的DPM,并总结DPM的特点,以提高临床医生对该病的认识。
病例资料
患者,女性,61岁,在2011年常规胸部CT扫描中发现双侧肺结节。否认吸烟史、恶性肿瘤史和呼吸道症状,包括咳嗽,咳痰或呼吸困难。体格检查和常规的血液检查未见明显异常。胸部高分辨率CT显示双肺实质随机分布1~5mm的磨玻璃结节病变(图1A)。患者为年度胸部CT随访。3年后,右乳房意外发现了一肿块。经过2年的随访观察,予以右侧乳房切除术,术后病理显示非特异性浸润性乳腺癌,WHO分级Ⅱ级,IA (T1,N0,cM0)。
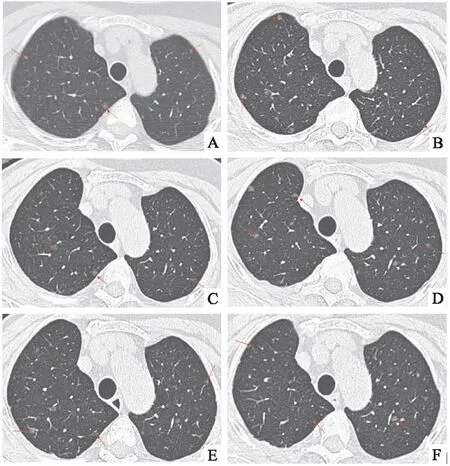
图1 患者胸部高分辨率CT 随访,可见双肺弥漫性磨玻璃结节A:2011年胸部高分辨率CT;B:2017年胸部高分辨率CT;C:2019年胸部高分辨率CT;D:2021年胸部高分辨率CT;E:2022年胸部高分辨率CT;F:2023年胸部高分辨率CT
在每年的胸部CT随访中,发现患者肺部磨玻璃结节的大小和数量略有增加,但随访期间患者未接受特殊治疗。2017年胸部CT随访发现双侧磨玻璃结节最大直径可达7 mm(图1B)。此时,患者仍无呼吸道症状,包括咳嗽、咳痰或呼吸困难。肺活量、超声心动图和血清肿瘤标志物水平均正常。HIV血清学结果为阴性。病变是否为恶性肿瘤的转移结节尚不清楚,患者接受了电视胸腔镜手术以明确诊断。
从肺右上和下叶获得标本,切割表面显示出小灰色结节。(如图2A)所示,显微镜下提示椭圆形或梭形细胞的间质增殖,该细胞胞质丰富,边界不明显,核椭圆形,具有细颗粒状染色质和不显眼的核仁,包含小血管。免疫组织化学分析显示上皮膜抗原(EMA),CD56和孕酮受体(PR)阳性(图2B-D)。细胞角蛋白、HMB45、S100、平滑肌肌动蛋白、Desmin、D2-40、CD31、CD34呈阴性。根据影像学和组织病理学得出了DPM的最终诊断。这是1例罕见的易被误诊为转移性疾病的DPM。术后患者随诊胸部CT,2019、2021、2022年(图1C-E)胸部CT仍见散在多发磨玻璃结节,最大者直径7mm,数量和大小较前未见明显变化。后续临床随访,2023年(图1F)患者胸部CT提示双肺弥漫性磨玻璃结节,数量较前稍有增加,部分结节大小较前增大,最大者直径8mm,患者仍无呼吸道症状,后续仍继续随访。

图2 病灶的组织学和免疫组化染色A:显微镜下提示椭圆形或梭形细胞的间质增殖,该细胞胞质丰富,边界不明显,椭圆形核,细颗粒状染色质,不显眼的核仁,包含小血管(HE染色,×400);B:上皮膜抗原(EMA)阳性(免疫组化分析,×100);C:CD56阳性;D:孕激素受体(PR)阳性
讨 论
MPMN是一种良性肺结节。它们是很小的病变,通常在手术或尸检肺标本中偶然发现。1960年,Korn等人首次观察到这些病变,由于它们的微观结构、细胞学特征以及与血管的关系,将其命名为“肺化学感受器瘤”[4]。很长一段时间内,MPMN 被认为是化学感受器,具有氧监测功能。1988年,Gaffey等人发现病变在细胞形态、免疫组化染色和超微结构上与脑膜瘤上皮细胞相似,将其更名为MPMN[5]。MPMN的影像学一般表现为肺磨玻璃或实性结节,当表现为弥漫性粟粒性结节或与间质性肺炎相似的特征,则称为DPM[6]。DPM发病率女性大于男性,通常发病年龄大于60岁[3, 6]。部分患者否认吸烟史和职业接触史,提示包括香烟在内的有害气体或粉尘吸入可能不是该病的主要致病因素[6]。
迄今为止,DPM的确切起源和发病机制尚不清楚。小儿肺标本中未见肺脑膜瘤样结节,表明它们不是先天性的。Niho等人通过免疫组织化学和基因分析表明,DPM具有更大的遗传不稳定性,可能代表反应性和肿瘤过程之间的转变[7]。鉴于这种情况,有人指出DPM与潜在的肺疾病之间存在一定相关性。患有引起缺氧、缺血等症状的慢性肺部疾病,或潜在肺部恶性肿瘤的患者,特别是肺腺癌,更易患有DPM[6]。也有一些研究表明,黄体酮刺激的激素失衡可能为DPM提供细胞生长刺激,这也许可以解释为何DPM 在女性中更为普遍[7]。
作为一种罕见的MPMN亚型,DPM缺乏特异性的临床表现。DPM多数无症状[8],少数患者有非特异性呼吸道症状[6, 9]。本病例无症状。DPM的影像学表现为双肺弥漫性小实性或磨玻璃结节,随机分布于双肺[6]。因此,DPM通常被误诊为其他疾病。DPM的影像学表现与其他小结节性疾病相似,在不确定的双侧弥漫性肺实质结节鉴别诊断中应考虑DPM[6]。肺是恶性肿瘤转移最常见的靶器官之一。DPM能模拟肺恶性结节的影像学表现,容易被误诊为转移性疾病,尤其是在恶性肿瘤患者中[1]。
由于其罕见性和缺乏特征性的影像学表现,组织病理学是诊断DPM的必要条件。这种情况通常通过外科肺活检来诊断。采用电视胸腔镜手术[6]和经支气管肺活检[8]确诊。在组织学上,DPM由中等大小的细胞组成,细胞胞质丰富,边界不明显,核是椭圆形的,具有细颗粒状染色质和不显眼的核仁[9]。这些细胞通常排列在肺泡间隔内,包围肺静脉。免疫组化研究表明,这些细胞上皮膜抗原(EMA)和孕激素受体(PR)呈阳性[6]。DPM患者对PR的免疫反应可能提示性激素在其发病机制中的作用,并解释了女性DPM发病率增加的原因。然而,确切的机制尚不清楚。本文报道的病例符合上述特点。DPM一般不需要特殊治疗,通常是观察和随访。
本病例提示在胸部影像学上发现多发双侧肺磨玻璃结节时,尤其是有恶性肿瘤病史的患者,应考虑弥漫性肺脑膜瘤样结节的可能。
