信迪利单抗致中毒性表皮坏死松解症1例
2024-05-10陈肖新
陈肖新,秦 俭
(1.右江民族医学院,广西 百色 533000;2.广西壮族自治区人民医院,广西 南宁 533002)
中毒性表皮坏死松解症(TEN)是一种严重的皮肤-黏膜反应,80%由药物引起,以水疱及泛发性表皮松解为特征,可伴有多系统受累[1]。信迪利单抗是常见的免疫检查点抑制剂(ICIs)之一,广泛应用于食管癌、霍奇金淋巴瘤、非小细胞肺癌等[2],可显著改善患者总生存期和生活质量。然而,ICIs也存在着许多潜在的并发症,称为免疫相关不良事件(irAEs),最常受累的是皮肤[3],其中TEN的死亡率高达50%。有相关文献报道,ICIs过度激活患者免疫系统后,皮肤受累可发展成TEN[4-5]。本文通过阅读相关文献并结合本例患者治疗经验,简要介绍了ICIs在肿瘤方面的应用及不良反应、TEN的诊治、淋巴血浆置换术(LPE)在TEN方面的应用,为临床诊治TEN提供参考。
1 临床资料
患者,男,78岁,因“确诊食管癌2个月余,全身皮肤多发皮疹2 d”于2022年5月11日就诊于广西壮族自治区人民医院。患者既往因“食管癌侵犯气管伴多发淋巴结转移,气管狭窄”行气管成形手术,有高血压病史,无其他特殊病史。入院查体:生命体征正常,神清,贫血貌,体形消瘦。面颈部灰黑色斑片状皮损,眼睛可见大量黄色分泌物,与眼睑粘连,口腔黏膜糜烂。躯干、外生殖器、四肢近端皮疹融合成大片状,多发大小不一水疱,最大的水疱长径达5 cm,大部分水疱破溃渗液后表面潮红,部分皮损坏死、剥脱,似烫伤样外观,伴皮损明显触痛不适。全身大于50%皮肤表皮分离,皮损处未见活动性出血(图1)。心脏及腹部查体未见明显异常。专科查体:体力状况评分1分,数字分级法评分1分,营养风险筛查2002评分大于3分,全身浅表淋巴结未触及肿大。肺部呼吸稍促,听诊两肺呼吸音粗,两肺未闻及明显干湿性啰音,两肺呼吸运动度两侧相等,叩诊清音。辅助检查:血常规提示中度贫血,感染指标提示白细胞计数水平升高至13.11×109/L,中性粒细胞百分比91.7%,C-反应蛋白大于200 mg/L,降钙素原0.41 ng/mL,白细胞介素6(IL-6)175.20 pg/mL;血生化检查提示白蛋白水平低至27.2 g/L,D-二聚体1.66 mg/L,电解质紊乱(低钠、低氯、低钙血症),空腹血糖水平升高(7.71 mmol/L)。大便隐血阳性。心肌酶谱五项指标、B型脑钠肽水平升高,但无临床指导意义。补体C3水平下降,免疫球蛋白(Ig)G水平升高,其他补体C4、IgA、IgM水平处于正常参考值范围。尿常规、肾功能、肿瘤标志物、12项细胞因子检查、血栓弹力图处于正常参考值范围。食道CT示:(1)气管后方肿块,大小约3.8 cm×5.5 cm×6.7 cm,考虑食管癌,侵犯气管;(2)左锁骨下窝、右侧颈部V区及纵隔多发淋巴结转移。临床诊断为:胸中段食管鳞癌(cT4bN3Mx,Ⅳ期,AJCC8th)。入院时已完成2周期化疗联合免疫治疗,具体方案为:静滴信迪利单抗200 mg(第1天)+白蛋白紫杉醇175 mg/m2(第1天)+卡铂(AUC=5,第1天,3周1次)。在计划行第3周期治疗前5 d,患者开始出现皮疹,2 d后皮疹从躯干迅速蔓延至四肢,全身大于50%皮肤表皮分离,为Ⅲ~Ⅳ皮疹(图1)。经多学科讨论,排查了既往用药史,并结合皮疹特点,考虑irAEs的皮肤毒性,皮疹可能与程序性细胞死亡蛋白-1(PD-1)抑制剂信迪利单抗相关,临床诊断为TEN。建议行皮肤组织活检,进一步明确诊断,但患者拒绝。暂停原计划第3周期抗肿瘤治疗,予头孢哌酮舒巴坦2 g(每12小时1次)、甲强龙80 mg/d,同时给予补充人血白蛋白、补液、维持内环境稳定、加强创面护理等治疗。2022年5月12日,患者皮疹继续增大,予床边LPE术治疗。2 d后,患者面颈部渗液较前减少,大量皮痂形成,可见少许新鲜皮肤组织形成,未见脏器衰竭征兆。考虑治疗有效,再次行床旁LPE治疗。2022年5月18日,患者眼睛分泌物明显减少,大部分湿性脱皮转为干性脱皮,头面部大范围皮痂脱落,可见表皮基本愈合,躯干及四肢皮损剥脱区可见多处新鲜皮肤组织形成。调整甲强龙用量,即80 mg/d减量至60 mg/d。2022年5月25日,患者一般情况可,复查感染指标降至正常参考值范围,停用抗生素,激素用量逐渐减量至40 mg/d。在院第16天,患者未见新发皮损,剥脱皮损区基本结痂愈合,复查血常规、血生化指标,未见异常,食道CT提示食管癌经治疗后肿块明显缩小(图2),予办理出院。
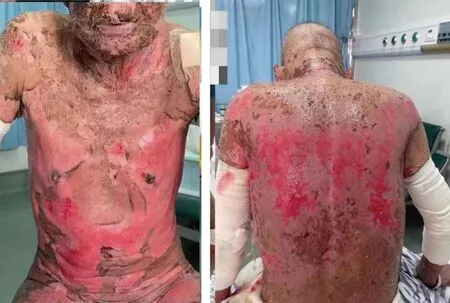
图1 患者胸部及背部皮疹表现

注:A.化疗前;B.化疗后。
2 讨 论
2.1ICIs在恶性肿瘤方面的应用 ICIs的应用极大地改变了多种恶性肿瘤的治疗格局,其中以PD-1/PD-L1抑制剂为代表的免疫疗法,包括帕博利珠单抗、信迪利单抗、卡瑞利珠单抗等,适应证覆盖多种恶性肿瘤[6]。国内外已获批上市的ICIs有10余种[7],大幅度提升了患者生存期及生活质量。免疫治疗在食管癌领域也取得了巨大进展。基于KEYNOTE-590、ESCORT、ORIENT-15等大型的多中心、随机、双盲的Ⅲ期临床研究[8-10],确立了免疫治疗在晚期食管癌中的地位,指南推荐将PD-1抑制剂(信迪利单抗、帕博利珠单抗、特瑞普利单抗、纳武利尤单抗、卡瑞利珠单抗)作为晚期食管癌的可选方案。2023年,中国临床肿瘤学会在此基础上新增了斯鲁利单抗、替雷利珠单抗作为Ⅰ级推荐。本案例患者诊断为晚期食管癌,肿瘤负荷大且侵犯气管伴多发淋巴结转移,根据指南推荐使用信迪利单抗联合白蛋白紫杉醇+卡铂方案治疗。
2.2irAEs与ICIs的抗肿瘤机制密切相关 ICIs的抗肿瘤机制不同于放化疗直接杀伤肿瘤细胞,而是通过抑制免疫检查点的活性,重新激活体内T细胞对肿瘤的免疫应答效应,从而进行杀灭和抑制肿瘤细胞增殖[11]。正常情况下,肿瘤细胞死亡后释放肿瘤细胞抗原,由树突状细胞呈递肿瘤细胞抗原,促使T细胞激活,进一步分化为CD4+、CD8+细胞[12],活化的T细胞将迁移、聚集、浸润至肿瘤细胞,发挥识别并歼灭肿瘤细胞的作用。然而,肿瘤细胞会通过目前熟知的细胞毒性T淋巴细胞相关抗原4[13]和PD-1/PD-L1免疫检查点进行免疫逃逸[14]。ICIs可阻断PD-1与PD-L1的相互作用,消除对CD4+T、CD8+T细胞的抑制,使T细胞恢复对肿瘤的识别功能,进而增强T细胞对肿瘤的免疫监视和杀伤能力,产生免疫应答。患者使用2个周期免疫联合化疗治疗后,复查影像学提示部分缓解。与传统化疗相比,免疫治疗的联合应用明显增加了该患者的客观有效率。然而,ICIs在增强T细胞抗肿瘤能力的同时,过度激活全身免疫也会引起一些不良反应,即irAEs,其发病的分子机制尚不明确,可能与免疫检查点在维持免疫稳态中发挥的作用有关。ICIs会破坏原有的免疫耐受机制,免疫细胞也会释放一些炎性介质(如肿瘤坏死因子、IL-6、IL-17、IL-23等),致组织免疫损伤,肿瘤细胞释放宿主抗原时可发生抗原交叉呈递,多因素作用下促进自身的免疫进展,引发自身免疫反应[15]。任何器官都可能受累,最常累及皮肤、胃肠道、内分泌腺、肝脏[15-16],而中枢神经系统及心血管、肺、肌肉骨骼和血液系统受累较少见。一项旨在评估irAEs的meta研究纳入了125项临床试验,涉及20 128例患者,结果显示,66%患者出现了至少1个任何级别的irAEs,3级或以上的irAEs占14%[17]。本案例患者出现了3级以上的TEN,由此可见,irAEs不容忽视。
2.3TEN的特点及诊断 TEN是irAEs中最严重的一种皮肤毒性,具有急、危、重的特点,其致死率随疾病严重程度评分[18]增加而升高,主要表现为广泛的表皮剥脱与坏死、黏膜糜烂,全身累及面积大于30%。绝大多数的TEN与药物相关,主要包括抗生素类、磺胺类、抗癫痫药、抗结核药等[1,19]。尽管irAEs引起TEN的概率较低,但也有不少免疫相关性TEN的报道[20-22]。本案例患者使用2周期信迪利单抗治疗后出现irAEs,起病初期主要表现为散在面部及躯干的斑丘疹伴瘙痒,随即出现皮疹迅速蔓延,水疱形成,进而发展为水疱融合、表皮剥脱,全身累及面积大于50%,临床诊断为TEN。irAEs的皮肤毒性[23]临床表现多不典型,需注意与常见的过敏性荨麻疹、苔藓样变、白癜风样皮损、银屑病样外观、大疱性类天疱疮及严重的Stevens-Johnson综合征/TEN等鉴别。本案例中,患者无药物过敏史、皮肤相关病史,进一步排查既往可能诱导药物性皮疹的药物(信迪利单抗、白蛋白紫杉醇、卡铂)。TEN并非紫杉醇与卡铂的已知不良反应,目前关于白蛋白紫杉醇、卡铂致TEN的不良反应的研究较少见,但对于信迪利单抗、帕博利珠单抗、替雷利珠单抗、纳武利尤单抗等均有相关文献支持[21,24-25]。据ALDEN评分标准[26]对白蛋白紫杉醇、卡铂、信迪利单抗进行评分,分别是-1分(极不可能)、0分(不可能)、2分(可能)。多因素考虑该患者为信迪利单抗导致TEN的相关性大,与白蛋白紫杉醇、卡铂相关性小。遗憾的是,患者拒绝行药物斑贴试验、药物诱导的T细胞增殖试验、淋巴细胞功能试验等进行辅助诊断,也不同意行皮肤组织活检进行病理确诊。
2.4TEN的治疗策略 目前,国内外尚无TEN诊治的统一标准。关于TEN的治疗策略,专家共识主要包括以下内容:(1)停用可疑药物,促进可疑药物的排泄;(2)维持内环境稳定,避免出现多脏器衰竭;(3)系统性联合治疗,包括应用糖皮质激素、人血丙种球蛋白、生物制剂及行血浆置换疗法等[1,27];(4)加强创面护理,避免感染;(5)对症支持治疗。患者入院时TEN疾病严重程度评分为4分(年龄、伴恶性肿瘤、入院时表皮松解面积大于10%、血清碳酸氢盐水平,各1分),死亡率约62%。经主管医生及输血科治疗团队评估后决定实施床边LPE联合泼尼松[起始量为1~2 mg/(kg·d)]治疗。约2周后,患者皮痂脱落,新鲜皮肤组织形成,表皮基本愈合。该患者全程未出现皮疹进展及多器官衰竭征象,短期内疗效显著。由此可见,LPE的应用在治疗上有别于传统的血浆置换术。
LPE是近年来在血浆置换基础上新发展的一项输血治疗技术,广泛应用于各种难治性免疫系统相关性疾病[28-30],包括吉兰-巴雷综合征、重症肌无力、银屑病、自身免疫性脑炎、系统性红斑狼疮等。LPE本质是离心式血浆置换,在血浆置换去除炎症因子和致病因子的免疫球蛋白的基础上将血浆分离,可有效去除活化的免疫T细胞、B细胞、自然杀伤细胞等,同时补充正常血浆,阻断免疫物质活化的产生[28,31]。与传统血浆置换术相比,LPE在血浆置换去除致病物质的基础上,还可以清除产生这些致病物质的免疫活性细胞,避免出现抗体“反跳”现象而加重病情。本案例患者首次实施LPE时共历时74 min,术中使用枸橼酸抗凝剂233 mL,总循环量2 743 mL,输注B型血浆1 320 mL、0.9%氯化钠注射液250 mL,去除患者体内淋巴细胞及血浆2 772 mL,2次LPE共置换病理血浆5 001 mL。继LPE治疗2~3 d后,观察到患者皮损逐渐愈合,疗效显著。目前,LPE也有一定的局限性,极少数患者会出现皮疹、感染、低血糖、低血压、低血钙等常见不良反应,严重者可见血栓形成、出血、肺水肿及过敏性休克等[29,31]。在LPE治疗期间,患者有轻微口唇麻木,予葡萄糖酸钙对症治疗后好转,未出现其他严重不良反应。
随着免疫治疗的不断探索,继化疗、靶向治疗、内分泌治疗之后,免疫治疗已是治疗肿瘤的重要手段之一。从动物试验到临床实践,免疫治疗的有效性及安全性已验证,但仍有极少的严重不良反应有待监测,需要更多的临床实践去发掘潜在的毒性反应,进而吸取教训。因个体差异,少数患者在使用ICIs治疗后出现了可致命性的TEN,可考虑LPE综合治疗。但目前LPE的应用尚未普及,更多的还是沿用传统的血浆置换。本案例经床边LPE成功救治了1例TEN患者,为免疫相关TEN的治疗策略提供了一定的参考。
