靶向STAT3通过调控糖酵解及间皮间充质转分化改善腹膜透析相关腹膜纤维化
2024-05-10邓启磊何萌萌黄大可
邓启磊, 符 姣,李 楠,何萌萌,黄大可,张 培
腹膜透析作为终末期肾病患者的一种治疗方式,其使用在全球范围内正在增加[1]。腹膜透析相关性腹膜纤维化是腹膜透析最常见的并发症之一。信号转导和转录激活因子 (signal transducer and activator of transcription 3,STAT3) 参与多种生物学过程,对细胞增殖、存活、分化和血管生成起到重要调节作用[2-3]。在高糖腹膜透析液诱导的小鼠腹膜纤维化模型和高糖刺激的间皮细胞以及脱落的人腹膜间皮细胞中发现STAT3 信号活化,且对STAT3的药理抑制可通过调控缺氧诱导因子-1α减轻间皮细胞的上皮-间充质转化[4]。间皮-间充质转化(mesothelial-mesenchymal transition,MMT)是发生于胸膜、腹膜等间皮细胞的Ⅱ型上皮-间充质转化,在致腹膜纤维化等过程中发挥重要作用。暴露于葡萄糖腹膜透析液会导致间皮细胞过度糖酵解,促进细胞表型转变和增殖[5]。该研究旨在探讨高糖是否通过激活STAT3上调 HMrSV5糖酵解相关酶的表达和促进MMT,阐明STAT3与糖酵解的交互对话机制以及抑制STAT3对腹膜透析过程中腹膜纤维化和血管新生的影响,为腹膜纤维化防治提供新思路。
1 材料与方法
1.1 实验动物与主要实验材料
1.1.1实验动物 健康雄性Sprague-Dawley大鼠18只,180~200 g,SPF级,4~6周龄,由安徽医科大学实验动物中心提供(批准号:LLSC20211055)。整个实验期间,给予所有大鼠标准饮食,自由饮水,适应性饲养1周后开始正式实验,整个实验周期为10周。
1.1.2实验药物和主要试剂 STAT3抑制剂BP-1-102(S776901)购自Selleck公司,化学式:C29H27F5N2O6S,分子量:626.59,BP-1-102是高效的特异性的STAT3小分子抑制剂,可抑制Stat3与pTyr肽段的相互作用和STAT3的激活。人腹膜间皮细胞系(HMrSV5)来源于上海子实生物科技有限公司。通用二步法试剂盒PV-6000、DAB 辣根过氧化物酶显色试剂盒购自北京中杉金桥公司;青霉素/链霉素溶液、胰蛋白酶购自上海碧云天生物技术有限公司;胎牛血清、MEM培养基购自美国Gibco公司;葡萄糖购自美国Sigma公司。兔抗p-STAT3克隆抗体和鼠抗STAT3多克隆抗体购自美国CST公司;兔抗E-钙黏蛋白(E-cadherin)、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、6-磷酸果糖-2-激酶/果糖-2,6-双磷酸酶-3 (6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3,PFKFB3)、乳酸脱氢酶A(lactate dehydrogenase A,LDHA)购自美国Affinity Biosciences公司;鼠抗β-actin单克隆抗体、辣根过氧化物酶标记羊抗兔/鼠IgG购自武汉三鹰生物技术有限公司;增强化学发光(ECL)试剂盒、BCA蛋白测定试剂盒、无蛋白快速封闭液均购自上海雅酶生物科技有限公司;PVDF膜购自美国Millipore公司。
1.2 方法
1.2.1高糖腹膜透析液诱导建立腹膜纤维化大鼠模型 所有雄性SD大鼠在安徽医科大学实验动物中心的特定无病原体条件下饲养。将动物分为3组(n=6):假手术组、模型组和STAT3抑制剂组。在大鼠背侧皮肤下手术植入微型腹膜透析导管,导管尖端置于腹膜内。假手术组:除了植入微型腹膜透析导管外,不进行其他任何处理;模型组:每天早晚通过腹膜透析导管注射10 ml含4.25%葡萄糖的腹膜透析液 (peritoneal dialysis fluid,PDF)诱导腹膜纤维化; STAT3抑制剂组:为了探索靶向抑制 STAT3 对腹膜纤维化的影响,STAT3抑制剂BP-1-102以1 mg/kg 的剂量溶于10 ml含4.25%葡萄糖的 PDF中,并通过腹膜透析导管给药。10周后,对大鼠进行腹膜平衡实验并收集大鼠腹膜组织及PDF用于进一步分析。
1.2.2腹膜平衡实验 在大鼠吸入麻醉后,给予腹腔注射20 ml 4.25%PDF,并在腹腔保留90 min。90 min后吸入麻醉下剪开大鼠腹腔,用注射器吸出PDF,记录PDF总量,计算超滤量,超滤量=腹腔最后的出液量-20 ml。
1.2.3苏木精-伊红(hematoxylin-eosin,HE)染色 大鼠腹膜组织用4%多聚甲醛固定48 h,包埋在石蜡中,制成3 μm厚的切片,切片常规脱蜡后通过浓度梯度的二甲苯和乙醇进行洗脱再水化,然后根据制造商 (美国Sigma公司) 提供的方案进行HE染色。
1.2.4免疫组化检测 大鼠腹膜组织经过脱水、透明、包埋后制成石蜡切片,将腹膜组织切片脱蜡、再水化,用内源性过氧化物酶阻断剂封闭内源性过氧化酶。通过高压锅修复腹膜组织表面抗原、山羊血清封闭。去除山羊血清后,将标本在4 ℃下用1 ∶100稀释TGF-β1抗体,孵育过夜。第2天,复温后,加入二抗,使用 3,3′-二氨基联苯胺 (DAB) 显色。经过脱水、透明和封片后,用正置荧光显微镜进行观察并捕获图像。
1.2.5细胞培养 人腹膜间皮细胞系(HMrSV5)培养在含有10% 胎牛血清和1%青霉素/链霉素溶液的MEM培养基中,所有细胞置于饱和湿度、5% CO2、37 ℃的温箱中常规培养。高糖处理前,将间皮细胞均匀接种至6孔板中培养过夜。MEM补充为葡萄糖浓度84、138、236 mmol/L的高糖溶液,用于模拟高葡萄糖透析环境,这相当于目前在临床上用于腹膜透析的含有1.5%、2.5%、4.25%葡萄糖的腹膜透析液。
1.2.6siRNA转染 使用 siRNA 特异性靶序列实现基因表达的沉默。所有 siRNA 特异性靶序列均来自上海吉玛制药技术有限公司。将细胞接种至6孔板培养孔中,使转染时细胞密度达 60%~80%,去除孔板中的培养基,用含有Lipofectamine2000(Invitrogen)的Opti-MEM将靶序列或阴性对照 (NC) 瞬时转染HMrSV5细胞。分组进行处理: 对照组、HG组(236 mmol/L 葡萄糖)、HG+NC siRNA组、HG+STAT3 siRNA 组,其中,siRNA转染6 h后换成完全培养基,加葡萄糖(236 mmol/L)刺激48 h后检测相关蛋白(STAT3、p-STAT3、PFKFB3、LDHA、E-cadherin、α-SMA)的表达。
1.2.7免疫印迹分析 将6孔板置于冰上,PBS清洗细胞后,使用含有2%蛋白酶抑制剂、2%磷酸酶抑制剂和2%乙二胺四乙酸的RIPA缓冲液裂解后提取总蛋白,测定各组总蛋白浓度。用10%SDS-PAGE凝胶电泳分离,然后转移到PVDF膜。用无蛋白快速封闭液封闭45 min,将蛋白质与一抗(抗STAT3 1 ∶1 000、抗p-STAT3 1 ∶1 000、抗E-cadherin 1 ∶1 000、抗α-SMA 1 ∶1 000、抗LDHA 1 ∶1 000、抗PFKFB3 1 ∶1 000、抗β-actin 1 ∶5 000)在4 ℃下过夜。次日,用TBST洗涤3次,然后与辣根过氧化物酶 (HRP) 偶联的二抗室温下孵育45 min。ECL试剂用于在全自动化学发光成像仪上检测抗体-抗原复合物。对获得的条带进行可视化和分析,结果用内源性参照物β-actin进行标准化。
1.3 统计学处理采用Graphpad Prism 8 软件、Image J 软件进行分析,数据表示为平均值±标准误。使用Levene方法进行方差齐性检验,多组数据间的差异通过单因素方差分析(one-way ANOVA) 比较,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠腹膜结构和功能的改变SD大鼠每天注射高糖腹膜透析液,10周后发现假手术组腹膜组织结构未见异常,模型组腹膜组织病理改变明显,表现为腹膜下区域增厚、胶原纤维沉积和血管新生,提示大鼠腹膜纤维化模型已成功构建。STAT3抑制剂组腹膜下区域增厚和血管新生情况较模型组明显改善。免疫组化染色显示,假手术组腹膜下区域TGF-β1表达较弱,模型组表达明显高于Sham组(F=200.3,P<0.05),STAT3抑制剂组腹膜组织及腹膜下区域TGF-β1表达明显低于模型组(P<0.05)。腹膜平衡实验结果显示,假手术组超滤量均值为8.3 ml,模型组的超滤量均值为3.3 ml(F=71.91,P<0.05),腹膜组织超滤功能受损,STAT3抑制剂组超滤量均值为5.8 ml,功能较模型组改善(P<0.05),见图1、2。

图1 各组大鼠腹膜组织HE染色 ×100

图2 免疫组化检测各组大鼠腹膜组织TGF-β1表达情况 ×100
2.2 高糖激活HMrSV5细胞中的STAT3使用蛋白质印迹分析探讨高糖对间皮细胞 (HMrSV5) STAT3 活化的影响。蛋白质印迹结果表明,在不同浓度葡萄糖(84、138、236 mmol/L)刺激后,STAT3磷酸化水平较对照组升高,差异有统计学意义(F=55.54,P<0.05),其中236 mmol/L葡萄糖处理的HMrSV5细胞中STAT3磷酸化最明显,见图3。
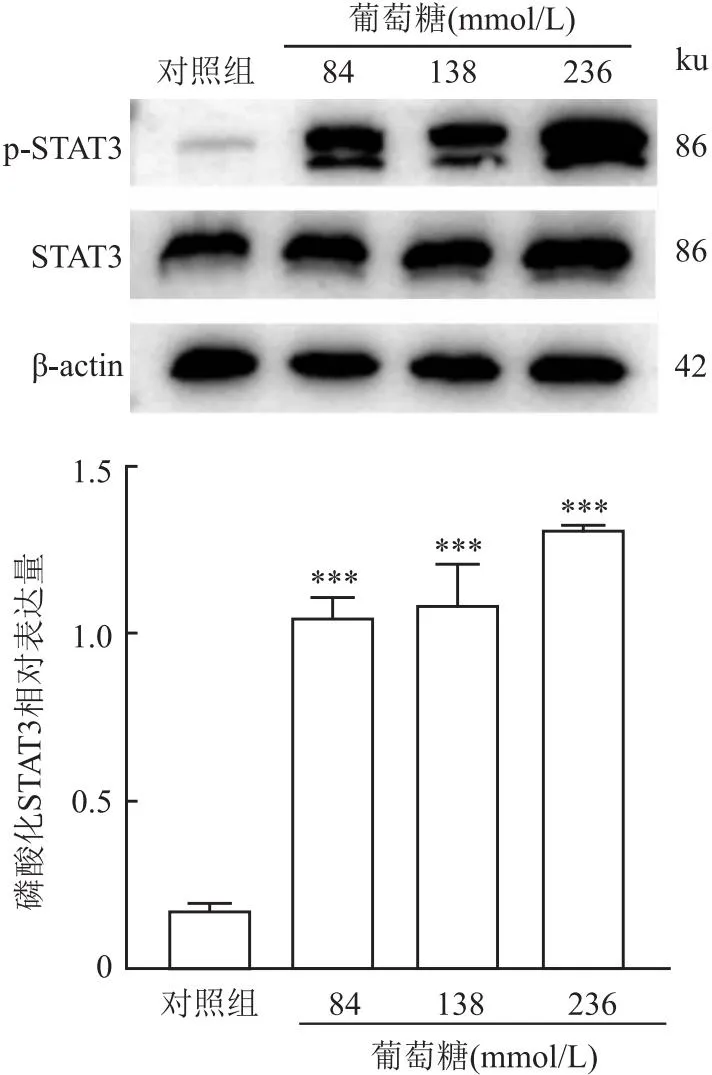
图3 蛋白质印迹法检测不同浓度高糖作用于HMrSV5细胞48 h p-STAT3、STAT3蛋白的表达水平
2.3 高糖引起HMrSV5细胞糖酵解增加和MMT使用蛋白质印迹分析探索高糖对人腹膜间皮细胞(HMrSV5)糖酵解和MMT的影响。结果表明,HMrSV5细胞在138、236 mmol/L的葡萄糖环境培养48 h后,LDHA蛋白表达升高(F=9.859,P<0.05),高糖(236 mmol/L)诱导HMrSV5细胞PFKFB3蛋白的表达增加(F=13.36,P<0.05)。同时测定与MMT相关的上皮间黏附蛋白标志物 E-cadherin和间充质标志物α-SMA的表达。蛋白印迹
分析显示高糖(138、236 mmol/L)培养基处理HMrSV5细胞上调α-SMA的表达(F=33.81,P<0.05),高糖(236 mmol/L)处理下调E-cadherin的表达(F=4.457,P<0.05)。由此推断236 mmol/L葡萄糖可引起HMrSV5细胞高糖酵解和MMT,见图4。
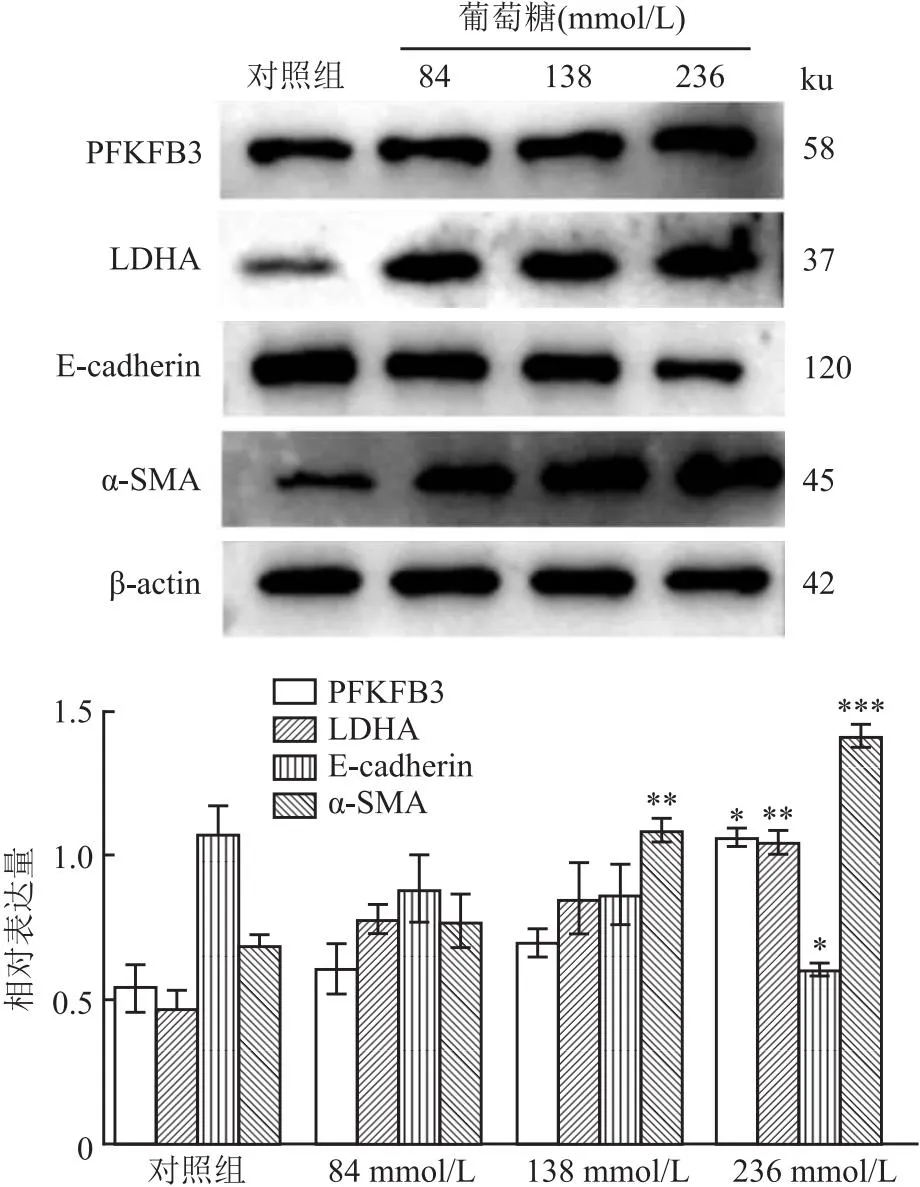
图4 蛋白质印迹法检测不同浓度高糖(84、138、236 mmol/L)作用于HMrSV5细胞48 h PFKFB3、LDHA、E-cadherin、α-SMA蛋白的表达水平
2.4 STAT3 siRNA抑制高糖环境中STAT3信号通路的激活与对照组(未处理的细胞)相比,HG组(236mmol/L葡萄糖处理的细胞)的STAT3的磷酸化蛋白增多(F=29.20,P<0.05); HG+NC siRNA组磷酸化STAT3较高糖组无变化(P>0.05);与HG+NC siRNA组相比,HG+STAT3 siRNA组降低高糖诱导的HMrSV5细胞中STAT3蛋白磷酸化(P<0.05),见图5。
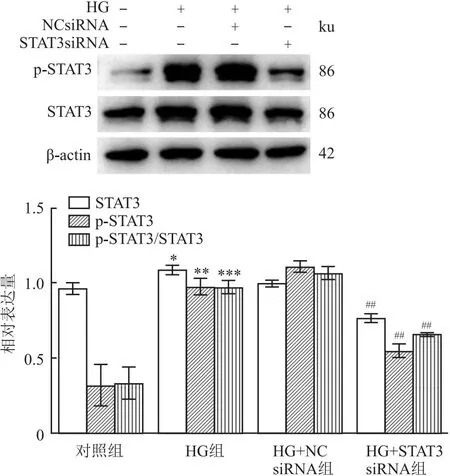
图5 敲低STAT3对高糖刺激的HMrSV5中相关蛋白的影响
2.5 STAT3 siRNA抑制高糖诱导的糖酵解相关代谢酶的高表达和MMT使用蛋白质印迹检测PFKFB3和LDHA的表达变化,结果显示高糖刺激后可以使PFKFB3和LDHA表达上调(F=40.92,P<0.05;F=22.74,P<0.05)。此外,高糖刺激后E-cadherin表达下调(F=14.67,P<0.05),α-SMA表达上调(F=9.589,P<0.05)。HG+NC siRNA组上述相关蛋白的表达较HG组无变化。STAT3 siRNA预处理的HMrSV5细胞中PFKFB3、LDHA和α-SMA的表达较HG+NC siRNA组下降,E-cadherin的表达较HG+NC siRNA组上调,见图6。
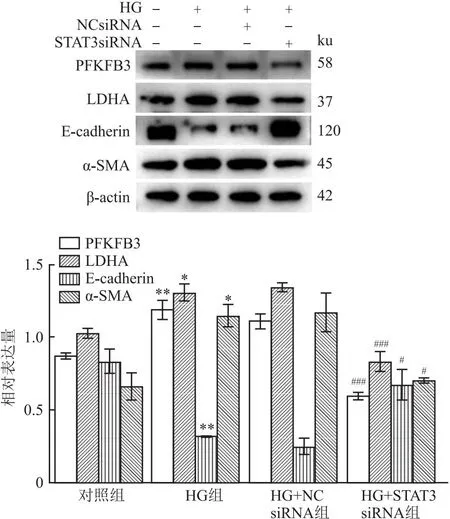
图6 敲低STAT3对高糖刺激的HMrSV5中糖酵解与MMT相关蛋白的影响
3 讨论
完整的腹膜结构和功能有助于达到良好的腹膜透析效果。长期腹膜透析治疗中的各种不利因素损伤腹膜结构和功能,最终导致腹膜纤维化。STAT3是一种关键的信号蛋白,参与多种生物学过程,包括细胞增殖、分化、纤维化和血管生成[2-3]。研究[6]表明,抑制肾小管上皮细胞中的STAT3 可以预防链脲佐菌素诱导的糖尿病小鼠肾纤维化和肾病。BET-溴结构域抑制剂JQ-1可抑制STAT3信号的激活进而部分改善日本血吸虫卵诱导的肝纤维化[7]。STAT3在肾脏、腹膜以及肝脏等器官纤维化过程中激活,介导器官损伤[4, 6, 8-9]。本研究通过构建腹膜透析动物模型,模拟人体长期腹膜透析环境,用以阐明STAT3参与腹膜纤维化的分子机制。HE染色结果显示腹膜纤维化大鼠模型中胶原纤维积累、皮下区域增厚和血管密度增加。免疫组化显示腹膜中TGF-β1(一种关键的纤维化因子)阳性表达增加。这些变化与接受长期腹膜透析的患者中发现的腹膜透析相关腹膜纤维化的关键病理特征相似[10]。本研究显示STAT3抑制剂BP-1-102显著降低血管密度、减轻TGF-β1阳性表达和皮下区域增厚,说明 STAT3 信号传导的药理学抑制可减弱高糖腹膜透析液介导的腹膜纤维化及血管新生。在腹膜纤维化患者中,由于间皮细胞的丢失、细胞外基质聚集、炎性细胞的渗出和血管新生,最终导致腹膜超滤衰竭。在模型组大鼠,发现超滤量降低,STAT3抑制剂BP-1-102明显改善透析所致的超滤量的减少,证明抑制STAT3信号传导有助于改善透析所致的腹膜超滤损伤。
腹膜纤维化的发展过程中,可以检测到与上皮-间充质转化相类似的间皮细胞转变的一种特殊形式,称为MMT[11]。上皮-间充质转化过程中上皮细胞的极性消失,转移和侵袭能力增强,同时伴有上皮细胞标志物的缺失和间充质标志物的获得,E-cadherin和α-SMA为腹膜间皮细胞MMT的特异性生化标志物。本研究利用高糖刺激腹膜间皮细胞,以此模拟腹膜透析时的高糖微环境,结果显示高糖诱导间皮细胞E-cadherin的低表达和α-SMA的高表达,证明高糖刺激诱导间皮细胞发生MMT。通过抑制腹膜透析刺激的MMT来预防腹膜纤维化已成为腹膜纤维化机制研究的主要策略。对正常腹膜活检中获得的间皮细胞和腹膜透析治疗患者的流出物的单细胞转录组进行分析,发现MMT的发展伴随着糖酵解相关代谢酶的改变,暴露于腹膜透析液会导致间皮细胞过度糖酵解,阻断过度糖酵解在两种类型的间皮细胞中都极大地抑制了MMT[5]。进而,本研究检测间皮细胞中糖酵解相关代谢酶的表达,结果显示高糖诱导间皮细胞高表达PFKFB3和LDHA,同时伴随STAT3激活。研究[12]表明,缺氧条件下STAT3通过下调LINC00671的表达激活LDHA,调节甲状腺癌的糖酵解、生长和转移。在肝细胞癌中,靶向抑制STAT3可阻止糖酵解关键酶的表达,并诱导免疫原性细胞死亡从而重建肿瘤免疫微环境[13]。LCN2可通过激活JAK2/STAT3信号通路促进有氧糖酵解,加速肝癌细胞的恶性增殖[14]。本研究中用siRNA影响细胞STAT3 的基因表达后,下调高糖诱导的糖酵解相关代谢酶PFKFB3和LDHA的高表达,表明靶向抑制STAT3可以调控高糖诱导的腹膜间皮细胞糖酵解活化,同时且逆转高糖诱导间皮细胞MMT标志性蛋白E-cadherin和α-SMA的表达。本研究结果表明,siRNA抑制STAT3 信号通路通过下调间皮细胞PFKFB3、LDHA的表达减轻HMrSV5 细胞MMT。
本研究表明抑制STAT3可部分减缓腹膜纤维化和血管新生的进展,高糖微环境中STAT3信号通路的激活在促进HMrSV5细胞 MMT过程中发挥促进作用,而抑制 STAT3 信号通路的激活能通过下调间皮细胞PFKFB3、LDHA的表达减轻HMrSV5 细胞MMT。综上所述,在腹膜纤维化中,靶向STAT3 信号通路通过调控腹膜间皮细胞糖酵解减缓腹膜透析相关腹膜纤维化和血管新生,为腹膜纤维化防治提供新思路。
