结构性心脏病介入治疗2023 年度报告精要
2024-05-09中国医师协会心血管分会结构性心脏病学组
中国医师协会心血管分会结构性心脏病学组
结构性心脏病(structural heart disease,SHD)是近年来心血管领域发展最快速的方向,随着SHD治疗新技术的不断研发及推广,SHD这一概念逐步被公众所熟知[1]。2023年国内外在SHD介入治疗领域取得较大突破,高质量基础和临床研究层出不穷,值得总结、思考和展望。本报告将过去1年主动脉瓣介入治疗、二尖瓣反流(mitral regurgitation,MR)介入治疗、三尖瓣反流(tricuspid regurgitation,TR)介入治疗、左心耳封堵术(left atrial appendage closure,LAAC)及先天性心脏病(congenital heart disease,CHD)介入治疗等方面取得的关键性成果进行了深度的梳理,内容涵盖了国内外的器械研发、临床诊疗、指南共识等方面的最新进展,并展望未来行业发展趋势,以期进一步推动SHD领域更好地发展。
1 经导管主动脉瓣置换
1.1 研究进展
PARTNER 3研究[2]是一项前瞻性、多中心、随机对照试验,纳入1 000例外科手术风险较低的重度主动脉瓣狭窄(aortic stenosis,AS)患者,1∶1随机接受SAPIEN 3球囊扩张式瓣膜经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)或外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)。在5年随访期间,TAVR组和SAVR组的临床事件发生率均较低且相似(全因死亡率10.0%比8.2%;脑卒中发生率5.8%比6.4%;再入院率13.7%比17.4%)。TAVR和SAVR均可有效改善瓣膜血流动力学,两组的主动脉瓣口面积、生物瓣膜衰败发生率(3.3%比3.8%)与结构性瓣膜退化发生率(4.2%比3.8%)比较,差异均无统计学意义。Evolut Low Risk研究[3]旨在比较TAVR和SAVR在外科手术低危的重度AS患者中的结局,TAVR组4年时全因死亡率和致残性脑卒中的总体发生率明显低于SAVR组(10.7%比14.1%,HR0.74,P=0.05),TAVR组的复合终点事件(全因死亡、致残性脑卒中或主动脉瓣再入院)发生率较低(18.0%比22.4%,HR0.78,P=0.04),心房颤动(房颤)发生率更低(14.0%比40.8%,P<0.0 0 1),新植入永久起搏器的比率更高(24.6%比9.9%,P<0.001),瓣膜再干预发生率相似(1.3%比1.7%,P=0.63),表明在低危人群中采用Evolut系列的TAVR可能优于SAVR,但永久起搏器植入风险或是年轻患者需要考虑的重要因素。该两项研究证明,外科手术低危的AS患者行TAVR的长期效果不劣于SAVR。
倾向性评分匹配研究纳入783对中危重度AS患者,比较了接受SAPIEN 3球囊扩张式瓣膜TAVR与SAVR手术的5年结局。SAPIEN 3 TAVR和SAVR的5年主要终点(死亡率和致残性脑卒中)差异无统计学意义(40.2%比42.7%,HR0.87,95%CI0.74~1.03,P=0.10)。SAPIEN 3 TAVR展现出了更为优异的长期血流动力学结果,有效瓣口面积大于SAVR(1.6 cm2比1.4 cm2),P<0.0001),两组平均跨瓣压差[11.2 mmHg比10.6 mmHg(1 mmHg=0.133 kPa),P=0.59]相近[4]。对接受CoreValve/Evolut R TAVR和SAVR治疗的中高危AS患者的预后分析发现,与SAVR相比,TAVR组在30 d随访或出院时的有效瓣口面积更大[(1.1±0.3)cm2比(0.9±0.3)cm2,P<0.001],平均跨瓣压差更小[(8.8±3.9)mmHg比(12.3±5.8)mmHg,P<0.001],而这些数据在随后的5年随访中基本保持不变[5]。上述研究显示,TAVR长期血流动力学表现优于SAVR,该趋势在自膨胀式瓣膜中更明显。
小瓣环AS患者的瓣膜选择和手术方式尚无定论,Swiss TAVI登记研究5年随访结果[6]显示,在小瓣环患者中自膨胀式瓣膜在血流动力学方面优于球囊扩张式瓣膜[平均压差(8.0±4.8)mmHg比(12.5±4.5)mmHg,P<0.001;有效瓣口面积(1.81±0.46)cm2比(1.49±0.42)cm2,P<0.001],但死亡率差异无统计学意义(50.4%比39.6%,P=0.269)。此外,自膨胀式瓣膜也带来了更高的致残性脑卒中发生率(6.6%比0.6%,P=0.030),自膨胀式瓣膜的血流动力学优势并未转化为临床获益。VIVA研究显示,在小瓣环AS患者中,TAVR或SAVR的2年全因死亡、脑卒中或心脏再入院率差异无统计学意义[7]。对于小瓣环AS患者,最佳治疗方式仍有待长期随访或更大型研究证实。
TAVR的社会经济学效益显著,其广泛应用不仅挽救了众多外科手术高危或禁忌的AS患者,降低了全球多个国家AS患者的总体死亡率,而且带来了显著的社会经济学效益[8-9]。磁共振成像(magnetic resonance imaging,MRI)指导与CT引导的TAVR之间在器械成功率方面差异无统计学意义,对无法接受增强CT检查的患者,MRI可能是TAVR术前评估的替代选择[10]。随着TAVR适应证向低龄、低危人群拓展,该人群的预期寿命较长,可能需要不止一次的干预治疗,因此,TAVR瓣膜衰败后的再次TAVR治疗成为目前的研究热点,冠状动脉风险、血流动力学及冠状动脉通路评估是当下面临的关键问题[11-12]。
1.2 器械研发
DurAVR THV仿生瓣膜由单片天然形状的组织制成,一体式瓣膜设计与天然主动脉瓣膜极为相似,理论上可提供更好的血流动力学性能和预期寿命。首次人体试验(first in man,FIM)研究[13]表明,DurAVR THV仿生瓣膜具有良好的安全性,预期可在1年内维持血流动力学性能,并恢复接近正常的血流动力学[30 d和1年的有效瓣口面积(2.00±0.17)cm2比(1.96±0.11)cm2;平均跨瓣压差(9.02±2.68)m mHg比(8.82±1.38)m m H g]。作为主动脉瓣反流(a o r t i c regurgitation,AR)领域备受关注的一款瓣膜,ALIGN-AR研究[14](NCT04415047)27例初步观察性结果表明,对于单纯AR且手术风险过高的患者,JenaValve置换似乎是手术的安全有效替代方法。2 0 2 3 年美国经导管心血管治疗学术会议(Transcatheter Cardiovascular Therapeutics,TCT)上公布的ALIGN-AR的1年随访结果[15]令人鼓舞,30 d主要安全性终点发生率为26.7%,1年主要有效性终点发生率为7.8%,关键试验结果已于2024年3月正式在Lancet上发表,有望成为美国首个批准用于治疗严重症状性AR的TAVR产品。体外聚焦超声震波技术作为一种创新的无创性治疗AS的方法,一经面世就备受学术界关注,研究纳入了2019至2022年期间接受无创性超声治疗的40例严重症状性AS患者,无手术相关死亡、危及生命或脑血管事件发生,6个月随访证实瓣膜功能改善,平均主动脉瓣面积增加10%,平均跨瓣压差降低7%,96%患者纽约心脏病协会心功能分级(New York heart association functional classification,NYHA-FC)改善或稳定,堪萨斯城心肌病问卷调查评分改善了33%[16]。在TAVR辅助器械方面,国外推出了一款兼具起搏和压力检测功能的TAVR专用导丝SavvyWire,研究证实其效果良好,未来的应用值得期待[17]。
1.3 指南共识
2023年,我国相继发布了《经导管主动脉瓣置换术临床实践指南》[18]、《心尖入路经导管主动脉瓣植入手术操作规范》[19]、《心尖途径经导管主动脉瓣置换术围术期管理规范专家建议》[20]、《经皮主动脉瓣置入患者冠状动脉粥样硬化性心脏病管理专家共识》[21]以及《体外膜肺氧合辅助循环崩溃高风险经导管主动脉瓣置换术技术要点专家共识》[22],有望进一步推动TAVR技术的推广和规范应用,提高医疗质量。值得一提的是,TAVR最初用于治疗AS,随后逐渐扩展至AR,国内外学者探索使用已上市的经股动脉TAVR瓣膜以“超适应证”方式治疗AR患者,与AS相比,AR在解剖结构、瓣膜选择、操作方式以及并发症等方面具有不同的特点,已上市的经股动脉TAVR瓣膜治疗AR手术难度大、成功率更低。为促进我国经股动脉TAVR治疗AR安全、规范、健康发展,中国医师协会心血管内科医师分会结构性心脏病学组牵头制定了国内外首部针对单纯AR的指导文件《单纯主动脉瓣反流经股动脉主动脉瓣置换中国专家共识2023》[23],为该技术的临床使用提供了重要技术支持和指导。
1.4 国内动态
截至2023年11月30日,2023年度国内已完成13 572例TAVR手术,而2023年1—10月TAVR置入量排名前五的分别是北京、四川、广东、上海和浙江。根据国家经导管瓣膜治疗数据库,全身麻醉(89%)是我国TAVR手术的主要麻醉方式,而最常用的入路方式仍是经股动脉(76.8%),其次是经心尖入路(21.7%)。随着TAVR适应证的拓宽,中低风险TAVR患者逐渐增多,在2010年至2023年接受TAVR手术的患者中,中低风险TAVR患者占比82.61%。TAVR围术期不良事件发生率持续下降,新发左束支传导阻滞(8.60%)、新发房室传导阻滞(6.96%)和永久起搏器植入(6.54%)是目前围术期不良事件的前三位。
2023年,TAVR器械在中国发展迅速,目前国内已有多款瓣膜上市应用(图1),包括VenusA/VenusA Plus、TA J-valve、VitaFlow/VitaFlow Liberty、Sapien 3、Taurus One/Elite和Evolut Pro等。同时,众多瓣膜蓄势待发,逐步进入临床研究阶段,其中单纯AR经股TAVR器械的研发成为新热点,器械包括HanChorValve、TF J-Valve、TF JenaValve、DOCS valve、PioneerValve等。PrizeValve、MuguetA和Renatus等球囊扩张式瓣膜已完成临床试验入组或已提交上市审批材料,即将填补市场空白。新型自膨胀式瓣膜如ALLEGRATMPlus、Venus Power X等将对目前上市瓣膜进行升级。世界首个聚合物TAVR瓣膜TRISKELE已完成FIM研究,初步临床研究结果极佳,聚合物瓣膜或将引领未来[24]。

图1 2023 年中国经导管主动脉瓣置换术瓣膜汇总Figure 1 Summary of transcatheter aortic valve replacement valves in China in 2023
我国主动脉瓣领域的基础和临床研究也取得了较大突破。王建安院士团队揭示了二叶式主动脉瓣形成的新机制,吴永健教授团队开发出TAVR术前主动脉瓣复合区CT评估及解剖风险因子检测全自动算法,基于深度学习实现了TAVR术前影像评估的关键突破。Hanchor Valve是中国首款经股动脉治疗单纯AR的球囊扩张式瓣膜器械,复旦大学附属中山医院潘文志教授代表中山团队在2023年TCT大会报告了Hanchor Valve器械的创新设计及早期临床结果,单中心27例确证性临床试验30 d的随访显示手术成功率为100%,术中无不良事件发生,所有患者术后即刻反流降至无或微量,左心室舒张末期内径明显改善。此外,潘教授通过1例超大瓣环单纯天然AR病例,向全球同行展示了其与周达新教授发明的“三明治”置入法,关键操作技巧及早期经验已发表[25-26]。因此“三明治”瓣中瓣置入技术可能是治疗高危手术风险AR患者的一种重要选择。
1.5 年度展望
2023年TAVR领域取得了显著进展,新器械的研发如火如荼,新型自膨胀式瓣膜和球囊扩张式瓣膜可能于2024年获批上市。TAVR技术日趋成熟,手术量逐年增加,适应证逐步拓宽,但仍面临诸多挑战,主要集中在小瓣环、耐久性、冠状动脉入路等方面。虽然我国在器械研发上取得了令人满意的成绩,但总体上仍缺乏高质量的前瞻性、随机对照研究。随着共识的发布及技术的提高,单纯AR经股动脉TAVR手术量将显著增加,诊断和治疗可能更加规范。
2 经导管MR介入治疗
2.1 经导管二尖瓣修复术
2.1.1 MitraClip系统 MitraClip经导管二尖瓣夹系统是目前应用最广泛的M R 介入治疗器械。COAPT试验[27]5年随访显示使用MitraClip系统经导管缘对缘修复(transcatheter edge-toedge repair,TEER)能持续给心力衰竭合并MR患者带来获益。研究共纳入614例心力衰竭合并中重度或重度功能性MR患者,随机分为MitraClip+指南指导的药物治疗(guideline-directed medical therapy,GDMT)组和单纯GDMT组。在5年随访期间,MitraClip+GDMT组因心力衰竭年再入院率明显低于单纯GDMT组(33.1%比57.2%,HR0.53,95%CI0.41~0.68),全因死亡率分别为57.3%和67.2%(HR0.72,95%CI0.58~0.89),心力衰竭再入院或死亡的发生率分别为73.6%和91.5%(HR0.53,95%CI0.44~0.64)。在接受TEER治疗的患者中,仅1.4%患者在5年内发生器械特异性安全事件,且均发生在术后30 d内。然而,随着随访时间延长,两者生存曲线有接近趋势,提示这些患者除了解决MR外,其原发疾病的治疗仍是根本。
STS/ACC TVT队列研究[28]分析了19 088例接受MitraClip器械进行TEER手术的单纯中重度或重度退行性MR患者,在术后30 d内NYHA-FC显著改善,死亡、脑卒中、二尖瓣再介入发生率分别为2.7%、1.2%和0.97%。随访1年时,死亡率为15.4%,二尖瓣再介入发生率为3.4%,与手术不成功的患者相比,成功患者的死亡率(14.0%比26.7%,HR0.49,95%CI0.42~0.56)、因心力衰竭再入院率(8.4%比16.9%,HR0.47,95%CI0.41~0.54)和二尖瓣介入发生率(2.1%比13.5%,HR0.15,95%CI0.12~0.19)均显著降低。在手术成功的患者中,残余MR≤1+且平均二尖瓣压力梯度≤5 mmHg的患者死亡率(11.4%比26.7%,HR0.40,95%CI0.34~0.47)和因心力衰竭再入院率(6.2%比16.9%,HR0.35,95%CI0.30~0.41)最低,证实在真实临床实践中,MitraClip能为退行性MR患者带来获益,同时也提示要尽量使得患者达到最优手术效果(残余MR≤1+且平均二尖瓣压力梯度≤5 mmHg),患者的临床获益才会最大。
EXPA ND G4研究[29]纳入了1 164例接受MitraClip G4系统治疗的器质性或功能性MR患者,在从基线到一年的配对分析中,92.9%的患者在治疗后实现了MR≤1+,术后30 d和1年的MR≤1+的比例无显著变化。与基线相比,患者的NYHA-FC显著改善,生活质量得到显著提高,随访1年时总人群全因死亡率、因心力衰竭再入院率、复合终点发生率分别为12.3%、16.9%和24%。该大样本前瞻性研究证实了MitraClip G4系统在真实世界中治疗MR安全有效,超过90%的患者MR严重程度持续降低,功能状态和生活质量均得到改善。
OCEAN-Mitral日本注册研究[30-31]共纳入2018年4月至2021年6月接受MitraClip TEER治疗的2 150例MR患者,新旧型号的TEER器械均具有良好的手术成功率(MitraClip G2 94.7%比G4 94.6%,P=0.961),证实了MitraClip TEER系统用于症状性原发性和继发性MR患者的良好短期结局。
2.1.2 PASCAL系统 CLASP IID随机对照研究[32]纳入了来自57家中心300例退行性MR 3+或4+且有外科手术禁忌的患者,2∶1随机分配至PASCAL组和MitraClip组。1年随访时,PASCAL组和MitraClip组的全因死亡率(8.8%比8.4%,P=0.953)、因心力衰竭再入院率(8.1%比3.3%,P=0.146)和主要不良事件发生率(15.3%比11.7%,P=0.471)相比,差异均无统计学意义。PASCAL组术后1年时MR≤2+的患者比例不劣于MitraClip组(95.8%比93.8%)。在MR情况、超声心动图结果、NYHA-FC和生活质量方面也有持续的总体改善,证实PASCAL系统是手术风险过高的症状性重度退行性MR患者有效的治疗方法,基于该研究PASCAL系统也获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市。
2.1.3 ValveClamp和DragonFly系统 世界首个经心尖TEER器械V alveClamp的上市前多中心研究(CLAMP-2研究)[33]结果显示,急性手术成功率为97%,88%的患者仅需置入1枚夹合装置即可达到治疗目标,术后1年的有效终点率为87.3%,不劣于国外同类产品。基于此研究,ValveClamp于2023年9月8日在我国上市,成为国产首个上市的MR介入治疗器械。2023年欧洲心血管介入医学(EuroPCR)大会公布了DRAGONFLY-DMR确证性临床试验结果[34],目前已正式发表于EuroIntervention。该研究旨在评价DragonFly系统治疗MR的安全性和有效性,共纳入来自中国27家中心120例症状性MR≥3+合并外科手术高危的退行性MR患者。术后即刻手术成功率和器械置入成功率均为99.2%,术后12个月治疗成功率为87.5%,MR≤2+占比92.0%,NYHA-FC和生活质量均显著改善,证明了DragonFly经导管二尖瓣瓣膜夹系统具有良好的安全性和有效性,或为外科手术高危的退行性MR患者提供更多的治疗选择。基于此研究,Dragonfly于2023年11月29日获国家药品监督管理局(National Medical Products Administration,NMPA)批准正式上市,成为国产首个上市的经股静脉TEER器械。
2.2 经导管二尖瓣置换术
根据自体二尖瓣的类型,经导管二尖瓣置换术(transcatheter mitral valve replacement,TMVR)可分为4种方式:(1)生物瓣损毁后的瓣中瓣(ViV),针对既往外科二尖瓣生物瓣衰败的患者;(2)成形环中瓣(ViR),针对既往外科瓣膜成形术置入人工二尖瓣瓣环的患者;(3)钙化环中瓣(ViMAC),针对自身二尖瓣瓣环严重钙化或关闭不全的患者;(4)自体瓣中瓣,针对二尖瓣瓣环无明显钙化的患者。
2023年EuroPCR会议展示了MITRAL试验[35]5年随访结果,研究纳入严重二尖瓣狭窄或MR且NYHA-FC Ⅱ级以上的患者或心脏团队评估为高危手术风险的患者,平均分配至ViV(N=30)、ViR(N=30)以及ViMAC(N=31)3种治疗策略中。5年全因死亡率分别为21.4%、65.5%和67.9%,二尖瓣再介入发生率分别为3.6%、10.3%和17.9%,生活质量评分与基线相比持续改善,各组二尖瓣人工瓣膜功能保持稳定。ViV、ViR和ViMAC TMVR是高危手术风险患者的合理选择。
CHOICE-MI研究[36]将接受TMVR治疗的262例功能性MR患者和EuroSMR注册研究中接受TEER治疗的1 065例功能性MR患者进行倾向性匹配分析发现,尽管TMVR术后30 d(6.8%比3.8%)与1年(25.8%比18.9%)的全因死亡率均略高于TEER,但组间比较,差异均无统计学意义。在30 d界标分析中,两组的1年死亡率比较,差异无统计学意义(TMVR 20.4%比TEER 15.8%,P=0.21)。与TEER相比,TMVR术后出院时MR≤1+的患者比例(95.8%比68.8%,P<0.001)以及1年时NYHA-FC≤Ⅱ级的患者比例(77.8%比64.3%,P=0.015)均更高,提示TMVR与更好的MR减少和更好的症状改善相关。另一项与COAPT试验中接受GDMT治疗的功能性MR患者倾向性匹配分析[37]表明,TMVR组的2年因心力衰竭再入院率明显低于GDMT组(32.8%比54.4%,HR0.59,95%CI0.35~0.99,P=0.04)。在1年和2年时,TMVR组所有患者的残余MR均≤1+,而单纯接受GDMT的患者分别为6.9%和7.7%,TMVR组NYHA-FCⅠ/Ⅱ级的患者比例均高于GDMT组(1年时78.2%比59.7%,P=0.03,2年时77.8%比53.2%,P=0.09)。两组的2年死亡率相似(TMVR 36.8%比GDMT 40.8%,HR1.01,95%CI0.62~1.64,P=0.98),表明TMVR与GDMT相比可显著降低MR、改善临床症状、减少因心力衰竭再入院率,但未能降低死亡率。
二尖瓣生物瓣衰败后再次外科二尖瓣置换(redo surgical mitral valve replacement,Redo SM V R)或T M V R 预后的证据有限,一项倾向性评分匹配分析[38]纳入了4 293例患者(Redo SMVR:64%;TMVR:36%),匹配队列的3年主要不良心血管事件(major adverse cardiovascular e v e n t s,M A C E)风险相当(校正H R0.9 2,95%CI0.80~1.04,P=0.2),界标分析显示前6个月TMVR的MACE风险较低(校正HR0.75,95%CI0.63~0.88,P<0.001),6个月后风险较高(校正HR1.28,95%CI1.04~1.58,P=0.02)。这表明在二尖瓣生物瓣衰败患者中,Redo SMVR和TMVR在3年时具有相似的结局,TMVR的初始风险较低,但6个月后MACE的风险较高。
Tendyne TMVR系统是一款经心尖入路的二尖瓣介入治疗器械,于20 20年2月获得欧盟(Conformite Europeenne,CE)认证,是全球首个获批上市的介入二尖瓣置换装置。其在美国上市关键临床试验SUMMIT(比较Tendyne与MitraClip的安全性和有效性)正在进行中。HighLife TSMVR是一款经房间隔穿刺入路的二尖瓣置换系统,采用独特的“Valve in Ring”设计理念,具有自适应、自同轴的特点,目前已在超过30家国际中心完成超100例以上研究性临床置入,在中国的上市前临床研究也在进行中。2023年EuroPCR大会公布的HighLife欧洲/澳洲临床试验的1年主要终点结果显示,52例患者的整体HighLife技术成功率为88%,100%患者安全离开手术室,术后30 d全因死亡和全因死亡+大出血复合终点发生率均为13.5%,术后30 d至1年患者维持了良好的血流动力学改善。Intrepid瓣膜也是一款临床置入最多的TMVR瓣膜之一,新一代的Intrepid瓣膜采用经股静脉置入,其早期可行性研究评估了中重度MR患者经股静脉置入Intrepid瓣膜30 d和1年的结果,共纳入33例患者,31例(93.9%)患者成功置入,30 d时未发生死亡或脑卒中,8例(24.2%)患者发生重大血管并发症,无需外科干预,4例患者发生了静脉血栓栓塞,均成功治疗无后遗症,1年全因死亡率为6.7%,所有患者均无/微量瓣周漏,91.7%的生存者NYHA-FC处于Ⅰ/Ⅱ级,生活质量评分改善,显示出良好的安全性和持久的瓣膜功能[39]。
2.3 指南共识
TEER已被2020年美国心脏病学会(American College of Cardiology,ACC)/美国心脏协会(American Heart Association,AHA)瓣膜指南及2021年欧洲心脏病学会瓣膜指南列为外科手术高危的MR患者的重要治疗方式,目前已成为心脏介入手术领域最热门的技术之一[40-41]。我国在该领域起步较晚,因缺乏规范的临床路径,2023年3月中国医师协会心血管内科医师分会结构性心脏病学组基于目前的循证医学证据以及临床应用经验,发布了《中国经导管二尖瓣缘对缘修复术临床路径(2022版)精简版》[42],针对TEER团队建设、患者临床评估、影像评估、手术规范流程、复杂病变处理、围术期管理、全生命周期康复和随访等关键问题进行梳理,以推动TEER技术在我国安全、规范地开展和推广。为规范TEER患者的心脏康复,2023年4月《经导管二尖瓣缘对缘修复术患者心脏康复中国专家共识》[43]发布,对个体化康复评估、康复教育、运动康复、药物治疗,营养、心理、睡眠和戒烟等相关问题干预提供建议,为TEER患者提供从住院到居家的综合康复管理方案。
2.4 国内动态
2020年6月,MitraClip系统在中国获批上市,为我国MR患者提供了微创治疗选择,已在全国近百家医院开展,2023年12月,新一代的MitraClip G4系统在我国获批上市。我国2021年、2022年开展的TEER分别为182例、355例,但在2023年,我国TEER猛增至1 274例。随着近年来该技术在我国的快速发展,涌现出一批国产创新TEER器械,2023年,捍宇医疗ValveClamp二尖瓣夹系统和德晋医疗DragonFly经导管二尖瓣夹系统已经获批,国内自主研发的TEER器械,如NovoClasp(应脉医疗)、ValveClasp(捍宇医疗)、SQ-Krine(申淇医疗)、ValveClip(纽脉医疗)、NeoNova(臻亿医疗)、KokaClip(科凯医疗)、JensClip(健世医疗)等,正在进行上市前临床研究,有望为TEER领域提供更多的选择。
2.5 年度展望
MR介入治疗发展迅猛,近年来在适应证上不断拓展,多项临床试验表明,TEER技术可以有效降低MR的严重程度,改善患者的症状和预后。二尖瓣创新修复器械的研发方兴未艾,多种TMVR系统已进入临床试验阶段,或将为MR患者提供更微创、更安全有效的治疗方案。二尖瓣介入治疗同时也存在诸多挑战,由于二尖瓣解剖结构复杂,人工瓣膜的定位和固定困难,且易引起各种并发症,二尖瓣介入治疗器械仍需进一步优化,需要进一步开展大规模的随机对照试验,探究TMVR的时机和安全性,为临床决策提供更有力的证据支持。
3 经导管三尖瓣介入治疗
3.1 经导管三尖瓣置换
EVOQUE瓣膜系统由镍钛合金自膨胀框架、瓣膜内环密封圈以及牛心包瓣叶组成,于2023年10月19日获得CE认证,用于对符合条件的TR患者进行经导管治疗。2023年11月,TRISCEND研究1年结果[44]公布,研究纳入了176例经药物治疗后仍有≥中度症状性TR患者,经股静脉EVOQUE三尖瓣置换术后1年全因死亡率为9.1%,因心力衰竭再入院率为10.2%,97.6%的患者TR减轻至轻度或微量,心功能和生活质量明显改善,93.3%的患者NYHA-FC改善至Ⅰ/Ⅱ级,生活质量评分较基线提高25.7分,6分钟步行距离较基线增加56.2 m。2022年11月,Topaz经导管三尖瓣置换系统首次被报道用于治疗重度功能性TR患者,取得了良好的短期效果[45],2023年TCT会议上公布了Topaz经导管三尖瓣置换系统早期临床试验结果,研究共纳入11例患者, 随访30 d时,1例患者死亡,90%患者TR降低至无/微量,患者NYHA-FC均恢复至Ⅰ/Ⅱ级。TricValve经导管双腔瓣膜系统由两个自膨胀式生物瓣膜组成,用于治疗TR和腔内反流患者,TRICUS研究和TRICUS EURO研究旨在探究NYHA-FC Ⅲ/Ⅳ级的严重TR患者置入TricValve瓣膜的安全性和有效性[46],42例(95.5%)患者术后1年临床症状改善,死亡率(6.8%)和因心力衰竭再入院率(29.5%)较低,所有患者均未发生支架断裂、传导系统紊乱及有临床意义的小叶血栓,63.8%患者肝静脉回流消失,初步证实了TricValve经导管双腔瓣膜治疗腔静脉回流且不宜接受外科手术的严重症状性TR患者具有良好的安全性和有效性。
3.2 经导管三尖瓣修复
经导管三尖瓣修复包括TEER、瓣环成形、反流口填充等类型。TEER是国际上使用最为广泛的三尖瓣介入修复技术,TriClip和PASCAL系统均已优先取得了CE认证,另一款三尖瓣环缩器械Cardioband系统也获得CE认证。其他修复器械仍处于早期临床应用阶段,例如Trialign、TriCinch。FORMA系统利用填充物的形式占用三尖瓣瓣口以减少TR,处于研究之中。
bRIGHT研究[47]纳入511例有症状的重度TR患者,主要终点为急性手术成功率,次要终点为全因死亡率或1年后三尖瓣再干预发生率。99%的受试者成功置入TriClip器械,77%的患者在30 d时TR降至中度以下。NYHA-FC和生活质量评分均显著改善。14例(2.5%)受试者在术后30 d内出现严重不良事件。TRILUMINATE Pivotal研究[48-49]旨在评估TriClip经导管三尖瓣修复系统治疗重度症状性TR患者的安全性和有效性,纳入来自全球多中心350例症状性重度TR患者,1年随访结果表明,TriClip能够安全有效地减少TR程度,并与患者1年后生活质量的改善相关。与药物治疗相比,TriClip TEER并未增加患者的死亡率、重大不良事件发生率或因心力衰竭再入院率,为重度TR患者提供了一种新的治疗手段。
PASCAL修复系统是用于治疗MR的TEER器械,2017年首次应用于TR治疗,于2020年5月获得三尖瓣介入治疗的CE认证。CLASP TR[50]是一项单臂、多中心、前瞻性研究,旨在评估PASCAL经导管瓣膜修复系统用于TR患者的安全性和有效性,共纳入65例TR患者,97%为重度以上的TR,随访1年时发现受试者TR严重程度显著降低,31例患者TR程度降至中度以下,且所有患者TR程度均至少降低1个等级。1年内免于全因死亡和因心力衰竭再入院的比例分别为87.9%和78.5%。所有患者NYHA-FC均显著改善,92%患者NYHA-FC改善至Ⅰ/Ⅱ级,6分钟步行距离和生活质量评分均显著提高。
Mistral是一种经皮三尖瓣修复装置,通过抓住和向内拉动三尖瓣的腱索达到减少瓣膜反流的效果。2022年9月,Mistral治疗严重功能性TR患者的FIM研究[51]发表,30 d研究结果显示,Mistral可减少TR并改善右心室功能和运动能力。6个月和1年随访结果均提示基于Mistral的三尖瓣修复具有良好的安全性和有效性[52-53]。
3.3 指南共识
2023年4月,国家心血管病专家委员会微创心血管外科专业委员会牵头发表了全球首部聚焦于左心瓣膜术后TR诊疗的专家共识,围绕左心瓣膜术后TR的发病机制、术前评估、手术干预指征、外科手术、介入手术、术后管理等方面进行了全面总结和讨论,以推动TR的规范化诊治[54]。2023年12月,欧洲心力衰竭协会(Heart Failure Association,HFA)联合欧洲经皮心血管介入学会(European Association of Percutaneous Cardiovascular Interventions,EAPCI)共同发布《2023 HFA/EAPCI临床共识声明:慢性右心衰竭和三尖瓣反流的流行病学、病理生理学、诊断和管理》[55],总结了目前关于右心衰竭TR的流行病学、病理生理学和治疗的知识,为患者的识别和诊疗管理提供实用的建议。
3.4 国内动态
LuX-Valve是我国自主研发的经导管人工三尖瓣瓣膜置换系统,采用非径向支撑力锚定的方式,不影响患者心脏收缩功能及三尖瓣周围重要解剖结构。LuX-Valve Plus是LuX-Valve第二代产品,对输送系统进行了改造和升级,采用经颈静脉置入,2023年2月,LuX-Valve Plus FIM研究[56]结果发表,90%的TR患者在术后30 d随访时处于NYHA-FC Ⅰ/Ⅱ级,全部患者TR分级降低至无/轻微,无患者死亡;1例(10%)患者需要植入起搏器,未发生其他严重不良事件,证实LuX-Valve Plus系统在严重TR患者中手术成功率高、安全性好,临床效果显著。目前,我国已有2款经导管三尖瓣修复器械进入临床研究阶段,包括经导管三尖瓣瓣膜夹系统DragonFly-T和K-Clip三尖瓣修复系统。DragonFly-T是一款经股静脉TR修复系统,2020年12月15日完成中国大陆首例人体临床应用。K-Clip是我国自主研发的一款基于夹子的三尖瓣环修复设备,动物实验表明K-Clip系统可显著缩小猪模型的三尖瓣瓣环面积并降低TR程度[57],FIM研究进一步证实了K-Clip系统良好的手术成功率、可接受的安全性和显著的临床改善效果[58]。我国经导管三尖瓣器械研发呈蓬勃发展之势,NeoBlazar、DragonFly-T、Koka Clam p、Cardiovalve、MonarQ等新器械必将极大促进经导管三尖瓣治疗技术的发展。
3.5 年度展望
TR是一种曾被忽视的右心系统疾病,既往药物及外科手术治疗效果均不理想,经导管三尖瓣介入治疗技术展现出良好的有效性和安全性,并逐渐改写了三尖瓣治疗的策略和指南。尽管我国在这一领域起步较晚,但在器械的研发上势头强劲,未来将根据TR患者的病因和解剖特征,基于多模态影像和AI辅助等技术为患者制定个性化的治疗策略。预计在未来几年,我国将有商业化三尖瓣介入产品上市,有望为我国TR患者提供更多的选择。
4 经导管LAAC
4.1 研究进展
NCDR研究[59]基于美国国家心血管数据探究了WATCHMAN左心耳封堵器置入术后的长期临床结局,共纳入2016年1月至2019年12月期间的34 975例患者,41.8%为女性,平均年龄77.5岁,平均CHA2DS2-VASc评分4.7分,平均HAS-BLED评分3.1分,33.1%患者存在充血性心力衰竭、21.3%患者存在脑卒中,尽管入组患者基线血栓栓塞风险较高,但置入WATCHMAN后长期脑卒中发生率较低,术后1年、2年、3年、3.7年脑卒中发生率分别为0.013%、0.027%、0.04%和0.05%,生存曲线分析显示,置入WATCHMAN封堵器术后1年、2年、3年、4年生存率分别为91.4%、82.6%、74.4%、63.8%,提示WATCHMAN对高龄、高危房颤患者具有良好的保护性。
SURPASS研究[60]是迄今为止最大样本量的WATCHMAN FLX真实世界研究,共纳入2020年8月至2022年8月期间743家中心接受置入治疗的66 894例患者,共18 233例患者接受1年随访。WATCHMAN FLX置入密封性高,术后45 d复查残余分流<3 mm的患者比例高达96%,术后1年随访显示,84%的患者术后未出现任何残余分流。随访1年后,接受WATCHMAN FLX置入的患者的全因死亡、脑卒中、大出血、缺血性脑卒中风险分别为8.3%、1.6%、6.7%和1.2%,证明了WATCHMAN FLX置入安全有效,在预防脑卒中方面效果良好。
Amulet IDE研究[61]是一项前瞻性、多中心、开放标签的随机对照研究,共纳入108家中心的1 878例房颤患者,随机分至Amulet和Watchman两组进行LAAC。术后随访3年,Amulet组未使用口服抗凝剂的患者比例显著高于Watchman组(96.2%比92.5%,P<0.01),两组缺血性脑卒中、体循环栓塞和心血管死亡的复合事件发生率分别为11.1%和12.7%(HR0.87,95%CI0.66~1.14,P=0.31),组间差异无统计学意义,且Watchman组患者在发生缺血性脑卒中和心血管死亡前的器械相关事件(器械相关血栓或器械残余漏≥3 mm)比Amulet组患者更常见,或有利于Amulet封堵器在临床的进一步推广。
SWISS-APERO研究[62]预先指定分析结果表明,术后13个月CT检查随访时,WATCHMAN Gen2.5/FLX封堵器与Amulet封堵器相比,在对比剂通过率、对比剂分流类型及器械相关血栓事件发生率上均相似。在临床终点事件方面,两组心原性死亡、脑卒中及系统性栓塞复合终点事件(P=0.829)及各亚组事件发生率(心原性死亡P=0.671、脑卒中P=0.706、系统性栓塞或肺栓塞P=0.341、出血事件P=0.098)差异均无统计学意义。
WATCH-TAVR是一项前瞻性、多中心随机对照试验[63],旨在评估与TAVR+药物治疗相比,TAVR+LAAC在合并严重AS的房颤患者中的可行性、安全性与有效性。研究纳入2017年12月至2020年11月美国34家中心的349例患者,以2年内全因死亡、脑卒中或重大出血事件作为研究复合终点。结果显示,TAVR+LAAC组的主要终点事件发生率更低,不劣于TAVR+药物治疗(22.7个事件/100患者年比27.3个事件/100患者年,HR0.86,P<0.001),证实了合并房颤的严重AS患者行TAVR+LAAC联合手术的可行性。
4.2 器械研发
动物实验表明,带有表面涂层的WATCHMAN FLX Pro封堵器较无涂层封堵器具有更好的内皮化程度,表现出较少的血栓形成和炎症,或可明显缩短患者服用抗栓药物的时间[64]。2023年9月6日,波士顿科学公司宣布,WATCHMAN FLX Pro左心耳封堵器获得美国FDA的正式批准,采用新型聚合物涂层减少器械相关血栓,实现更快内皮化,增加可视化标记点以提高置入器械的精确度,器械尺寸范围更大可用于处理大心耳。Laminar LAA是一个球锁结合的装置,通过旋转来关闭左心耳,而并非封堵,有望规避传统左心耳封堵器存在的血栓形成、残余漏等弊端。动物研究显示,在45 d和150 d的所有Laminar LAA受试犬中均未发现残余漏或器械相关血栓形成,组织学检查显示完全闭合的左心耳覆有新生内膜。15例房颤患者顺利置入了Laminar LAA装置,术后12个月内未发生任何安全事件[65]。Laminar LAA展现出不错的有效性与安全性,未来或在左心耳封堵领域有一席之地,正因如此,2023年11月强生医疗科技宣布完成了对Laminar医疗器械公司的收购。
4.3 指南共识
2 0 2 3 年3 月,《心血管造影和介入学会(Society f or Cardiovascular Angiography and Interventions,SCAI)/美国心律学会(Hea r t R h yt hm Societ y,HRS)经导管左心耳封堵专家共识》[66]再次更新,重点强调了L A A C 术中的“七大”技术细节,包括尽量通过右股静脉进行,根据术者习惯决定肝素化与房间隔穿刺的先后顺序,根据经食管超声心动图9 0°时的心耳轴向决定穿刺点高低,多数建议使用双弯鞘管,强调鞘管进入左心房后的排气与肝素盐水冲洗,建议将左心房平均压提至12 mmHg以上正确测量左心耳,应在释放前仔细评估封堵器尺寸、锚定稳定性、心耳内定位及残余分流情况。2023年11月30日,ACC/AHA/美国胸科医师学会(American College of Chest Physicians,ACCP)/HRS联合发布了《2023 ACC/AHA/ACCP/HRS心房颤动诊断和管理指南》[67],对LAAC给出了更高级别的推荐,对于CHA2DS2-VASc评分≥2分且有长期口服抗凝禁忌证的患者,经皮LAAC被认为是合理的选择(Ⅱa级)。对于中高度脑卒中风险且在抗凝治疗下有严重出血风险的患者,LAAC可能是口服抗凝的合理替代方案(Ⅱb级)。《心房颤动诊断和治疗中国指南 2023》[68]建议,有长期抗凝绝对禁忌证的房颤患者,应考虑LAAC(Ⅱa C),有长期抗凝相对禁忌证的脑卒中高风险房颤患者,可考虑行LAAC(Ⅱb C),对于充分抗凝后仍发生脑卒中的房颤患者,排除明确脑血管狭窄相关脑卒中后,可考虑行LAAC(Ⅱb C)。
4.4 国内动态
2023年,我国LAAC完成例数约为26 000例。全国目前有超过700家中心开展LAAC,年置入量大于100台的有30余家中心,全国LAAC手术呈增长趋势,总置入量相较于2022年增长超过30%,超过1 000位术者能独立完成LAAC,以电生理专家为主要术者,其次为冠状动脉介入专家。Bio-Lefort生物可降解左心耳封堵器上市前临床试验进展顺利,2023年2月1日,全球首枚Bio-Lefort生物可降解左心耳封堵器于合肥高新心血管病医院顺利置入人体。SimuLock为全球首款仿生型且可组装式左心耳封堵器,2023年11月8日,复旦大学附属中山医院葛均波院士团队完成SimuLock的前瞻性、多中心、随机对照确证临床试验的全国首例入组和成功置入。普实医疗在LACbes的基础上不断创新,正研发分体式结构和仿生设计封堵器,可根据心耳尺寸自由组装内外盘,在更大程度上匹配不同形态心耳的手术需求,近期将启动全国上市前临床试验。消融联合LAAC“一站式”手术预防非瓣膜性房颤患者脑卒中的疗效和安全性被进一步证实[69-73],心腔内超声可作为指导LAAC手术操作的潜在工具[74-76]。
4.5 年度展望
LAAC在过去的1年中得到了迅猛发展,器械的结构和功能得到进一步优化,针对器械相关血栓和器械周围残余漏的新器械研发和临床试验稳步进行,可吸收封堵器逐步崭露头角。新型影像和技术手段如3D打印、虚拟现实等使得LAAC手术更快、更安全,让患者更舒适。然而,目前国内关于LAAC的高质量临床研究屈指可数,随着指南推荐等级的提升,期待有更多中国本土高质量研究成果产出。
5 CHD介入治疗
5.1 研究进展
2 0 2 3 年3 月,中国医学科学院阜外医院闫朝武教授团队首次揭示了卵圆孔未闭(patent f oramen ovale,PFO)相关脑卒中的新机制[77],研究发现,脑卒中组、偏头痛组和无症状组分别有8 3.7%、5 7.1%和0 例患者通过光学相干断层成像技术检测到原位血栓(P<0.001),原位血栓与脑卒中风险显著相关(OR4.59)。71.9%原位血栓患者合并内膜异常,但在无血栓患者中并未发现内膜异常,提示原位血栓和内膜异常可能在PFO相关脑卒中或偏头痛患者中发挥重要作用。PFO相关偏头痛的随机对照研究如COMPETE-2研究、RELIFE研究、SPRING研究均顺利完成入组。多项从不同角度探索PFO与偏头痛相关性的研究正在进行中,如动态脑血流自动调节功能评估、血小板衍生生长因子-BB差异、偏头痛PFO筛查率差异、右向左分流量与偏头痛程度相关性、PFO患者头痛患病率、偏头痛有无PFO的MRI区别等,有望为PFO相关偏头痛的介入治疗提供更多的理论依据。
异常血管栓塞与异常缺损漏口封堵是复杂先心介入治疗领域的核心问题。异常血管栓塞包括体肺侧支、肺动静脉瘘、冠状动脉瘘、异常血管、人工血管闭合,微血管塞在CHD介入领域已广泛应用,使用造影导管或微导管释放相对更具操作优势,然而,目前除Amplatzer 4代血管塞外,其余产品均尚未进入国内。异常缺损漏口封堵囊括瓦氏窦瘤破裂、假性动脉瘤/瘘、残余漏、瓣周漏、开窗口、分流口等情况,先健Konar-MFO已在印度地区成功应用于左冠状动脉异常起源于肺动脉、室间隔破裂、瓣周漏等[78]。对于先天性血管狭窄性疾病,如主动脉缩窄、肺动脉狭窄、肺静脉狭窄、腔静脉狭窄、人工管道狭窄、体肺侧支狭窄等,血管支架成形介入治疗在2023年也取得显著进步,Cheatyam Platinum支架和PulStent肺动脉支架置入量均显著增长。
因新生儿血管细小的特点,介入器械的治疗与选择相对困难且局限。2023年全国多家中心已在新生儿介入治疗方面取得诸多突破,经导管肺动脉瓣打孔术是治疗新生儿室间隔完整型肺动脉闭锁的安全、有效措施,中期随访疗效确切[79]。动脉导管支架置入术也被证实可作为室间隔完整型肺动脉闭锁和室间隔缺损(ventricular septal defect,VSD)型肺动脉闭锁患儿的一期治疗方法[80]。经导管右心室流出道支架置入术对低出生体质量、伴有严重合并症的法洛四联症患儿具有良好的手术效果[81-82]。新生儿和低龄婴幼儿主动脉缩窄首选外科手术治疗,但对危重患儿,主动脉支架介入治疗或是有效的补充手段[83]。
2023年PADN-5和PADN-CFDA临床研究正式发表,为经皮肺动脉去神经术在肺动脉高压患者中的应用提供重要的数据支撑,而环形肺动脉射频消融导管和肺动脉射频消融仪获NMPA批准上市,将极大促进经皮肺动脉去神经术在国内的开展和推广[84-86];房间隔分流相关临床试验也正处于开展阶段,反向分流术也成为终末期肺动脉高压患者与CHD术后肺动脉高压患者的新选择[87]。肺动脉高压靶向药物的联合使用已被证实明显改善艾森曼格综合征患者的生活质量和远期预后[88-89]。
5.2 指南共识
基于国内外PFO领域的最新进展,2023年《卵圆孔未闭超声诊断中国专家共识》[90]与《卵圆孔未闭相关非卒中性疾病防治中国专家共识》[91]顺利发布,将进一步规范PFO诊断和治疗流程,更好地指导临床实践。《肺静脉狭窄诊治中国专家共识》[92]概述了肺静脉狭窄介入的适应证、治疗原则、操作建议、治疗策略、并发症的处理、术后随访等,有望规范该疾病临床诊疗,优化全程管理。2023年AHA发布了CHD中肺动脉高压的科学声明[93],国家心血管病中心肺动脉高压专科联盟发布了《中国肺动脉高压诊治临床路径》[94],均为我国肺动脉高压患者的临床诊疗提供了可靠的参考与依据。
5.3 国内动态
2020年至2023年国内10家封堵器厂家的CHD封堵器置入数据分析表明,CHD封堵器置入数量呈逐年递增趋势,亚组分析提示2023年VSD封堵器置入量与2022年基本持平,但均明显高于2021年;动脉导管未闭(patent ductus arteriosus,PDA)封堵器、房间隔缺损(atrial septal defect,ASD)封堵器和PFO封堵器置入量均逐年增加,其中PFO封堵器每年以近2万例次的“井喷式”速度增长,俨然提示PFO封堵术已成为CHD介入领域的热点之一,或许得益于心原性脑卒中概念的普及以及介入诊疗技术的推广(图2)。
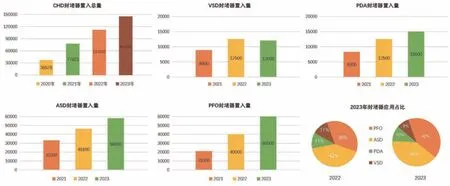
图2 国内CHD 介入封堵器械置入量年度统计Figure 2 Annual statistics of interventional occlusion device implantation for CHD in China.Note: The data comes from ten occlusion device manufacturers in China
我国新型介入封堵器的研发应用呈百花齐放的蓬勃态势。乐普可降解VSD封堵器上市后应用数量已超160例、可降解PFO封堵器上市后应用数量超140例;乐普可降解ASD封堵器、锦葵可降解PDA/ASD/VSD/PFO封堵器仍处于临床研究中;新一代PDA Amplatzer Piccolo封堵器上市后正逐步开始推广;捍宇医疗可穿刺房间隔封堵器ReAces研究患者入组已完成;国产Konar-MF治疗急性室间隔穿孔及瓣周漏已在中东、南亚、东南亚地区开展相关应用。其中,PFO作为当前CHD领域中的热点,在2023年取得了诸多发展和进步。国内新型PFO封堵器研发方向分为可降解、可穿刺、减少金属与无置入缝合四大类,其中Amplatzer Talisman、MemoSorb已正式商用,D-Shufo已获批上市,此外Ceraflex、脉搏PFO、NeoSorb、TriFlower、瀚芯PFO缝合、德诺电生理、Omniseal、无忧跳动等多种PFO封堵器均处于在研阶段,或为未来PFO患者提供新的个体化选择(图3)。

图3 国内新型PFO 封堵器Figure 3 Diagram of novel PFO occlusion devices in China
5.4 年度展望
总体而言,我国CHD负担仍然较重,ASD与PFO封堵器置入量持续上升,CHD的诊疗已向低龄化、复杂化方向不断发展,介入无置入的理念逐步深入人心,生物可降解封堵器、射频消融和机械损伤、经皮导管缝合等可能成为未来PFO介入治疗的新热点。5G远程医疗、VR技术、AI学习、多模态影像融合、3D打印[95]及计算机仿真技术等可能为未来国内CHD领域提供新的技术指导和研究方向。
6 结语
SHD领域近年来得到了迅猛发展,虽然我国在二尖瓣、三尖瓣、主动脉瓣等领域起步较晚,但发展势如破竹,中国SHD领域的创新之路,正不断开创崭新局面。我国在较短时期内已积累了丰富的SHD介入治疗经验,同时众多自主研发的器械涌入临床,多个符合中国国情的诊疗指南和共识重磅发布,总体进步比较明显。然而,需要清晰认识到的是,国内原创性、大规模、高质量的基础和临床研究较为匮乏,但相关临床研究数据库的建立和中心认证等工作正在有条不紊地进行之中,有望缩小与西方国家之间的差距。砥砺奋进正当时,继往开来铸华章,相信在众多领域专家学者的努力和推动下,SHD患者能迎来更加灿烂的明天。
写作组成员:潘文志(复旦大学附属中山医院),金旗(复旦大学附属中山医院),宋光远(首都医科大学附属北京安贞医院),刘先宝(浙江大学医学院附属第二医院),陆方林(上海交通大学附属第一人民医院),白元(海军军医大学第一附属医院),尚小珂(华中科技大学同济医学院附属协和医院),周达新(复旦大学附属中山医院),吴永健(中国医学科学院阜外医院)
协同作者组成员:李捷(广东省人民医院),张晓春(复旦大学附属中山医院),张源(复旦大学附属中山医院),张戈军(中国医学科学院阜外医院),曾杰(四川省人民医院),姜小飞(珠海市人民医院)
利益冲突 所有作者均声明不存在利益冲突
