基因治疗在遗传代谢性肝病中的应用进展
2024-05-08张银纯梁普平郝虎
张银纯 梁普平 郝虎
遗传代谢性肝病(IMLD)是由于各种基因缺陷而导致肝脏代谢异常的一大类疾病,这类疾病的临床表型差异显著,以黄疸、肝脏肿大、肝细胞损害和低血糖为主要表现,并常合并肝脏外损伤。其种类繁多,尽管每种疾病的发病率不高,但由于疾病谱广,总体发病率较高[1-3]。IMLD包含多种不同的遗传性罕见病,通常具有单一或多个致病基因,目前手术和药物治疗的方法非常有限,且疗效欠佳并通常给患者带来极重的负担。随着测序技术对致病基因的解析及分子生物学的快速发展,基因治疗已经发展为一种重要的遗传疾病治疗手段。目前靶向肝脏的基因治疗已被认为是除肝移植、肝再生治疗外一种更高效、更安全且可能彻底治愈IMLD的方法[4],包括急性间歇性卟啉[5]、鸟氨酸氨甲酰转移酶缺乏症[6]、肝豆状核变性[7]、Crigler-Najjar综合征[8]等。本文将概述基因治疗在IMLD中的应用进展,总结分析当前基因治疗存在问题及潜在解决方案,以期为基因治疗在IMLD中的研究和应用提供借鉴和参考。
一、IMLD基因治疗策略
基因治疗包括体外基因治疗和体内基因治疗两种不同方式,IMLD的治疗通常采用体内基因治疗的方式[9]。体外基因治疗是将患者的细胞(通常是成体干细胞)从体内分离在体外进行培养,然后向体外培养的细胞中导入能表达正常基因的载体,或者通过基因编辑修复体外培养细胞中的病因突变,最后将以上细胞回输至患者体内以进行疾病的治疗。体内基因治疗则是直接使用病毒或非病毒载体将正常基因导入患者病灶或全身从而弥补突变基因的功能缺失,或者是直接向患者病灶或全身导入基因编辑工具从而在体内修复患者突变基因的治疗方法(图1)。基因编辑是通过位点特异性核酸酶定点切割靶基因进而激发靶位点处DNA的损伤修复,或者利用位点特异性碱基脱氨酶或DNA糖基化酶直接催化碱基的置换,从而修饰靶基因的遗传工程技术。其主要包含锌指核酸酶(ZFN)、TALEN核酸酶(TALEN)、Cas核酸酶、单碱基编辑器(BE)和先导编辑器(PE)等。其中,基于规律成簇间隔短回文重复序列及其相关蛋白(CRISPR/Cas)系统的Cas核酸酶、单碱基编辑器由于效率更高、使用更便利等优势而发展最为迅猛。如Cas核酸酶和单碱基编辑技术已被用于纠正人源化鸟氨酸氨甲酰转移酶小鼠模型[6]、肝豆状核变性小鼠模型[7]、甲基丙二酸血症小鼠模型[10]和苯丙酮尿症小鼠模型[11]等,其纠正了部分临床表型且提升了模型小鼠的存活率。
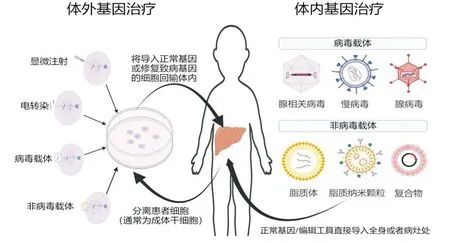
图1 IMLD基因治疗策略和载体系统
二、基因治疗递送载体系统
体内基因治疗是IMLD最常用的基因治疗策略,如何安全有效地实现靶基因特异递送是基因治疗药物面临的一个重要挑战。目前体内基因治疗主要运用两种递送系统,即病毒和非病毒载体。其中病毒载体主要包括逆转录病毒(RV)、慢病毒(LV)、腺病毒(AdV)、腺相关病毒(AAV)等。非病毒载体主要包括脂质体、纳米载体等[12-14](图1)。与病毒载体相比,非病毒载体较为安全,其不依赖于病毒基因组,不受基因组包装能力的限制,且通常具有较低的免疫原性,还可通过化学修饰进行调节,易于控制且成本较低。考虑能高效用非病毒载体进行递送的仅有肝脏、脾脏等少数器官,而病毒载体如AAV载体则能靶向多种组织器官,如肝脏、神经、肌肉等。同时病毒载体亦存在一些缺点:如可能引起较为强烈的宿主免疫反应,载体随机整合至基因组,包装能力有限导致无法递送大片的DNA。目前IMLD基因治疗的载体主要包括AdV、AAV、LV和脂质纳米颗粒(LNP)[8],其具体特点见表1。

表1 IMLD基因治疗常用的载体/递送技术特点及应用[8,12-14]
三、IMLD基因治疗的应用进展
靶向肝脏的基因治疗已成为IMLD最有效的方法之一,目前在多种疾病的诊疗研究中均取得一定的进展,主要包括尿素循环障碍、有机酸血症、肝豆状核变性、苯丙酮尿症和糖原代谢障碍等。
1.尿素循环障碍:尿素循环障碍是指因参与尿素循环的酶和转运蛋白缺陷,导致氨基酸分解代谢产生的氨不能通过尿素循环形成尿素排出体外,引起血氨升高为特征的一组遗传代谢病[15]。据估计,尿素循环障碍总体发病率至少为1/35 000[16]。目前对于氨甲酰磷酸合成酶Ⅰ缺乏症的临床前研究中,基于AAV的基因治疗明显改善了其临床表型,提升了该小鼠模型的存活率,并使血氨和血氨基酸水平正常化[17]。鸟氨酸氨甲酰转移酶缺乏症基因治疗的研究较为广泛,如Yang等[18]使用双AAV系统递送CRISPR/Cas9核酸酶至新生鸟氨酸氨甲酰转移酶缺乏小鼠模型中,一个AAV表达化脓性链球菌Cas9(SpCas9),另一个表达gRNA并提供供体模板DNA,可修复10%肝细胞突变。Wang等[19]使用了双AAV系统,一个AAV载体递送OTC基因,一个AAV载体则递送CRISPR/Cas9进行同源定向修复以纠正10%的OTC等位基因中的G>A突变,以此实现长期修复。同时,针对鸟氨酸氨甲酰转移酶缺乏症基因治疗的多项临床试验也在招募阶段,包括Ⅲ期临床试验(NCT05345171)、Ⅰ/Ⅱ期临床试验(NCT05092685)[20]。通过LNP等非病毒载体递送mRNA,可有效纠正肝脏靶向和表型,包括鸟氨酸氨甲酰转移酶缺乏症[21]、精氨琥珀酸裂解酶缺乏症[22]和精氨酸酶缺乏症[23]。
然而,AAV的基因治疗在动物试验模型中也显示出明显的局限性,如CRISPR/Cas9编辑技术仅针对某些突变位点,而为了克服这个问题,wang等[6]和Cunningham等[24]研究开发了整个转基因整合策略,通过核酸酶介导的同源重组序列在宿主基因组的特定位点进行整合,且在鸟氨酸氨甲酰转移酶缺陷小鼠模型中得以验证其有效性。
2.有机酸血症:有机酸血症也称为有机酸尿症,是由于体内有机酸代谢过程中酶的功能缺陷,导致体内有机酸及其旁路代谢产物蓄积,从而引起的一类疾病[25]。目前,在甲基丙二酸血症、丙酸血症和遗传性酪氨酸血症Ⅰ型等致病基因治疗的临床前研究也取得重要进展,如AAV介导的基因编辑治疗在新生和幼年甲基丙二酸血症小鼠模型中均可纠正其临床表型[16,26],同时也进行了AAV介导的MUT基因Ⅰ/Ⅱ期临床试验(NCT04581785),但试验过程中因患者出现血栓性微血管病变等并发症而终止;LNP-mRNA基因治疗也在小鼠模型中取得一定进展[27],且正在招募Ⅰ/Ⅱ期临床试验(NCT04899310)患者。而在丙酸血症的基因治疗中,LNP递送PCCA-PCCB双基因mRNA也可纠正丙酸血症的临床表型[28],且正在招募Ⅰ/Ⅱ期临床试验(NCT04159103)患者。Dongho Choi团队[29]利用BE和PE成功纠正遗传性酪氨酸血症I型小鼠肝祖细胞,并通过再移植后延长小鼠存活时间。
3.肝豆状核变性:肝豆状核变性又称为Wilson病,是由于ATP7B基因缺陷导致的铜代谢障碍性疾病,目前主要以铜螯合剂和锌盐治疗为主。对于肝豆状核变性的基因治疗研究较为广泛,包括AAV8递送全长ATP7B基因治疗[7,30]、双AAV载体介导的ATP7B基因治疗[31]均在成年Wilson小鼠模型中获得了成功,同时目前针对肝豆状核变性的Ⅰ/Ⅱ期临床试验(NCT04537377、NCT04884815)也提示具有一定的临床疗效。
4.苯丙酮尿症:苯丙酮尿症是由于苯丙氨酸代谢途径中的酶缺陷,导致苯丙氨酸及其酮酸蓄积的代谢性疾病。目前对于苯丙酮尿症的基因治疗研究较为广泛,Vonada等[32]开发了体内慢病毒基因治疗策略,通过Cypor酶系统解决生长肝脏中AAV介导的转基因表达游离丢失的问题。通过AAV2/8载体递送CRISPR/Cas9可纠正苯丙酮尿症小鼠模型突变位点,但肝细胞编辑效率较低[33]。AAV介导的单碱基编辑器有效纠正了苯丙酮尿症小鼠的错义突变,并使体内苯丙氨酸水平正常化[11]。同时,LNP-mRNA介导的基因编辑也具有同样疗效[34-35]。
5.其他IMLD:(1)糖原累积病Ⅰa型是一种由于G6PC基因突变导致葡萄糖-6-磷酸酶活性不足,糖原在肝脏、肾脏和小肠中过度累积的常染色体隐性遗传病。AAV8介导的G6PC基因靶向肝脏治疗,可减少玉米淀粉的使用和维持血糖水平正常[36],目前正进行Ⅰ/Ⅱ期临床试验(NCT03517085)。mRNA治疗也在该疾病中具有纠正低血糖和减少肝脏肿瘤发生的疗效[37],其Ⅰ/Ⅱ期临床试验(NCT05095727)也正处于招募阶段。(2)Crigler-Najjar综合征是由胆红素尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)活性降低或缺乏所导致的非结合性高胆红素血症。研究者将GeneRide系统与靶向插入位点的CRISPR/Cas系统联合,在Crigler-Najjar综合征小鼠模型中将编辑效率提高20~50倍,且预测部位未观察到脱靶效应[38]。最近Généthon开发的基因疗法GNT0003,利用AAV8载体表达编码UGT1A1的转基因,有效降低患者血清胆红素水平[39]。(3)转甲状腺素蛋白淀粉样变性是由于TRR基因突变导致肝脏产生错误折叠的转甲状腺素蛋白而引起多脏器淀粉样变性。LNP递送TRR基因CRISPR/Cas9编辑(NTLA-2001)的Ⅰ/Ⅱ期临床试验结果提示患者血清中的转甲状腺素蛋白水平明显降低[40],并且已经进行Ⅲ期临床试验(NCT06128629)患者招募。(4)α1-抗胰蛋白酶缺乏症是以血清α1-抗胰蛋白酶缺乏为特征的遗传性疾病,可导致慢性肺脏和(或)肝脏疾病。研究发现通过同源定向修复校正突变基因可防止突变型α1-抗胰蛋白酶的积累,且校正后的肝细胞具有存活优势[41]。
四、存在问题和潜在解决方案
众所周知,基因治疗的递送需克服复杂的细胞和组织障碍,将遗传信息传递到靶细胞中,被校正的细胞数量或正常基因表达量均需足够多才能达到矫正缺陷的治疗作用。同时还需长期维持这些作用,逃避免疫或细胞内的清除机制。同时要考虑机体免疫反应、致癌性风险、高剂量载体毒性作用等。
1.免疫反应:目前大多数成功的用于临床前和临床研究的AAV仅限于天然的衣壳血清型,由于人类长期暴露于野生型AAV中,通常携带抗衣壳中和抗体,因此在临床上应用存在明显的局限性。抗AAV中和抗体的存在是全身输送的一个重要障碍,这些中和抗体干扰AAV进入靶细胞、细胞内运输和细胞核内的解包装,从而阻止了转导[42]。因此多种抑制AAV中和抗体的方法被开发,包括衣壳修饰、表面偶联和封装、血浆分离、B和(或)T细胞活化调节、IgG裂解蛋白酶等[43]。如通过雷帕霉素与AAV载体联合组装合成的疫苗可有效阻断抗衣壳介导的体液免疫和细胞免疫[44]。使用聚合物、脂类和水凝胶的表面栓系和包封均能保护AAV衣壳免受中和抗体的侵袭,使其能够逃避免疫系统的检测和抗体反应。最近有研究已经证明,通过将免疫球蛋白或人血清与共价偶联AAV颗粒的珠子孵育,可在体外去除中和抗体/因子[45]。
2.高载体剂量毒性:一些临床前研究发现了AAV载体引发的炎症反应,尤其是针对AAV高剂量给药。研究人员对恒河猴与仔猪予高剂量AAV9(2×1014vg/kg)后,出现转氨酶升高、肝衰竭和休克等不良反应[46]。Wilson团队[47]也指出了使用高剂量基因疗法的动物会导致肝脏和神经系统损伤。Audentes公司[48]主导的ASPIRO试验(NCT03199469)由于采用高剂量AAV病毒载体(3×1014vg/kg)治疗X连锁肌小管性肌病从而导致3例受试患者死亡。以上研究均证实AAV病毒载体高剂量使用有可能导致的不良后果。据报道AAV的肝毒性是由先天免疫反应或适应性免疫反应介导的常见不良事件,可通过免疫调节来缓解[49],同时这些并发症往往更易发生在已致病的肝脏中[48],因此高剂量载体的毒性背后的机制尚不清楚。
3.致癌风险:基因治疗的病毒载体有可能插入到人体的原癌基因中去并将其激活,从而导致癌症。一项历经十年针对患血友病的狗接受AAV基因治疗的研究发现,AAV的使用可能会增加肝癌风险的基因组变化[50],但具体致癌情况需要较长时间的随访观察。同时在一项X-连锁严重联合免疫缺陷临床试验中,受试者也出现白血病的并发症[51]。而在对1例经基因治疗的B型血友病患者发展为肝癌的事件调查中,发现该病毒载体不太可能是导致肝癌的原因[52]。因此,AAV载体是否真的会致癌仍是一个悬而未决的问题。目前AAV基因治疗相关的致癌风险多受病毒载体剂量、启动子活性和患者注射年龄等复杂因素的影响[8],其具体机制尚未完全清楚。
4.伦理风险:基因治疗技术的发展为目前无法治愈的IMLD等遗传疾病的治疗带来新希望,但也存在一定的伦理风险。因此,早在2015年华盛顿召开的人类基因编辑国际峰会上就明确指出“禁止出于生殖目的而使用基因编辑技术改变人类胚胎或生殖细胞”。而目前普通基因治疗针对的是体细胞,由于基因治疗导致的基因组变异不会遗传给下一代,所以伦理风险较小。目前进一步提高公众对基因治疗的认识,不断完善知情同意制度,完善相关法律法规,加强国家对基因编辑的监管审批,才能实现基因治疗在人类疾病更好的应用。
五、总结与展望
目前针对IMLD的基因治疗取得了巨大进展,包括病毒载体、非病毒载体等的不断更新换代都为各种IMLD基因治疗提供了更安全的选择。对载体与宿主相互作用、基因治疗存在的局限性和问题日益了解,都为完善和改进下一代基因治疗载体提供了新见解。随着递送技术和基因编辑技术的改进,未来将有更多IMLD患者受益于基因治疗。
