中性粒细胞与淋巴细胞比值、D-二聚体、白细胞介素-6、干扰素-γ对急性Stanford B型主动脉夹层患者院内死亡风险的预测效能
2024-05-08薛才广江昆宋伟程思强郭建
薛才广 江昆 宋伟 程思强 郭建
急性Stanford B型主动脉夹层(AADB)是一种较为严重的大血管病变,据统计,所有AADB患者中超过70%为高危患者,其院内总死亡率高达27%以上,临床防治工作难度较大[1-3]。有研究显示,中性粒细胞与淋巴细胞比值(NLR)是反映机体炎症反应的指标[4-6],主动脉夹层发生后会导致机体产生一系列应激反应,导致NLR升高[7]。D-二聚体(D-D)水平升高提示机体血流动力学障碍,与AADB发生发展密切相关[8]。白细胞介素(IL)-6在炎症免疫反应中具有重要作用,是心血管病变的炎症标志物[9-10]。另有研究指出,干扰素(IFN)-γ过多表达能加快血管壁中炎症因子聚集,从而加重血管炎症反应,在心血管疾病发生、发展中发挥促进作用[11]。因此,本研究主要探讨NLR、D-D、IL-6、IFN-γ对AADB患者院内死亡风险的预测效能,以期为临床防治工作提供参考依据。
对象与方法
1.对象:选取2018年7月~2023年5月于我院就诊的AADB患者86例。纳入标准:(1)经主动脉CT血管造影检查证实为AADB;(2)符合AADB相关诊断标准[12];(3)首次发病。排除标准:(1)A型主动脉夹层;(2)复发性AADB;(3)由于外伤、穿透性溃疡性疾病等其他原因引起的主动脉损伤;(4)合并恶性肿瘤。根据院内终点事件发生情况,将所有患者分为存活组71例和死亡组15例。本研究经我院伦理委员会审核批准(2018-001-02),所有患者均签署知情同意书。
2.方法
(1)治疗方法:所有患者入院后均给予标准内科药物治疗:①镇静镇痛:哌替啶100 mg或吗啡5~10 mg静脉注射,必要时可间隔6~8 h给药1次;②降低心率和血压:β受体阻滞剂或α受体阻滞剂是最基础的药物治疗;若降压效果欠佳,可联合应用钙离子通道阻滞剂,血压控制的目标是将平均动脉压(MAP)维持在60~70 mmHg,收缩压(SBP)降至100~130 mmHg为宜,心率(HR)控制的目标在60~80次/分。同时,在此基础上进行胸主动脉腔内修复术治疗。
(2)一般临床资料收集:利用患者入院的电子病历、病程记录单收集临床资料,包括年龄、性别、BMI、病史(包括糖尿病、高血压、冠心病、动脉粥样硬化)、吸烟史、饮酒史、HR、左心室射血分数(LVEF)、SBP、舒张压(DBP)及实验室检查指标[WBC计数、PLT计数、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)]。
(3)NLR、D-D、IL-6、IFN-γ检测方法:均于所有患者确诊AADB后采集外周静脉血3~5 ml(2份),1份置于抗凝管中用于检测中性粒细胞及淋巴细胞计数,计算NLR;1份置于离心管中,采用美国Thermo公司的低温高速离心机进行离心处理,离心半径为10 cm,离心速度为3 500 r/min,离心10 min后取血清,保存于-70 ℃冰箱中,备用。采用酶联免疫吸附试验检测IL-6、IFN-γ水平,采用stago和ACLTOP 750仪器、应用免疫比浊法检测D-D水平。
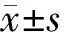
结 果
1.两组患者一般临床资料比较:两组患者性别、年龄、BMI、糖尿病史、高血压史、冠心病史、动脉粥样硬化史、饮酒史、TC、TG、LDL-C、HDL-C及LVEF比较差异均无统计学意义(P>0.05)。死亡组吸烟史患者比例及WBC计数、SBP、DBP、HR均高于存活组,PLT计数低于存活组(P<0.05)。见表1。
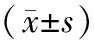
表1 两组患者一般临床资料比较
2.两组患者NLR、D-D、IL-6、IFN-γ水平比较:因死亡组在入院第1 d就出现死亡病例,故仅比较入院时两组患者NLR、D-D、IL-6、IFN-γ水平。死亡组患者入院时NLR、D-D、IL-6、IFN-γ水平均高于存活组(P<0.05),见表2。
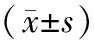
表2 两组患者入院时NLR、D-D、IL-6、IFN-γ水平比较
3.AADB患者院内死亡的影响因素分析:Cox回归分析结果显示,吸烟史、WBC计数、PLT计数、SBP、DBP、HR、NLR、D-D、IL-6、IFN-γ均为AADB患者院内死亡的独立危险因素(P<0.001),见表3。校正吸烟史、WBC计数、PLT计数、SBP、DBP、HR等因素后,NLR(HR=1.529,95%CI1.620~13.127)、D-D(HR=1.804,95%CI2.091~17.642)、IL-6(HR=1.393,95%CI1.296~12.516)、IFN-γ(HR=1.237,95%CI1.182~10.041)仍为AADB患者院内死亡的独立危险因素(P<0.001)。
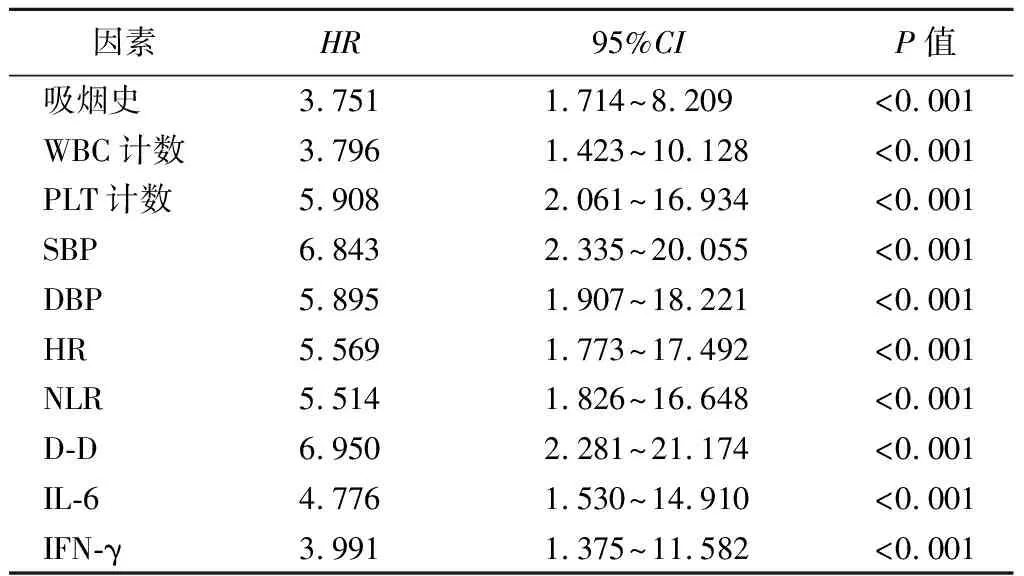
表3 AADB患者院内死亡影响因素的Cox回归分析
4.NLR、D-D、IL-6、IFN-γ对AADB患者院内死亡的预测效能:ROC曲线分析结果显示,NLR预测AADB患者院内死亡的ROC曲线下面积(AUC)为0.835(95%CI0.739~0.906),约登指数为0.659,最佳截断值为10.39,敏感度为80.00%,特异度为85.92%;D-D预测AADB患者院内死亡的AUC为0.798(95%CI0.697~0.877),约登指数为0.554,最佳截断值为8.86 ng/L,敏感度为66.67%,特异度为88.73%;IL-6预测AADB患者院内死亡的AUC为0.811(95%CI0.713~0.888),约登指数为0.571,最佳截断值为15.39 pg/ml,敏感度为86.67%,特异度为70.42%;IFN-γ预测AADB患者院内死亡的AUC为0.756(95%CI0.652~0.841),约登指数为0.483,最佳截断值为2.75 ng/L,敏感度为93.33%,特异度为54.93%。将NLR、D-D、IL-6、IFN-γ进行logistic二元回归拟合,返回预测概率Logit(P)作为独立检验变量,获取NLR、D-D、IL-6、IFN-γ联合预测AADB患者院内死亡的AUC为0.919(95%CI0.840~0.946),约登指数为0.694,敏感度为93.33%,特异度为76.06%,优于各指标单独的预测效能。
5.NLR、D-D、IL-6、IFN-γ阳性表达对AADB患者院内死亡风险的影响:根据NLR、D-D、IL-6、IFN-γ最佳截断值(10.39、8.86 ng/L、15.39 pg/ml、2.75 ng/L)分为阳性(≥最佳截断值)与阴性(<最佳截断值)表达。NLR、D-D、IL-6、IFN-γ阳性表达AADB患者院内死亡率均高于对应指标阴性表达患者[54.55%(12/22)比4.69%(3/64)、55.56%(10/18)比7.35%(5/68)、38.24%(13/34)比3.85%(2/52)、30.43%(14/46)比2.50%(1/40),χ2=24.907、19.740、16.884、11.595,P均<0.001]。RR分析结果显示,NLR、D-D、IL-6、IFN-γ阳性表达均显著增加AADB患者的院内死亡风险(P<0.001)。见表4。
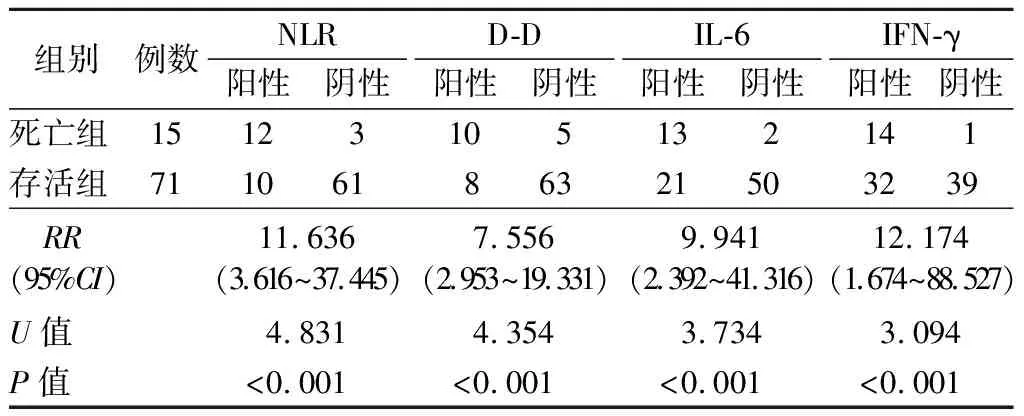
表4 NLR、D-D、IL-6、IFN-γ阳性表达对AADB患者院内死亡风险影响的RR分析(例)
讨 论
既往研究指出,NLR越高,心血管不良事件发生风险越大,NLR可作为反映心血管疾病病情的辅助指标[13]。亦有研究结果显示,AADB患者NLR较高,与AADB发生及病情程度有关[14]。本研究结果显示,死亡组患者NLR高于存活组,且NLR是AADB患者院内死亡的独立危险因素。因为主动脉壁损伤会引起较为严重的炎症反应,刺激机体产生过多的炎症因子,导致NLR显著升高,高NLR意味着机体的炎症负荷增加,而炎症负荷过重的状态下大量聚集的炎症因子会浸润主动脉壁,加重主动脉壁损伤,并诱导主动脉壁平滑肌细胞凋亡,降低主动脉内膜弹性,加速主动脉扩张[15]。同时,在AADB诱发机体应激反应时会激活下丘脑-垂体-肾上腺轴,诱导皮质醇分泌增多,从而促使中性粒细胞过多合成,淋巴细胞减少合成,进而导致NLR异常升高[16]。进一步分析发现,NLR预测AADB患者院内死亡的效能良好,NLR阳性表达显著增加AADB患者的院内死亡风险,表明NLR可作为早期预测AADB患者院内死亡风险的重要指标。
D-D能直接反映机体凝血功能和纤溶活性。已有报道指出,与急性心肌梗死患者相比,主动脉夹层患者D-D水平更高,与主动脉夹层累及血管范围更大,诱发的高凝状态和继发性纤溶反应更严重有关[17]。潘小高等[18]研究结果显示,发生院内死亡的急性主动脉夹层患者入院时D-D水平高于生存患者。在此基础上,本研究结果显示,死亡组患者D-D水平高于存活组,且为AADB患者院内死亡的独立危险因素。究其原因,AADB能通过激活内、外源性凝血系统促进主动脉真腔与假腔内血栓形成,病情越严重,血栓形成越快,纤溶系统活性越高,导致D-D水平呈不断升高趋势[19-20]。且AADB会导致主动脉破口处血管内膜暴露,促使血管内皮细胞因子被过多释放,诱发并加重凝血级联反应和继发性纤溶反应,最终加速病情恶化,增加死亡风险[21]。本研究ROC曲线分析结果显示,D-D能有效预测AADB患者院内死亡风险,其阳性表达显著增加AADB患者院内死亡风险,提示D-D具有良好的阈值效应,能为临床制定防治措施提供有效的指导信息。
IL-6是一种由B淋巴细胞、T淋巴细胞、单核/巨噬细胞分泌的糖蛋白,在多种血管炎症性疾病、心血管疾病的炎症血栓形成中扮演重要角色[22-23]。相关研究结果表明,炎症血栓状态是AADB发生、发展的重要机制之一[24]。IFN-γ是一种与炎症免疫相关的细胞因子,主要由自然杀伤(NK)细胞、辅助性T细胞1(Th1细胞)、B细胞分泌。张霍等[25]的研究结果显示,AADB患者治疗前IFN-γ水平呈异常升高趋势,经带膜血管内支架植入术治疗后明显下降,可见IFN-γ水平与AADB患者治疗情况有关。在校正其他因素前后,IL-6、IFN-γ均为AADB患者院内死亡的独立危险因素。分析原因如下,IL-6除具有促炎作用外,其还能通过上调基质金属蛋白酶(MMPs)表达,增加周围静脉中MMPs含量,从而加速主动脉中层蛋白聚糖、弹力蛋白及胶原蛋白等物质的溶解,从而加快主动脉血管重塑,导致主动脉损伤不断加重,进而使患者死亡风险上升[26-27]。IFN-γ能通过加快促炎介质分泌、加速血管壁中炎症细胞因子聚集的途径促进AADB患者血管炎症反应进展;在血管壁炎症部位聚集的炎症细胞会过多释放IFN-γ,导致血管局部扩张、局部血流速度减缓,致使血液聚集于假腔血管内,加重AADB损伤[28-29]。本研究结果也表明,IL-6、IFN-γ在预测AADB患者院内死亡方面具有良好的预测效能和阈值效应。
此外,本研究结果显示,NLR、D-D、IL-6、IFN-γ联合预测AADB患者院内死亡的AUC高达0.919,高于各指标单独预测的AUC,可作为临床优选的预测方式,但样本量偏少,可能存在一定偏倚,不能忽视NLR、D-D、IL-6、IFN-γ阴性表达AADB患者的院内死亡风险,将来需进一步探讨以获取更可靠的数据支持。
综上,NLR、D-D、IL-6、IFN-γ是AADB患者院内死亡的独立预测因子,其阳性表达显著增加AADB患者的院内死亡风险,4者联合具有可靠的预测效能,对临床提高AADB患者院内存活率具有重要的指导意义。
