重组人胸腺素β4对急性放射损伤小鼠多组织中炎症小体和凋亡相关基因表达的影响
2024-05-07王勇懿叶雨萌李小宇王雪佳段敏杨雪枫左红艳郝延辉李杨周平坤
王勇懿,叶雨萌,李小宇,王雪佳,段敏,杨雪枫,左红艳,郝延辉,李杨,周平坤
(1.南华大学公共卫生学院,湖南衡阳 421200;2.军事科学院军事医学研究院辐射医学研究所,北京 100850)
放射损伤主要发生于临床肿瘤放疗和多种核辐射突发事件。基于肠、肺和脑的生理功能及其组织的放射敏感性,其放射损伤及防治受到关注[1]。小肠为电离辐射高度敏感组织,肺和脑分别为中度和低敏感组织[2-4]。放射性小肠损伤导致消化、吸收功能和肠免疫屏障功能下降,引起一系列并发症甚至死亡[5]。放射性肺纤维化为放射病的非随机性远后效应之一,严重者也可导致呼吸衰竭而死亡。放射性脑损伤能引起脑组织长期慢性炎症反应,持续的炎症反应导致神经元功能障碍和细胞死亡[6]。
抗放射药物主要分为放射保护剂、放射缓解剂和放射治疗药物[7]。放射保护剂指机体在受照射前使用能够缓解放射对机体造成损伤的药物,如含硫化合物氨磷汀(amifostine)等[8]。放射缓解剂需要在受照后24 h 内使用,减轻放射损伤,如帕利夫明(palifermin)[9]等。放射后的救治药物称为放射治疗药物,美国食品和药物管理局批准的4 种放射治疗药物为非格司亭(filgrastim)、硫培非格司亭(mecapegfilgrastim)、沙格司亭(sargramostim)和罗米司亭(romiplostim),其发挥治疗作用的关键在于促进造血功能恢复[10-11]。放射导致机体多组织多类型损伤,造血系统的功能恢复为放射损伤治疗的关键环节之一,但寻找其他机制的放射治疗药物仍至关重要。
重组人胸腺素β4(recombinant human thymosin β4,rh-Tβ4)是我国具有自主知识产权的重组蛋白。前期研究表明,rh-Tβ4 能够减轻电离辐射所致细胞DNA 损伤,进而抑制细胞凋亡,并促进照射后细胞增殖,减轻炎症,其作用机制尚未阐明[22]。PCR 芯片从技术上以其高通量、高准确性、高速和少污染等优势解决了传统核酸检测技术操作繁杂、检测效率低等不足,且具有通路特异性,能针对某通路或某生物学过程筛选出特异差异基因及差异通路[12-14]。炎症小体和凋亡PCR 芯片可以检测放射及给药后相关的炎症小体和凋亡相关基因的表达水平。本研究选择放射敏感程度不同的小肠、肺和脑3 个组织作为主要研究对象,通过炎症小体及凋亡PCR 功能分类基因芯片初步探讨rh-Tβ4 对急性放射多组织损伤的治疗作用及其可能机制,并筛选有价值的并需进行深入机制研究的分子靶点。
1 材料与方法
1.1 药物、主要试剂和仪器
rh-Tβ4冻干粉剂(每支0.1 mg),纯度>95%,生物学活性为1.51,每支内毒素含量<1 EU,批号:C20210401,由北京诺思兰德生物技术股份有限公司生产。用生理盐水配制成0.1 g·L-1原液,临用前用生理盐水稀释至0.4 mg·L-1备用。
放射免疫沉淀测定(radio-immunoprecipitation assay,RIPA)裂解液,中国Bioworld公司;蛋白酶抑制剂,美国Bimake 公司;Trizol(R411-01)、逆转录试剂盒(Q712)和PCR试剂盒(R233-01),南京诺唯赞生物技术有限公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、转化生长因子β(transforming growth factor-β,TGF-β)、白细胞介素4(interleukin-4,IL-4)、IL-13 和IL-18 放射免疫检测试剂盒,福瑞润泽生物技术有限公司;炎症小体及凋亡功能分类PCR芯片,上海卓灏医药科技有限公司;使用Primer 5 软件设计扩增基因引物,引物序列(表1)由上海卓灏医药科技有限公司合成。实时荧光定量PCR(RT-qPCR)仪(CFX Opus 96),伯乐生命医学产品(上海)有限公司。
Tab.1 Primer sequences for real-time quantiative PCR(RT-qPCR)
1.2 动物、分组和处理
90 只SPF 级雄性C57BL/6N 小鼠,体重20~22 g,北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006,饲养于军事医学研究院实验动物中心(温度22~23 ℃,湿度40%)。将小鼠随机均分为3组:正常对照组、模型组、模型+rh-Tβ4 5 μg·kg-1组,每组25只。
小鼠装入电离辐射专用照射盒中,模型组和模型+rh-Tβ4 组小鼠采用60Co-γ 射线单次照射,照射剂量为8 Gy,靶距为4 m,剂量率59.84 cGy·min-1。将正常对照组置于相同时间和条件下假照射。
照射后24 h ip给予rh-Tβ4 5 μg·kg-1,每天1次,连续3 d。正常对照组和模型组给予等体积生理盐水。
1.3 组织样品制备
照射后第3,7 和11 天进行取材,每组每时间点随机选5 只小鼠,根据体重ip给予0.5%戊巴比妥钠麻醉后处死,取全脑、全肺和全小肠并用生理盐水洗净,滤纸吸干水分后,取右脑、右肺和空肠2 cm(幽门下11 cm)用于细胞因子检测;取左脑、左肺、空肠1 cm(幽门下10 cm)用于PCR 功能分类基因芯片检测;组织样品均冻存于液氮中备用。细胞因子检测和炎症小体PCR 芯片差异基因验证实验的取材时间点为照射后第11 天,凋亡PCR 芯片差异基因验证实验的取材时间点为照射后第3,7和11天。
1.4 放射免疫法检测小鼠脑、肺和小肠组织中细胞因子TNF-α,lL-4,lL-13,lL-18和TGF-β含量
取1.3 制备的组织样品,称重,按照1∶10 加入RIPA 裂解液(含10%蛋白酶抑制剂),并用超声仪将组织震碎,离心(15 294×g,10 min)后取上清液。根据说明书,用放射免疫试剂盒检测TNF-α,IL-4,IL-13,IL-18和TGF-β含量。
1.5 PCR 功能分类基因芯片检测小鼠炎症小体及凋亡相关差异基因
取1.3 制备的组织样品,采用Trizol 法提取RNA,反转录得到cDNA,加入荧光定量PCR 扩增试剂(染料法)550 μL,cDNA 10 ng,无RNA 酶纯水补至总体积1100 μL;将上述混合液加到PCR 芯片各孔,室温离心;后将芯片置于RT-qPCR 仪进行PCR反应。程序设置如下:聚合酶激活/变性95 ℃,30 min后,扩增40个循环(95 ℃,15 s;60 ℃,1 min)。使用多个内源参考基因β 肌动蛋白(β-actin,ACTB)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,DAPDH)、次黄嘌呤磷酸核糖转移酶(hypoxanthine phosphoribosyltransferase,HPRT)、核糖体蛋白侧柄亚基P1(ribosomal protein lateral stalk subunit P1,RPLP1)和葡萄糖醛酸酶β(glucuronidase beta,GUSB)对mRNA 表达水平进行标准化,通过2-ΔΔCt法计算每组基因表达倍数变化。P<0.05 且差异倍数>1.5 确定为差异基因。
1.6 RT-qPCR验证差异表达基因
取1.3 制备的组织样品,用Trizol 法提取组织RNA,反转录得到cDNA,加入2×TaqPro Universal SYBR qPCR Master Mix 10 μL,cDNA 1 μL,正反引物1 μL,无RNA酶水补至总体积20 μL;将配制好的反应体系放入qPCR仪中进行反应,反应程序为:95 ℃30 s;95 ℃10 s,60 ℃30 s,循环40 次;65 ℃5 s;95 ℃,5 s。用GAPDH为内参,通过2-ΔΔCt方法计算待测基因相对表达水平。
1.7 统计学分析
实验结果数据以±s表示,应用SPSS19.0 软件进行统计分析。细胞因子和RT-qPCR 结果分析采用单因素方差分析,两两比较采用LSD 法;PCR基因芯片结果分析采用t检验。P<0.05为具有统计学差异。
2 结果
2.1 rh-Tβ4对照射后小鼠小肠、肺和脑组织炎症细胞因子TNF-α,TGF-β,lL-4,lL-13和lL-18含量的影响
与正常对照组相比,模型组小鼠小肠、肺及脑组织中细胞因子TNF-α,TGF-β 和IL-18 含量显著升高(P<0.05,P<0.01),IL-4 和IL-13 含量无明显变化;与模型组相比,模型+rh-Tβ4 组小鼠小肠、肺及脑组织中TNF-α含量显著降低(P<0.05),小肠和脑组织中TGF-β 和IL-18 含量显著降低(P<0.05,P<0.01),且与正常对照组无明显差异(图1)。

Fig.1 Effect of recombinant human thymosin β4(rh-Tβ4)on contents of TNF-α(A),TGF-β(B),lL-4(C),lL-13(D)and lL-18(E)in small intestine,lung and brain tissues of mice after irradiation.C57BL/6N mice were randomly divided equally into 3 groups:normal control group,model group,and model+rh-Tβ4 5 μg·kg-1 group.Mice in the model and model+rh-Tβ4 groups were radiated with 60Co-γ rays in a single exposure at a dose of 8 Gy,and the mice in normal control group were placed under sham irradiation at the same time and under the same conditions.The mice in model+rh-Tβ4 group were ip administered rh-Tβ4 5 μg·kg-1 24 h after irradiation,once a day for 3 consecutive days.Equal volumes of saline were given to the mice in normal control and model groups.Mice were sacrificed on day 11 after irradiation,and the right brain,right lung,and 2 cm of jejunum(11 cm below the pylorus)were removed for cytokine detection.±s,n=5.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.2 rh-Tβ4 对照射后小鼠炎症小体通路相关基因表达的影响
2.2.1 小肠组织
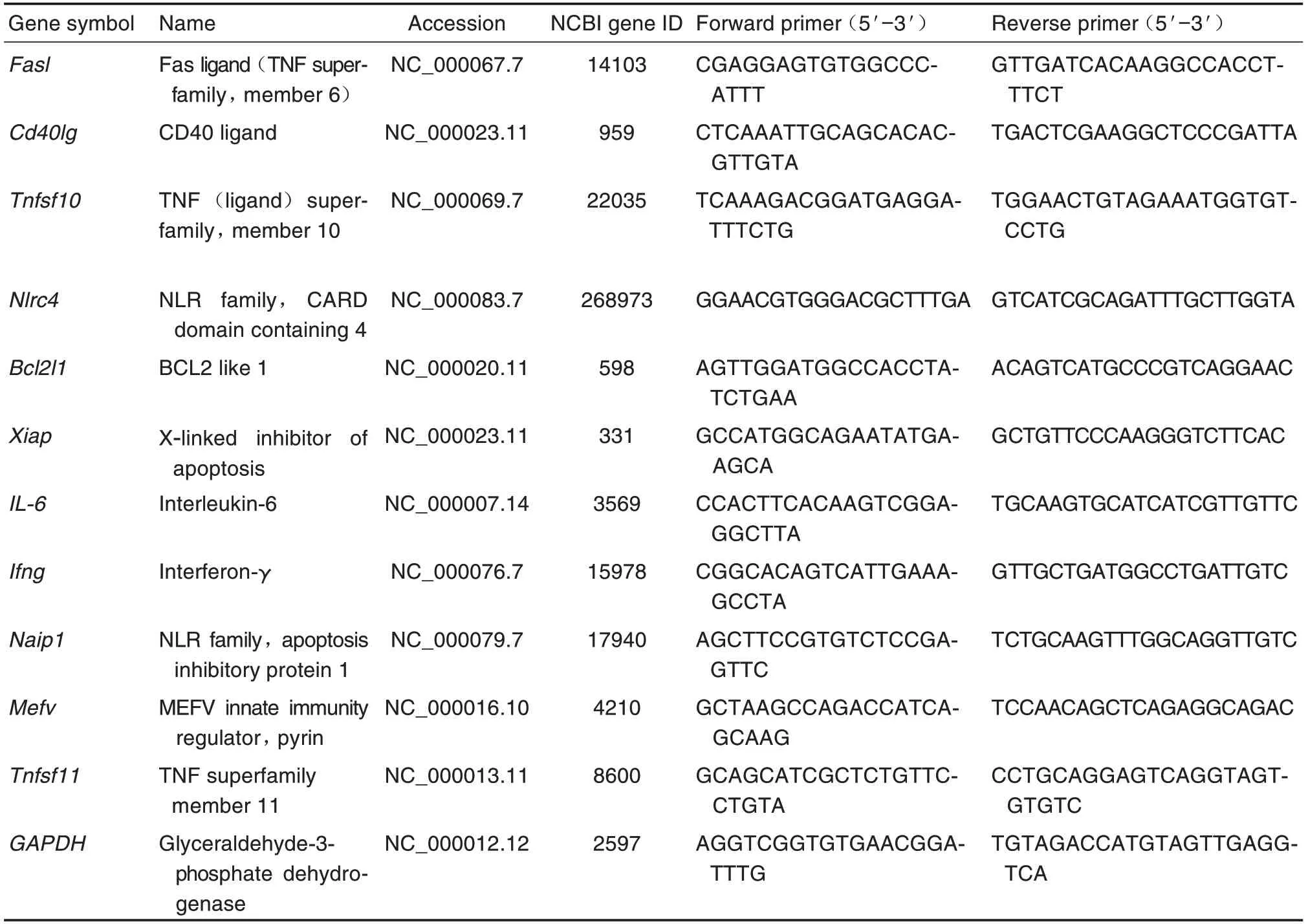
与正常对照组相比,模型组小鼠小肠组织中差异基因共13 个:上调基因3 个,其中Ccl12和Ccl7为NOD-样受体下游信号通路基因,IL-18属于炎症小体下游信号基因;下调基因10个,其中Nlrc4是炎症小体相关基因,P2rx7是其下游信号基因,Bcl2l1为炎症小体负调节基因,Irf4,Ccl5,Chuk,Birc3,Xiap,Mapk3和Mapk8属于NOD-样受体下游信号基因。模型+rh-Tβ4 组上调基因3 个,其中Casp12为炎症小体相关基因,Bag3和Bax是其下游信号基因;下调基因2 个,Bak1和Casp8属于下游信号基因。与模型组相比,模型+rh-Tβ4组下调基因1个,为Ciita,属于NOD-样受体(表2,图2)。
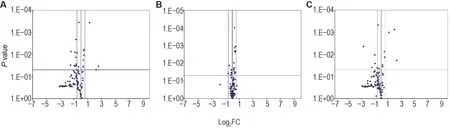
Fig.2 Volcano plot of effect of rh-Tβ4 on expressions of inflammasome-related genes in small intestinal tissues of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed on day 11 after irradiation,and 1 cm of jejunum(10 cm below the pylorus)was removed for inflammasome PCR gene chip assay.Significant difference was defined as P<0.05,and a fold change(FC)>1.5 was used as a criterion for differential gene determination.A:model group compared to normal control group;B:model+rh-Tβ4 group compared to model group;C:model+rh-Tβ4 group compared to normal control group.

Tab.2 Effect of rh-Tβ4 on expressions of inflammasome-related genes in small intestinal tissue of mice after irradiation
2.2.2 肺组织
与正常对照组相比,模型组小鼠肺组织中差异基因共9个:上调基因7个,其中Nod2属于NOD-样受体,Ccl12,Cflar,Chuk,Mapk8,Mok和Notch1是其下游信号基因;下调基因2 个,其中Ccl5为NOD-样受体下游信号通路基因,Tnfsf14属于炎症小体负调节基因。模型+rh-Tβ4 组上调基因1 个,为Bag3,属于炎症小体下游信号基因;下调基因2 个,为Mif和Trp53,属于炎症小体下游信号基因。与模型组相比,模型+rh-Tβ4 组上调基因4 个,Nlrp12和Nlrp9b属于NOD-样受体,IL-6和Tnf是其下游信号基因(表3,图3)。
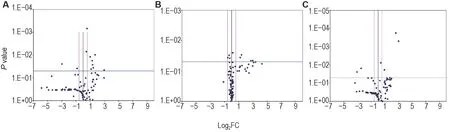
Fig.3 Volcano plot of effect of rh-Tβ4 on expressions of inflammasome-related genes in lung tissues of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed on day 11 after irradiation,and the left lung was removed for inflammasome PCR gene chip assay.Significant difference was defined as P<0.05,and FC>1.5 was used as a criterion for differential gene determination.A:model group compared to normal control group;B;model+rh-Tβ4 group compared to model group;C:Model+rh-Tβ4 group compared to normal control group.

Tab.3 Effect of rh-Tβ4 on expressions of inflammasome-related genes in lung tissues of mice after irradiation
2.2.3 脑组织
与正常对照组比较,模型组小鼠脑组织中差异基因共11 个,上调基因10 个,其中Naip1属于炎症小体相关基因,Ifng是其下游信号基因,Tnfsf11,Tnfsf4和Mefv属于炎症小体负调节基因,Nlrp4b,Nlrp4e,Nlrp5和Nlrp9b属于NOD-样受体,IL-6是其下游信号基因;下调基因Ciita属于NOD-样受体。模型+rh-Tβ4 组上调基因1 个,Igf1r属于炎症小体下游信号基因,下调基因2 个,Bcl2l1属于炎症小体负调节基因,Trp53属于炎症小体下游信号基因。与模型组相比,模型+rh-Tβ4 组有20 个差异基因,全部为下调基因,其中Naip1和Naip5属于炎症小体相关基因,Ifng,IL-12b,IL-1b和Irf4是其下游信号基因,Cd40lg,Tnfsf11,Tnfsf14,Tnfsf4和Mefv属于炎症小体负调节基因,Nlrp12,Nlrp4b,Nlrp4e,Nlrp5和Nlrp9b属于NOD-样受体,Ifnb1,IL-6和Tnf是其下游信号基因(表4,图4)。
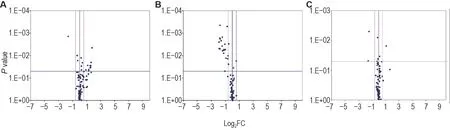
Fig.4 Volcano plot of effect of rh-Tβ4 on expressions of inflammasome-related genes in brain tissue of mice after irradiation.See Fig.1 for the mouse treatment.Mice were executed on day 11 after irradiation and the left brain was removed for inflammasome PCR gene chip assay.Significant difference was defined as P<0.05,and FC>1.5 was used as a criterion for differential gene determination.A:model group compared to normal control group;B:model+rh-Tβ4 group compared to model group;C:model+rh-Tβ4 group compared to normal control group.

Tab.4 Effect of rh-Tβ4 on expressions of inflammasome-related genes in brain tissues of mice after irradiation
2.3 炎症小体PCR芯片差异基因验证
根据炎症小体基因芯片筛选出的差异基因及其功能,小肠、肺和脑组织各选择3 个基因进行验证。小肠选择炎症小体相关基因Nlrc4、炎症小体负向调节基因Bcl2l1和NOD-样受体下游信号基因Xiap;肺组织选择NOD-样受体下游信号基因IL-6,Tnf和炎症小体下游信号基因Ifng;脑组织选择炎症小体相关基因Naip、负向调节基因Mefv和Tnfsf11。
2.3.1 小肠组织
与正常对照组相比,模型组小鼠小肠组织中Nlrc4mRNA 表达显著上调(P<0.01);模型+rh-Tβ4组无显著差异,且与模型组相比亦无显著差异;与PCR 芯片结果不一致。与正常对照组相比,模型组Bcl2l1mRNA表达显著降低(P<0.01);模型+rh-Tβ4组无显著差异,但较模型组显著上调(P<0.05);与PCR 芯片结果一致。与正常对照组相比,模型组XiapmRNA 表达有升高趋势,模型+rh-Tβ4 组较模型组有下调趋势,但均无显著性差异,与PCR 芯片结果不一致(图5A)。
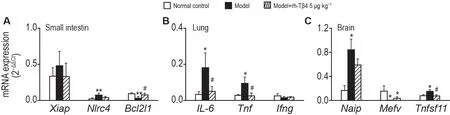
Fig.5 Effect of rh-Tβ4 on inflammasome-related genes in small intestine(A),lung(B)and brain(C)tissues of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed on day 11 after irradiation,and the left brain,left lung,and 1 cm of jejunum(10 cm below the pylorus)were removed for inflammasome PCR microarray differential gene validation.±s,n=5.*P<0.05,**P<0.01,compared with the normal control group;#P<0.05,compared with model group.
2.3.2 肺组织
与正常对照组相比,模型组小鼠肺组织中IL-6mRNA 表达显著上调(P<0.05);模型+rh-Tβ4 组无显著差异,但较模型组显著下调(P<0.05);与PCR芯片结果不一致。与正常对照组相比,模型组小鼠肺组织中TnfmRNA 表达显著上调(P<0.05);模型+rh-Tβ4组无显著差异,但较模型组显著下调(P<0.05);与PCR 芯片结果不一致。与正常对照组相比,模型和模型+rh-Tβ4 组Ifng表达均无显著差异,与PCR芯片结果不一致(图5B)。
2.3.3 脑组织
与正常对照组相比,模型组及模型+rh-Tβ4 组小鼠脑组织中MefvmRNA 表达显著下调(P<0.05),模型+rh-Tβ4 组较模型组无显著差异,与PCR 芯片结果一致。与正常对照组相比,模型组小鼠脑组织中NaipmRNA 表达显著上调(P<0.05);模型+rh-Tβ4 组无显著差异,较模型组亦无显著差异;与基因芯片结果一致。与正常对照组相比,模型组脑组织中Tnfsf11mRNA 表达显著上调(P<0.05);模型+rh-Tβ4 组无显著差异,但较模型组显著下调(P<0.05);与PCR芯片结果一致(图5C)。
2.4 rh-Tβ4 对照射后小鼠凋亡相关基因表达的影响
采用凋亡PCR芯片分析了84个参与细胞凋亡的关键基因的表达。该芯片包括TNF 配体及其受体、死亡结构域、死亡效应结构域以及P53 和DNA损伤途径中涉及的基因。
2.4.1 小肠组织
与正常对照组相比,模型组小鼠小肠组织中差异表达基因共3 个,全部为上调基因,Birc5为抗凋亡基因,Cideb为DNA 损伤基因,Tnfsf10b为死亡域受体;模型+rh-Tβ4 组差异基因共10 个,上调基因Bax和Casp14为促凋亡基因,下调基因Casp1,Casp4和Casp7为促凋亡基因,Naip1,Pycard和Tnfsf10为抗凋亡基因。与模型组相比,模型+rh-Tβ4组无差异基因(表5,图6)。

Fig.6 Volcano plot of effect of rh-Tβ4 on expressions of apoptosis-related genes in small intestinal tissues of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed on day 11 after irradiation and 1 cm of jejunum(10 cm below the pylorus)was used for apoptosis PCR microarray assay.Significant difference was defined as P<0.05,and FC>1.5 was used as a criterion for differential gene determination.A:model group compared to normal control group;B;model+rh-Tβ4 group compared to model group;C:model+rh-Tβ4 group compared to normal control group.

Tab.5 Effect of rh-Tβ4 on apoptosis-related gene expressions in small intestinal tissues of mice after irradiation
2.4.2 肺组织
与正常对照组相比,模型组小鼠肺组织中差异表达基因共6 个:上调基因Bax为促凋亡基因,Tnfsf10b为死亡域受体基因;下调基因Birc5和Cd40lg为抗凋亡基因,Casp1和Fasl属于促凋亡基因。模型+rh-Tβ4组差异基因共4个,上调基因Bax为促凋亡基因,Tnfrsf10b为死亡域受体基因,下调基因Birc5和Cd40lg为抗凋亡基因。与模型组相比,模型+rh-Tβ4组较模型组无差异基因(表6,图7)。
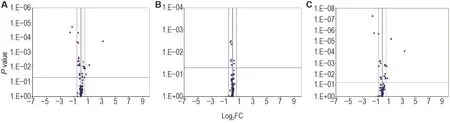
Fig.7 Volcano plot of effect of rh-Tβ4 on expressions of apoptosis-related genes in lung tissues of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed on day 11 after irradiation,and the left lung was taken for apoptosis PCR microarray detection.Significant difference was defined as P<0.05,and FC>1.5 was used as a criterion for differential gene determination.A:model group compared to normal control group;B:model+rh-Tβ4 group compared to model group;C:model+rh-Tβ4 group compared to normal control group.

Tab.6 Effect of rh-Tβ4 on apoptosis-related gene expressions in lung tissue of mice after irradiation.
2.4.3 脑组织
与正常对照组相比,模型组脑组织中差异表达基因共12 个,上调基因Bax和Casp14属于促凋亡基因;下调基因IL-10,Cd40lg,Naip1,Pycard,Tnfsf10和Traf属于抗凋亡基因,Fasl属于促凋亡基因。模型+rh-Tβ4 组差异基因共1 个,上调基因Tnfrsf10b,为死亡域受体基因。与模型组相比,模型+rh-Tβ4 组有4 个上调差异基因Cd40lg,Nr2e1,Trp73和Lhx4,均属于抗凋亡基因(表7,图8)。
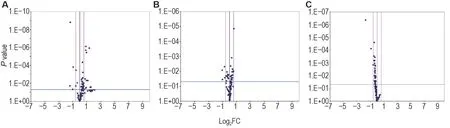
Fig.8 Volcano plot of effect of rh-Tβ4 on expressions of apoptosis-related genes in brain tissue of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed day 11 after irradiation,and the left brain was taken for apoptosis PCR microarray.Significant difference was defined as P<0.05,and FC>1.5 was used as a criterion for differential gene determination.A:model group compared to normal control group;B:model+rh-Tβ4 group compared to model group;C:model+rh-Tβ4 group compared to normal control group.

Tab.7 Effects of rh-Tβ4 on apoptosis-related gene expressions in brain tissue of mice after irradiation
2.5 凋亡PCR芯片差异表达基因验证
由于凋亡芯片取材时间为照射后11 d,检测出差异表达基因较少,故验证时增加了照射后3 和7 d 2 个时间点,验证凋亡PCR 芯片筛选出的抗凋亡差异表达基因Tnfsf10和Cd40lg及促凋亡差异表达基因Fasl。
2.5.1 Tnfsf10
小肠组织:照射后3 d,模型组和模型+rh-Tβ4组Tnfsf10mRNA 表达较正常对照组显著下调(P<0.01),其他时间点各组无差异,与PCR 芯片结果不一致(图9A)。
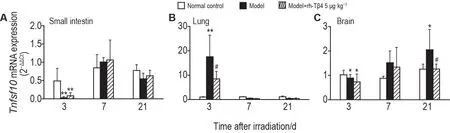
Fig.9 Effect of rh-Tβ4 on Tnfsf10 gene expression in small intestine(A),lung(B),and brain(C)tissues of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed on day 3,7,and 11 after irradiation,and the right brain,right lung,and 1 cm of jejunum(10 cm below the pylorus)were removed for apoptosis PCR microarray differential gene validation.±s,n=5.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with model group.
肺组织:照射后3 d,模型组Tnfsf10mRNA 较正常对照组显著上调(P<0.01),模型+rh-Tβ4 组与正常对照组无显著差异,较模型组显著下调(P<0.05);其他时间点各组无差异;与PCR 芯片结果一致(图9B)。
脑组织:照射后3 d,模型组和模型+rh-Tβ4 组Tnfsf10mRNA 表达较正常对照组显著下调(P<0.05),模型+rh-Tβ4 组与模型组无显著差异,与PCR 芯片结果不一致。照射后11 d,模型组Tnfsf10mRNA 表达较正常对照组显著上调(P<0.05);模型+rh-Tβ4 组与正常对照组无显著差异,较模型组显著下调(P<0.05);与PCR 芯片结果一致(图9C)。
2.5.2 Cd40lg
小肠组织:照射后3,7 和11 d,模型组及模型+rh-Tβ4 组Cd40lgmRNA 表达较正常对照组显著下调(P<0.01),与PCR芯片结果不一致(图10A)。
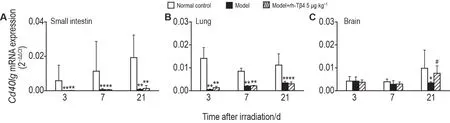
Fig.10 Effect of rh-Tβ4 on Cd40lg gene expression in small intestine(A),lung(B),and brain(C)tissues of mice after irradiation.See Fig.1 for the mouse treatment.Mice were sacrificed on days 3,7,and 11 after irradiation,and the right brain,right lung,and 1 cm of jejunum(10 cm below the pylorus)were removed for apoptosis PCR microarray differential gene validation.±s,n=5.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with model group.
肺组织:照射后3,7 和11d,模型组及模型+rh-Tβ4 组Cd40lgmRNA 表达较正常对照组显著下调(P<0.01),与PCR芯片结果一致(图10B)。
脑组织:照射后11 d,模型组Cd40lgmRNA 表达较正常对照组显著下调(P<0.05);模型+rh-Tβ4 组与正常对照组无显著差异,较模型组显著上调(P<0.05);其他时间点各组无差异;与PCR 芯片结果一致(图10C)。
2.5.3 Fasl
小肠组织:照射后3,7 和11 d,模型组和模型+rh-Tβ4 组FaslmRNA 较正常对照组显著下调(P<0.01),与PCR芯片结果不一致(图11A)。

Fig.11 Effect of rh-Tβ4 on Fasl gene expression in small intestine(A),lung(B),and brain(C)tissues of mice after irradiated.See Fig.1 for the mouse treatment.Mice were sacrified on days 3,7,and 11 after irradiation,and the right brain,right lung,and 1 cm of jejunum(10 cm below the pylorus)were removed for apoptosis PCR microarray differential gene validation.±s,n=5.**P<0.01,compared with the normal control group;#P<0.05,compared with the model group.
肺组织:照射后3 d,模型组FaslmRNA较正常对照组显著下调(P<0.05);模型+rh-Tβ4 组与正常对照组无显著差异,较模型组显著上调(P<0.05);与PCR芯片结果一致(图11B)。
脑组织:照射后3,7和11 d,各组小鼠FaslmRNA表达无显著差异,与PCR 芯片结果不一致(图11C)。
3 讨论
电离辐射通过激活炎症相关基因和过度表达炎症因子诱导炎症环境,导致细胞因子分泌异常[15],如TNF-α,IL-1,TGF-β,IFN-γ,G-CSF和IL-6等[15-17]。照射诱导的细胞因子级联反应进一步加重多组织放射损伤,因此炎症细胞因子也可能成为急性放射性多组织损伤治疗的靶点。TNF-α 和TGF-β 属于Th1 型细胞因子。TNF-α 是由巨噬-单核细胞在急性炎症过程中产生的炎症细胞因子,参与机体炎症反应及免疫调节过程[18]。TGF-β 可由机体多种细胞分泌[19]。TGF-β 对于炎症反应的调节具有两面性,可以促进炎症反应或起抗炎作用。IL-4和IL-13主要由活化的Th2细胞产生,能够刺激活化B 细胞和T 细胞增殖,也在调节体液免疫和适应性免疫中起关键作用[20]。IL-18 是促炎细胞因子,刺激Th1 细胞分泌多种细胞因子,炎症小体及其复合物激活后导致IL-18 上调。本研究结果表明,照射后小鼠小肠、肺和脑组织中TNF-α,IL-18和TGF-β 含量增加,rh-Tβ4 可显著降低上述组织中TNF-α,IL-18及TGF-β含量;而照射后IL-4和IL-13的含量在小肠、肺和脑中无明显变化,rh-Tβ4对IL-4和IL-13 的含量无影响。表明电离辐射可诱发炎症,导致Th1细胞和Th2 细胞分泌失衡[21];rh-Tβ4能够调节Th1 和Th2 细胞因子平衡。我们既往研究发现,rh-Tβ4可减轻放射导致的多组织炎症反应,其对促炎细胞因子的抑制为其减轻炎症反应机制之一[22-23]。
炎症细胞因子水平与炎症小体相关,炎症小体是由多种蛋白质组成的复合体,能够调节胱天蛋白酶1 的活化,在天然免疫防御过程中促进细胞因子前体pro-IL-1β 和pro-IL-18 的成熟和分泌,其还调节胱天蛋白酶1 依赖的细胞凋亡,诱导细胞在炎症和应激条件下死亡[24]。有研究发现,NLRP3 炎症小体表达上调在辐射损伤中起关键作用[25-28],且NLRP3 炎症小体可激活胱天蛋白酶1,导致促炎细胞因子IL-18 和IL-1β 的释放[29]。本研究应用的炎症小体PCR 芯片包含84 个与炎症小体功能相关的关键基因,包括编码炎症小体成分的基因、参与下游信号传导和炎症小体功能抑制的基因、NOD-样受体及其下游分子。此外,该芯片还包括其他NLR家族成员。本研究发现,Tnfsf11和Naip-nlrc4炎症小体基因表达下调,炎症细胞因子IL-1β和IL-18基因表达下调。提示rh-Tβ4 可能通过下调TNF 家族促凋亡因子的表达及作用于NOD 样受体进而降低炎症细胞因子的释放而抑制炎症反应。该结果为进一步探讨rh-Tβ4 作用机制提供了切入点。PCR芯片反应样本整体的基因表达变化趋势,每一个基因的变化趋势不一定都与RT-qPCR 保持一致。本研究中,部分基因RT-qPCR 验证与PCR 芯片筛选结果不一致,原因可能为批次和个体差异、验证的基因可能表达量低致差异不显著及2种方法本身存在差异。我们将在后续实验中扩大样本并对于筛选获得的差异基因上下游分子进行检测,以进一步揭示差异基因变化规律及其作用。
本课题组前期研究发现,rh-Tβ4 可抑制照射后小肠上皮细胞和肺上皮细胞凋亡,但机制尚未阐明。炎症小体通过调控胱天蛋白酶1和胱天蛋白酶5的活化,介导促炎细胞因子IL-1β,IL-18和TNF-α等上调[24],且炎症小体可调控胱天蛋白酶1 依赖的程序性细胞死亡[30]。本研究结果表明,rh-Tβ4 可显著降低照射后小鼠多组织中IL-18 和TNF-α 表达;此外炎症小体PCR芯片筛选发现,rh-Tβ4可下调参与凋亡调控的Tnfsf11和Bcl2l1的表达,rh-Tβ4 对多个炎症小体相关基因具有调控作用。NLR 活化可激活一系列信号通路,其中包括NF-κB 和MAPK活化,提示rh-Tβ4 对凋亡的调控可能为其作用机制之一,且与炎症小体相关分子可能具有关联性。故本研究进一步采用凋亡PCR 芯片从凋亡调控角度探讨rh-Tβ4 的作用机制。选择照射后11 d 与炎症小体PCR芯片一致的检测时间点,此时凋亡并非由电离辐射直接导致,主要考虑从炎症细胞因子、炎症小体相关分子对凋亡调控的角度予以探讨。通过芯片筛选及RT-qPCR 验证,照射后TNF 家族促凋亡因子激活,其中Fasl 和TNFSF10 与相应受体结合后,激活Bcl-2 家族促凋亡因子,TNF 与相应受体结合后继续募集胱天蛋白酶8;活化的胱天蛋白酶8可激活Bcl-2家族,通过线粒体途径释放细胞色素c(cytochrme c,Cytc);Cytc可活化胱天蛋白酶9,随后激活胱天蛋白酶3,从而导致细胞凋亡。rh-Tβ4 下调Fasl,Tnfsf10和Tnf基因表达,上调Bcl2l1基因表达,可能为其抑制细胞凋亡的机制之一(图12)。
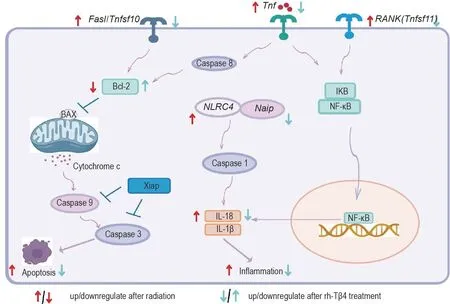
Fig.12 An illustration of apoptosis and inflammation pathways regulated by rh-Tβ4 in radiation-induced injury mouse model.rh-Tβ4 downregulates Fas/Tnfsf10,Tnf,RANK(Tnfsf11),NLRC4 and IL-1β which are upregulated by irradiation,meanwhile Bcl-2 downregulated by irradiation is upregulated by rh-Tβ4.IκB:inhibitor of NF-κB;RANK:receptor-activating factor for NF-κB.
综上所述,本研究在前期研究基础上探讨了rh-Tβ4 治疗急性放射损伤的可能机制,通过炎症小体及凋亡RT-qPCR 芯片筛选和炎症细胞因子检测,发现rh-Tβ4 能够抑制Th1 型反应,进而调节Th1 和Th2 免疫平衡;下调炎症小体Naip 及NOD-样受体基因,可能为其减轻电离辐射所致多组织炎症反应机制之一。此外,rh-Tβ4 通过上调抗凋亡基因并下调促凋亡基因,进而抑制细胞凋亡。本研究为揭示rh-Tβ4 治疗急性放射损伤的机制提供切入点,后续深入研究有助于将rh-Tβ4 开发为急性放射损伤治疗药物,并揭示其作用机制。
