产气荚膜梭菌致病机制及其治疗性抗体研究进展
2024-05-07赵品楠罗龙龙
赵品楠,罗龙龙
(军事科学院军事医学研究院毒物药物研究所,国家安全特需药品全国重点实验室,北京 100850)
产气荚膜梭菌(Clostridiumperfringens,CP)又称魏氏梭菌(C.Welchii),主要存在于土壤、污水以及人和动物肠道中,可引发多种疾病,包括人气性坏疽、食物中毒、动物坏死性肠炎和肠毒血症等,严重危害公共卫生安全[1]。美国病理学家William H.Welch 于1982 年在1 例尸检过程中分离得到CP,CP 的独特表现是在被感染的血管中能观察到气泡。开放性创伤使CP 感染的控制更加困难。第一次世界大战(一战)期间,约1%的士兵死于CP感染[2]。二战期间,由于战争波及到更多国家,武器机械化程度更高,杀伤性更强,导致的伤亡人数和受伤程度大幅上升,战伤使感染CP 的比例大幅增加,气性坏疽发生率由一战的1%增长至10%[3]。国内同样发生过CP群体感染事件。2008年汶川地震时,由于大面积开放性创伤、恶劣环境及炎热天气,CP迅速传播,出现近百例气性坏疽患者[4]。另外,CP可以引起大规模禽类坏死性肠炎和羊肠毒血症,给养殖业造成巨大的经济损失[1]。因此,CP对公共卫生的影响不容小觑,如何有效控制CP 感染引起的各种疾病的发生,找到有效的防治方案迫在眉睫。目前,针对CP 感染的主要治疗手段还是及时清创并大量使用抗生素,但由于多重耐药菌株的大量出现、耐药谱的扩大以及不同血清型混合感染等问题,亟需新型的预防和治疗策略。本文简述CP 的主要致病因子、致病机制和基因工程抗体治疗研究进展,为CP感染防治提供参考。
1 主要致病因子和致病机制
CP 是一种革兰阳性粗大杆菌,有荚膜,无鞭毛,不能运动;芽孢位于次级端,呈椭圆形;抗热能力很强,可在114 ℃的高温下存活1~4 h,这也是其广泛存在、传播力强的主要原因。CP 属于厌氧菌,但并非绝对厌氧,在微量氧的情况下也能生长。该细菌培养有两大特点:①菌落在血平板上形成双层溶血环(内环由θ 毒素引起完全溶血,外环由α 毒素引起不完全溶血);②在牛乳培养基中因分解乳糖产酸而使酪蛋白凝固,同时产生大量气体,将凝固的酪蛋白冲成蜂窝状,该现象被称为“汹涌发酵”。
水解酶和外毒素是CP 最主要的致病因子。CP 可分泌近20 余种毒素,其中最主要的致病毒素为α,β,ε 和τ 毒素及肠毒素(C.perfringensenterotoxin,CPE)和坏死性肠炎B 样毒素(necrotic enteritis B-like toxin,NetB)。另外,根据其主要产生的毒素可将CP 分为7 种血清型,分别是A 型(α 毒素)、B 型(α,β 和ε 毒素)、C 型(α 和β 毒素)、D 型(α 和ε 毒素)、E 型(α 和τ 毒素)、F 型(α 毒素和CPE)和G 型(α 毒素和NetB)[2]。由于各型CP 的宿主和主要致病毒素不同,其导致的疾病也不同,其中A型为最常见类型,主要引起人气性坏疽、食物中毒和家禽坏死性肠炎等;B,C 和G 型导致绵羊和反刍动物坏死性肠炎等;D 和E 型引起动物肠毒血症;F型引起人食物中毒和抗生素相关性腹泻等。
1.1 α毒素
1.1.1 分子结构
研究发现,各型CP 均可产生α 毒素。α 毒素是A 型CP最主要的毒力因子,也是第1个被发现既有酶活性又有毒素特性的细菌蛋白[5]。α毒素由370个氨基酸组成,具有磷脂酶C 活性,编码基因位于细菌染色体的稳定区域,包括β 折叠组成的膜结合C端结构域、α 螺旋组成的催化N 端结构域和含有神经节苷脂结合位点的中心环结构域[6],在钙离子存在时结合至宿主细胞膜上[7],通过破坏细胞膜结构导致细胞裂解坏死。N端和C端单独存在时无溶血活性,只有两者共同作用时α毒素才具有毒性[8]。
1.1.2 致病机制
α 毒素同时含磷脂酶和鞘磷脂酶活性,可水解质膜上的卵磷脂和鞘磷脂,产生二酰基甘油和神经酰胺[6];还可通过与Gi型GTP结合蛋白的相互作用激活内源性磷脂酶和鞘磷脂酶[9],通过一系列级联反应和信号通路破坏细胞膜结构的完整性,引起细胞裂解,并促使白细胞介素8(interlukin-8,IL-8)、活性氧和钙离子升高,从而表现出毒素的细胞毒性、致死性和溶血活性等[10]。此外,α 毒素作用不仅限于膜破坏,还能特异性结合神经节苷脂类糖,随后促进其聚集和酪氨酸激酶A的激活,触发IL-8释放,继而通过招募和激活中性粒细胞引起细胞急性炎症,最终导致细胞死亡[11-12](图1)。Oda等[13]报道,IL-8升高可促进嗜中性粒细胞与细胞外基质蛋白黏附,促使嗜中性粒细胞在血管内皮上积聚,最终导致气性坏疽发生。还有研究报道,α 毒素可诱导外周血中性粒细胞分化[14],该作用归因于外周血中性粒细胞中含神经节苷脂类糖的脂筏改变[15]。在病理方面,α 毒素能够影响免疫细胞如嗜中性粒细胞向感染组织转移(机制目前未知),因此其可潜在地减少感染部位的病原体清除。α 毒素还可导致血管收缩,减少组织的血液供应,从而产生有利于CP 生长的低氧环境。另外,α 毒素所引发的代谢中的炎症级联反应(花生四烯酸和蛋白激酶C)是导致细胞死亡的主要原因[2]。人气性坏疽主要由A 型CP 导致,尤其发生在战争或地震环境中。由于α 毒素能分解肌肉和组织中的糖类物质,从而产生大量气体,造成气肿;同时血管通透性增加,局部发生水肿,挤压周围软组织和血管,影响血供,造成组织坏死。
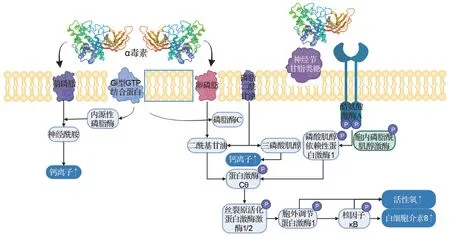
图1 α毒素致病机制.↑:升高;:磷酸化.
1.2 肠毒素
1.2.1 分子结构
流行病学研究表明,CPE 是引起F 型CP 的人类食物中毒及非食源性腹泻的主要毒素[16],该毒素缺乏与其他毒素一级氨基酸序列的同源性,但在结构上属于成孔毒素家族[17]。CPE基因位于染色体或质粒上,毒素的表达仅发生在孢子形成期间[18]。CPE由含有319个氨基酸的单一蛋白组成[19],CPE 蛋白由无毒的C端受体结合结构域和N端细胞毒性结构域组成,其在孔形成期间介导寡聚化和膜插入[20]。
1.2.2 致病机制
紧密连接蛋白是CPE 的细胞受体,对于维持由上皮和内皮细胞形成的紧密连接的结构和功能具有重要作用[21]。初始CPE 与紧密连接蛋白的结合导致小复合物形成,6 个小复合物的相互作用可导致CPE 低聚和质膜上孔的形成,最终形成六聚体复合物1(hexamer complex-1,CH-1)[22]。该复合物将来自CPE 的β-发卡环组装成β-桶状结构,其插入膜中形成增强离子内流的活性孔,从而导致细胞死亡[23](图2)。CPE 孔可渗透小分子,特别是阳离子[24]。CPE 较低剂量即可引起钙离子内流,诱导钙蛋白酶活化触发胱天蛋白酶3 介导的细胞凋亡;而CPE 较高剂量引起大量钙离子内流,可诱导强烈的钙蛋白酶活化并导致混合系列蛋白激酶样结构域依赖性坏死性细胞凋亡。CPE 对人类健康危害极大,在肠道中其不但引起上皮细胞死亡,导致体液积聚和电解质损失,导致腹泻;而且还诱导肠上皮组织损伤,包括绒毛缩短、上皮坏死和脱屑,使得CPE 进入血循环并进入肝,在肝中与紧密连接蛋白3 结合,诱导可能危及生命的高钾血症[25]。典型F 型CP 的CPE 黏附于肠黏膜上皮,阻碍营养物质的输运和吸收,且通过改变细胞膜的通透性,造成小分子的流失进而引起腹泻或食物中毒。
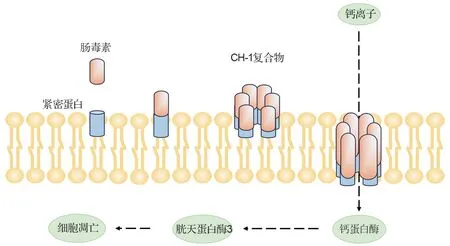
图2 肠毒素致病机制.CH-1:六聚体复合物1.
1.3 ε毒素
1.3.1 分子结构
ε 毒素属于气溶素样成孔毒素家族,是B 型和D 型CP 菌的主要致病毒素,可引起肠毒血症。肠毒血症是一种高度致死性疾病,对家养反刍动物,特别是绵羊养殖具有重大影响[26]。在小鼠中其半数致死剂量(LD50)为100 ng·kg-1,是继肉毒杆菌毒素和破伤风毒素之后已知的第3种最有效的细菌毒素[27]。由于这种高效力,ε 毒素被认为是一种潜在的生物战剂,并已被美国疾病控制和预防中心归为B 类生物战剂[28]。ε 毒素具有3 个由β-折叠组成的结构域。结构域Ⅰ含有1 个大的α-螺旋,随后是1 个环和1 个短α-螺旋。在结构域Ⅰ和Ⅱ之间,存在另1 个α-螺旋,随后是1 个环。结构域Ⅱ是由2 个反向平行的β-折叠和β-发夹组成的β-夹心。结构域Ⅲ也是具有2 个β-折叠的β-夹心结构,且这2个折叠中的第2个形成毒素的C端[29]。
1.3.2 致病机制
ε 毒素发挥毒性作用的过程大致为:ε 毒素被胰蛋白酶和胰凝乳蛋白酶激活[26];活化的ε 毒素与位于细胞膜区域中的受体结合[30],促进中性鞘磷脂酶激活,导致鞘磷脂水解和神经酰胺生成[31],从而促进寡聚体形成。寡聚化导致七聚体孔,诱导钾离子快速丢失,氯离子和钠离子进入,随后钙离子增加,最终导致细胞损伤[31-32](图3)。有研究表明,这些七聚体也被内化并引起细胞损伤[33]。肠中ε毒素的作用可导致体液聚积和黏膜出血,小肠和大肠的组织病理变化包括黏膜充血和糜烂及中度多形核细胞浸润等。ε 毒素除被肠道吸收外,其他靶器官如肾、肺和脑中也发现了该毒素[34]。

图3 ε毒素致病机制.+:促进.
2 临床治疗和耐药性
目前,临床上针对CP 感染最常用的治疗方法还是大剂量使用抗生素,对于严重的气性坏疽需采取紧急外科处理,包括及时反复冲洗伤口和切除坏死组织等。但由于该菌导致的疾病具有发病急、病程短和死亡率高等特点,临床用药具有一定的滞后性,很难达到较好的治疗效果。另外,尽管抗生素可用于大部分细菌感染,大幅降低细菌感染后的死亡率,然而全球许多常见菌正在对抗生素产生耐药性,导致长期慢性感染性疾病频发,CP 也不例外。青霉素、四环素、氯霉素和甲硝唑是临床治疗CP 感染的常规药物[35],但由于抗生素的不规范使用和滥用,使得CP 耐药性不断增强甚至发生多重耐药。2004 年,瑞典、丹麦和挪威分离的CP 菌株均存在对四环素的耐药,耐药率分别为10%,29%和80%,并且通过PCR 扩增到了2 个抗性基因tetA(P)和tetB(P)[36],它们分别编码外排蛋白和核糖体保护型蛋白[37],通过干扰抗生素与核糖体的结合发挥作用。Gholamiandehkordi 等[38]从肉鸡中分离的CP对四环素耐药率高达66%。Kartalidis 等[39]报道,CP 中存在糖肽类抗生素耐药基因,且万古霉素耐药基因的存在已得到证实。众所周知,抗生素抑菌机制主要是抑制细菌细胞壁合成或抑制细菌蛋白质合成,包括细菌灭活酶的产生、细菌药物靶点改变和细菌细胞膜通透性改变等[40]。而CP 主要致病物质是其产生的外毒素和水解酶,并非细菌本身。因此,抗生素对CP 感染的治疗既达不到完全有效又会产生耐药性。目前疫苗预防和抗体治疗已成为研究的突破点。
3 基因工程治疗性疫苗和抗体
随着科学技术发展和医药研究进入新阶段,抗体药物呈现蓬勃发展的态势,在肿瘤、免疫系统疾病和感染性疾病等方面均取得突破性的进展,也因此逐渐成为新药开发的热点。单克隆抗体药物经历了从鼠源单抗、人鼠嵌合抗体、人源化抗体到全人源化抗体的发展[41],上述技术的迭代逐步优化抗体药物的免疫原性和半衰期,对疾病和治疗效果呈跨越式提高,不良反应也明显降低[42]。传统的单克隆抗体具有完整的“Y”字形抗体结构,包括与抗原结合的Fab 段和诱导抗体依赖的细胞介导的细胞毒性作用、补体依赖的细胞毒性作用的可结晶片段(Fc 段)。然而随着抗体工程化技术的发展和对抗体药物的深入研究,近年来衍生出了多种非天然的新型抗体结构模式,包括抗体-融合蛋白[43]、双特异性抗体[44]和抗体偶联药物[45]等。临床实践证明,应用抗体治疗CP 感染具有一定的疗效,无论是鼠源性单抗还是全人源单链抗体,均针对CP 分泌的外毒素,协同抗生素对CP 繁殖的抑制,产生更加有效的保护作用[46]。
3.1 抗α毒素疫苗和抗体
目前,许多抗CPα 毒素的疫苗被认为是CP 感染有效的预防剂。Hoang 等[47]等报道,表达α 毒素的重组枯草芽孢杆菌是针对坏死性肠炎的候选口服疫苗。Uppalapati 等[48]研制出二价重组蛋白,这可能是针对CP 诊断和治疗领域的一种新型干预措施。研究发现,缺乏任何酶和毒素活性的膜结合C端结构域可能是α 毒素疫苗的主要免疫原[49]。最近,Shreya 等[50]报道了用二价嵌合蛋白(由α 毒素和CPE 的C 端结构域组成)免疫小鼠可预防A 型CP感染。
除疫苗外,针对α 毒素的抗体因具有高效的中和效应被广泛关注。Logan等[51]和Singh等[52]通过将骨髓瘤细胞与用戊二醛灭活或甲醛灭活的α毒素免疫的小鼠脾细胞相融合,制备了抗α 毒素的鼠单克隆抗体。该单克隆抗体与α毒素反应强烈并特异性结合,可中和α毒素的磷脂酶C活性、溶血活性和致死作用。赵宝华等[53]利用实时荧光定量PCR 和分子克隆技术制备单链抗体scFv-1A8,其由抗α 毒素杂交瘤细胞系的重链和轻链的可变区组成,并用柔性的短接头肽连接。该单链抗体在体外能中和α 毒素的磷脂酶C 活性,在小鼠模型中对致死量α毒素攻击具有保护作用。scFv 的优点是其相对分子质量较低,渗透性较强[54]。Wang 等[55]等从天然合成的噬菌体展示文库中制备了抗α毒素的人源单链抗体,并以小鼠为模型检测了其预防和治疗效果。为证明scFv 中和毒素的潜力,将α 毒素与scFv 预孵育,随后测试其卵磷脂酶和溶血活性以及iv 给予小鼠后的致死作用。经分析发现,该单链抗体可抑制卵磷脂酶和溶血活性。另外,用2 倍LD50的α 毒素攻击小鼠,发现在30 min 内用scFv 处理小鼠的存活率可达80%。上述结果均表明,制备的抗A 型CPα 毒素人源单链抗体可用于预防和治疗α毒素相关疾病。但由于存在人抗鼠免疫反应[56]、单链抗体结合力低和易被肾清除等缺点,治疗效果被限制。
王冬冬等[57]在抗A 型CPα 毒素单链抗体的基础上,利用基因工程技术构建了双价单链抗体。通过体外检测该抗体抑制α毒素水解卵磷脂的活性和溶血活性以及小鼠攻毒保护实验,初步研究该双价单链抗体的生物学活性。结果表明,构建的双价单链抗体scFv2-5 和scFv2-15 均正确,并且与α 毒素具有特异结合活性,scFv2-15 和scFv2-5 与抗原的结合活性明显高于scFv,且scFv2-15 中和毒素的能力较scFv2-5 和scFv 具有明显优势。邱玥等[58]构建了抗A 型CPα 毒素单链抗体,是利用全人源噬菌体抗体库筛选获得的抗α 毒素的全人源scFv 抗体。他们构建5种不同组分的重组表达质粒后转入表达菌,获得5 个单分子抗体的表达菌。利用EILSA 检测该5 种单分子抗体蛋白的抗原免疫结合活性。结果显示,scFv-CH2-CH3(scFv-Fc)的结合活性最高。随后进行攻毒保护实验,发现该抗体对α毒素感染具有很好的治疗作用,且半衰期较长。
此外,自20 世纪90 年代纳米抗体被发现以来,其已经成为动物和人类疾病预防和治疗的新型小分子抗体药物[59-60]。纳米抗体是衍生自骆驼科动物(单峰驼、骆驼和美洲驼)及鲨鱼等血清中天然存在的重链(缺乏轻链和重链1结构域)抗体[61]。与传统抗体相比,纳米抗体具有多个突出的理化性质,如相对分子质量小、稳定性高、靶向性强和水溶性好等,且可在细菌中进行规模化生产,生产成本大大降低[62-63]。尽管具备上述优势,但纳米抗体和常规单抗药物存在同样的问题,即口服递送仍不成功,且费用昂贵。研究发现,微生物载体为纳米抗体的口服递送提供了机会。例如,硅乳杆菌、乳球菌、沙门氏菌和大肠杆菌被工程化后可将靶分子直接递送至疾病部位,可实现更经济、更有效的疾病治疗。使用载体递送不仅保护靶分子免受胃肠道环境的影响,还可使其有效性最大化并使脱靶效应最小化[64]。此外,微生物载体还具有制备简单、成本低等优势。调查发现,重组乳杆菌已广泛用作活载体以递送治疗性和预防性分子[65-66]。乳杆菌对CP 有较强拮抗活性,可抑制毒素产生,减少促炎细胞因子,改善肠道病变和免疫应答,纠正微生物生态失调,恢复与亚临床坏死性肠炎相关的性能缺陷[67-68]。目前,乳杆菌已经用作纳米抗体的有效递送、表达系统,用于不同胃肠道感染性疾病的治疗。Dharanesh 等[69]使用重组乳杆菌作为活载体用于原位递送抗CP NetB 和α 毒素的纳米抗体,这些纳米抗体中和NetB 和α 毒素协同重组乳杆菌的肠道调节活性,可大大降低家禽坏死性肠炎的发生率。实践证明,来自载体活菌和纳米抗体的双重作用是解决复杂疾病如坏死性肠炎的突破口,这种治疗策略对其他类似复杂疾病的治疗潜力也值得探讨。
3.2 抗肠毒素疫苗和抗体
由于在小肠内CPE 可诱导大量的上皮细胞脱落和纤毛缩短,各种组织病理损伤可造成相关细胞水分和电介质转移的改变,进而引起腹泻症状,并且孢子形成的CP 耐热,煮熟食物几乎不能降低其致病性[70]。因此,目前与CPE相关的疾病既难预防也无有效治疗手段[71]。膜蛋白的紧密连接蛋白家族是已知的CPE 受体,还可控制紧密连接的结构和功能,为细胞间分子输运制造障碍。CPE 通过紧密连接蛋白与上皮细胞结合,使紧密连接蛋白屏障功能失效,进而诱导细胞毒性,破坏肠道稳态[72]。Hanna 等[73]使用合成抗原结合片段(sFab)文库发现了2个结合紧密连接蛋白4和CPE C端复合物的合成抗原结合片段,为CPE 相关的胃肠道疾病治疗提供了框架和策略。然而,鉴于CPE 感染不常见,目前针对该毒素的疫苗或抗体的研究报道很少,还有待研究。
3.3 抗ε毒素疫苗和抗体
由于ε 毒素致病机制复杂,对人类和动物多个器官均具有较强的毒性作用,目前仍然无针对该毒素的完善的预防或治疗策略。Garcia 等[74]报道,用本氏烟草产生的中和单克隆抗体(c4D7)可预防和治疗CP ε 毒素中毒。Jiang 等[75]报道,ETX-Y71A可作为CP 的无毒突变体,在小鼠和绵羊中诱导保护性免疫。但上述方案尚未得到临床验证。
3.4 抗体-抗生素偶联药物策略
除上述抗CP治疗性抗体(表1)外,为提高对耐药细菌的治疗效果,借助抗体偶联药物的设计原理,研究人员还提出了一种用于治疗细菌感染的抗体-抗生素偶联药物策略,其主要结构包括可特异性靶向识别细菌的抗体以及用于杀死细菌的抗生素有效载荷[76]。研究发现,数千个抗体-抗生素偶联药物可与单个细菌结合,并可被吞噬至细菌体内释放出足够浓度的游离抗生素[77],以此提高药物的有效性(降低药物剂量和不良反应),从而降低耐药性。抗体-抗生素偶联药物策略通过将抗体和抗生素的药理学属性结合到单个药物中,为感染性疾病的防治提供全新的治疗手段。尽管目前还未开发出针对CP 感染的抗体-抗生素偶联药物,但这些非临床研究案例将大大促进治疗CP 感染的抗体-抗生素偶联药物的发展,在一定程度上解决CP 耐药问题。

表1 抗产气荚膜梭菌治疗性抗体
4 结语
CP 感染是自然界现存最具危害性的革兰阳性细菌之一。因此,针对CP 做好科学有效的预防策略,不仅能够提高动物生产数量和质量,也能消除其给人类健康带来的威胁。面对CP 抗生素治疗后耐药性激增,预防性疫苗、治疗性抗体以及抗体-抗生素偶联药物可在一定程度上阻止其耐药进程。目前,针对预防和治疗CP 感染的疫苗和抗体逐渐成为大家关注和研究的重点,无论是单链抗体、双价单链抗体,其结合活性、中和活性以及保护活性均有待提高。更重要的是,对具有重大临床应用价值的候选药物,需开展进一步的非临床和临床研究,以满足临床上对CP 感染治疗的需求。相信随着生物科技的迅猛发展,在应对感染性疾病方面不再局限于传统的抗生素疗法,越来越多的新型生物疗法将不断涌现,为人类对抗“顽固性耐药菌”感染提供更多有效的措施。
