基于人肾类器官构建顺铂诱导急性肾损伤模型
2024-05-07马瑞麟岳亮贠志敏楼张蓉刘琦崔宏图钟鹏飞高卓檀英霞吴成君
马瑞麟,岳亮,贠志敏,楼张蓉,刘琦,崔宏图,钟鹏飞,高卓,檀英霞,吴成君
(1.大连理工大学生物医学工程学院,辽宁 大连 116024;2.军事科学院军事医学研究院卫生勤务与血液研究所,北京 100850;3.空军特色医学中心肾病科,北京 100089)
急性肾损伤(acute kidney injury,AKI)是指由多种病因造成肾功能在短期内的迅速下降[1]。导致AKI 的原因众多,如药物肾毒性、肾血流减少、重大手术后遗症和败血病等[2]。药物不良反应是导致AKI 的一个重要诱因,如西多福韦(cidofovir)、阿德福韦(adefovir)和替诺福韦(tenofovir)等抗病毒药物会导致急性肾小管坏死等症状继而导致AKI 发生[3]。药物的肾毒性与AKI 患者发病率和死亡率相关,也是药物研发临床试验失败的重要原因。抗肿瘤药物顺铂(cisplatin)是典型的致AKI 药物,可诱导胱天蛋白酶介导的肾近端小管细胞急性凋亡[4]。因此,其抗肿瘤疗效受到严重肾毒性的限制。
AKI 在病因学、病理生理学和肾疾病进展方面是一种高度异质性疾病,而肾作为人体的重要代谢器官和药物毒性的主要靶器官,合适的筛选肾毒性化合物平台对于早期预测新药安全和改善肾毒性药物的临床管理至关重要。然而每种生物模型都有其固有的优点和局限性,因种属差异性动物很难用于表征人类对药物的真实反应、2D细胞系对药物暴露的敏感性低等问题,限制了对AKI 致病机制的研究[5]。因此,开发基于人类的体外模型对于阐明AKI致病机制、探寻新的治疗方法具有重要意义[6]。
类器官是类似于组织器官的细胞培养物,是由多能干细胞(pluripotent stem cells,PSC)在体外培育而成的具有来源器官显微解剖特征的多细胞3D结构,是目前生物医学中极具特色而且富有活力的新兴技术[7-8]。肾类器官通过模拟生理状态下人胚胎肾发育过程,诱导胚胎干细胞(embryonic stem cells,ES)或诱导性多能干细胞(induced pluripotent stem cells,iPSC)朝肾发育[9]。在Wnt 通路和骨形态发生蛋白(bone morphogenetic protein,Bmp)的作用下[10-11],ES 或iPSC 被诱导成为原条细胞[12],继而分化为中胚层。中胚层可划分为轴旁、侧板及中间中胚层(intermediate mesoderm,IM)[13]。源自IM 发育而来的输尿管芽(ureteric bud)与后肾间充质(metanephric mesenchyme)互相诱导分化,最终产生成熟的肾[14]。成熟的肾类器官由1 或2 个肾单位样结构组成,包括肾小球、肾小管(远端肾小管和近端肾小管)、不同节段的管状细胞、足细胞和间质细胞等,可以实现肾实质细胞间的交互作用(cross-talk)。
肾类器官避免了动物实验因种属差异带来的实验误差,临床相关性更强,比动物模型更容易操作,在培养皿中可实现高通量操作,是药物毒性筛选及研究AKI潜在机制的理想模型[15-17]。本研究建立源自iPSC 的肾类器官,以此为体外研究模型,构建广谱抗肿瘤药物顺铂诱发的AKI 模型,并对其进行了细胞存活和肾损伤标志物检测,进而确定不同浓度顺铂导致的AKI损伤程度。本研究以人肾类器官作为药物致肾毒性的人体外研究模型,以期为开发更安全的药物和改善肾毒性药物的临床管理提供重要研究平台。
1 材料与方法
1.1 细胞、试剂和仪器
人iPSC(RC01001-A),中国中盛溯源公司。mTeSR1 培养基和Accutase 细胞消化液,加拿大Stem Cell 公司;台盼蓝染色液、Advanced RPMI 1640、IMDM 培养基、谷氨酰胺(GlutaMax,Glu)、MEM非必需氨基酸溶液(MEM non-essential amino acids solution,NEAA)、HEPES 缓冲液、血清替代物(KnockOutTMSerum Replacement-MultiSpecies)、β-巯基乙醇(2-mercaptoethanol)、PFHM-Ⅱproteinfree hybridoma 培养基、DMEM 培养基,Ham′s F12 nutrient mixture、青链霉素(penicillin streptomycin,PS)、化学成分确定的脂质浓缩物(chemically defined lipid concentrate,CD Lipid concentrate)、杜氏磷酸盐缓冲液(DPBS)、牛血清白蛋白(ProbuminTMbovine serum albumin,BSA)和胰岛素转铁蛋白-硒-氨基乙醇(insulin-transferrin-seleniumethanolamine,ITS-X),美国Gibco公司;溴乙啡锭二聚体Ⅰ(ethidium homodimer-Ⅰ,EthD-Ⅰ)、钙黄绿素AM(Calcein AM),中国优逸兰迪生物公司;ROCK抑制剂Y-27632、聚乙烯醇(poly vinyl alcohol,PVA)、L-抗坏血酸2-磷酸盐倍半镁盐水合物(L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate,AA2P)和α-硫代甘油(1-thioglycerol),美国Sigma 公司;支原体去除剂Normocin,法国Invivogen 公司;Wnt 信号激动剂CHIR99021,美国Selleck 公司。标记远端肾小管的一抗为鼠上皮钙黏蛋白(epithelialcadherin,ECAD)单克隆抗体,美国BD Biosciences 公司;对应二抗为羊抗鼠IgG2a多克隆抗体(Alexa Fluor 568),美国赛默飞公司。标记远端肾小管的一抗为鼠GATA 结合蛋3(GATA-binding protein 3,GATA3)单克隆抗体,美国Invitrogen公司;对应二抗为羊抗鼠IgG1多克隆抗体(Alexa Fluor 647),美国赛默飞公司。标记近端小管的一抗为莲藕凝集素(lotustetragonolobuslectin,LTL),美国Vector公司;对应二抗为Alexa FluorTM 488 链霉亲和素偶联物,美国赛默飞公司。标记肾间质内皮细胞的一抗为兔血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)单克隆抗体,英国Abcam 公司;对应二抗为羊抗兔IgG 多克隆抗体(Alexa Fluor 647),美国赛默飞公司。标记足细胞的一抗为兔足细胞特异性蛋白(podo-calyxin,PODXL)多克隆抗体,美国Sigma 公司;对应二抗为羊抗兔IgG 多克隆抗体(Alexa Fluor 488),美国赛默飞公司。标记肾小管上皮细胞的一抗为小鼠上皮细胞黏附分子(epithelialcelladhe-sionmolecule,EPCAM)单克隆抗体,英国Abcam 公司;对应二抗为羊抗鼠IgG1多克隆抗体(Alexa Fluor 647),美国赛默飞公司。肾损伤标志物肾损伤因子1(kidney injury molecule-1,Kim-1)和炎症细胞因子白细胞介素8(interleukin-8,IL-8)PCR 引物序列见表1,由生工生物工程(上海)股份有限公司合成。高速离心机(centrifuge 5810R),德国艾本德公司;恒温培养箱(HERAcell 150iCO2)、超微量分光光度计(ND8000),美国赛默飞公司;分体式摇床,中国MIULAB 公司;全自动定量分析系统(Vectra),美国Perkin elmer 公司;细胞计数仪(TC20TM)、细胞计数板和CFX96TMReal-Time System,美国伯乐公司;PCR 仪(PCR System 2400),美国GeneAmp 公司;封口膜,美国PARAFILM 公司;0.2 μm 滤器,美国Pall 公司;低黏附6孔板和干细胞生长基质胶Matrigel354277,美国康宁公司。
1.2 肾类器官构建和鉴定
1.2.1 肾类器官构建
将长到70%汇合度的人iPSC 用Accutase 酶消化为单细胞状态;300×g离心5 min,保留细胞沉淀;1 mL培养基重悬细胞,台盼蓝染色计数,以每孔3 500 细胞接种在低黏附96 孔板内。48 h 后形成球形拟胚体,将其吸出转移到低黏附6孔板内,放入摇床培养24 h;在第3 天更换为诱导培养基。此后每2~3 d 更换1 次培养基,约8 d 类胚体出现肾类器官典型管状结构,12 d后肾类器官成熟[9]。
1.2.2 肾类器官鉴定
为检测所构建肾类器官是否具有人胚胎肾脏相似的结构和细胞类型,对体外分化成熟的肾类器官(培养12~15 d)进行HE染色和免疫荧光鉴定。
HE 染色鉴定:①类器官样品固定:4%多聚甲醛固定肾类器官过夜;②脱水:加入80%乙醇过夜,90%乙醇、无水乙醇Ⅰ、无水乙醇Ⅱ、二甲苯脱水各5 min;③制备石蜡切片,厚度4 μm,烘干;④脱蜡:二甲苯Ⅰ、二甲苯Ⅱ、90%乙醇、80%乙醇和60%乙醇各脱蜡5 min;⑤苏木素染细胞核:切片置苏木素染液染3~8 min,自来水洗,1%氨水溶液返蓝3~5 s 或自来水泛蓝10 min,流水冲洗;⑥伊红染细胞质:切片置伊红染液中染色3~5 min,流水漂洗;⑦脱水封片待观察。用组织切片全自动定量分析系统(Vectra)分析HE染色结果。
免疫荧光鉴定:使用带荧光标记的肾特异性抗体在组织细胞内与对应抗原结合,对待测肾类器官中的细胞类型进行定位及定性研究。步骤包括:抗原修复和封闭液封闭。用封闭液按比例稀释一抗〔ECAD(1∶200);GATA3(1∶200);LTL(1∶200);CD31(1∶200);PODXL(1∶100);EPCAM(1∶100)〕,室温孵育2 h,PBS溶液清洗,封闭液稀释二抗(1∶500),避光孵育1 h;PBS溶液洗去二抗后DAPI染色10 min。抗荧光淬灭剂滴在组织上,荧光显微镜观察类器官中是否表达特异性肾组织的生物标志物[18],如表达于近端小管的生物标志物LTL,表达于远端小管的生物标志物ECAD 和GATA3等,以确定构建的类器官是否成功。
1.3 肾类器官急性肾损伤模型构建和鉴定
将肾类器官用DPBS 漂洗后转移至低黏附96 孔板中,顺铂20,50 和75 μmol·L-1与肾类器官于37 ℃细胞培养箱中共同孵育48 h,测定细胞存活率和肾损伤标志物。
1.3.1 Live/Dead 染色法测定急性肾损伤模型的细胞存活率
将Live/Dead 染色试剂EthD-Ⅰ和Calcein AM用培养基配制成终浓度分别为4 和2 μmol·L-1的染色工作液,与肾类器官于37 ℃孵育1 h 后用激光共聚焦显微镜的488 激光通道拍摄绿色荧光图像,568 激光通道拍摄红色荧光图像,观察不同浓度顺铂处理的肾类器官中细胞凋亡率。类器官中的活细胞显示为绿色且边缘清晰,类器官中的死细胞显示为红色。同时显微镜观察肾类器官给药后的形态变化。
1.3.2 RT-qPCR检测Kim-1和IL-8 mRNA表达水平
Trizol 试剂提取总RNA,用超微量分光光度计ND8000进行浓度测定。取1 μg RNA 作为模板,逆转录合成cDNA。逆转录程序:55 ℃孵育5 min,85 ℃加热5 s,4 ℃冷却。将所得cDNA作为模板进行RT-qPCR 扩增。反应体系:1~2 μL 模板cDNA,2×SYBR Mix 和正、反向引物各1 μL,补充无RNA酶水至20 μL。RT-qPCR程序:95 ℃预变性10 min;95 ℃变性5 s,60 ℃退火15 s,72 ℃延伸10 s,40个循环,获得各样品的熔解曲线。以hGAPDH作为内参,以2-△△Ct法计算目的基因mRNA相对表达水平。
1.4 统计学分析
实验结果数据用±s表示,使用R语言软件进行分析。两组之间差异的统计学分析用studentst检验(符合正态分布的数据)或Wilcoxon rank sum 检验(非正态分布的数据)。P<0.05为差异具有统计学意义。
2 结果
2.1 肾类器官构建及鉴定
以人iPSC 为起始细胞(图1A),诱导发育成肾类器官的过程及各阶段的形态如图1 所示。第0 天消化为单细胞状态(图1B),离心后细胞聚集在U型孔底部。48 h 后,细胞开始在U 型孔底部形成类胚体球体(图1C)。第2 天更换培养基后肾类器官开始加速生长。直至第8 天,肾类器官开始出现典型的管状结构(图1D),第12 天即可成熟(图1E),HE染色可查看到培养的肾类器官有着典型的原始的肾小管样结构(图1F)。

Fig.1 Morphology of key node cells in renal organoid culture process recorded by optical microscope.Human induced pluripotent stem cells(hiPSCs)were used as starting cells(A),and digested into single-cell state on day 0(B).After 48 h,bubble-like spheroids formed at the bottom of the U-shaped wells(C).After changing the medium on day 2,renal organoids began to grow at an accelerated rate,and began to exhibit typical tubular structures on day 8(D),and matured on day 12(E).HE staining showed that the cultured renal organoids had typical primitive tubule-like structure(F,left is the 12th day stage,right is the 18th day stage)
利用免疫荧光染色技术鉴定构建的肾类器官中关键肾组织标志物的表达,结果见图2。培养12 d后的肾类器官具有LTL 表达阳性(LTL+)近端小管、GATA3+和ECAD+远端小管、CD31+肾间质内皮细胞、PODXL+足细胞等典型的肾组织结构和相应的肾细胞种类。其中,标记远端小管的GATA3和ECAD表达定位基本重合(图2B 和2D),且与LTL 标记的近端小管存在位置上的连续性(图2A),证明肾类器官中肾小管样结构的完整性。此外,肾间质内皮细胞和肾小管上皮细胞主要在远端小管部分表达(图2A和2C)。表明本研究成功构建了包含近端小管、远端小管、足细胞、肾间质内皮细胞和肾小管上皮细胞等多种细胞类型和组织结构的肾脏类器官。
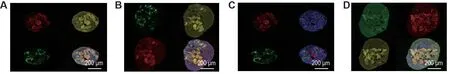
Fig.2 lmmunofluorescence identification of renal organoids which contained proximal tubules,distal tubules,podocytes,tubular epithelial cells,interstitial endothelial cells and other cell types observed by immunofluorescence staining.After 12 days of renal organion cultrure,epithelial cadherin(ECAD)was used for labeling distal tubules,while lotustetragonolobus lectins(LTL)for proximal tubules,platelet endothelial cell adhesion molecule-1(CD31)for renal interstitial endothelial cells,gata-binding protein 3(GATA3)for distal tubules,capsulin-specific protein antibody(PODXL)for podocytes,and epithelial cell adhesion molecules(EPCAM)for kidney tubular epithelial cells.A:yellow ECAD,red CD31,green LTL;B:yellow ECAD,green LTL,red GATA3;C:blue DAPI,green LTL,red CD31;D:green PODXL,yellow ECAD,red EPCAM.
2.2 急性肾损伤模型构建及鉴定
为构建急性肾损伤模型,本研究选择顺铂20,50 和75 μmol·L-1,作用后48 h 可观察到随顺铂浓度增加,肾类器官结构遭到破坏,类器官个体减小,外侧结构解离,细胞大量脱落,肾类器官变黑且管状结构明显减少,球体变得致密(图3)。结合图2免疫荧光染色结果可知,近端小管标志物LTL 和远端小管标志物ECAD主要表达于肾类器官中管状结构位置,可以认为顺铂主要对肾小管结构造成损伤。
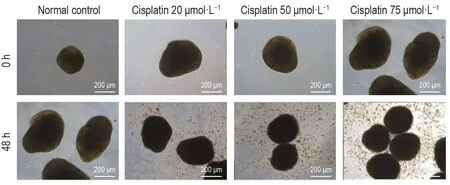
Fig.3 Morphology of organoid injury model induced by cisplatin under a microscope.For mature renal organoids,medium containing cisplatin 20,50 or 75 μmol·L-1 was added and left for 48 h in the incubator.
Live/Dead染色结果(图4)表明,顺铂20 μmol·L-1组肾类器官细胞存活率<50%,随顺铂浓度升高细胞存活率逐渐降低,75 μmol·L-1组细胞存活率接近0。
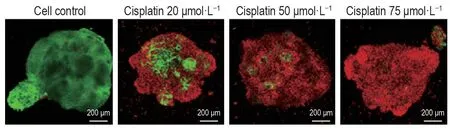
Fig.4 Kidney organoid cell activity of organoid injury model induced by cisplatin by Live/Dead staining and laser confocal observation.After treatment with cisplatin for 48 h,cell activity of kidney organoids was observed by Live/Dead staining and then laser confocal observation.
RT-qPCR 结果(图5)表明,顺铂处理48 h 后,顺铂20,50和75 μmol·L-1均能显著诱导肾类器官细胞Kim-1mRNA(P<0.01)和IL-8mRNA(P<0.01)表达。

Fig.5 Expressions of kidney injury molecule-1(A)and interleukin-8 mRNA(B)in organoid injury model induced by cisplatin.After treatment with cisplatin for 48 h,mRNA expressions were detected by RT-qPCR.±s,n=3.**P<0.01,compared with normal control group.
3 讨论
人肾类器官作为新的体外模型平台,常用于发育、疾病模型、药物毒性和再生修复的研究[19]。越来越多的研究表明,人肾类器官作为药物致肾损伤的人体外研究模型是可行的,如多柔比星、庆大霉素、红霉素、IL-1β、他克莫司(tacrolimus)和脂多糖等均通过肾类器官构建了肾损伤模型,并开展了相关损伤机制的研究[20],为开发更安全的药物和改善肾毒性药物的临床管理提供了重要的研究平台,同时减少实验动物的使用。本研究成功构建了具有原始肾小管样结构,含近端小管、远端小管、足细胞、肾间质内皮细胞和肾小管上皮细胞在内的多种细胞类型的肾类器官,并基于此模型重点关注了抗癌药物顺铂的肾毒性。
顺铂是一种用于治疗多种癌症的化疗药物。顺铂化疗后致AKI 是一种常见的严重不良反应,主要损伤近端小管。AKI的诊断基于非临床或临床生物标志物水平,血清肌酐和尿素氮均AKI 晚期的生物标志物,缺乏敏感性[21]。
为了提高预测发生AKI的能力以便及时进行治疗,越来越多的研究致力于寻找比血肌酐更早更敏感的AKI 诊断的新的生物标志物。Kim-1 是甲型肝炎病毒和含T-细胞免疫球蛋白黏蛋白域蛋白4(T-cell immunoglobulin and mucin domain containing protein 4)的膜受体,是肾近曲小管上皮细胞的一种跨膜糖蛋白,与肾损伤的严重程度密切相关。正常情况下,肾组织几乎不表达Kim-1蛋白,但在肾损伤后数小时内Kim-1 的表达水平即显著升高。Kim-1作为AKI 发生早期的生物标志物,在体外和体内研究中均能特异识别肾损伤,在药物诱导的AKI 肾毒性中具有很好的预测作用[22]。本研究结果表明,随着顺铂浓度增加,Kim-1mRNA 表达水平显著升高,即Kim-1mRNA 表达水平与顺铂存在剂量依赖效应,表明Kim-1 作为评估AKI标志物具有可行性。后期本课题组计划检测AKI 患者尿液中Kim-1 浓度,以期为诊断、监控和量化肾损伤提供非侵入性和更敏感的生物标志物。IL-8 又称CXCL8,是趋化因子家族的细胞因子,通过对中性粒细胞的细胞趋化作用而实现其对炎症反应的调节。将Kim-1 联合其他早期诊断标志物(如IL-8)和中性粒细胞明胶酶相关载脂蛋白等,可为临床诊断提供可靠的依据。本研究结果表明,IL-8mRNA 表达水平在给药后显著升高,但未呈现浓度依赖效应,后续需进一步验证。
本研究结果表明,在顺铂致AKI 模型中,Kim-1作为肾损伤标志物更稳定,可为顺铂的临床安全应用提供参考,进而为该类药物相关用药决策制定和不良反应的应对措施提供科学依据和判断标准。
