湖南省部分地区禽致病性大肠杆菌分离鉴定及生物特性分析
2024-05-07刘伯承燕海峰陈一峰周望平
刘伯承,燕海峰,罗 阳,王 慧,杨 俊,陈一峰,周望平
(湖南省畜牧兽医研究所,湖南长沙 410131)
禽大肠杆菌病是由禽致病性大肠杆菌(avian pathogenicEscherichia coli,APEC)引起的鸡、火鸡等禽类的多系统混合感染性疾病,临床表现心包炎、肝周炎、气囊炎、脑膜炎、关节炎、腹膜炎等多种病症,甚至引起败血症而急性死亡[1]。该病是危害养禽业的重要传染病之一,在国内流行率可达5%~30%,病死率最高可达90%[2],可对养禽业造成严重经济损失。APEC 血清型众多,全球公认的常见血清型有O1、O2、O78、O35,此外O8、O145、O88、O20、O141 等也常有报道[3]。在我国已报道有70 种,主要有O2、O76、O78、O92、O93,其在各地区分布不尽相同[4]。APEC 致病机制目前尚不明确,其致病过程与携带的毒力因子之间的相互协调作用有着密切联系[5]。APEC 与新生儿脑膜炎大肠杆菌(neonatal meningitisE. coli,NMEC)和人尿道源致病性大肠杆菌(uropathogenicE. coli,UPEC)关系密切,是潜在的人兽共患病病原菌,对人类公共健康造成了威胁[6]。
随着集约化养殖持续发展,国内各地区APEC临床病例报道也越来越多[7-9]。有研究报道,山东[10]、重庆[11]、山西[2]、河北[12]等省份的大肠杆菌分离株有一定的致病力,血清型多样,毒力基因种类多,大部分分离株表现为多重耐药。因此,基于APEC 流行的复杂多样特性及其对家禽养殖业带来的危害,掌握各地区APEC 分子生物特性,对建立禽大肠杆菌病监测体系和精准防控具有重要意义。近年来有关湖南省APEC 的研究报道甚少,为此本研究对湖南省部分规模肉鸡场临床疑似病例样品进行了大肠杆菌分离鉴定和菌种保存,并分析这些菌株血清型、种群发育、致病性、毒力基因及MLST 型,以期为本地区APEC 感染防控提供参考。
1 材料与方法
1.1 主要试剂
血琼脂培养基,购自贝瑞特生物科技有限公司;LB 肉汤培养基、麦康凯培养基、伊红美蓝培养基,购自杭州百思生物科技有限公司;MH 琼脂培养基,购自青岛海博生物科技有限公司;大肠杆菌生化鉴定管,购自招远拓普生物科技有限公司;细菌基因组提取试剂盒,购自张家口赛诺生物科技有限公司;PremixTaq™,购自宝日医生物技术(北京)有限公司;DL 2 000 DNA Marker,购自湖南擎科生物技术有限公司;药敏纸片,购自广州誉维生物科技仪器有限公司;50 种大肠杆菌O 抗原单因子定型血清,购自中国兽医药品监察所。
1.2 主要仪器
超净无菌工作台(SW-CJ-1FD),购自苏州净化设备有限公司;美国伯乐梯度PCR 仪(T 100),购置北京莱博瑞杰科技有限公司;奥林巴斯生物显微镜(CX23),购自南京伊诺达仪器设备有限公司;生化培养箱(SPX-50B),购置上海坤天仪器有限责任公司;高速冷冻离心机(ST-16R),购自赛默飞世尔科技(中国)有限公司;疑胶成像系统(3500R),购自上海天能科技有限公司。其他实验器材均由湖南省畜牧兽医研究所兽医兽药实验室提供。
1.3 样品采集
2021 年在长沙县、望城区、宁乡市、浏阳市各选择1 个规模肉鸡场(共4 个),无菌采集病鸡肝脏组织样品122 份。发病肉鸡为40 日龄左右,用药前发病率约为5%,主要表现精神萎靡,头部眼睑肿大,采食量下降,羽毛蓬乱,日增重明显下降,肛门下周围羽毛有黄绿色稀样粪便等临床症状。病鸡解剖可见:肝脏明显肿大,心、肝表面着有不同程度的黄色渗出性纤维素性膜,严重的有白色坏死斑;关节肿胀,腔内有浑浊关节液。
1.4 细菌分离培养
无菌条件下,使用接种环蘸取组织样品于血琼脂培养基上划线,37 ℃恒温培养18~20 h;挑取表面湿润光滑、灰色半透明圆形的疑似大肠杆菌菌落,分别划线接种于麦康凯琼脂培养基、伊红美蓝培养基上,培养18~20 h,观察菌落生长形态;取单个菌落进行革兰氏染色,在显微镜下观察,同时转接于LB 液体培养基,37 ℃摇床培养30 h 后冷藏保存备用。
1.5 生化试验
挑取纯化培养的菌落接种于大肠杆菌微量生化反应管中,37 ℃恒温培养24 h,观察并记录结果,参照《伯杰细菌鉴定手册》[13]进行鉴定。
1.6 细菌DNA 提取与PCR 扩增
按照细菌基因组提取试剂盒说明书步骤操作,提取后标记为模板DNA。针对大肠杆菌持家基因PhoA,登录GenBank 查找并比对目的基因序列,利用Primer 5 软件设计大肠杆菌特异性引物。参照文献[14]设计系统发育群TspE4.C2、chuA、yjaA基因引物,参照文献[15-16]用NCBI 网站中BLAST 软件比对序列设计14 对毒力基因引物。所有引物均由湖南擎科基因生物有限公司合成,引物序列见表1。PCR 反应体系、琼脂糖凝胶电泳检测步骤参考文献[17]。产物回收后送湖南擎科基因生物有限公司测序,在NCBI 上进行序列比对与分析。
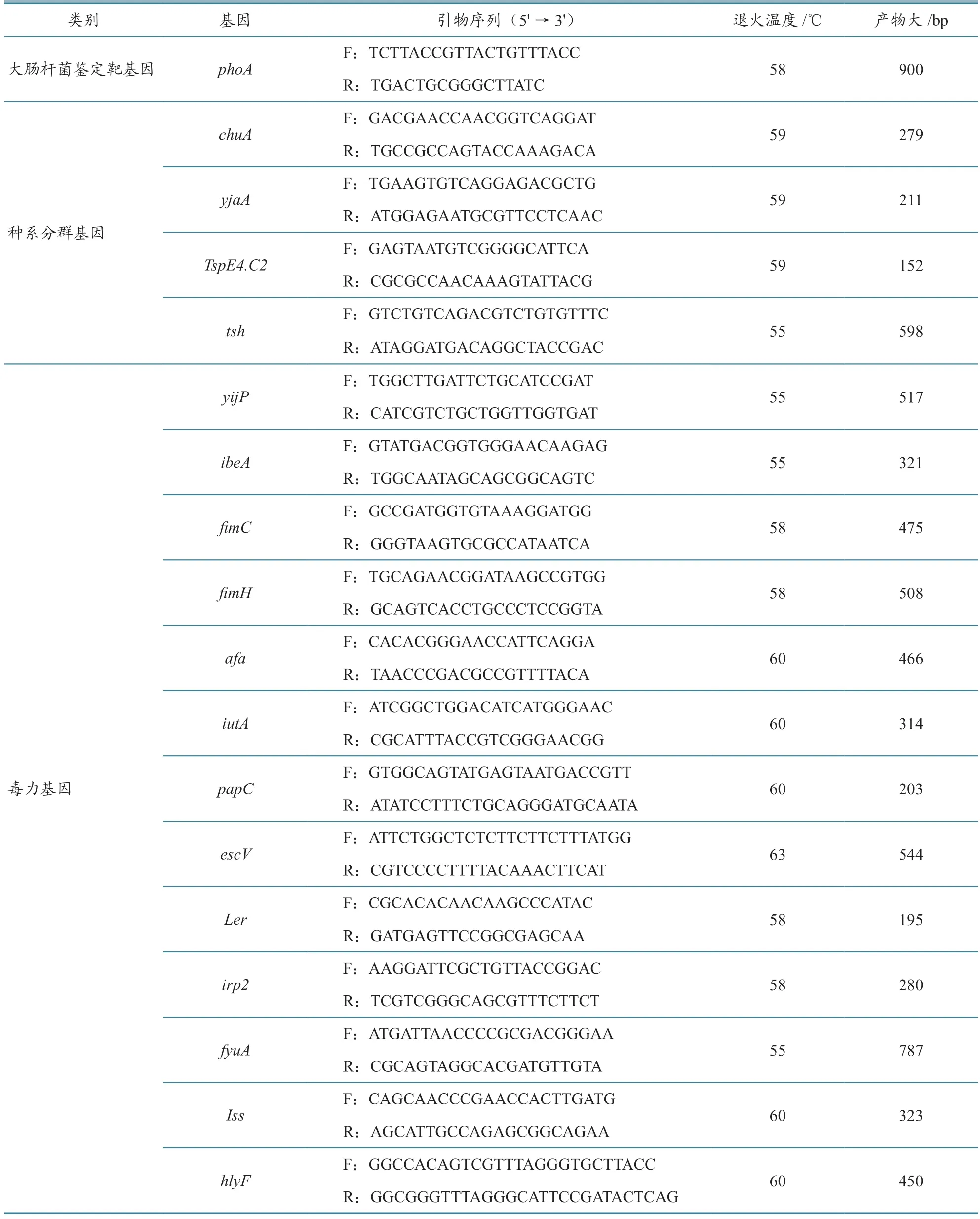
表1 PCR 扩增引物信息
1.7 种系发育群检测、血清型鉴定、多位点序列分型(MLST)鉴定
1.7.1 种系发育群检测 对种系分群PCR 扩增结果,依照Clermont 等[18]提出的二分树方法判定:yjaA基因阳性或yjaA、TspE4.C2、chuA基因阴性为A 群,仅TspE4.C2基因阳性为B1 群,chuA和yjaA基因阳性或3 种基因均阳性认定为B2 群,chuA基因阳性或chuA、TspE4.C2基因均阳性为D 群。
1.7.2 血清型鉴定 将受试菌在麦康凯琼脂平板上划线,37 ℃培养24 h;挑选光滑圆整菌落接种于TSA 琼脂斜面,37 ℃培养24 h;用1.5~2.0 mL石炭酸生理盐水将菌落全部洗下,收集于试管中,于121 ℃高压2 h,破坏其K 抗原;各取50 μL 制备好的抗原和血清于洁净载玻片上混匀,涂成直径约2 cm 的圆膜,1 min 内出现明显凝集颗粒判定为阳性。同时以抗原与0.5%石炭酸生理盐水混合物作对照。
1.7.3 MLST 鉴定 根据https://bigsdb.pasteur.fr/E coli/primers-used网站提供的大肠杆菌分型方案,合成8 对大肠杆菌持家基因引物并进行PCR 扩增,引物序列及退火温度见表2。合成产物送湖南擎科基因公司进行正反向测序。用DNAstar 中的SeqMan 软件将正反向序列进行拼接校正,上传至Pasteur 数据库,进行大肠杆菌等位基因序列比对分析,得到一个精准等位基因号,8 个持家基因的等位基因序号组成该菌株的等位基因谱;将等位基因谱提交至Pasteur 数据库(https://bigsdb.pasteur.fr/Escherichia coli Pasteur MLST)进行分析,得到该菌株的ST(sequence type)型。

表2 8 个持家基因PCR 引物
1.8 动物致病性试验
参考文献[19]将受试株菌液调整至108CFU/mL,按0.1 mL/只腹部皮下接种2 日龄健康雏鸡6 只,并设磷酸盐缓冲液(PBS)为阴性对照,每4 h 观察1 次,记录各组死亡数。解剖观察死亡鸡的内脏形态,同时无菌取心脏、气囊及肝脏组织进行细菌回收鉴定。1 周后扑杀所有试验存活鸡,解剖观察病变,并做细菌回收鉴定。根据病变程度和死亡数量确定病原菌的致病性,参考文献[16]判断其致病力。
1.9 药物敏感性试验
将菌液浓度调整至108CFU/mL,采用纸片扩散法(K-B),取100 μL 菌液置厚度4 mm 的MH琼脂培养培养基上,用玻棒涂布均匀。选择常用的10 种抗生素(头孢西丁、诺氟沙星、四环素、庆大霉素、氨苄西林、氟苯尼考、丁胺卡那、新生霉素、克林霉素及复方新诺明)药敏纸片贴于平板上,每个平板4 张纸片,间距5 cm,37 ℃培养16 h,用游标卡尺测量抑菌圈直径,参照美国临床实验室标准委员会(Clinical and Laboratory Standard Institute,CLSI)标准判定结果[20]。
2 结果与分析
2.1 细菌分离培养
122 份样品中所分离的大肠杆菌在血琼脂培养基上生长成圆形凸起、光滑、湿润、半透明灰色菌落,在麦康凯琼脂培养基上生长成圆形粉红色的中等大小菌落,在伊红美蓝培养基上生长成圆形金属光泽菌落;革兰氏染色镜检可见两端钝圆、较小的粉红色杆菌。
2.2 生化鉴定
分离菌在甘露糖、山梨醇、麦芽糖、木胶糖、鸟氨酸及赖氨酸脱氢酶试剂管中呈阳性,在尿素、侧盏金花醇、葡萄糖酸盐、枸橼酸盐、苯丙氨酸、硫化氢试剂管中呈阴性,根据大肠杆菌生化反应试剂管结果,共有83 株初步确定分离菌为大肠杆菌。
2.3 phoA 基因扩增
83 株分离菌经PCR 扩增,凝胶电泳检测可见大小约900 bp 条带,与目的基因片段一致(图1),经核苷酸序列比对,与GenBank 中大肠杆菌参考株ATCC 25922(登录号CP037449.1)同源率为99.8%~100%,确定分离菌为大肠杆菌。
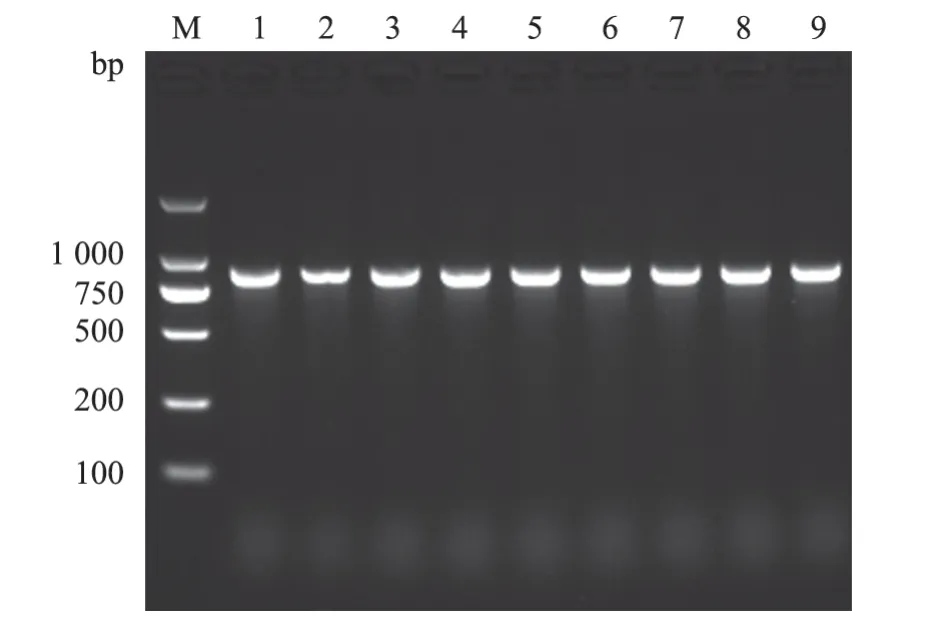
M. DL 2 000 DNA Marker;1~8.分离菌株;9. 阳性对照。图1 部分菌株phoA 基因PCR 扩增结果
2.4 动物致病性试验
将分离菌接种至2 日龄雏鸡,发现4 h 后雏鸡出现不同程度的病症,表现羽毛蓬乱、精神萎靡、缩颈垂翅膀等症状,解剖死亡鸡可见心包积液、肝脏肿大、气囊浑浊等病变。由表3 可知:1 周内死亡率在50%以上的有46 株,占55.42%(46/83),判定为高致病性;死亡率在20%~50%的有31 株,占37.35%(31/83),判定为中等致病性;死亡率在20%以下的有6 株,占7.23%(6/83),判定为低致病性。从未死亡雏鸡的心、肝、脾、肺等肠外器官均分离到大肠杆菌,其生长特性及革兰氏染色结果与原受试菌株一致;对照组未出现临床症状,解剖后取肝组织划线分离培养,也未发现菌落生长。
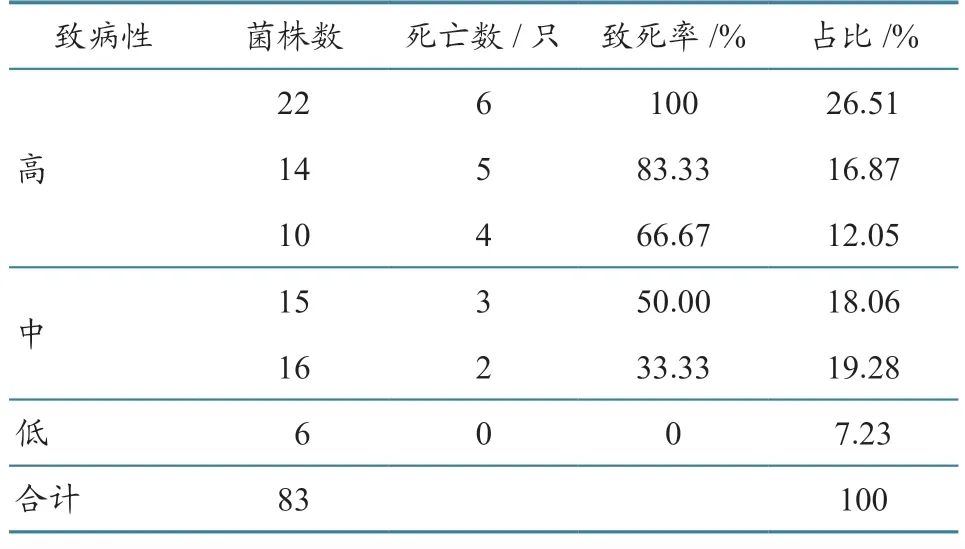
表3 动物致病性试验结果
2.5 APEC 生物特性
2.5.1 血清型 由表4 可知:83 株分离菌经玻片凝集试验共鉴定出15 种血清型,另有14 株未定型。分析显示,优势血清表型为O2、O1、O78 和O14,分别占分离菌的19.28%、14.46%、12.05%和9.64%,其余11 种血清型菌株占比为27.70%。

表4 APEC 血清型鉴定结果
2.5.2 毒力基因 如图2 和3 所示,经PCR 扩增大肠杆菌相关毒力基因,检测出irp2、afa、fyuA、iutA、hlyF、iss、papC、fimC共8 种毒力基因,其中irp2、fyuA、iutA、fimC检出率均为100%,afa、hlyF、iss、papC检出率分别为71.08%(59/83)、74.69%(62/83)、87.95%(73/83)、75.9%(63/83),未检出escV、Ler、Tsh、yijP、ibeA、hlyF等6 种毒力基因。由表5 可知:被检毒力基因经分析形成8 种不同的基因组合图谱,其中同时携带8 种毒力基因的致病菌株占38.55%(32/83)。
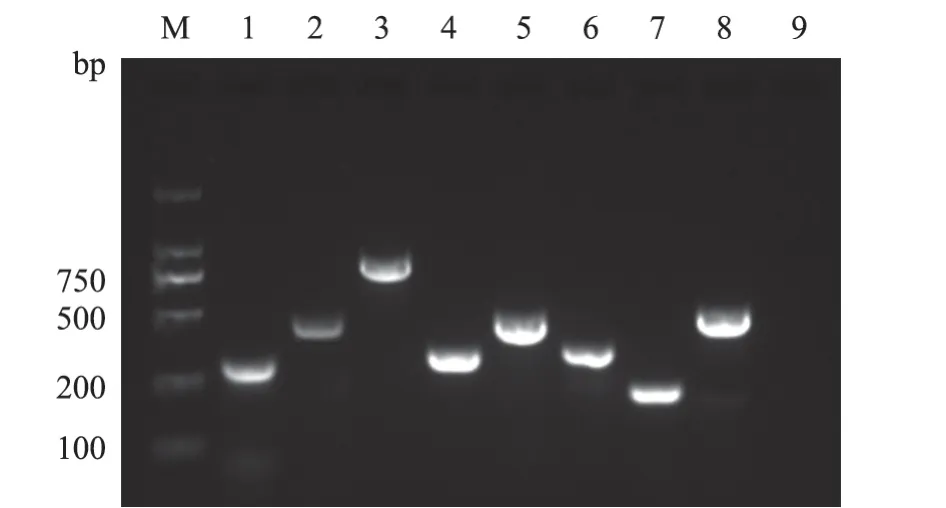
M. DL 2 000 DNA Marker;1~8. 依次为irp2、Afa、fyuA、iutA、hlyF、iss、papC、fimC;9. 阴性对照。图2 部分菌株毒力基因PCR 扩增结果
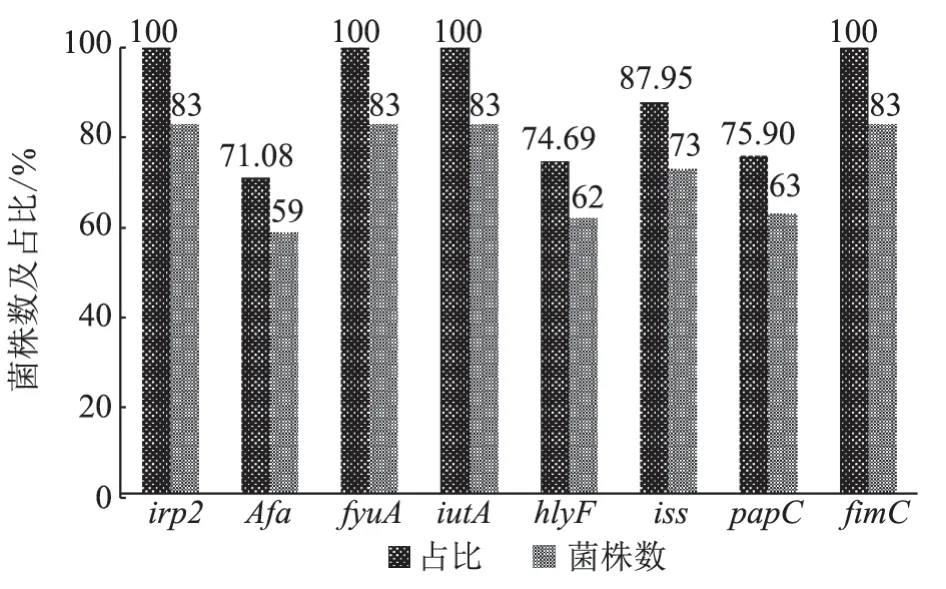
图3 8 种毒力基因在83 株APEC 中的分布

表5 APEC 毒力基因组合分布
2.5.3 种系发育群 利用种系分群基因chuA、yjaA、TspE4.C2进行PCR 扩增,结果发现产物条带与目的基因大小一致(图4)。由6 表可知:83株分离菌株经二分树判定得到B2、B1、A 和D 共4 个种群,占比分别为42.17%(35/83)、38.55%(32/83)、10.85%(9/83)和8.43%(7/83),大部分高致病菌株来自B2(31 株)、B1(10 株)种群。
M. DL 2 000 DNA Marker;1. TspE4.C2;2. chuA;3. yjaA;4. 阴性对照。图4 部分大肠杆菌分离菌株PCR 扩增结果
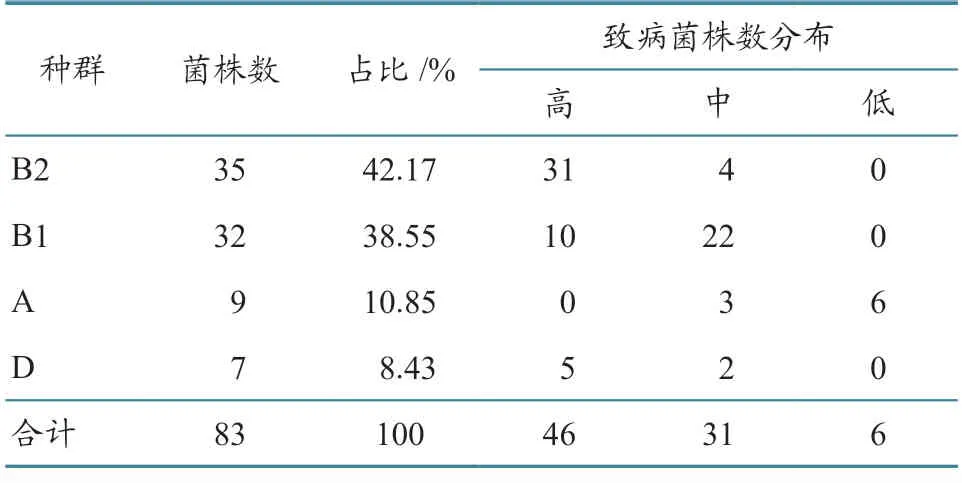
表6 种系发育群分析结果
2.5.4 MLST 分型 PCR 扩增结果(图5)显示,8 个大肠杆菌持家基因产物条带与目的基因大小一致。由表7 可知:83 株APEC 共获得12 种ST 型。其中:ST95、ST481、ST350 为本次分离菌株的主要ST 型,占比分别为19.28%(16/83)、14.46%(12/83)、15.66%(13/83);其次为ST396(10 株)、ST954(5 株)、ST336(4 株)和ST317(4 株);另有5 个新ST 型(19 株)被检出。结果表明,本次分离菌株的遗传发育整体呈多态性。

M. DL 2 000 DNA Marker;1~8. IcdA,pabB,trpA,trpB,dinB,polB,putP,uidA。图5 8 个持家基因PCR 扩增结果
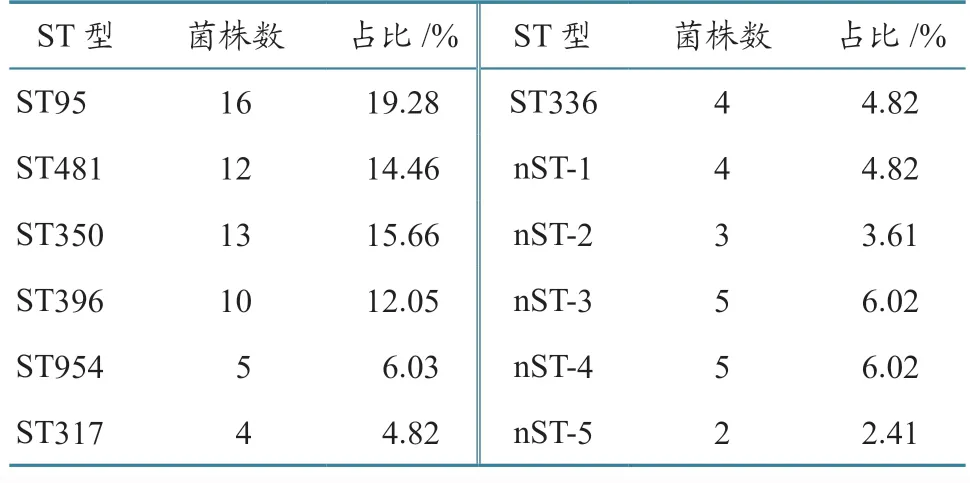
表7 APEC 的MLST 分型结果
2.5.5 致病性与血清型、毒力基因、种系发育群、MLST 之间相关性 由表8 可知:中、高致病菌株主要来自B2、B1 种群,高致病性菌株中主要血清型分布由高到底依次为O2、O1、O78,ST 型主要分布在ST95、ST481、ST350,毒力基因组合主要为I、II、III、IV、V;而低致病菌株主要来自A 群,对应的血清型及ST 型较少。综合分析,本次分离菌株致病性和优势血清型、优势ST 型、种群发育及毒力基因携带种类呈一定相关性,但整体分布无规则,非绝对性相关。

表8 APEC 种系发育群、血清型、MLST、毒力基因相关性
2.5.6 药物敏感试验 由表9 可知:83 株APEC对所选10 种受试抗生素呈不同程度耐药,其中对四环素和新生霉素耐药程度最强,耐药率分别为96.38%和92.77%;其次是氨苄西林、复方新诺明、克林霉素、氟苯尼考及庆大霉素,耐药率为79.52%~59.04%。大部分菌株对头孢西丁和丁胺卡那敏感,敏感率分别为81.93%和79.52%,对喹诺酮类(诺氟沙星)表现为中介和敏感的约各占40%。

表9 药物敏感性试验结果 单位:%
3 讨论
3.1 APEC 血清型
APEC 传播途径广泛,除通过加强卫生管理外,生产上主要依靠接种疫苗和药物来预防[21]。大肠杆菌血清型复杂,各地区流行血清型差异较大,同时各型间的交叉保护力不强,因此血清分型是评估APEC致病潜力最受认可的方法。戴建华等[22]报道,2018—2020 年江苏省部分地区鸭源APEC 主要血清型为O78(19.0%)、O65(14.3%)、O24(14.3%)和O1(11.9%)。张立伟等[12]报道,河北省鸡源大肠杆菌主要流行血清型为O78(26.79%)、O2(23.21%)、O157(17.86%)和O1(14.29%)。刘香敏[1]报道,山东等省部分地区鸡场优势血清型为O14、O35、O1、O2、O78、O88。而最近有研究[23]报道,O145 可能正在成为我国APEC 的主要血清型。本研究从湖南省部分地区规模鸡场的83 株APEC 中鉴定出15 种血清型,其中O2、O1、O78、O14 为主要流行血清型,在定型株中占比分别为19.28%、14.46%、12.05%、9.46%,优势血清型与大部分报道一致,另外还鉴定出O135、O141 等11 种血清型,提示湖南省APEC 血清型呈多样性分布。
3.2 APEC 毒力基因
基于APEC 对家禽业的重要影响,目前国内外对其检测方法以及致病机制的研究越来越多。大肠杆菌主要致病因子如F1 菌毛、P 菌毛、耶尔森菌强毒力岛(HPI)、摄铁系统、肠细胞脱落位点(LEE)毒力岛、Ⅲ型分泌系统2(ETT2 毒力岛)、溶血素(hlyF)、温度敏感性血凝素(Tsh)、侵袭素和空泡毒素成为近年来致病机制的研究热点[24-25]。刘华[26]利用毒力基因papC、iucD、tsh、irp2、iss建立一种同时检测APEC 5 种毒力基因的多重PCR 方法;吴剑梅等[27]对大肠杆菌Ⅲ型分泌系统2(ETT2)转录因子EivF 的功能研究发现,EivF 参与调控APEC 运动能力和在不良环境中的存活能力;Tu 等[28]发现irp2-fyuA基因簇是参与高致病性毒力岛(HPI)合成的主要基因;Asai等[29]研究表明,iutA、hlyF、iss、iroN和ompT这5 种基因与APEC 中高致病力密切相关;程雪梅等[30]研究发现,新疆和田地区鹅场禽致病性杆菌irp2基因检出率达98%;张跃东等[31]研究发现,鸽源APEC O55 型毒力基因fyuA、iss的检出率分别为66.7%、50.0%,基因irp-2、fimC、tsh检出率均为33.3%;徐亚亚等[32]研究发现,江苏省部分地区鸡源APEC 毒力基因iutA、iss检出率分别为90.0%、78.3%,且高致病株iutA、tsh、iroN、irp-2、iss和cvaC基因检出率显著高于低致病株(P<0.05)。本研究发现,83 株致病菌中irp-2、fyuA、iutA、fimC携带率均为100%,hlyF、iss携带率分别为74.69%、87.95%, 表明irp2、fyuA、iutA、fimC、hlyF、iss在各地区APEC 中携带率较高,与菌株高致病性有着重要的关系,但其相互作用机制还需进一步研究。
3.3 致病性与种群、血清型、MLST 相关性
Clermont 等[18]利用PCR 技术建立了大肠杆菌种系发育快速分型方法,可将大肠杆菌分为B1、B2、A 和D 型4 个种群。A 型常为环境共生菌,B1 型一般为环境共生菌和肠道内致病菌,B2 型主要为肠道外致病菌,D 型为肠道内致病菌[14]。王颖[33]报道,安徽省92 株APEC 属于A 群的有19株(20.65%),属于B1 群的有35 株(38.04%),属于B2 群的有20 株(21.74%),属于D 群的有18 株(19.57%),与本研究中83 株致病株中的高、中致病株主要属于B1、B2 群相一致。最近研究[34]表明,APEC(特别是属于序列类型ST95 和ST131,或O1、O2 和O18 血清型的分离株)是潜在的食源性人兽共患病病原体,也是人类肠外感染的病原菌,与人类尿路致病性大肠杆菌具有遗传相似性。本研究中,分离菌株血清型集中在O1、O2,ST 型集中在ST95,提示这些地区需加强对畜禽场禽群及饲养管理人员的大肠杆菌感染监测,做好卫生消毒,防止病原传播。
3.4 APEC 耐药性分析
大肠杆菌可通过染色体的改变,或质粒、转座子、整合子介导转移获得多种耐药机制,在遗传物质上稳定下来,并在水平和垂直方向上迅速转移和传播[35],给消除和控制细菌耐药性增加了难度。胡紫萌等[36]研究发现,广西地区69 株APEC 对氨苄西林(91.3%)、四环素(98.6%)高度耐药;李蕴玉等[37]研究发现,秦皇岛市APEC 对磺胺二甲氧嘧啶、磺胺间甲氧嘧啶、阿莫西林、林可霉素4 种药物的耐药率均为100%。本研究发现,湖南省部分地区规模肉鸡场APEC 对四环素、新生霉素、氨苄西林、复方新诺明、克林霉素、氟苯尼考等6种抗生素耐药率达60%以上,其中对四环素、氨苄西林的耐药率较高,与上述报道较相近,这可能与实际生产中普遍使用这几类抗生素有关,也可能与耐药基因水平传播有关。
4 结论
研究发现:湖南省肉鸡场流行的APEC 具有一定致病力,携带的毒力基因种类广、组合类型复杂,血清型和ST型多样,已对多种抗生素产生耐药。提示湖南省应加强对畜禽场禽群及饲养管理人员的大肠杆菌感染监测及耐药性监测,做好卫生消毒,建立科学的抗生素使用方案,防止病原及耐药性传播。
