Ⅱ型鹅星状病毒VP27 蛋白生物信息学分析
2024-05-07蒋欣芫吴晓艳于天浩张彦龙
蒋欣芫,吴晓艳,曹 章,赵 静,张 旭,于天浩,张彦龙
(东北林业大学野生动物与自然保护地学院,黑龙江哈尔滨 150040)
鹅星状病毒(goose astrovirus,GAstV)属于星状病毒科成员,是一种无囊膜、单股正链RNA病毒。雏鹅对GAstV 易感,感染后心包、肝、肾等内脏以及关节出现尿酸盐沉积等症状,发病率和病死率均高达50%以上[1]。GAstV 给我国养鹅业带来了严重经济损失。根据全序列核苷酸多样性,GAstV 可分为两个基因群,即GAstV-Ⅰ和GAstV- Ⅱ, 其中GAstV- Ⅱ发病率远高于GAstV-Ⅰ[2]。GAstV 基因组长度约为7.2 kb,包含1个5'非翻译区(UTR)、3个开放阅读框(ORF1a、ORF1b 和ORF2)、1 个3' UTR 和1 个多聚腺苷酸(Poly A)尾。ORF2 基因编码的衣壳蛋白由704个氨基酸构成,包括4 个功能域:S、P1、P2 和酸性C 末端结构域。其中,第425~665 位氨基酸属于P2 结构域,其编码的VP27 蛋白,又称刺突蛋白,位于病毒结构表面[3]。已有研究[4-5]表明,刺突蛋白参与细胞表面相关受体的识别及机体的免疫应答,可诱导机体产生中和抗体,是GAstV 的主要保护性抗原蛋白。
自第一例GAstV感染病例在我国被报道以来,该病已传播至我国各省份,并持续蔓延[6]。由于目前针对GAstV 各蛋白结构、功能和作用机制的研究有限,并且GAstV 具有传播速度快、突变率高和容易重组的特点,因此尚未研发出针对该病毒安全高效的商品化疫苗。本研究通过生物信息学方法对具有良好免疫原性GAstV-Ⅱ ZYL02 株的VP27蛋白结构与功能进行分析,进一步对其B 细胞抗原表位进行预测,以期为GAstV-Ⅱ疫苗研发提供理论支持。
1 材料与方法
1.1 毒株序列
GAstV-Ⅱ ZYL02 株,由东北林业大学野生动物与自然保护地学院分离并保存,经测序获得了其基因组序列(GenBank 登录号OM811460)。该毒株ORF2 基因编码704 个氨基酸,其中VP27 蛋白的氨基酸序列位于第425~665 位。ZYL02 株VP27基因开放阅读框推导的氨基酸序列:QVTPSLVYNFQGERQSTTESCSFLVFGIPQADSRSRYNANITFNVGYRGRTSTSFTLGTHNWWAVMTLSQTGVIFAPPAVGTGVCNTLATAIQHLNPELETAVLRVNTSTTSTGGQITELRNRLNIADGDYVISMGDPQGNRSALYFRNSDQKWVWLWAGDSNPGETFQSFKMPVLINWSVSDSQEQYNARVRMVQYANAQQQTLTDPEEDDDPLSDVTSLFDPTAEDETDFHLAVSLKTS。
1.2 方法
1.2.1 VP27 蛋白主要理化特性分析 利用Expasy-ProtParam(http://web.expasy.org/protparam/)在线软件,分析ZYL02 株VP27 蛋白氨基酸组成、等电点、原子组成及亲疏水性等理化性质。
1.2.2 VP27 蛋白亚细胞定位、跨膜结构域、信号肽分析 利用PSORT II Prediction 在线软件(http://psort.hgc.jp/form2.html),在线分析VP27 蛋白亚细胞定位;利用ProtScale 在线软件(https://web.expasy.org/protscale/),预测目标蛋白的亲疏水性;运 用SignalP 4.1(https://services.healthtech.dtu.dk/services/SignalP-4.1/)和TMHMM 2.0在线软件(https://services.healthtech.dtu.dk/services/TMHMM-2.0/), 分别预测VP27 蛋白是否含有信号肽和跨膜结构域。
1.2.3 VP27 蛋白二、三级结构预测 利用SOPMA 在线软件(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.plpage=npsa_sopma.html),预测VP27 蛋白二级结构特征,计算其所含的α-螺旋、β-折叠、β-转角、无规卷曲及扩展链的数目与百分比;采用Phyer2 在线软件(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index),建模并预测VP27 蛋白三级结构。
1.2.4 B 细胞表位预测及可视化 运用BepiPred-2.0(https://services.healthtech.dtu.dk/services/BepiPred-2.0/)和ABCpred(http://crdd.osdd.net/raghava/abcpred/)两个在线软件综合预测潜在B 细胞抗原表位,其中ABCpred 预测肽长度选择20 aa,阈值设为0.5。将上述预测得到的潜在B 细胞抗原表位通过ToxinPred2(https://webs.iiitd.edu.in/raghava/toxinpred2/)、VaxiJen v2.0(http://www.ddg-pharmfac.net/vaxijen/VaxiJen/VaxiJen.html)和IEDB(http://tools.iedb.org/main/)等在线软件分别进行毒性、抗原性、β-转角、表面可及性、灵活性和疏水性分析,以期筛选出优势B 细胞抗原表位,然后使用PyMOL 软件可视化优势B 细胞抗原表位。
2 结果与分析
2.1 VP27 蛋白理化性质分析
利用ProtParam 在线软件对ZYL02 株VP27蛋白进行理化性质分析。结果显示:该蛋白由20种241 个氨基酸组成,其中Thr 占比最高(10.8%),Cys 占比最低(0.8%);带正电荷残基数(Arg+Lys)共15 个,带负电荷残基数(Asp+Glu)共26 个(表1)。蛋白分子式为C1173H1794N324O382S6,分子质量为26.739 45 kDa,理论等电点为4.59,不稳定指数为41.8,脂肪指数为70.37,平均疏水性(GRAVY)为-0.418。根据ProtParam 软件“不稳定指数大于40 为不稳定蛋白,小于40 为稳定蛋白,GRAVY值在-2~2 范围内属于亲水性蛋白”的规定,判定VP27 为不稳定的亲水蛋白。

表1 ZYL02 株VP27 蛋白氨基酸组成
2.2 VP27 蛋白亲疏水性、亚细胞定位、跨膜区及信号肽预测
利用ProtScale 对ZYL02 株VP27 蛋白亲疏水性的预测结果(图1)显示:该蛋白多肽链中第24位氨基酸处疏水值最大,为2.067,第210 位氨基酸处疏水值最小,为-2.767,整条多肽链中亲水氨基酸残基数量多于疏水氨基酸残基。因此,综合分析VP27 为亲水性蛋白,与2.1 中预测结果一致。TMHMM Server v 2.0 和SignalP 4.1 在线软件预测结果(图2~3)显示,VP27 蛋白无跨膜区和信号肽。利用PSORT II Prediction 在线软件分析VP27蛋白亚细胞定位的结果显示,其定位于细胞质、细胞核、线粒体以及过氧化物酶体中的可能性分别为69.6%、17.4%、8.7%以及4.3%,即VP27 蛋白定位于细胞质的概率最高。
图3 ZYL02 株VP27 蛋白信号肽预测结果
2.3 VP27 蛋白二级、三级结构预测
利用SOPMA 在线软件对ZYL02 株VP27 蛋白二级结构的预测结果(图4)显示:VP27 蛋白中101 个氨基酸组成无规卷曲(random coil,Cc),占总氨基酸的41.91%;70 个氨基酸构成延伸链(extended strand,Be),约占总氨基酸的29.05%;54 个氨基酸构成α 螺旋(alpha helix,Hh),约占总氨基酸的22.41%;16 个氨基酸构成β 转角(beta turn,Tt),约占总氨基酸的6.64%。结果表明,VP27 蛋白二级结构的主要构成为无规卷曲,其次是延伸链。进一步通过Pyhre 在线软件以PDB ID 3ts3 为模板进行VP27 蛋白同源建模,预测的模型覆盖率为79%,置信度为100%。使用PyMOL 软件对该模型进行了可视化,并对α 螺旋、β 折叠和无规卷曲进行了标记,具体结果见图5。
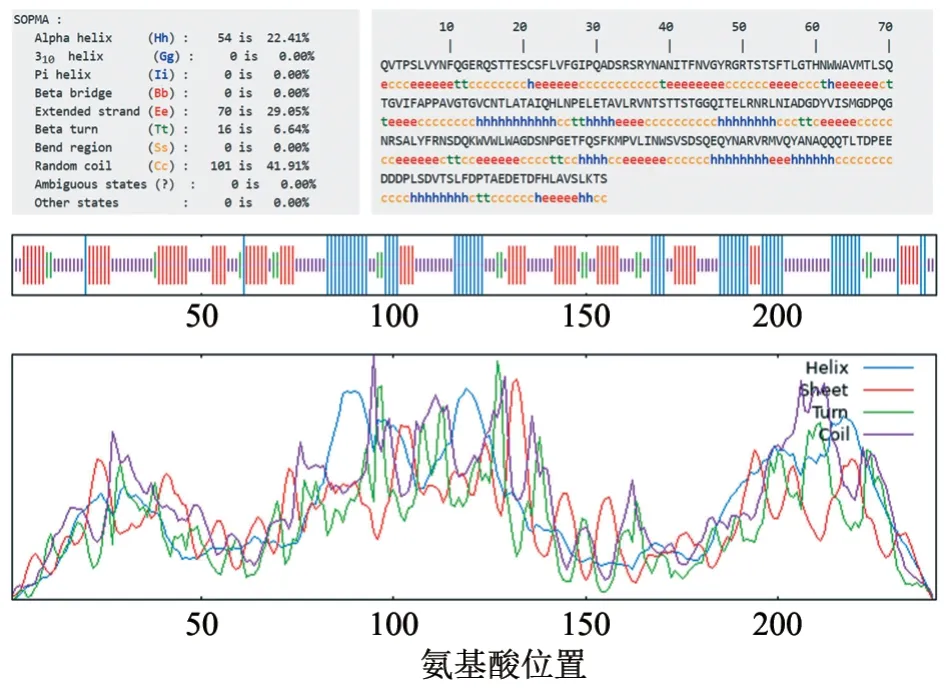
图4 ZYL02 株VP27 蛋白二级结构预测结果

图5 ZYL02 株VP27 蛋白三级结构的可视化模型
2.4 B 细胞表位预测与表位的三维空间位置分析
为更好地评价由BepiPred-2.0 和ABCpred 在线软件预测获得的26 条VP27 蛋白B 细胞表位(表2),利用IEDB 在线软件从抗原性、β-转角结构、表面可及性、柔韧性和亲水性5 个方面进行预测,分别选取得分前10 位的氨基酸序列(表3),再结合VP27 蛋白的二级结构,以及ToxinPred2 和VaxiJen v2 在线软件的预测结果综合分析,共筛选出4 条优势抗原表位(表2),分别位于26~41 aa(FGIPQADSRSRYNANI)、48~57 aa(RGRTSTSFTL)、111~126 aa(TSTGGQITELRNRLNI)、174~189 aa(PVLINWSVSDSQEQYN)。这些表位具有无毒性,抗原性强,处于β-转角,表面可及性大和亲水性高等特点。随后,利用PyMOL 软件将预测的4条优势抗原表位在三级结构模型中进行可视化(图6),从而获得各优势B 细胞抗原表位的相对位置。

图6 ZYL02 株VP27 蛋白优势抗原表位空间结构

表3 ZYL02 株VP27 蛋白IEDB 预测结果
3 讨论
自2017 年Zhang 等[7]首次分离到GAstV 以来,我国各养鹅地区均有关于该病毒的报道。因GAstV毒株具有突变率高、容易重组等特点,其感染防控工作面临较大挑战。现阶段,人们对GAstV 主要抗原蛋白的结构、功能及其与宿主的作用机制认识有限[7]。本研究利用生物信息学软件解析了ZYL02 株VP27 蛋白,旨在探究VP27 蛋白中可作为潜在疫苗的肽段,不仅节省了试验时间和成本,更为制备安全高效的疫苗打下了坚实基础[8-9]。
VP27 蛋白是构成星状病毒刺突的部分,具有诱导中和抗体的功能[10],且本实验室保存毒株ZYL02 具有良好的免疫原性[11]。GAstV-Ⅱ ZYL02株VP27 蛋白分析结果显示,该蛋白由241 个氨基酸组成,理论等电点为4.59,不稳定系数为41.8,GRAVY 值为-0.418,因此推测VP27 是不稳定的亲水蛋白,这可为病毒蛋白的分离纯化试验提供先验信息。亚细胞定位结果显示,该蛋白主要定位于细胞质,无跨膜结构域和信号肽,推测其可能为非分泌型蛋白,提示真核细胞、大肠杆菌、昆虫细胞-杆状病毒等多种表达系统都可用于该蛋白的高效表达。二级和三级结构预测结果显示,无规卷曲占比最高(41.91%)。因无规卷曲相对松散且易发生扭曲盘旋,多突出在蛋白质表面,有利于与抗体结合,所以该结构特点提示VP27 蛋白产生抗原决定簇区域的概率较高[12]。Phyer2 在线软件以PDB ID 3ts3 为模板构建VP27 蛋白模型,预测的模型覆盖率为75%,置信度达100%,说明构建的模型质量较好,结构合理可靠。建模结果显示,该蛋白是由β 链紧密堆积形成的疏水核和α-螺旋及无规卷曲围绕在外侧构成,与其他禽星状病毒结构相似[13],为后文B 细胞抗原表位预测提供了支撑。B 细胞介导体液免疫和细胞免疫,具有识别多种抗原的作用,因此对B 细胞抗原表位的预测极其重要[14]。在对B 细胞抗原表位的预测中,通过BepiPred-2.0 和ABCpred 在线软件共预测出26 条抗原表位。本研究根据不同分析方法,将二级结构为无规卷曲和β-转角的区域,与抗原性强、无毒性和表面可及性大的区域结合分析,综合得分高的重叠肽段作为筛选抗原表位的优先选项,最终筛选出4 条优势B 细胞抗原表位,分别位于48~57 aa(RGRTSTSFTL)、26~41 aa(FGIPQADSRSRYNANI)、111~126 aa(TSTGGQITELRNRLNI)、174~189 aa(PVLINWSVSDSQEQYN),优势B 细胞抗原表位具有更高诱导机体相关免疫应答的概率,可供疫苗设计与研究。已有研究[15]表明,B 淋巴细胞受体(BCR)能识别构象表位和线性表位,且识别位置通常处于抗原分子表面。在三维结构中,利用PyMOL 软件对筛选出的4 条优势表位进行定位,发现4 条优势表位均处于VP27 蛋白的顶端表面突出部分,进一步证实了预测的准确可靠。
综上所述,本研究利用生物信息学软件对GAstV-II ZYL02 株VP27 蛋白的特性、结构进行了较为全面系统的分析,并且筛选出4 条基于潜在表位之上的优势抗原表位,为了解VP27 蛋白的生物学功能以及对GAstV 潜在免疫靶点的研究提供了理论及数据依据,也为研制优质高效的GAstV 疫苗奠定了基础。
