紫玉米花色苷辅色配方优化及其对紫玉米品质的影响
2024-05-06庞文倩
庞文倩
于 蕊1,3
李大婧1
刘春菊1
白 冰2
(1. 江苏省农业科学院农产品加工研究所,江苏 南京 210014;2. 沈阳农业大学食品学院,辽宁 沈阳 110161;3. 南京农业大学食品科学技术学院,江苏 南京 210014)
紫玉米(ZeamayzL.)为禾本科玉米属植物,其籽粒和穗丝均呈紫红色[1]。紫玉米不仅色泽独特,且因富含花色苷而备受关注。Aoki等[2]研究发现,紫玉米色素提取物中73.3%为矢车菊-3-O-葡萄糖苷,9.3%为天竺葵-3-O-葡萄糖苷,17.5%为芍药-3-O-葡萄糖苷,其中矢车菊素及芍药素呈紫红色,天竺葵素呈红橙色,这是紫玉米色泽呈现紫红色的主要原因。花色苷是一种有效的抗氧化剂,有助于保护身体免受自由基的损害,花色苷与抗炎症、抗氧化、抗糖尿病、抗癌等有关,同时促进血液循环,调节血压,控制胆固醇水平等[3-4]。
紫玉米花色苷的性质很不稳定,除了受本身结构的影响外,温度、pH值、光照、氧气、过氧化物和辅色剂等因素也都易使花色苷的稳定性发生改变。当花色苷溶液受热时,花色苷黄盐阳离子(红色)平衡向着查耳酮C(无色)和假碱B(无色)方向移动,使花色苷黄盐阳离子(红色)减少,花色苷含量降低[5]。添加辅色剂可以有效提高紫玉米花色苷的稳定性,其原理主要是通过花色苷与辅色剂间的共色作用来减缓花色苷的降解速率[6]。糖作为辅色剂降低了紫玉米的水分活度,导致紫玉米花色苷的降解反应速率下降,生成假碱式结构的速度减慢,从而使花色苷得到了保护[7]。有机酸中的羟基与花色苷中的黄阳盐离子发生分子间非共价键辅色作用,提高了花色苷的稳定性,或者有机酸与花色苷之间相互作用保护发色团免受亲核攻击,从而提高了花色苷的稳定性[8]。花色苷黄阳盐离子和果胶游离羧基之间的离子相互作用,以及花色苷的芳环堆积作用提高了花色苷的稳定性[9]。管敬喜等[10]研究发现,10%果糖对毛葡萄皮渣的花色苷有辅色作用,10%果糖处理后毛葡萄皮渣花色苷的吸光值比对照组高;楼乐燕等[11]研究发现,随着单宁酸浓度的增加,杨梅花色苷最大吸收波长发生红移,花色苷稳定性明显提高;麦日艳古·亚生等[12]研究发现,果胶通过与花色苷分子间的相互作用提高了果汁花色苷体系的稳定性。
研究在前期单因素试验的基础上,拟以紫玉米为研究对象,优化以果糖、单宁酸和果胶为辅色剂的辅色配方,以期为提高紫玉米花色苷稳定性提供理论依据。
1 材料与方法
1.1 试验材料与试剂
紫玉米:苏科糯1505,江苏省农业科学院;
无水乙醇、盐酸、氯化钾、无水乙酸钠、磷酸、氯化铁、过硫酸钾、乙酸、氢氧化钠、甲醇、抗坏血酸:食品级,国药集团化学试剂有限公司;
果糖、单宁酸、果胶:食品级,河南万邦化工科技有限公司。
1.2 主要仪器
液相色谱仪:Agilent 1200型,美国安捷伦科技有限公司;
手提式高压蒸汽杀菌器:XFS-280MB型,上海申安医疗器械厂;
电热恒温水槽:DK-8D型,上海一恒科技有限公司;
分光测色仪:CM-700d1型,上海精密科学仪器有限公司;
酶标仪:ELX-808IU型,美国伯腾仪器有限公司;
研磨机:A-11-B-S025型,德国IKA集团/艾卡(广州)仪器设备有限公司;
台式高速离心机:TG16-WS型,长沙湘仪离心机仪器有限公司;
pH计:FE20型,梅特勒—托利多仪器(上海)有限公司;
超声波粉碎机:JY 92-Ⅱ型,宁波新芝生科技股份有限公司;
电子舌系统:ASTREE型,法国Alpha MOS公司;
千分之一天平:JA-3003型,上海舜宇恒平科学仪器有限公司;
海尔电冰柜:DC/BD-379H型,海尔集团海尔电冰箱有限公司。
1.3 试验方法
1.3.1 样品制备 紫玉米于乳熟期采收,要求紫玉米颗粒饱满,色泽、形状相似,无病虫害,无机械损伤。将紫玉米先后置于果糖溶液和单宁酸溶液中各浸渍30 min,再于其表面涂抹果胶溶液,待控干水分后,将处理后的紫玉米在120 ℃下热加工30 min,对紫玉米随机取粒进行指标测定,每组处理为3根形状大小相似的紫玉米。
1.3.2 试验设计 在前期单因素试验的基础上,采用响应面分析法设计试验,以果糖、单宁酸和果胶质量分数为自变量,如表1所示,以综合评分为响应值,设计17组处理方式,通过响应面分析进行紫玉米花色苷最佳组合配方的优化。

表1 响应面分析因素及水平
1.3.3 总花色苷提取和测定 采用pH示差法[13]测定紫玉米花色苷含量。将处理后的紫玉米用液氮速冻,再用研磨机碾磨成均匀粉末状,准确称取1.000 g,添加20 mL无水乙醇—0.2 mol/L盐酸溶液(V无水乙醇∶V盐酸=3∶2),于400 W超声条件下提取30 min,50 ℃水浴浸提60 min,4 ℃、8 000 r/min离心10 min,分别用pH 1.0的氯化钾缓冲液和pH 4.5的无水乙酸钠缓冲液将上清液稀释10倍,常温下避光平衡15 min,再于525 nm和700 nm处测定花色苷吸光值,按式(1)、式(2)计算花色苷含量。
A=(A525 nm-A700 nm)pH=1-(A525 nm-A700 nm)pH=4.5,
(1)
(2)
式中:
A——辅色后总花色苷吸光值;
A525 nm——525 nm处总花色苷吸光值;
A700 nm——700 nm处总花色苷吸光值;
C——辅色后提取液中总花色苷质量浓度,mg/L;
MW——矢车菊素-3-O-葡萄糖苷的相对分子质量,449.2;
DF——稀释倍数;
ε——消光系数,26 900 L/(mol·cm);
L——光程,1.0 cm。
1.3.4 花色苷组分测定
(1) 花色苷标准溶液制备:紫玉米中主要含有3种花色苷,分别精密称取3种标准品各1.000 mg,用质量分数为10%盐酸甲醇溶液溶解并定容至10 mL容量瓶中,充分摇匀,即为100 mg/L标准溶液,并逐级稀释为1.0,12.5,20.0,50.0 mg/L,再用HPLC-DAD法测定标准溶液的标准曲线,于-20 ℃下密闭的棕色玻璃瓶中,保存有效期为6个月。
(2) 紫玉米花色苷的标准曲线绘制及含量测定:采用HPLC-DAD法对紫玉米花色苷提取液进行含量测定,分析柱为Agilent-ZORBAXSB-C18色谱柱(4.6 mm×250.0 mm,5 μm),动相A为1%甲酸水溶液,流动相B为1%甲酸乙腈溶液。梯度洗脱:0 min 8% B;0~2 min 12% B;2~5 min 18% B;5~10 min 20% B;10~12 min 25% B;12~15 min 30% B;15~18 min 45% B;18~20 min 80% B;20~22 min 8% B;22~30 min 8% B;流速0.8 mL/min,柱温35 ℃,检测波长530 nm,进样体积20 μL[14]。
1.3.5 色泽测定 采用CM-700d1型分光测色仪测定紫玉米样品的L*、a*、b*值。基于L*、a*、b*值计算总色差。
(3)
式中:
L0、a0、b0——未处理紫玉米亮度值、红绿值、黄蓝值;
L*、a*、b*、ΔE——辅色后紫玉米的亮度值、红绿值、黄蓝值、总色差。
1.3.6 质地测定 采用CT3 25K型质构仪测定,测试条件:探头型号为TA25/1000圆柱型探头,测试类型为压缩,测试速度0.50 mm/s,测后返回速度0.50 mm/s,测试距离7 mm,每个相同样品测定3次,取平均值作为结果,根据质地剖面的力度—时间曲线,获取硬度、弹性、胶着性、咀嚼性、内聚性等信息[15]。
1.3.7 滋味测定 准确称取50.000 g紫玉米粉末置于料理机中,加入200 mL蒸馏水,搅拌均匀后持续30 s,随后,以3 000 r/min离心5 min,收集上清液进行测定。根据文献[16],修改如下:选用AAE、GL1、CTO、CAO、AE1、COO味觉传感器及对应2个参比传感器,每个相同样品测定3次,取平均值作为结果。
1.3.8 抗氧化活性测定
(1) DPPH自由基清除率测定:参照文献[17],按式(4)计算DPPH自由基清除率。
(4)
式中:
I——DPPH自由基清除率,%;
Ai——添加样品的吸光值;
Aj——添加无水乙醇和样品的吸光值;
Ac——添加无水乙醇的吸光值。
(2) ABTS自由基清除率测定:参照文献[17],按式(5)计算ABTS自由基清除率。
(5)
式中:
I——ABTS自由基清除率,%;
A0——不加清除剂的吸光值;
A1——加入清除剂后的吸光值。
(3) 铁离子还原能力:参照文献[17]。
1.3.9 综合评分 感官评价小组为20名具有感官评价经验的老师和学生构成,评价指标为色泽、滋味、外观、质地。参照文献[18],设计紫玉米花色苷综合评分表,如表2所示,由1.3.3可知紫玉米总花色苷含量,综合评分由花色苷评分和感官评分共同组成。

表2 紫玉米花色苷综合评分
1.4 数据统计
采用 Microsoft Excel 2016、SPSS 26.0和OriginPro 8.6软件进行数据处理和显著性分析。
2 结果与分析
2.1 响应面试验结果
2.1.1 响应面试验设计与显著性分析 响应面试验设计与结果见表3。
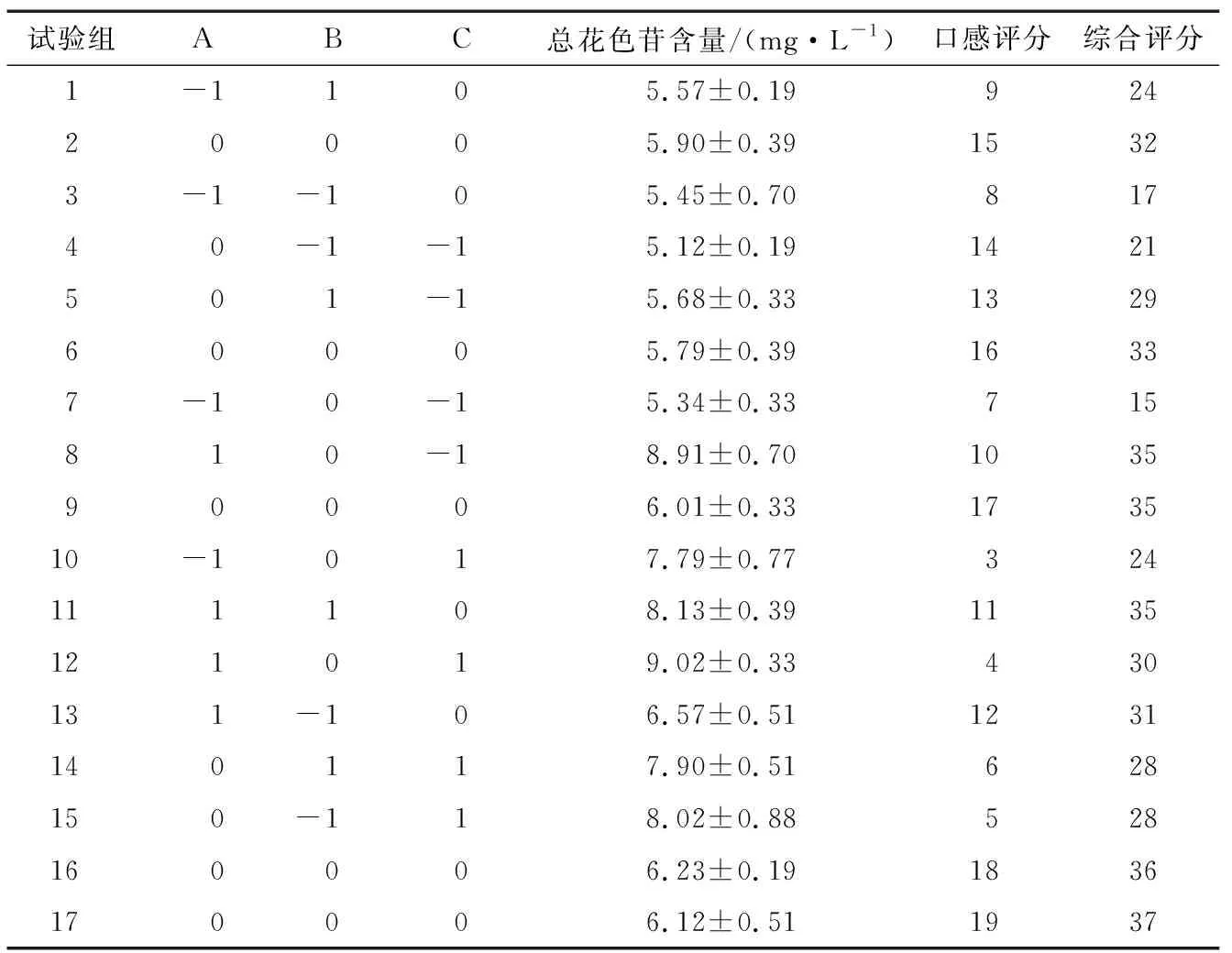
表3 响应面试验设计与结果

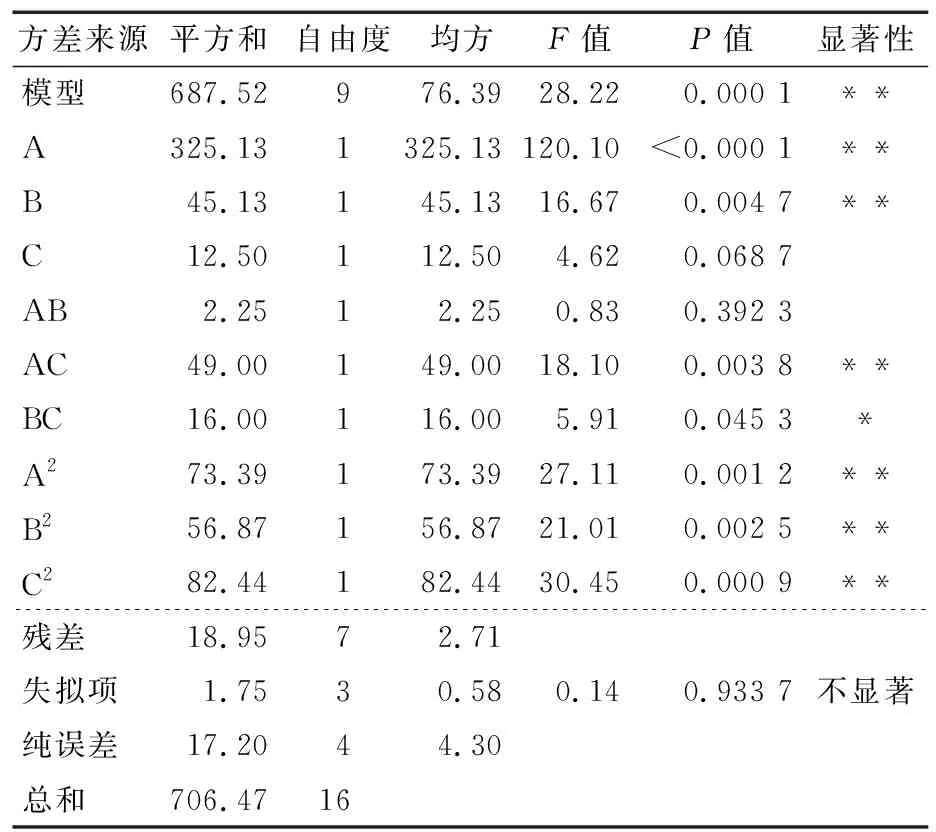
表4 回归方程方差分析表†
另外,A、B、AC、A2、B2、C2对紫玉米综合评分影响均极显著(P<0.01),BC对紫玉米综合评分影响显著(P>0.05),通过对比F值可见对紫玉米综合评分的影响程度强弱顺序为果糖>单宁酸>果胶,即不同浸渍涂膜处理时,果糖对紫玉米综合评分的影响程度要大于单宁酸和果胶。
2.1.2 响应面分析与优化 如图1所示,果糖和单宁酸的3D响应曲面图坡度平缓,等高线图接近圆形,表明二者的交互作用不显著;果糖和果胶、单宁酸和果胶的等高线图接近椭圆,3D响应曲面图陡峭,表明二者的交互作用显著。
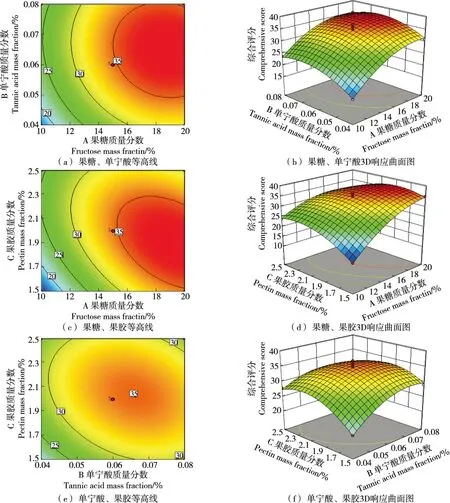
图1 各因素交互作用对紫玉米综合评分的影响
2.1.3 最佳辅色配方的确定 通过响应面软件优化预测出最佳工艺条件为:果糖质量分数19.230%,单宁酸质量分数0.066%,果胶质量分数1.868%,紫玉米总花色苷的综合评分为37.499分。考虑实际操作修订为果糖质量分数19%,单宁酸质量分数0.07%和果胶质量分数1.9%,在此条件下进行验证实验,试验所得结果的实际值与预测值的综合评分分别为37.499和37.333,相对误差为0.443%,表明该模型有较好的预测作用,合理可行。
2.2 最佳辅色配方与未处理紫玉米的品质差异
2.2.1 花色苷组分和色泽 如表5所示,经最佳辅色配方处理后,紫玉米花色苷组分及总花色苷含量均大于未处理的;矢车菊-3-O-葡萄糖苷、天竺葵-3-O-葡萄糖苷和芍药-3-O-葡萄糖苷含量分别增加了77.64%,64.82%,54.75%,总花色苷含量增加了67.98%。说明辅色处理显著提高了紫玉米花色苷的稳定性。Daravingas等[19]在对黑莓的研究中发现,10%果糖对花色苷具有明显的辅色作用。潘颖等[20]在对紫甘蓝的研究中发现,单宁酸质量浓度增加到0.1 mg/mL时花色苷吸光值增加了59.70%。Buchweitz等[9]研究发现,添加果胶对不同来源的花色苷稳定性有不同的效果,其中对草莓花色苷的辅色效果最好。果糖作为辅色剂降低了水分活度,使花色苷的降解反应速率下降,生成假碱式结构的速度减慢,花色苷得到了保护,单宁酸中的羟基与花色苷中的黄阳盐离子(AH+)发生分子间非共价键辅色作用,提高了花色苷的稳定性,花色苷黄阳盐离子(AH+)和果胶游离羧基之间的离子相互作用以及花色苷的芳环堆积作用提高了花色苷的稳定性[21]。

表5 不同处理之间花色苷组分含量的差异
如表6所示,与未处理紫玉米相比,经最佳辅色配方处理后,紫玉米色泽L*值、b*值和ΔE值分别下降了26.47%,54.23%,66.30%,a*值增加了78.38%,紫玉米花色苷含量与a*值呈正相关,花色苷含量越高,a*值越大,紫玉米色泽越好,说明经辅色处理后紫玉米色泽明显改善。紫玉米经过浸渍涂膜处理,紫玉米表面的保护作用逐渐增加,阻止酶与底物的接触,氧化反应程度下降,紫玉米色泽得以保护[22]。

表6 不同处理之间色泽的差异
2.2.2 质地和滋味 如表7所示,与未处理的紫玉米相比,经最佳辅色配方处理后紫玉米的硬度、胶着性、咀嚼性分别增加了35.19%,7.21%,4.10%,弹性、内聚性降低了3.97%,33.33%,紫玉米质地得到显著改善(P<0.05)。这可能是因为果糖、单宁酸浸渍处理改变了紫玉米细胞壁孔室结构和强度变化,使其组织结构发生变化,果胶在紫玉米表皮形成保护膜,使紫玉米表皮硬度增加,咀嚼性增加,弹性、内聚性降低,胶着性增加。
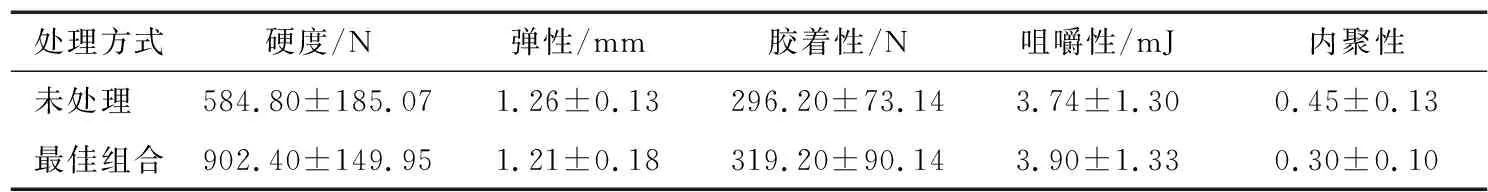
表7 不同处理之间质地的差异
以未处理的紫玉米为对照,并将其各滋味指标相对强度值定义为0。由图2可知,最佳组合和未处理紫玉米的苦味、涩味、涩的回味的各个点基本汇于一处,说明两者在这几个滋味品质上差异不大,而酸味、甜味、咸味、鲜味、苦的回味及鲜的回味的各点分布较近,说明两者在这几个滋味品质上存在差异。这可能是浸渍液中的果糖增加了紫玉米的甜味,单宁酸增加了酸味,果胶在紫玉米的表面形成了保护层,3种辅色剂的添加对紫玉米的滋味产生一定的影响。
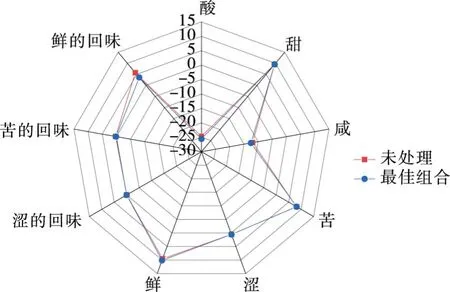
图2 电子舌滋味强度雷达图谱
2.2.3 抗氧化活性 由图3(a)可知,在质量浓度0.02~0.06 mg/mL范围内,未处理的紫玉米花色苷对DPPH自由基的清除率为31%~70%,经最佳辅色配方处理的对DPPH自由基的清除率为39%~79%,二者均显示出较强的DPPH自由基清除能力。未处理和经辅色处理的紫玉米花色苷对DPPH自由基清除能力均随其质量浓度的增加而增加,最佳组合的DPPH自由基清除能力显著大于未处理的紫玉米花色苷(P<0.05)。

图3 辅色处理对紫玉米花色苷抗氧化活性的影响
由图3(b)可知,在质量浓度0.02~0.06 mg/mL范围内,未处理的紫玉米花色苷对ABTS自由基的清除率为17%~61%,经最佳辅色配方处理的对ABTS自由基的清除率为27%~67%。质量浓度<0.06 mg/mL时,ABTS自由基清除率增长迅速,质量浓度>0.06 mg/mL时,增长速率减慢,但两者均表现出较强的清除能力。
由图3(c)可知,在质量浓度0.02~0.06 mg/mL范围内,未处理的紫玉米花色苷对铁离子还原能力为52%~72%,经最佳辅色配方处理的对铁离子还原能力为54%~74%,二者对铁离子还原能力随其质量浓度的增加而增加。当质量浓度为0.06 mg/mL时,最佳组合的铁离子还原能力与未处理紫玉米花色苷的差异最大。
综上所述,紫玉米经过果糖、单宁酸和果胶辅色处理后,提高了紫玉米花色苷的抗氧化活性。
3 结论
研究以果糖、单宁酸和果胶作为辅色剂,分析了不同组合方式对紫玉米花色苷辅色效果的影响。通过响应面分析法,优化得出果糖质量分数19%、单宁酸质量分数0.07%、果胶质量分数1.9%的组合对紫玉米花色苷的辅色效果最佳。与未处理的紫玉米相比,最佳组合配方优化后紫玉米花色苷组分、色泽、质地、滋味和抗氧化活性均能有效提升。
