基于转录组测序分析葡萄籽原花青素对HepG2细胞基因及其相关功能的影响
2024-05-06郑万财
郑万财
党 斌1,2
张 迹3
罗巧玉4
冯作山5
(1. 青海大学农林科学院青藏高原种质资源研究与利用实验室,青海 西宁 810023;2. 青海省青藏高原农产品加工重点实验室,青海 西宁 810023;3. 淮阴师范学院生命科学学院,江苏 淮安 223300;4. 青海师范大学生命科学学院,青海 西宁 810023;5. 新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830000)
近年来,对植物中的活性成分的分析成为研究热点。其中,原花青素(procyanidins,PCs)作为一类重要的植物次生代谢产物,具有抗氧化、抗炎、抗肿瘤等多种生物活性[1-5]。然而,原花青素对人体细胞的影响及其相关功能尚不完全清楚。原花青素是植物中广泛存在的酚类化合物[6-8],主要被应用于保健食品、功能性食品和生物医药等方面的开发利用[9-11]。目前,HepG2细胞作为人类肝癌细胞系,在肝癌研究中被广泛应用。通过研究原花青素对HepG2细胞的影响,可以探索其对肝癌的潜在治疗作用。然而,有关原花青素对HepG2细胞及其相关功能的影响机制还存在许多未知之处[12-15]。中国肝癌发病总数占全球肝癌病人总数的50%,已成为影响人们生命健康的主要疾病[16]。化学疗法是肝癌中最常用的治疗方法,由于癌细胞的剂量限制和耐药性,化学药物不能完全有效地治疗癌症[17]。
研究拟采用转录组测序(RNA-Seq)技术[18-20],通过分析HepG2细胞在原花青素处理前后的基因表达差异,来鉴定潜在的关键基因和通路。利用RNA-Seq技术研究葡萄籽原花青素对HepG2细胞的作用机制,为进一步研究其在肝癌治疗中的应用提供依据。同时,也有助于拓展对原花青素的认识,并为开发植物活性成分的药物提供新的思路和方向。
1 材料与方法
1.1 材料与试剂
葡萄籽原花青素:原花青素质量分数>95%,四川省维克奇生物科技有限公司;
RPMI 1640培养基、胎牛血清:美国Corning公司;
HepG2细胞:北京中科院生物化学和细胞生物学研究所;
Real-time试剂盒:美国BIO-RAD公司;
琼脂糖:荷兰Duchefa Biochemie公司;
Trizol:美国Ambion公司。
1.2 仪器与设备
分析天平:BT25S型,北京赛多利斯仪器系统有限公司;
真空冷冻干燥机:FD-1A-50型,德国Christ公司;
台式高速冷冻离心机:5810R型,德国Eppendorf公司;
PCR扩增仪:T100 Thermal型,德国Eppendorf公司;
酶标仪:Infinite M200 Pro型,瑞士Tecan公司;
超微量紫外可见光分光光度计:NanoDrop One型,美国Thermo公司;
二氧化碳培养箱:HERACELL I50i型,日本SANYO公司;
PCR电泳槽:Power PacTMHC型,美国BIO-RAD公司。
1.3 试验方法
1.3.1 细胞培养及处理 取对数生长期人肝癌HepG2细胞于37 ℃、体积分数为5%的CO2培养箱中培养,每3 d传代1次,当细胞贴壁达到70%时,以体积分数为0.25%的胰酶消化传代。预试验采用不同质量浓度的原花青素(5,10,15,20,25 g/mL)处理HepG2细胞24,48 h,以确认后续转录组处理的原花青素最适质量浓度及时间。选取50 μg/mL的虾青素添加到HepG2细胞中,处理48 h;另添加等量1%的DMSO作为溶剂对照组。
1.3.2 RNA提取和质量检测 采用Trizol试剂法[21]提取总RNA,每组3个重复。利用紫外分光光度计测定RNA的浓度和纯度;提取样本的总RNA后,通过常规试剂盒去除rRNA,将mRNA富集。进一步将富集得到的mRNA反转录形成双链cDNA,修复cDNA双末端后,加上接头,PCR扩增构建上机文库。通过带有Oligo(dT)的磁珠富集具有polyA尾巴的真核mRNA后,用超声波将mRNA打断。以片段化的mRNA为模板,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成cDNA第一条链,随后用RNaseH降解RNA链,并在DNA polymerase I 体系下,以dNTPs为原料合成cDNA第二条链。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选200 bp左右的cDNA,进行PCR扩增并再次使用AMPure XP beads纯化PCR产物,最终获得文库。为保证测序质量,采用严格的质控构建文库。
1.3.3 转录组测序和差异基因分析 由广州基迪奥生物科技有限公司利用Illumina HiseqTM 4000system平台进行转录组测序。对测序得到的原始序列(raw reads)进行过滤,去除接头序列、重复冗余序列和低质量的reads,得到高质量序列(clean reads)。利用HISAT2[22]软件开展基于参考基因组的比对分析。根据HISAT2的比对结果,利用Stringtie重构转录本,并计算每个样本中所有基因的表达量。基于基因表达量信息,利用R(http://www.r-project.org/)开展主成分分析(PCA),基因差异表达分析的数据为基因表达水平分析中得到的reads count数据,使用DESeq2[23]软件分析筛选差异表达基因,差异倍数筛选FDR<0.05 且 |log2FC|>1的基因为显著差异基因。
利用GO和KEGG数据库对差异表达基因进行功能注释,并采用FPKM值反映基因的表达量。
1.4 数据处理
利用IBM SPSS Statistics 22软件、计算机软件R(版本3.5.0)、Excel对数据进行分析并作图。
2 结果与分析
2.1 葡萄籽原花青素对HepG2细胞转录组数据分析
由表1可知,最小Q20值为98.04%,最小Q30值为94.31%,说明获得的clean reads质量较高,重复性在误差范围内,完全满足后续生物学及相关分析的要求。

表1 数据质量和参考序列比对分析结果†
由图1可知,Control组和PCs组各自聚为一类,且Control组的重复性较好。每两个样品之间的皮尔斯(Pearson)相关系数均>0.99,说明同一处理组样品间差异较少,组内稳定性较好;不同组样品间的相关性均>0.90,不同处理组之间差异表达基因较少,说明不同组之间差异较小。

图1 葡萄原花青素对HepG2细胞转录组主成分和相关系数分析
2.2 葡萄籽原花青素对HepG2细胞转录组差异表达基因分析
原花青素处理细胞后,通过两组转录本对比,对基因表达进行层次聚类分析(图2、图3),并筛选差异基因(表达倍数差异log2FC>2,显著性P-value<0.05)结果显示,共有2 554个差异基因,其中有887个上调基因和1 667个下调基因。由图4、图5可知,在PCs的作用下,细胞HepG2差异表达基因表达上调与表达下调的数量相比,下调的基因数高于上调的。原花青素的生物活性主要是清除自由基抗氧化,原花青素通过抑制细胞生长增殖、诱导细胞程序性凋亡、调节核因子NF-κB的活性、阻滞细胞周期、抑制目标基因的表达等达到其抗癌作用[24]。课题组[25]前期研究表明:小剂量PCs(50 μg/mL)即能诱导HepG2细胞凋亡,与空白对照相比差异极显著(P<0.01),且PCs对HepG2细胞增殖的抑制作用具有时间和浓度依赖关系。通过两组样本中差异表达基因分析,原花青素可明显抑制HepG细胞中基因的转录水平。

深灰色代表上调基因;浅灰色代表下调基因;白色代表基因无显著差异
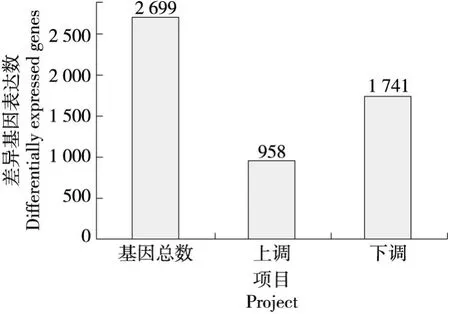
图3 差异表达基因统计

图4 HepG2细胞葡萄籽原花青素处理条件下的差异基因表达火山图

A1. 细胞 A2. 细胞部分 A3. 细胞器 A4. 细胞器部分 A5. 大分子复合物 A6. 膜封闭腔 A7. 膜 A8. 细胞外区域 A9. 细胞外区域部分 A10. 细胞外基质 B1. 结合 B2. 催化活性 B3. 核酸结合转录因子活性 B4. 转运活性 B5. 分子功能调节 B6. 结构分子活性 B7. 转录因子活性 C1. 细胞过程 C2. 单一生物过程 C3. 代谢过程 C4. 应激效应 C5. 生物调节 C6. 细胞组分组织或合成 C7. 发育进程 C8. 信号转导 C9. 胞质定位 C10. 生物调控过程 C11. 免疫系统过程 C12. 多细胞组织过程 C13. 运动调节 C14. 生物黏附 C15. 繁殖调节 C16. 生长调节 C17. 多组织过程
2.3 葡萄籽原花青素对HepG2细胞转录组GO功能分析
对葡萄籽原花青素处理的HepG2细胞转录组数据进行差异表达基因GO功能富集分析。每组差异基因被注释到生物学过程、分子功能、细胞组分和3个GO分类中(图5),2 279个差异基因富集到166个分子功能通路中,具有显著差异的通路依次为细胞过程、单一生物过程、代谢过程、刺激反应、生物调节、细胞组分组织或合成、发育进程、信号转导、胞质定位、生物调控过程、免疫系统过程、多细胞组织过程、运动调节、生物黏附、繁殖调节、生长调节、多组织过程。2 286个差异基因富集到62个分子功能通路中,具有显著差异的通路依次为结合、催化活性、核酸结合转录因子活性、转运活性、分子功能调节、结构分子活性、转录因子活性。2 400个差异基因富集到60个细胞组分通路中,具有显著差异的通路依次为细胞、细胞部分、细胞器、细胞器部分、大分子复合物、膜封闭腔、膜、细胞外区域、细胞外区域部分、细胞外基质。
葡萄籽原花青素处理后主要富集到的生物学过程为细胞过程、代谢过程、生物调控过程、免疫系统过程、繁殖调节、生长调节,符合原花青素在肝癌细胞上的作用机制[26]。杜宏等[27]研究发现,莲房原花青素可诱导肝癌细胞凋亡,抑制其生长且呈浓度依赖性,通过对肝癌细胞周期比率分析显示,莲房原花青素具有抑制肝癌细胞DNA合成,阻滞其增殖的作用。梁惠敏等[28]研究发现,原花青素可抑制肝癌细胞的生长,且浓度和时间呈剂量关系,原花青素对肝癌细胞SMMC27721具有抑制增殖和促进肝癌细胞分化作用,进一步研究发现,原花青素通过清除活性氧酶活降低脂质过氧化反应抑制细胞增殖,促进细胞凋亡。许慧等[29]研究发现,莲房原花青素可降低肝癌细胞合成DNA的能力,使其停滞于S期,继而抑制细胞的生长介导其凋亡。综上,原花青素通过抑制细胞生长,清除氧自由基,对癌细胞DNA合成具有抑制作用,可以阻滞细胞增殖,导致细胞凋亡。
2.4 葡萄籽原花青素对HepG2细胞转录组KEGG Pathway富集分析
葡萄籽原花青素对HepG2细胞转录组的KEGG通路富集分析,共有1 016个基因富集到322条代谢通路(图6、图7),差异基因主要被聚类到六大途径:基础代谢过程、生物系统、人类疾病、细胞过程、基因信息过程和环境信息过程。基础代谢过程包括外源化合物的生物降解与代谢、氨基酸代谢、脂质代谢、碳水化合物代谢和核苷酸代谢等;生物系统包括免疫系统、内分泌系统、神经系统和消化系统等;人类疾病包括传染性疾病、癌症、内分泌和代谢疾病、心血管疾病、神经衰退行性疾病和免疫疾病等;细胞过程包括细胞凋亡、运输与分解代谢和细胞运动等;基因信息过程主要包括基因复制、修复、翻译、折叠、转录和降解等;环境信息过程包括信号转导、信号分子与相互作用、膜运输。如图7所示,细胞凋亡相关的信号传导途径包括TNF信号通路、p53信号传导途径被显著地富集。这两个途径类别中的差异表达基因可能与原花青素处理引起的细胞凋亡密切相关,突显出葡萄籽原花青素在抑制HepG2细胞的作用,与TNF信号通路、p53信号传导途径相关的信号通路有PI3K/Akt信号通路、NF-κB信号通路、MAPK信号通路均与细胞凋亡密切相关。

A. 基础代谢过程 A1. 外源化合物的生物降解与代谢 A2. 氨基酸代谢 A3. 脂质代谢 A4. 碳水化合物代谢 A5. 核苷酸代谢 A6. 辅因子和维生素代谢 A7. 其他氨基酸的代谢 A8. 多糖合成和代谢 A9. 外源生物的生物降解与代谢 A10. 能量代谢 A11. 其他次生代谢生物的生物合成 A12. 萜类和聚酮类代谢 B. 生物系统 B1. 免疫系统 B2. 内分泌系统 B3. 神经系统 B4. 消化系统 B5. 发育 B6. 环境适应 B7. 血液循环系统 B8. 感官系统 B9. 排泄系统 B10. 老化 C. 人类疾病 C1. 传染性疾病 C2. 癌症 C3. 内分泌 C4. 代谢疾病 C5. 心血管疾病 C6. 神经衰退性疾病 C7. 免疫疾病 C8. 抗药性 D. 细胞过程 D1. 细胞凋亡 D2. 运输与分解代谢 D3. 真核细胞群落 D4. 细胞运动 E. 基因信息过程 E1. 基因复制和修复 E2. 翻译 E3. 折叠和转录 E4. 降解 F. 环境信息过程 F1. 信号转导 F2. 信号分子与相互作用 F3. 膜运输
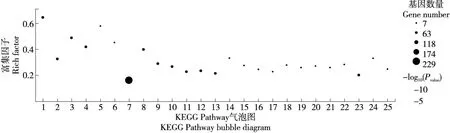
1. DNA复制 2. 细胞周期 3. 同源重组 4. 范可尼贫血信号通路 5. 失配修正 6. 碱基切除修复 7. 代谢途径 8. 甘氨酸、丝氨酸和苏氨酸代谢 9. 过氧化物酶体 10. 真核生物核糖体的生物发生 11. 流体剪切应力与动脉粥样硬化 12. 为嘧啶代谢 13. TNF信号通路 14. 二羧酸代谢 15. 胆固醇代谢 16. p53信号通路 17. TGF-β信号通路 18. 膀胱癌 19. 核苷酸切除修复 20. 脂肪酸降解 21. 精氨酸和脯氨酸代谢 22. 丙氨酸、天冬氨酸和谷氨酸代谢 23. 白细胞经外周迁移 24. 精氨酸生物合成 25. 缬氨酸、亮氨酸和异亮氨酸降解
通过细胞凋亡相关差异基因筛选出5条与细胞凋亡相关的通路,包括NF-κB信号通路、MAPK通路、TNF信号通路、p53信号传导途径和PI3K/Akt信号通路,NF-κB是基因表达的重要调控因子之一。Maldonado等[30]研究发现,原花青素通过NF-κB和p53上调细胞凋亡相关受体的表达与其诱导的癌细胞凋亡具有一定的相关性。卢婷婷等[31]研究发现,用荧光素酶表达载体PGL3质粒转染A549细胞,原花青素对COX-2启动子活性有明显抑制作用。Engelbrecht等[32]研究发现,原花青素处理后Caco细胞无明显变化,而NCM460细胞随原花青素浓度的增大,其细胞抑制率也增大,通过蛋白印迹试验,原花青素使PI3K/Akt的催化亚基(P110)和调节亚基(P85)出现衰减,使PKB-SER473的磷酸化减弱,细胞出现程序性死亡。据报道[33-34],丝裂原活化蛋白激酶(MAPK)信号通路参与细胞内炎症信号的级联,与促炎细胞因子和NF-κB转录激活密切相关,并参与增殖、分化、转化和凋亡等一系列生物学过程。综上,原花青素通过抑制HepG2细胞相关基因的表达和通路的活化,诱导HepG2细胞发生凋亡。
2.5 葡萄籽原花青素对HepG2细胞转录组信号通路及差异基因表达分析
对两组差异代谢通路对比分析(表2),细胞凋亡通路相关的差异基因24个,与TNF信号通路相关的差异基因28个,p53信号通路相关的差异基因18个,MAPK信号通路相关的差异基因47个,PI3K-Akt信号通路相关的差异基因51个,NF-κB信号通路相关的差异基因18个。
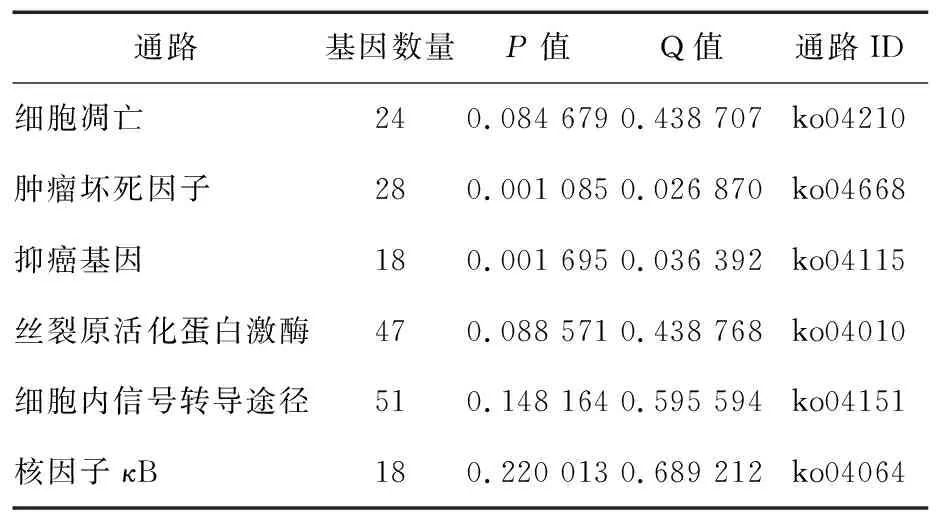
表2 差异基因与细胞凋亡相关的KEGG途径
结合GO和KEGG富集结果,与细胞凋亡相关的差异基因有24个(表3),12个关键差异基因中,上调基因有9个,下调基因有3个。细胞凋亡12个关键差异基因与TNF、p53、MAPK、PI3K-Akt、NF-κB信号通路密切相关,其中,与TNF信号通路相关差异基因有9个,与p53信号通路相关的差异基因有2个,与MAPK信号通路相关差异基因有6个,与PI3K-Akt信号通路相关差异基因有2个,与NF-κB信号通路相关差异基因有6个。

表3 原花青素对HepG2细胞差异基因及差异表达水平分析
葡萄籽原花青素对HepG2细胞的转录组信号通路产生了明显影响,尤其在细胞凋亡过程中起到了重要的调控作用。差异基因与多个信号通路的调控相互交织,共同参与了细胞凋亡的调控过程。
3 结论
葡萄籽花青素处理HepG2细胞后,其主要富集到的生物学过程为细胞过程、代谢过程、生物调控过程、免疫系统过程、繁殖调节和生长调节。通过KEGG pathway分析,葡萄籽花青素处理HepG2细胞后的基因差异表达水平涉及到细胞凋亡和多个信号通路的调控。12个关键差异基因与相关通路结果表明,细胞凋亡与TNF信号通路、p53信号传导途径、PI3K/Akt信号通路、NF-κB信号通路及MAPK信号通路密切相关。葡萄籽花青素通过调节这些信号通路的活性,可能在细胞中诱导细胞凋亡,从而抑制细胞进一步生长和扩散。后续可以重点关注差异基因在信号通路中的具体作用和相互调控关系,以深入揭示葡萄原花青素在肝癌细胞中的作用机制。
