黄芩苷与盐酸小檗碱自沉淀理化性质及抑菌作用机制研究
2024-05-03蒋庆佳徐杨杜叶刘日慧刘涛徐玉玲
蒋庆佳 徐杨 杜叶 刘日慧 刘涛 徐玉玲
摘要:目的 以黃芩苷和盐酸小檗碱产生的自沉淀为研究对象,探究其理化性质,对其抑菌作用及其机制展开研究,为中药自沉淀现象产生的物质深入研究提供参考。方法 采用差示热量扫描法、红外光谱扫描和紫外光谱扫描测定黄芩苷和盐酸小檗碱的自沉淀理化性质;采用牛津杯法探索黄芩苷、盐酸小檗碱及自沉淀对大肠埃希菌、金黄色葡萄球菌的抑菌活性;采用二倍稀释法进一步研究黄芩苷、盐酸小檗碱、自沉淀对大肠埃希菌和金黄色葡萄球菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC),并通过测定菌体的生长曲线、胞外核酸相对含量、胞外可溶性蛋白质含量和电导率研究黄芩苷、盐酸小檗碱及自沉淀对大肠埃希菌、金黄色葡萄球菌的抗菌机制,分析对比黄芩苷、盐酸小檗碱反应前后抑菌作用机制是否发生改变。结果 差示热量扫描法结果显示盐酸小檗碱与黄芩苷反应前后存在热量变化,该自沉淀是一种不同于盐酸小檗碱、黄芩苷的新物质或复合物,其官能团、紫外吸收均发生了变化。盐酸小檗碱对大肠埃希菌的MIC为0.9375 mg/mL,MBC为7.5 mg/mL;对金黄色葡萄球菌的MIC为0.9375 mg/mL,MBC为7.5 mg/mL。黄芩苷对大肠埃希菌的MIC为1.875 mg/mL,MBC为7.5 mg/mL;对金黄色葡萄球菌的MIC为3.75 mg/mL,MBC为15 mg/mL。自沉淀对大肠埃希菌的MIC为3.75 mg/mL,MBC为3.75 mg/mL;对金黄色葡萄球菌的MIC为3.75 mg/mL,MBC为3.75 mg/mL。3种物质对大肠埃希菌和金黄色葡萄球菌菌体生长均有显著的抑制效果,但作用机制有所差异。结论 3种物质对大肠埃希菌和金黄色葡萄球菌显示出较好的抑菌活性,由强到弱为盐酸小檗碱、黄芩苷、自沉淀,均通过对细菌细胞膜造成损伤改变其通透性,影响细菌生长,从而起到抑制细菌生长的目的。三种物质虽能使菌体内容物大量渗出,但对胞内物质泄出作用存在差异,研究成果为进一步探究中药自沉淀提供参考。
关键词:自沉淀;黄芩苷;盐酸小檗碱;抑菌机制
中图分类号:R961文献标志码:A
Study on the physicochemical properties and antibacterial mechanism of precipitation in baicalin and berberine hydrochloride
Abstract Objective The substances produced by traditional Chinese medicine through the self-precipitation phenomenon have special properties and development potential. This paper takes the precipitation produced by baicalin and berberine hydrochloride as the research object, explores its physical and chemical properties, and studies its antibacterial effect and mechanism. Methods The physical and chemical properties of the preipitation were determined by differential scanning calorimetry, infrared spectroscopy scanning, and ultraviolet spectroscopy scanning. The antibacterial activity of baicalin, berberine hydrochloride and precipitation against Escherichia coli and Staphylococcus aureus was studied by Oxford cup method. The minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) of baicalin, berberine hydrochloride and precipitation against Escherichia coli and Staphylococcus aureus were further studied by double dilution method, and the antibacterial mechanisms of baicalin, berberine hydrochloride and precipitation against Escherichia coli and Staphylococcus aureus were studied by measuring the growth curve of the bacterial body, the relative content of extracellular nucleic acid, the content of extracellular soluble protein and electrical conductivity. Then, the changes in antibacterial mechanisms of baicalin and berberine hydrochloride were analyzed and compared before and after the reaction. Results The results of differential scanning calorimetry showed that there was a heat change before and after the reaction of berberine hydrochloride with baicalin. The precipitation was a new substance different from berberine hydrochloride and baicalin, and its functional groups and UV absorption changed. Berberine hydrochloride, baicalin, and precipitation have different antibacterial activities and mechanisms. In general, berberine hydrochloride has the best antibacterial activity, followed by self precipitation, and baicalin is relatively weak. The MIC of berberine hydrochloride against Escherichia coli was 0.9375 mg/mL, and the MBC was 7.5 mg/mL; The MIC against Staphylococcus aureus was 0.9375 mg/mL, and the MBC was 7.5 mg/mL. The MIC of baicalin against Escherichia coli was 1.875 mg/mL, and the MBC was 7.5 mg/mL; The MIC against Staphylococcus aureus was 3.75 mg/mL, and the MBC was 15 mg/mL. The MIC and MBC of precipitation against Escherichia coli were 3.75 mg/mL and 3.75 mg/mL, respectively; The MIC against Staphylococcus aureus was 3.75 mg/mL, and the MBC was 3.75 mg/mL. The three substances had significant inhibitory effects on the growth of Escherichia coli and Staphylococcus aureus, but their mechanisms of action varied. Conclusion The three substances that showed good antibacterial activity against Escherichia coli and Staphylococcus aureus, from strong to weak, were berberine hydrochloride, baicalin, and precipitation. All of them changed their permeability by damaging the bacterial cell membrane, affecting bacterial growth, and thereby inhibiting bacterial growth. Although the three substances could cause a large amount of exudation from the bacterial body, there were differences in the release of intracellular substances. The research results provided a reference for further understanding the precipitation of traditional Chinese medicine.
Keywords Self precipitation; Baicalin; Berberine hydrochloride; Antibacterial mechanism
中药自沉淀是指中药饮片在中医药理论指导下(包括中医治疗原则、方剂的组成结构、药物的配伍规律以及服药宜忌等)进行配伍组方后,复方药物经水煎煮或其他溶媒提取之后,药液中化学成分之间相互作用产生沉淀,被称为“自沉淀”[1]。黄连解毒汤在水煮过程中常出现较明显的中药自沉淀现象,研究发现为黄连解毒汤中苷类成分黄芩苷(baicalin,BA)与生物碱类盐酸小檗碱(berberine hydrochloride,BH)发生酸碱络合生成水不溶性物质沉出[2]。研究认为盐酸小檗碱与黄芩苷配伍产生的是一类自沉淀(BBP),且其采用一种相对较弱的结合,如氢键、分子间作用力等[3]。田学浩等[4]对黄连解毒汤采用等温滴定量热法了解析自沉淀形成过程中内在的各种分子热力学参数,确定了沉淀产生主要来源于BA与BH相作用的结果,并从化学层面更深层次地揭示中药间相互作用的机制。目前已利用BA与BH成功模拟出黄芩-黄连合煎过程中出现的自沉淀。并且发现黄芩苷与盐酸小檗碱自沉淀的产生受到了比例、加热方法、pH、离子强度等多因素的影响。
BBP是由于BA与BH官能团的结合,导致生成沉淀后的物质油水分布系数发生了显著的变化,对其口服后胃肠道吸收及药物体内的行为具有一定的影响,提示该物质存在药理价值[5]。现有研究表示,该类由BH与BA作用生成的BBP具有抗炎、保护神经细胞等广泛的药理活性[6-8]。而BH与BA都具有较好的抑菌活性,推测反应产物BBP可能具有较好的抑菌活性。目前研究仅对BBP的抑菌活性进行研究,其抑菌作用机制还有待进一步研究。本文对BBP的理化性质进行研究,并探究其对大肠埃希菌(Escherichia coli,EC)与金黄色葡萄球菌(Staphylococcus aureus,SA)的抑菌活性,同时通过测定BBP对细菌核酸、胞外蛋白、电导率的影响,对其抑菌作用机制进行阐述,为进一步理解中药自沉淀性质及其药理作用提供参考。
1 材料
1.1 仪器
差示热量扫描仪(梅特勒托利多科技中国有限公司),TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司),Specterum Tow傅里叶变换红外光谱仪(美国Perkin Elmer公司),DH3006A型电热恒温培养箱(西安禾普生物科技有限公司),ZQTY-70E振荡培养箱(上海知楚仪器有限公司),TG20G型离心机(天津广丰科技公司),XFS-280型手提式壓力蒸汽灭菌器(浙江新丰医疗器械有限公司),JJ-CJ-2FD型洁净工作台(苏州市金净净化设备科技有限公司)其他仪器包括96孔一次性细胞培养板、移液枪、比浊管等。
1.2 材料
黄芩苷提取物(纯度≥90%南京本草益康生物科技有限公司);盐酸小檗碱提取物(纯度≥98%南京本草益康生物科技有限公司);SA、EC菌株由成都大学附属医院提供;考马斯亮蓝G-250购自成都市科隆化学品有限公司等。其他实验材料包括蛋白胨、琼脂粉、氯化钠、酵母浸出粉等。
2 方法与结果
2.1 BBP的制备
根据课题组前期研究结果,分别称取BA和BH提取物,按一定比例投入沸水中,加热搅拌使其充分反应,至温度冷却至室温后,滤过,分离出自沉淀后,加入过量甲醇充分洗涤,滤过,于60 ℃鼓风干燥,研末,备用。
2.2 差示热量扫描
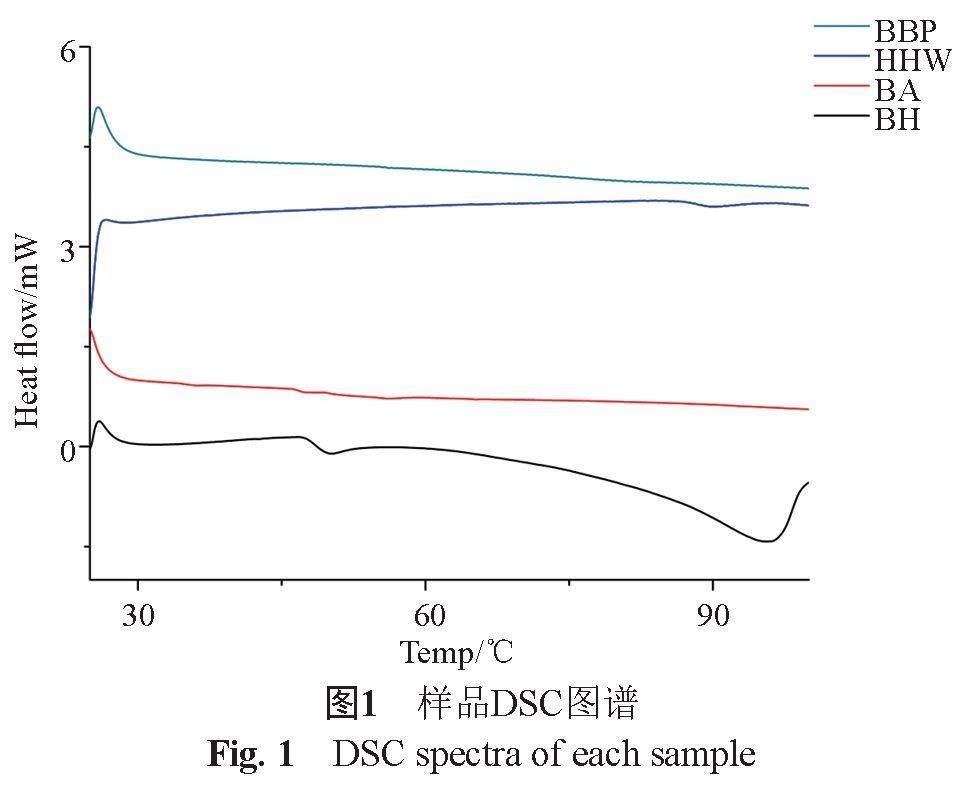
称取等量的BA与BH,混合均匀后做混合对照物。精密称取BA、BH、BBP及混合对照物各20 mg,进行扫描,条件为:10 ℃/min升温速率从25 ℃升到100 ℃,结果如图1。
BH在95 ℃附近出现较大的吸收峰,焓值约为-2.28 J/g,BA在100 ℃升温过程中未出现热吸收过程。混合物在89 ℃出现较大的吸收峰,焓值约为-8.027×10-2 J/g。而BBP在100 ℃升温过程中未出现热量变化,说明BBP不仅仅是BH与BA的简单物理混合,存在化学键的断裂与生成,确定该BBP是一种不同于BH、BA的新物质,且其在100 ℃内无热量变化,见图1。
2.3 BBP红外光谱特征
以烘干的KBr为空白,分别制备BH、BA、BBP及加热煮沸冷却后BH、BA的红外测试样品。取供试品粉末约1.0 mg,加干燥的溴化钾粉末约100 mg置于玛瑙乳钵中,研细,混合均匀,置压片模具中,组合模具并于粉末压片机上压片1.5 min[7],采用傅里叶变换红外光谱仪测定,结果如图2。
红外光谱结果表明,BH vN-H 3500~3100 cm-1的特征吸收峰与BA vO-H3300~2500 cm-1特征吸收峰发生酸碱络合反应,而产生共轭效应导致BBP在该波长特征吸收峰产生变化。单独加热煮沸冷却后的BH、BA红外光谱扫描图,并发现与未加热煮沸的图谱相比官能图并未发生变化,因此可以说明BBP红外光谱变化并不由于加热等导致的降解。由红外光谱结果可知,BBP是BA中的羟基与BH中的季胺盐离子发生酸碱络合反应生成的。
2.4 BBP紫外-可见光谱
称取BH、BA及BBP约0.0100 g溶于10 mL甲醇中,超声溶解。加入适量甲醇稀释样液200倍后,以甲醇为参比液为基线,使用UVWin紫外软件V6.0.0扫描光谱,波长200~800,光谱带宽2 nm,采样间隔1 nm,快速扫描[9],结果如图3。
BBP紫外吸收最大波长(λ=420 nm),相比于BA(λ=315 nm)与BH(λ=430 nm)的最大吸收波长发生偏移,BBP在200~800 nm间紫外吸收与BA、BH有显著性差异(P<0.01)。
3 抑菌作用研究
3.1 样品制备
精密称取BH、BA及BBP适量,加入溶于二甲亚砜,超声使溶解,配置成60 mg/mL的溶液。
3.2 菌株活化
将细菌分别接种在LB液体培养基中,以37 ℃、
120 r/min的条件下活化培养细菌12~24 h,制得菌悬液,用无菌水将菌悬液浓度稀释至1×106~
1×107 CFU/mL,备用[10]。
3.3 牛津杯法
将配制好的固体培养基、纯水、试管、培养皿等放入高压灭菌锅中灭菌1 h左右取出,将固体培养基分别倒入培养皿中冷却待凝固后使用,用移液管分别移取菌悬液(EC、SA)1 mL,放置牛津杯,并向牛津杯中分别加入150 ?L BH、BA和BBP,37 ℃恒温培养24 h。
3.4 最小抑菌浓度(MIC)的测定
采用二倍稀释法,设置阳性对照、阴性对照、空白对照。进行接种实验,置于37 ℃摇床培养24 h后取出观察结果[10]。若小孔内澄清即视为细菌生长受到了抑制,澄清小孔中所对应的最低药物浓度为对该菌的最低抑菌浓度。每组设2个重复。目前中药抗菌作用尚未有明确的评判标准,参考刘忠义等[12]的研究:当MIC>250 mg/mL为不敏感,MIC介于7.81~250 mg/mL为中敏,MIC≤7.81 mg/mL为高敏。
3.5 最小杀菌浓度(MBC)测定
上述96孔板中透明澄清液体接种于固体培养基中,經37 ℃恒温培养24 h后观察结果。琼脂平板上无菌落生长则视为细菌100%被杀灭,对应孔的药物浓度值为其MBC值[10]。
3.6 抑菌机制研究
3.6.1 抑菌曲线的绘制
调整LB液体培养基中样品质量浓度为MIC和1/2MIC,然后分别接入含有1×106~107 CFU/mL菌悬液,在37 ℃、120 r/min条件下连续培养15 h,每隔1 h取样测定A600,以不含样品的空白培养基为对照,绘制细菌的生长曲线,每组设2个重复[10]。
3.6.2 胞外核酸相对量的测定
配制样品溶液,使药物质量浓度为MIC和2 MIC,分别加入菌悬液,在37 ℃、120 r/min培养8 h,以空白培养基作对照,每隔1 h定时分别取样,加入无菌水稀释后4000 r/min离心10 min,取其上清液于260 nm 波长处测定吸光度,以 A260值表示核酸相对量,每组设2个重复[10]。
3.6.3 胞外可溶性蛋白的测定
配制样品溶液,使药物质量浓度为MIC和2 MIC,分别加入菌悬液,在37 ℃、120 r/min培养8 h,以空白培养基作对照,每隔1 h定时取样,用无菌水稀释后4000 r/min离心10 min,取其上清液1 mL加入考马斯亮蓝试剂2 mL,静置10 min,于595 nm波长处测定吸光度,以A595值表示胞外蛋白相对量,每组设2个重复[10]。
3.6.4 电导率测定
配制样品溶液,使药物质量浓度为MIC,分别加入菌悬液,在37 ℃、120 r/min培养8 h,以空白培养基作对照,每隔1 h定时分别取样,加入无菌水稀释后4000 r/min离心2 min,取其上清液测定电导率,以电导率仪显示值表示电导率,每组设2个重复[11]。
4 抑菌抑菌结果
4.1 牛津杯法
将已灭菌的牛津杯置于试验平板中,往杯中注入一定量的待测样品,培养一段时间后观察抑菌圈大小。由图4结果显示,BH、BA、BBP均具有一定的抑菌活性,且溶剂不存在抑菌活性。
4.2 MIC、MBC测定
采用二倍稀释法测定了BH、BA、BBP对大肠埃希菌和金黄色葡萄球菌的抗菌活性,结果见图5~6。所测各组中,阳性对照和阴性对照均显示细菌长势良好,排除菌液和二甲基亚砜对实验的干扰,空白对照显示无细菌生长。图5可见BH浓度≥0.9375 mg/mL,
BA浓度≥1.8375 mg/mL,BBP浓度≥3.75 mg/mL时的大肠埃希菌溶液澄清;图6可见BH浓度≥0.9375 mg/mL,
BA浓度≥3.75 mg/mL,BBP浓度≥3.75 mg时的金黄色葡萄球菌溶液澄清。
BH、BA、BBP对大肠埃希菌、金黄色葡萄球菌的MIC、MBC结果如表1所示,均具有抑菌活性。结果显示BH、BA、BBP对大肠埃希菌、金黄葡萄球菌均为高敏性,但活性存在一定的差异。相较于BH、BA,反应后产生的BBP对大肠埃希菌的作用活性略微下降,但对菌的杀灭作用强于BA与BH。对于金黄色葡萄球菌,BBP的抑菌活性与BA作用强弱相同,且其最小杀菌作用增强。
4.3 BH、BA、BBP对大肠埃希菌的抑菌作用机制
4.3.1 对细菌生长曲线的影响
BH、BA、BBP对大肠埃希菌生长均有一定的抑制效果。当溶液中药液浓度为MIC时,培养液中细菌的生长受到了明显的减慢。并且随着药液浓度增加其抑制效果更加明显,结果见图7。
4.3.2 对细菌胞外核酸相对含量的影响
由图8可知,当BH、BA、BBP作用后,大肠埃希菌胞外核酸相对量增加,表明BA、BH、BBP能够损伤细胞膜,影响细菌的正常生理活动,抑制细菌生长。作为细菌的保护屏障的细胞膜在药液的作用下破裂,胞内大分子物质DNA、RNA等穿过细胞膜泄漏到培养液中,导致培养液在260 nm处的吸光度值增大。
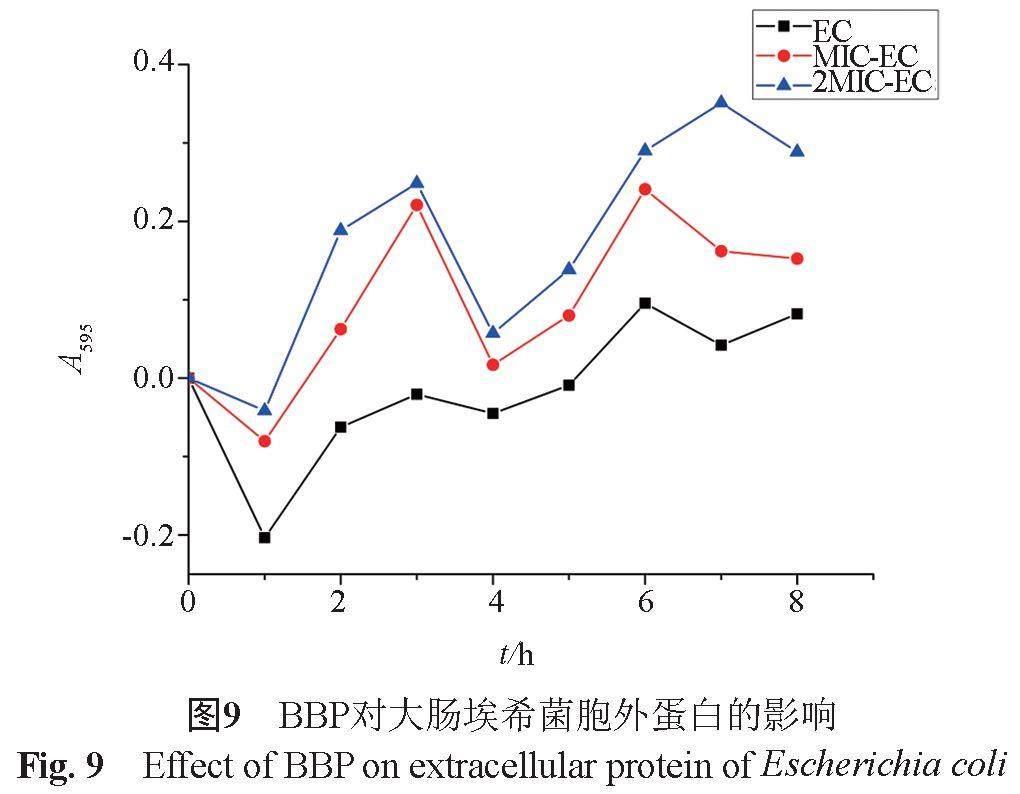
4.3.3对细菌胞外蛋白相对含量的影响
由图9可见,当BBP作用于大肠埃希菌后,菌液中的蛋白质含量显著增加,且EC-MIC、EC-2MIC试验组培养液的蛋白浓度均显著高于空白对照组。说明BBP可以改变细胞膜的通透性,可使胞内的蛋白质通过细胞膜泄漏到细胞外。但研究中发现BH、BA对大肠埃希菌胞外蛋白的渗出量并无明显的量效关系,而BBP能够使蛋白质大量泄出,存在一定的量效关系。BBP对胞外蛋白的溶出是不同于BH、BA的作用机制。
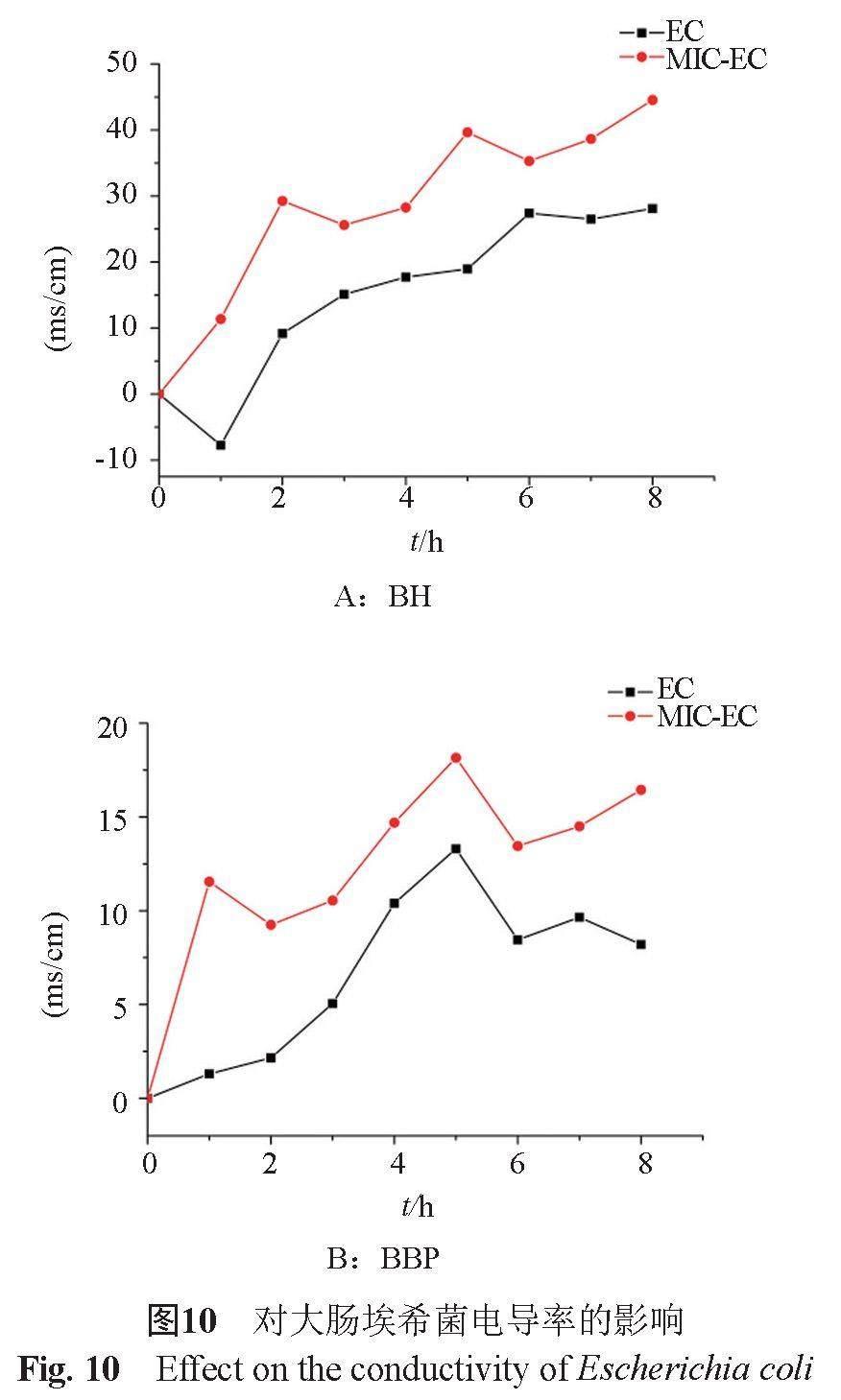
4.3.4 对细胞培养液电导率的影响
当细胞膜没有受到损伤时,细胞内的带电离子不能自由通过细胞膜[13]。当细胞膜受到损伤,会导致细胞内的离子大量外流,从而菌液的电导率会升高。由图10可知,BH、BBP药液作用于细菌时,会损伤细胞膜,导致细胞内电解质外流。而研究发现BA作用于细菌时,电解质的变化并不明显,说明BA通过损伤细胞膜抑制大肠埃希菌的生长作用较微弱,主要通过其他的机制抑制细菌生长。
4.4 BH、BA、BBP对金黄色葡萄球菌的抑菌作用机制
4.4.1 对细菌生长曲线的影响
当溶液中BH、BA和BBP药液浓度为MIC时,金黄色葡萄球菌的生长具有明显的抑制效果,并且随着药液浓度增加其抑制效果更加明显,结果见图11。
4.4.2 对细菌胞外核酸相对含量的影响
BH和BBP作用后,金黄色葡萄球菌胞外核酸相对量明显高于对照组。任何对细胞膜结构完整性和稳定性的轻微干扰都可能损害细菌细胞的正常代谢功能。结果表明,BA和BBP能够作用于金黄色葡萄球菌细胞膜,引起膜裂解,使胞内核酸大量泄出,影响细菌活力。但其中BA对金黄色葡萄球菌胞外核酸相对含量的影响未随着药物质量浓度的增大而增大,无明显量效关系,见图12。
4.4.3 对细菌胞外蛋白相对含量的影响
由图13可见,当BBP作用于金黄色葡萄球菌后,菌液中的蛋白质含量显著增加,说明BBP可以改变细胞膜的通透性,可使胞内的蛋白质通过细胞膜泄漏到细胞外。研究中发现BH、BA对金黄色葡萄球菌胞外蛋白的渗出量并无明显的量效关系,BBP对胞外蛋白的溶出是不同于BH、BA的作用机制。
4.4.4 对细胞培养液电导率的影响
当细胞膜受到损伤,会导致细胞内的离子大量外流,从而菌液的电导率会升高[13]。由图14可知,BH、BBP药液作用于细菌时,会损伤细胞膜,导致细胞内电解质外流。而研究发现BA作用于细菌时,电解质的变化同样并不明显,提示BA可能通过其他途径抑制细菌的生长。
5 讨论
传统中医认为,汤剂与沉淀物同服可以有效提高疗效,提示自沉淀同样具有药理活性。目前就含黄芩苷与盐酸小檗碱的中成药研究发现,该类中成药在制备过程中大部分都将自沉淀与药渣一同过滤弃去,造成了一定的药用成分的浪费,而由于配伍反应发生自沉淀,黄芩苷与盐酸小檗碱的含量下降,甚至可能会导致中成药疗效的不稳定,加大该类中成药的质量控制难度[14-15]。本研究通过红外与紫外光谱分析了BA与BH络合形成BBP的化学键合变化,提示其不饱和基团的共轭关系发生变化。红外结果也证实了黄芩苷与盐酸小檗碱在煎煮过程中会发生新的键合,该种键合可能是季胺离子与羧酸离子之间的酸碱络合作用,该反应会使BA和BH的疏水部分面向水相,使得BBP水溶性大大降低,从而产生自沉淀。并以DSC探究BBP反应前后的热量吸收变化,表明该物质部分理化性质有异于两者的物理混合物。BA与BH都是临床常用的抗菌活性物质,现有研究证明BBP同样具有一定的抑菌活性,本研究通过对BA、BH和BBP的抑菌机制进行研究,探究BBP的具体作用机制,同时发现BA、BH和BBP都能使菌体内容物大量渗出,但胞内物质泄出存在差异,BBP能够使胞外核酸渗出的同时细菌的胞外蛋白渗出量相比于BA、BH增加,其作用机制存在变化。
由于抗生素耐药性的问题越来越严重,需要细菌能够通过形成外排泵、耐药质粒、生物被膜等途径抵抗外来药物的干扰,并且该类外排泵、耐药质粒、生物膜还会在抗生素的刺激下不断诱导进化,增强其耐药性[16-17]。中药及其活性成分对耐药菌具有抗菌活性,可增强耐药菌的敏感性[18]。与抗生素联用具有良好的抑菌活性,同时能够减少所需的抗菌剂剂量和耐药率[19-20]。但一些中药的长期使用,也可引起细菌耐药性增加[21]。因此,在中药中寻找新的抑菌活性物质具有重要意义。通过对BBP的抑菌活性及其作用机制研究,为进一步理解中药自沉淀性质及其药理作用提供参考。中药活性物质能够通过破坏细胞壁、细胞膜的完整性;抑制蛋白质核酸的合成及酶的活性等多种途径抑制细菌的生长[22]。本文研究仅对BBP对细胞膜的作用机制进行研究阐述,其对细菌酶活性、蛋白质核酸的合成是否存在影响还需要进一步的研究。
参 考 文 献
陈燕, 李倩, 杨新荣, 等 黄连解毒汤及其自沉淀的研究进展及前景[J]. 辽宁中医药大学学报: 1-18.
游丽娟, 伍旭明, 迟宗良. 黄连-黄芩药对配伍机理研究[J]. 中国中医药科技, 2018, 25(5): 672-674.
李桐, 王辉, 张昊, 等. 基于分子热力学特征探讨黄连解毒汤水煎自沉淀形成机制[J]. 中草药, 2017, 48(17): 3505-3510.
田学浩, 张昊, 李桐, 等. 中药配伍理论科学内涵的外在表象——复方水煎自沉淀[J]. 中草药, 2017, 48(22): 4778-4783.
Zhang C, Sun L, Wang D, et al. Advances in antimicrobial resistance testing[J]. Adv Clin Chem, 2022, 111: 1-68.
孫磊, 冯军, 雷艳丽, 等. 黄芩苷-盐酸小檗碱复合物的溶解度与油水分配系数测定[J]. 中国实验方剂学杂志, 2017, 23(21): 35-38.
柯秀梅, 张立胜, 李欣, 等. 黄芩-黄连合煎液中络合物表征及其体外抗菌活性[J]. 中成药, 2020, 42(8): 2192-2195.
李建荣, 张广平, 吴兰生, 等. 泻心汤配伍沉淀物的药效学研究[J]. 中国实验方剂学杂志, 2004(5): 27-30.
杨俊莉, 杨放, 谭瑶琳, 等. 干燥方式对熊胆粉物理特性、紫外及抑菌作用的影响[J]. 中国抗生素杂志, 2023, 48(2): 186-193.
汪晓辉, 郭溶, 聂晓彬, 等. 佛手抗菌活性及其药效成分橙皮苷对金黄色葡萄球菌的作用机制研究[J]. 中国抗生素杂志, 2021, 46(5): 437-441.
杨慧, 刘晓凤, 刘钱, 等. Q-marker思路下的黄连花薹抗菌作用及机制研究[J]. 中国抗生素杂志, 2022, 47(6): 550-555.
刘忠义, 张国威, 何云志. 解脲支原体中药药敏试验[J]. 中华皮肤科杂志, 1996(5): 349-351.
黄梅, 罗俊, 沈建英. 双氢青蒿素与头孢呋辛对大肠杆菌的协同抗菌作用及机制研究[J]. 中国中药杂志, 2020, 45(12): 2975-2981.
张文文, 王姚, 曾嵘, 等. 黄连解毒丸质量标准的再评价[J]. 中成药, 2019, 41(10): 2328-2333.
贺英俊, 刘博文, 刘前呈, 等. 中药方剂物质基础及质量控制探析[J]. 成都大学学报(自然科学版), 2023, 42(1): 1-5.
Huemer M, Mairpady Shambat S, Brugger S D, et al. Antibiotic resistance and persistence-implications for human health and treatment perspectives[J]. EMBO Rep, 2020, 21(12): e51034.
Su T, Qiu Y, Hua X, et al. Novel opportunity to reverse antibiotic resistance: To explore traditional Chinese medicine with potential activity against antibiotics-resistance bacteria[J]. Front Microbiol, 2020, 22(11): 610070.
Li Y, Li X, Tan Z. An overview of traditional Chinese medicine therapy for Helicobacter pylori-related gastritis[J]. Helicobacter, 2021, 26(3): e12799.
Li J, Feng S, Liu X, Jet al. Effects of traditional Chinese medicine and its active ingredients on drug-resistant bacteria[J]. Front Pharmacol, 2022 2(13): 837907.
Liu B G, Xie M, Dong Y, et al. Antimicrobial mechanisms of traditional Chinese medicine and reversal of drug resistance: a narrative review[J]. Eur Rev Med Pharmacol Sci, 2022, 26(15): 5553-5561.
廖燕科, 藍素桂, 苏爱秋, 等. 逆转细菌耐药性研究进展[J]. 中国抗生素杂志, 2023, 48(1): 32-40.
蒋庆佳, 杨放, 杨安迪, 等. 中药抑菌活性成分及其作用机制研究进展[J]. 中国抗生素杂志, 2023,48(8): 855-861.
