黄芩苷诱导人乳腺癌细胞株MCF—7凋亡的机制研究
2017-05-20吴贵才赵丹曾青磊李仕卓
吴贵才?赵丹?曾青磊?李仕卓

[摘要] 目的 探讨中草药黄芩苷对人乳腺癌细胞株MCF-7的作用及此作用存在的内在机制。 方法 0μmol/L (NC)、50μmol/L、100μmol/L、150μmol/L、200μmol/L、250μmol/L的黄芩苷作用于人乳腺癌细胞株MCF-7不同时间后,观察细胞形态,MTT法测黄芩苷对细胞增殖的影响,并用流式细胞仪检测黄芩苷是否诱导细胞的凋亡,最后用RT-PCR来检测凋亡相关基因mRNA的表达。 结果 在一定的时间和一定的黄芩苷药物浓度的范围内,黄芩苷能抑制人乳腺癌细胞株MCF-7的增殖和迁移并诱导人乳腺癌细胞株MCF-7的凋亡,50μmol/L组抑制MCF-7的迁移与对照组之间有统计学差异(P<0.05)。而且能引起ERK信号通路中凋亡相关基因 mRNA表达量的变化。给药组的caspase-3和caspase-9被激活,50μmol/L组bcl-2、bax与对照组之间有统计学意义(P<0.05)。 结论 黄芩苷通过ERK这条信号通路激活caspase-3和caspase-9,下调bcl-2,上调p-ERK、bax、p38从而诱导乳腺癌MCF-7细胞凋亡。黄芩苷能够显现出较大的经济效益,且更重要的是能够为乳腺癌患者提供新的药物方案和治疗思路。
[关键词] 黄芩苷;信号通路;凋亡
[中图分类号] R285 [文献标识码] A [文章编号] 2095-0616(2017)05-14-05
[Abstract] Objective To explore the internal mechanism of chinese herbal medicine baicalin in induction of apoptosis of human breast cancer cell line MCF-7. Methods After some time of 0μmol/L (NC), 50μmol/L, 100μmol/L, 150μmol/L, 200μmol/L, 250μmol/L baicalin effected on human breast cancer cell line MCF-7, cell morphology was observed. MTT assay was used to detect the effect of Baicalin on cell proliferation. Flow cytometry was used to detect weather baicalin induced cell apoptosis or not. RT-PCR was used to detect the expression of apoptosis related gene mRNA. Results Within a certain period of time and a certain concentration of baicalin, baicalin could inhibit the proliferation and migration of human breast cancer cell line MCF-7 and induce the apoptosis of human breast cancer cell line MCF-7. There was a significant difference between 50μmol/L group and control group on inhibition of MCF-7 migration (P<0.05). Moreover, it could cause the change of the expression of apoptosis related gene mRNA in ERK signaling pathway. Caspase-3 and caspase-9 were activated. There was a significant difference on Bcl-2 and Bax between the 50umol/L group and the control group (P<0.05). Conclusion Baicalin activates caspase-3 and caspase-9 through the ERK signaling pathway. Down regulation of Bcl-2, up regulation of p-ERK, Bax, p38, it induces apoptosis of breast cancer MCF-7 cells. Baicalin can show greater economic benefits. Whats more, it can provide a new medicine and treatment for breast cancer patients.
[Key words] Baicalin; Signaling pathway; Apoptosis
乳腺癌是全球婦女最常见的恶性肿瘤,我国也不例外,大约占全球女性肿瘤的23%[1]。近年来,乳腺癌的患病者的年龄呈现年轻化的趋势,并且乳腺癌的发病率逐年增长。在西方发达国家中,乳腺癌的发病率同样位于女性恶性肿瘤的首位,发病率大约为0.1%[2]。研究表明,乳腺癌的发生与个人的生活方式、生活习惯、环境因素和饮食习惯的改变有密切关系。这可能是多个基因变异的累积,从而逐渐演变导致包括抗癌基因的失活和原癌基因的激活等异常[3]。肿瘤细胞具有两个显著的特征,即恶性增殖、侵袭转移。所以当前乳腺癌研究的热点之一就是抑制乳腺癌细胞的增殖与转移并诱导乳腺癌细胞的凋亡[4-5]。目前乳腺癌的治疗方式主要是放化疗、手术、内分泌治疗、靶向治疗等综合治疗。但是化疗的药物毒副作用很大。内分泌治疗又较为容易产生耐受,更有甚者,某些会出现雌孕激素受体由阳性转为阴性的情况。因此,优化乳腺癌的治疗方案中药物的选择显得尤为重要。随着分子生物学与基础医学研究的进一步发展,传统中药越来越多的被用于各种常见疾病以及多各肿瘤的治疗,并取得了较好的治疗效果[6]。
黄芩苷作为一种天然的中草药,近年来越来越多的研究发现,黄芩苷具有毒性低,价格便宜和较为广泛的抗肿瘤活性,对肝癌、大肠癌、前列腺癌等肿瘤都具有一定的治疗效果。目前对黄芩苷抗乳腺癌的研究还较少,特别是对于其抗乳腺癌的机制研究还较少见到。
1 材料与试剂
1.1 材料
购自于上海科学院细胞库的人乳腺癌细胞株MCF-7。
1.2 药物
黄芩苷(Baiclin)购自于上海源叶生物科技有限公司(国药准字:H20073931),黄芩苷用于本研究纯度超过99.90%,最终浓度是以相应培养基及DMSO稀释为0μmol/L(NC)、50μmol/L、100μmol/L、150μmol/L、200μmol/L、250μmol/L用于本实验。
1.3 主要仪器
苏净安泰洁净工作台:苏净安泰洁净工作台;显微镜:日本OLYMPUS公司;Real-time PCR仪:瑞士罗氏公司;RT-PCR仪:瑞士罗氏公司。
2 实验方法
2.1 细胞培养
MCF-7细胞株复苏后接种于培养瓶中,加入含100ml/L小牛血清DMEM的新鲜培养基中,放置于37℃、5%CO2的恒温培养箱中培养。
2.2 MTT检测细胞增殖
选取对数期生长且状态较好的细胞,配制好细胞悬液的浓度,在5%CO2,37℃的培养箱中孵育,后加入浓度梯度的黄芩苷,在5%CO2,37℃的培养箱中孵育24、48、72h后,于倒置显微镜下观察。 加入MTT溶液,终止培养,最后在每孔中加入DMSO,然后在酶联免疫检测仪OD490nm处测量各孔的吸光度值用于分析。
2.3 Transwell检测细胞的迁移能力
对数期生长良好的乳腺癌MCF-7细胞加入Transwell上室,置于200μL无血清的培养基中。Transwell下室加入600μL培养基其中含有20% FBS的培养,Transwell小室置于37℃,5%CO2培养箱中培养48h;处理后完整撕下Transwell小室基底膜,置于载玻片上,显微镜下观察穿过底模的细胞数目,拍照,并统计穿膜细胞数。
2.4 流式细胞仪检测细胞凋亡
在乳腺癌MCF-7细胞生长状态良好时,消化后用细胞培养液重悬后接种于6孔板中,过24h后,待细胞贴壁后,将不同浓度的黄芩苷作用48h;收集细胞上机,用流式细胞仪检测细胞的早期凋亡和晚期凋亡。
2.5 Real-time PCR
将0μmol/L(NC)、50μmol/L、150μmol/L、250μmol/L四组浓度的黄芩苷作用于MCF-7细胞48h,提取RNA,逆转录后采用两步染料嵌合荧光RT-PCR法检测GAPDH 、Bax、Bcl-2、P38、p-ERK1和p-ERK2 mRNA表达水平,用 PCR仪进行分析。引物序列见表1。
3 结果
3.1 黄芩苷抑制乳腺癌细胞MCF-7的增殖
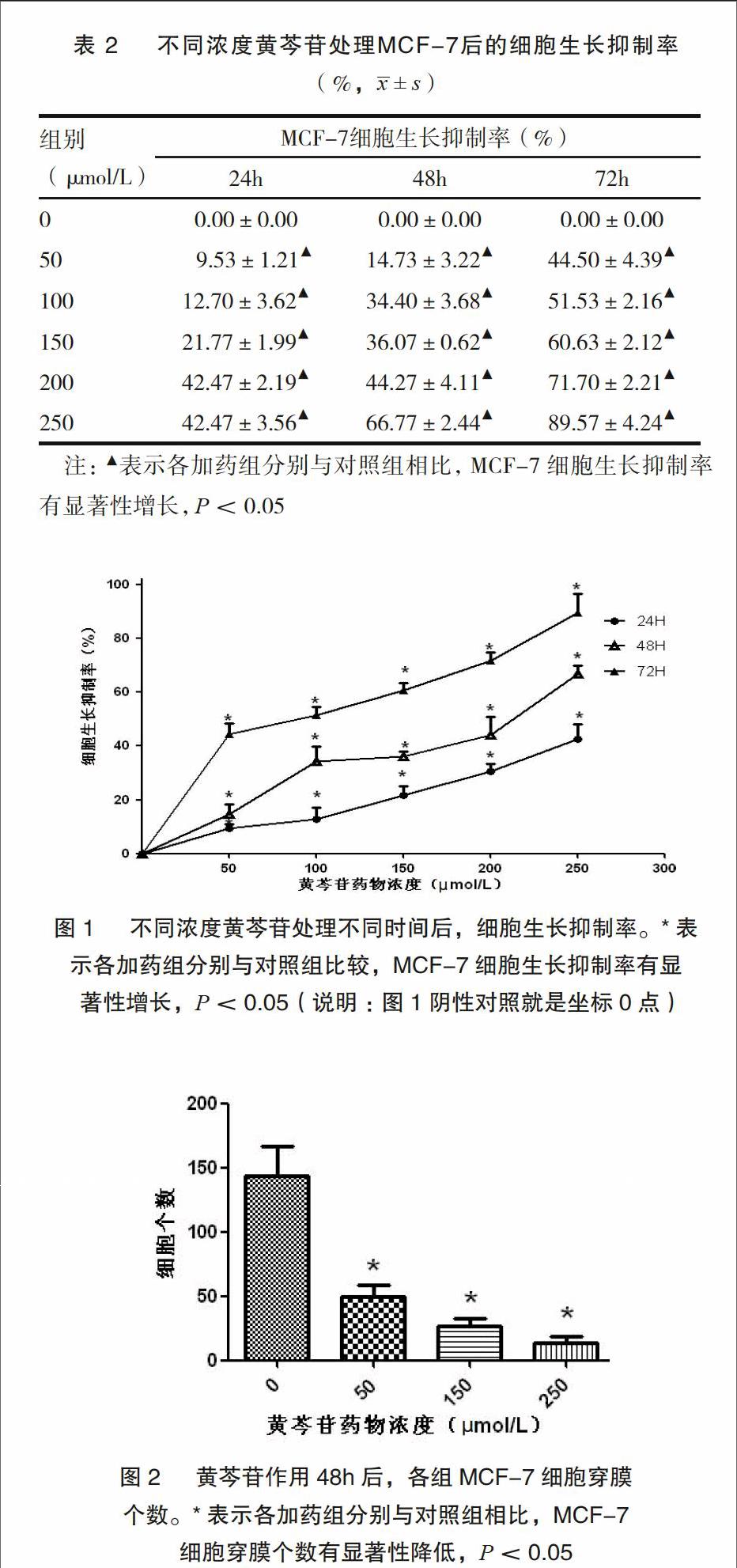
将0μmol/L(NC)、50μmol/L、100μmol/L、150μmol/L、200μmol/L和250μmol/L浓度的黄芩苷分别作用于乳腺癌细胞MCF-7 24、48和72h后,乳腺癌细胞MCF-7的生长受到明显的抑制,且在一定的时间和浓度范围内呈时间、浓度依赖性。各给药组与阴性对照组之间的差异均具有统计学意义(P<0.05),见表2、图1。
3.2 黄芩苷抑制乳腺癌细胞MCF-7的迁移
將有代表性的0μmol/L(NC)、50μmol/L、150μmol/L、250μmol/L四组浓度的黄芩苷作用于MCF-7细胞48h后,观察各组细胞穿过Transwell小室聚碳烯膜的情况。100x高倍镜下可见0μmol/L、
50μmol/L、150μmol/L、250μmol/L四组穿过Transwell小室聚碳烯膜的细胞数分别为:(144.00±27.22)个、(69.67±9.76)、(26.67±6.88)和(14.00±4.27)。50μmol/L组与对照组之间有统计学差异(P<0.05),余与阴性对照组之间均有统计学差异(P<0.05),见图2。
3.3 黄芩苷诱导乳腺癌细胞MCF-7凋亡
将有代表性的0μmol/L(NC)、50μmol/L、150μmol/L、250μmol/L四组浓度的黄芩苷作用于MCF-7细胞48h后,用流式细胞仪检测。结果显示0μmol/L、50μmol/L、150μmol/L、250μmol/L四组细胞早期凋亡率(%)分别为(2.58±0.97)、(8.5±1.27)、(13.6±1.47)、(22.7±2.38),晚期凋亡率(%)分别为(2.38±0.72)、(5.0±0.39)、(15.0±2.39)、(39.8±4.59),各给药组与阴性对照组之间无论是早期凋亡率还是晚期凋亡率均具有统计学差异(P<0.05),见图3。
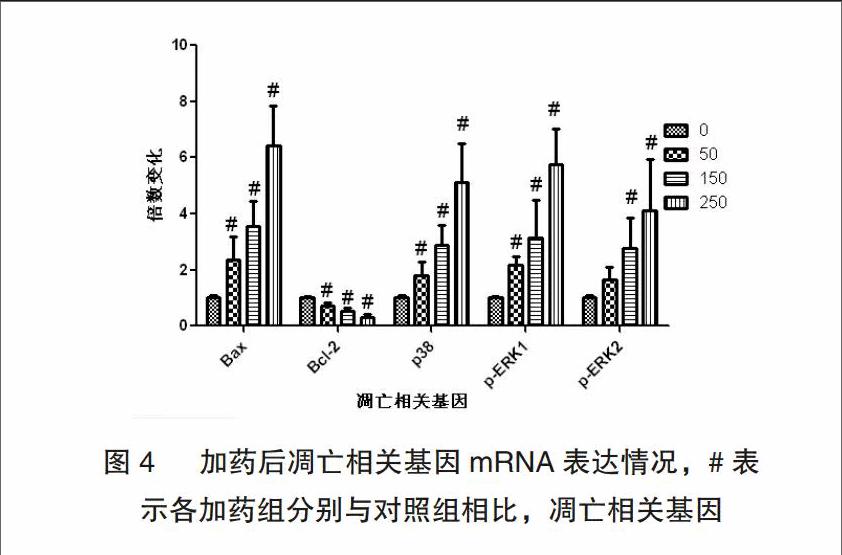
3.4 黄芩苷调控乳腺癌细胞MCF-7凋亡相关mRNA的表达
将有代表性的0μmol/L(NC)、50μmol/L、150μmol/L、250μmol/L四组浓度的黄芩苷作用于MCF-7细胞48h,逆转录后,PCR结果显示:与阴性对照组相比,50μmol/L、150μmol/L、250μmol/L三个加药组中Bax、P38、p-ERK1、p-ERK2的mRNA表达量均呈显著性递增。而Bcl-2的mRNA表达量则呈显著性递减,差异均具有统计学意义(P<0.05)。50μmol/L组bcl-2、bax与对照组之间差异具有统计学意义(P<0.05)。值得注意的是50μmol/L 加药组中p-ERK2的mRNA表达量虽较阴性对照组中增多,但差异无统计学意义(P>0.05),见图4。4 讨论
在我国发达城市中,乳腺癌的发病率业已位居女性恶性肿瘤的首位[7],并且乳腺癌的发病年龄逐渐呈现年轻化的特点。目前来讲,最为棘手的问题是乳腺癌手术后的局部复发和转移。所以如果有其它较好的手段,如新药物、新基因等手段辅助手术联合治疗对于乳腺癌患者来说无疑是一利好。黄芩苷作为天然的中草药,现有研究表明其对肝癌、大肠癌、前列腺癌等肿瘤均具有一定的治疗效果。所以本实验的目标就是揭示黄芩苷对乳腺癌细胞株MCF-7的影响。
在本次研究中,我们将不同浓度的黄芩苷加入到人乳腺癌细胞株MCF-7 24、48和72h后发现乳腺癌细胞MCF-7的生长受到明显的抑制,且在一定的浓度范围和一定的时间内呈现出时间和浓度的依赖性。这与先前在膀胱癌和前列腺癌中的研究是一致的[8-9]。而后我们选取有代表性的三个加药组来做迁移实验。发现加药组相对于对照组来说,乳腺癌细胞穿过Transwell小室聚碳烯膜的数量显著减少了。而且随着加药浓度升高,穿过的细胞数量越来越低,呈明显的负相关趋势。
细胞死亡通常分为两个类别即细胞凋亡和细胞坏死:凋亡代表“主动的”程序性细胞死亡; 坏死则是代表“被动”的意外的细胞死亡[10]。而抗癌治疗的关键就是诱导癌细胞的凋亡。有报告指出,黄芩苷能诱导前列腺癌细胞凋亡[11],黄芩苷对乳腺癌有生长抑制效应[12]。所以为了揭示黄芩苷是否可以促进乳腺癌MCF-7细胞凋亡这个命题,我们用流式细胞仪检测不同加药组的细胞凋亡率,结果显示随着黄芩苷的浓度增加,加药组无论是早期凋亡率还是晚期凋亡率都有了明显的增加,且随着浓度增加,凋亡率也显著增加。
药物一般通过外在途径或细胞质途径和内在途径或线粒体途径来诱导细胞凋亡。然而,无论是外在途径还是内在途径都通过caspase-3。内在途径中,位于caspase-3上游的是caspase-9 [13]。在本实验中,给药组的caspase-9和caspase-3被激活。结果表明,caspase-3和caspase-9的被激活作为一种机制参与了用药组诱导细胞凋亡的过程。Lee[14]等研究发现黄芩苷通过下调bcl-2和上调Bax 蛋白表达水平,通过降低线粒体膜电位,从而促进细胞色素C的释放,最后激活细胞内线粒体途径,从而活化caspase-3而诱导乳腺癌细胞凋亡。还有报道称,黄芩素的作用涉及ERK[15]及P38 MAPK和AKT的磷酸化[16]。本实验中,我们发现给药组中Bax、P38、p-ERK1、p-ERK2的mRNA表达量呈递增趋势。而Bcl-2的mRNA量则呈递减趋势。给药组中的Bcl-2表达量下降而Bax表达增加了,呈负相关。给药组与阴性对照组相比较,均具有统计学意义。上述结果表明药物组诱导的凋亡不仅涉及内在途径,同时也通过下调Bcl-2基因和上调Bax基因起作用。综上,黄芩苷通过ERK 信号通路激活caspase-3和caspase-9,下调bcl-2,上调p-ERK、bax、p38从而诱导乳腺癌MCF-7细胞凋亡。
乳腺癌的发生发展涉及多因素多基因,从开始到进展的多阶段的复杂过程。中草药作为转化医学的重要手段,深入研究中草药黄芩苷,或许能够显现出较大的经济效益,且更重要的是能够为乳腺癌患者提供新的药物方案和治疗思路。
[参考文献]
[1] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics[J]. CA Cancer J Clin,2005,55(2):74-108.
[2] Seitz HK,Pelucchi C,Bagnardi V, et al. Epidemiology and pathophysiology of alcohol and breast cancer[J]. Alcohol, 2012,47(3):204-212.
[3] 牛瑞芳,杨毅,刘红,等. 乳腺癌中癌基因抗癌基因表达分析[J]. 中国肿瘤临床, 2003,30(3):167-171.
[4] Li YY, Fu S, Wang XP, et al. Down-regulation of c9orf86 in human breast cancer cells inhibits cell proliferation,invasion and tumor growth and correlates with suvival of breast cancer patients[J]. PloS One,2013,8(8):71764-71775.
[5] Androutsopoulos VP, Mahale S, Arroo RRJ, et al. Anticancer effects of the flavonoid diosmetin on cell cycle progression and proliferation of MDA-MB-468 breast cancer cells due to CYP1 activation[J]. Oncology Reports,2009,21(6):1525-1534.
[6] 李敏華,唐健,王春亮. 甘草黄酮对长期大强度运动小鼠心肌损伤的保护作用[J].基因组学与应用生物学, 2015, 34(2):290-295.
[7] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin,2013,61(3):11-30.
[8] Ikezoe T, Chen SS, Heber D, et al. Baicalin is a major component of PC-SPES which inhibits the proliferation of human cancer cells via apoptosis and cell cycel arrest[J]. Prostate, 2001, 49(4):285-92.
[9] Chao JI, Su WC, Liu HF. Baicalein induces cancer cell death and proliferation retardation by the inhibition of CDC2 kinase and survivin associated with opposite role of p38 mitogen-activated protein kinase and AKT[J]. Mol Cancer Ther, 2007, 6(11):3039-3048.
[10] Herr I, Debatin KM. Cellular stress response and apoptosis in cancer therapy[J].Blood,2001, 98(9):2603-2614.
[11] Chen S, Ruan Q, Bedner E, et al. Effects of the flavonoid baicalin and its metabolite baicalein on androgen receptor expression, cell cycel progression and apoptosis of prostate cancer cell lines[J]. Cell Prolif, 2001,34(5): 293-304.
[12] Parajuli P, Joshee N, Rimando AM, et al. In vitro antitumor mechanisms of various scutellaria extracts and constituent flavonoids[J]. Planta Med,2009,75:41-48.
[13] Ghobrial IM, Witzig TE, Adjei AA. Targeting apoptosis pathways in cancer therapy. CA Cancer J Clin[J], 2005;55:178-194.
[14] Lee JH, Li YC, Ip SW, et al. The role of Ca2+ in baicalein induced apooptosis in human breast MDA-MB-231 cancer cells through mitochondria-and caspase-3-dependent pathway[J]. Anticancer Res, 2008, 28(3A):1701-1711.
[15] Peng CY, Pan SL, Huang YW, et al. Baicalein attenuates intimal hyperplasia after rat carotid balloon injury though arresting cell-cycle progression and inhibiting ERK, Akt, and NF-kappaB activity in vascular smooth-muscle cells[J]. Naunyn Schmiedebergs Arch Pharmacol,2008,378:579-588.
[16] Chao JI, Su WC, Liu HF. Baicalein induces cancer cell death and proliferation retardation by the inhibition of CDC2 kinase and survivin associated with opposite role of p38 mitogen-activated protein kinase and AKT[J]. Mol Cancer Ther,2007,6:3039-3048.
(收稿日期:2017-01-02)
