大黄酸对高糖诱导的H9c2心肌细胞损伤的保护作用及机制
2024-04-29王甜甜王魏杨翠华卢斌
王甜甜 王魏 杨翠华 卢斌
摘要 目的:研究大黄酸(RH)对高糖处理的H9c2心肌细胞的保护作用及可能机制。方法:H9c2细胞分为正常葡萄糖浓度组(NG组,葡萄糖浓度为5.5 mmol/L)、高糖组(HG组,葡萄糖浓度为35 mmol/L)、高糖+大黄酸组(HG+RH 5组、HG+RH 10组、HG+RH 30组,大黄酸浓度分别为5、10、30 μmol/L)。细胞增殖/凋亡检测(CCK-8)法检测各组细胞活力,蛋白质免疫印迹法(Western Blot)检测沉默信息调节因子1(Sirt1)、过氧化物酶体增殖物激活受体γ共激活因子-1α(PGC-1α)、线粒体转录因子A(TFAM)蛋白表达。H9c2细胞分为正常葡萄糖浓度组(NG 组)、高糖组(HG组)、高糖+大黄酸组(HG+RH10组,RH为10 μmol/L)、高糖+大黄酸+EX527组(HG+RH+EX527组,EX527为10 μmol/L)。实时荧光定量聚合酶链式反应(PCR)检测Sirt1、PGC-1α、TFAM、核呼吸因子1(NRF-1)、解偶联蛋白2(UCP2)mRNA水平;Western Blot检测Sirt1、PGC-1α、TFAM蛋白表达。结果:与NG组比较,HG组细胞活力下降(P<0.05);不同浓度的大黄酸干预组细胞活力有一定程度升高,但差异无统计学意义(P>0.05);与NG组比较,HG组Sirt1、PGC-1α、TFAM蛋白水平明显下降(P<0.05);与HG组比较,浓度为10 μmol/L的大黄酸干预组Sirt1、PGC-1α、TFAM蛋白水平均升高(P<0.05);与NG组比较,HG组Sirt1、PGC-1α、TFAM、NRF-1、UCP2 mRNA表达水平降低(P<0.05),与HG组比较,HG+RH10组Sirt1、PGC-1α、TFAM、NRF-1、UCP2 mRNA表达水平升高,而EX527处理组各指标表达较HG+RH10组降低(P<0.05)。结论:大黄酸对高糖诱导的心肌细胞损伤具有保护作用,其机制可能是通过激活Sirt1/PGC-1α通路实现的
关键词 糖尿病心肌病;大黄酸;心肌细胞损伤;保护作用;沉默信息调节因子1;过氧化物酶体增殖物激活受体γ共激活因子-1α;实验研究
doi:10.12102/j.issn.1672-1349.2024.03.010
Protective Effect and Mechanism of Rhein on H9c2 Cardiomyocytes Injury Induced by High Glucose
WANG Tiantian, WANG Wei, YANG Cuihua, LU Bin
Jinling Clinical Medical School of Nanjing Medical University, General Hospital of Eastern Theater Command, People′s Liberation Army of China, Nanjing 210002, Jiangsu, China
Corresponding Author LU Bin, E-mail: lubin@nju.edu.cn
Abstract Objective:To observe the protective effect of rhein(RH) on H9c2 cardiomyocytes injury induced by high glucose and its possible mechanism.Methods:H9c2 cells were divided into normal glucose group(NG group,glucose concentration was 5.5 mmol/L),high glucose group(HG group,glucose concentration was 35 mmol/L),high glucose+rhein group(HG+RH 5 group,HG+RH 10 group,HG+RH 30 group).The concentration of rhein was 5 μmol/L,10 μmol/L,and 30 μmol/L,respectively.Cell viability was detected by cell counting kit-8(CCK-8).Protein expression of silencing information regulator 1(Sirt1),peroxisome proliferator-activated receptor-γ-coactivator-1α(PGC-1α) and mitochondrial transcription factor A(TFAM) were detected by Western Blot.H9c2 cells were divided into normal glucose group(NG group),high glucose group(HG group),high glucose+rhein group(HG+RH10 group,rhein 10 μmol/L),high glucose+rhein +EX527 group(HG+RH10+EX527 group,EX527 10 μmol/L).Real-time fluorescence quantitative polymerase chain reaction(PCR) was used to detect mRNA levels of Sirt1,PGC-1α,TFAM,nuclear respiratory factor 1(NRF-1) and uncoupling protein 2(UCP2).The expressions of Sirt1,PGC-1α and TFAM were detected by Western Blot.Results:Compared with NG group,the cell viability of HG group decreased(P<0.05).The cell viability of different concentrations of rhein group increased to a certain extent,but the difference was not statistically significant(P>0.05).Compared with NG group,the protein levels of Sirt1,PGC-1α and TFAM in HG group significantly decreased(P<0.05).Compared with HG group,the protein levels of Sirt1,PGC-1α and TFAM in RH 10 μmol/L group increased(P<0.05).Compared with NG group,mRNA levels of Sirt1,PGC-1α,TFAM,NRF-1 and UCP2 in HG group decreased(P<0.05).Compared with HG group,the above mRNA levels in HG+RH10 group increased,and EX527 inhibited the increase of rhein(P<0.05).Conclusion:Rhein showed some aprotective effect on cardiomyocytes injury induced by high glucose,which might be achieved by activating of Sirt1/PGC-1α pathway
Keywords diabetic cardiomyopathy; rhein; cardiomyocytes injury; protective effect; Silencing information regulator 1, Sirt1, peroxisome proliferator activator receptor γ coactivator 1α, PGC-1α; experimental study
基金项目 国家自然科学基金项目(No.81873174)
作者单位 南京医科大学金陵临床医学院/中国人民解放军东部战区总医院(南京210002)
通讯作者 卢斌,E-mail:lubin@nju.edu.cn
引用信息 王甜甜,王魏,杨翠华,等.大黄酸对高糖诱导的H9c2心肌细胞损伤的保护作用及机制[J].中西医结合心脑血管病杂志,2024,22(3):459-463;469.
糖尿病心肌病(diabetic cardiomyopathy,DCM)是指糖尿病引起的以心脏结构和心室舒缩功能改变为特点的一种心脏病变,临床表现主要有充血性心力衰竭、心绞痛和心律失常,是临床较常见的一种糖尿病并发症。已有研究表明,糖脂代谢异常、炎症反应、氧化应激、线粒体功能紊乱、心肌纤维化、细胞凋亡、自噬等均参与DCM的发生发展[1-2]。心脏的能量消耗约占人体三磷酸腺苷(ATP)总消耗量的8%,线粒体占心肌细胞体积的30%~40%[3],线粒体功能稳定对于心脏正常生理功能具有重要作用。糖尿病存在的糖脂代谢紊乱、氧化应激、糖基化修饰等均会损害心肌线粒体的结构和功能[1]。多项研究显示线粒体损伤在DCM发病的多个环节中起重要调控作用,可导致或者加快DCM的发生,而改善线粒体功能可减少糖尿病对心脏的损害[4-6]。
大黄酸(Rhein,RH)是一种从中药大黄中分离出来的蒽醌化合物,有改善糖脂代谢、抗炎、抗氧化应激等作用。研究表明大黄酸能够延缓糖尿病肾病进展,改善胰岛功能,治疗脂肪肝等[7-9]。本研究采用高糖培养H9c2心肌细胞模拟DCM模型,探讨大黄酸对H9c2心肌细胞的保护作用及可能机制,为大黄酸制剂用于DCM的治疗提供理论依据。
1 材料与方法
1.1 实验材料
H9c2心肌细胞系、低糖DMEM培养基、磷酸缓冲盐溶液(PBS)(上海中乔新舟公司);胎牛血清(NEWZERUM);双抗、0.25%胰蛋白酶(Gibco);大黄酸(南京景竹生物科技有限公司);EX527(Sigma公司);沉默信息调节因子1(silent information regulator 1,Sirt1)抗体(Millipore)、过氧化物酶体增殖物激活受体γ共激活剂-1α(peroxisome proliferator-activated receptor-γ coactivator,PGC-1α)抗体(Abcam公司)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)抗体、 β-tubulin抗体(ABclonal);实时荧光定量聚合酶链式反应(PCR)引物包括Sirt1、PGC-1α、TFAM、核呼吸因子1(nuclear respiratory factor-1,NRF-1)、解偶联蛋白2(uncoupling protein 2,UCP2),细胞增殖/凋亡检测(Cell Counting Kit-8,CCK-8)法试剂盒(南京普诺恩生物技术有限公司);Trizol、RNA反转录和扩增试剂(南京诺唯赞生物科技股份有限公司)。
1.2 细胞培养及不同浓度大黄酸干预分组
将H9c2细胞培养在含10%胎牛血清、1%双抗生素的低糖培养基中,于37 ℃、5% CO2的条件下培养,每天或2 d进行换液,3~4 d传代。待细胞贴壁汇合成80%~90%状态时,用胰酶37 ℃消化1 mim,离心重悬后分为5组:正常葡萄糖浓度组(NG 组,葡萄糖浓度为5.5 mmol/L)、高糖组(HG组,葡萄糖浓度为35 mmol/L)、高糖+大黄酸组(HG+RH5组、HG+RH10组、HG+RH30组,大黄酸浓度分别为5、10、30 μmol/L)。
1.3 CCK8法检测细胞活力
当H9c2细胞生长至90%密度时,常规消化细胞,接种于96孔板中,每孔2 000个细胞。按照实验分组,待细胞融合度达80%~90%时,每孔加入10 μL CCK8试剂,于37 ℃培养箱孵育2 h,酶标仪450 nm波长处检测吸光值。
1.4 蛋白质免疫印迹法(Western Blot)检测Sirt1、PGC-1α、TFAM蛋白表达水平
将H9c2细胞接种于6孔板中,细胞融合至90%时,弃去培养液,PBS洗涤2次,每孔加入RIPA裂解液,收集细胞离心留取上清,二喹啉甲酸法(BCA)测定蛋白浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离、湿转至二氨基联苯胺(PVDF)膜,并用5%牛血清白蛋白(BSA)的酸性磷酸酶抗体(TBST)封闭1 h,之后分别用Sirt1、PGC-1α(1∶1 000)、TFAM(1∶2 000)、β-tublin(1∶5 000)抗体4 ℃孵育过夜,然后用TBST洗涤4次,在室温下孵育相应的山羊抗兔、抗鼠IgG二抗(1∶5 000)1.5 h,再次TBST洗涤4次,用超敏增强型化学发光(ECL)试剂显影曝光拍照。利用Image J软件分析条带灰度值。
1.5 EX527干预分组
将H9c2细胞分为正常葡萄糖组(NG 组)、高糖组(HG组)、高糖+大黄酸组(HG+RH10组,大黄酸为10 μmol/L)、高糖+大黄酸+EX527组(HG+RH10+EX527组,EX527为10 μmol/L)。
1.6 PCR检测Sirt1、PGC-1α、TFAM、NRF-1和UCP2 mRNA水平
将H9c2细胞接种于6孔板中,细胞融合至90%时,弃去培养液,进一步PBS洗涤2次,应用Trizol法提取细胞总RNA,根据逆转录试剂盒说明合成cDNA。详细PCR引物序列如下,Sirt1正向引物:CAGGTAGTTCCTCGGTGTCC,Sirt1反向引物:TGAAGGCAGAGGTTCCCTATT;PGC-1α正向引物:CCGATCACCATATTCCAGGT,PGC-1α反向引物:TTCAGACTCCCGCTTCTCAT;TFAM正向引物:GAGCCATAGTGCCCATCAGT,TFAM反向引物:ATCAAGACTGTGCGTGCATC;NRF-1正向引物:ATGGAGGAACACGGAGTGAC,NRF-1反向引物:GCTGCCGTGGAGTTGAGTAT;UCP2正向引物:TTGAAGAACGGGACACCTTT,UCP2反向引物:CTGCAATACAGGCTGCTGTC。根据实时定量PCR扩增试剂盒说明,反应程序:第一步预变性:95 ℃ 5 min,1个循环:第二步PCR反应:95 ℃ 10 s,60 ℃ 34 s,40个循环;第三步,熔解曲线分析。使用2-△△Ct法计算各样本中相对mRNA量,以GAPDH作为内参。
1.7 统计学处理
采用GraphPad Prism 9.0软件进行数据分析。符合正态分布的定量资料以均数±标准差(x-±s)表示,多组间比较采用单因素方差分析(One-way ANOVA)检验,组间差异比较采用Tukey′s多重比较检验。以P<0.05为差异有统计学意义。
2 结 果
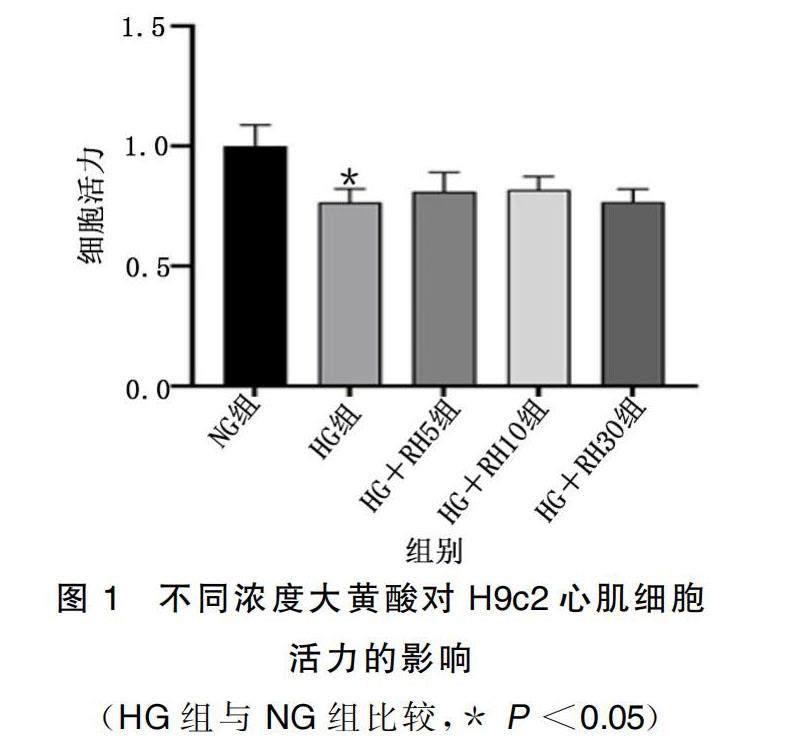
2.1 不同浓度大黄酸对高糖处理后的H9c2心肌细胞活力的影响
与NG组相比,HG组细胞活力下降(P<0.05)。与HG组相比,HG+RH5组、HG+RH10组、HG+RH30组细胞活力有一定程度升高,但差异无统计学意义(P>0.05)。详见图1。
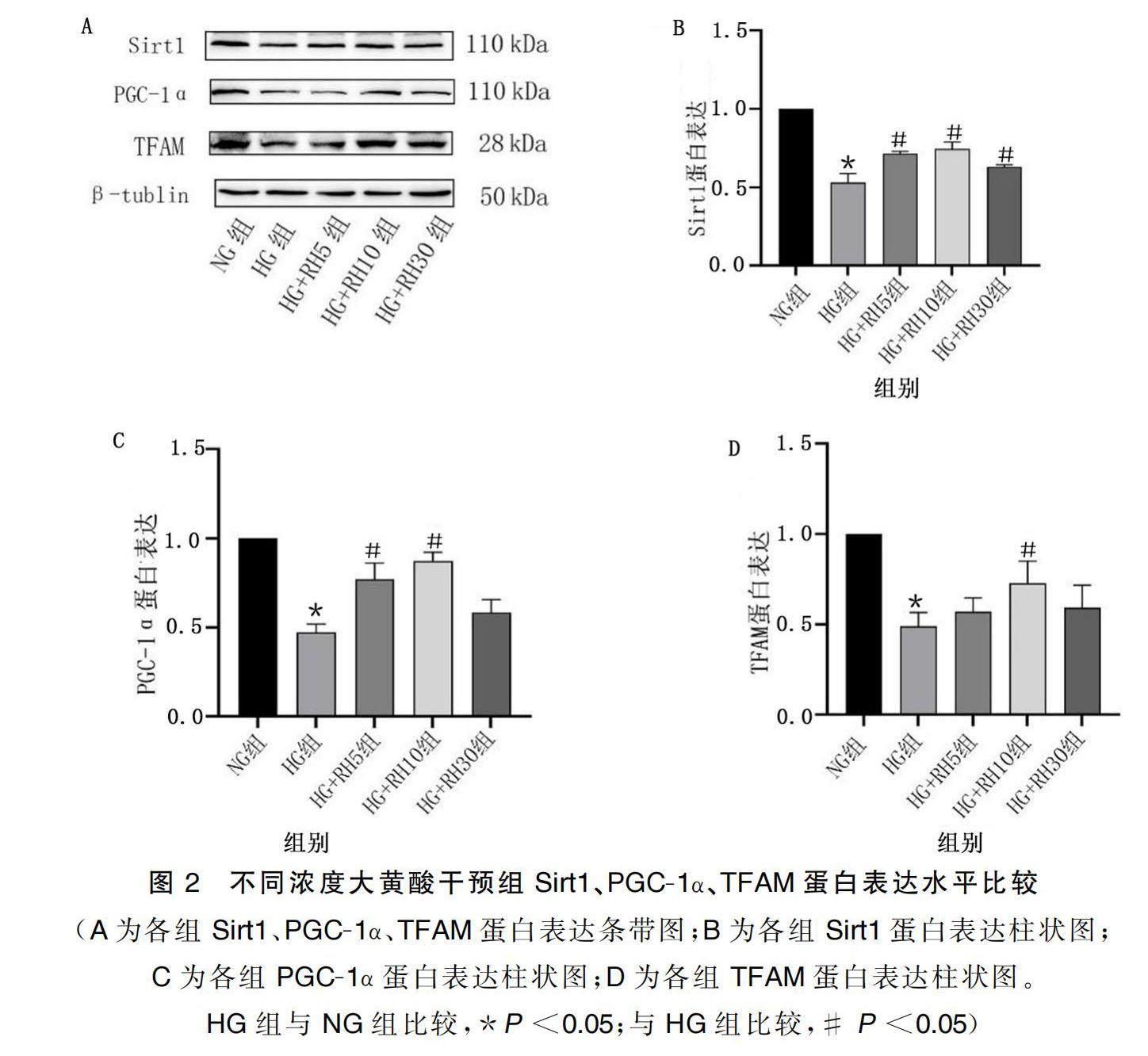
2.2 不同浓度大黄酸对高糖处理的H9c2心肌细胞蛋白表达的影响
与NG组相比,HG组Sirt1、PGC-1α、TFAM蛋白水平明显下降(P<0.05)。与HG组相比,HG+RH5组、HG+RH10组、HG+RH30组Sirt1蛋白表达均明显增加(P<0.05),其中以HG+RH10组升高最为明显。与HG组相比,HG+RH5组、HG+RH10组PGC-1α蛋白表达均明显增加(P<0.05),HG+RH30组PGC-1α蛋白表达升高,差异无统计学意义。与HG组相比,HG+RH10组的TFAM蛋白表达明显升高(P<0.05),HG+RH5组、HG+RH30组的TFAM蛋白表达有所增加,但差异无统计学意义。详见图2。最终选择大黄酸10 μmol/L作为干预浓度。
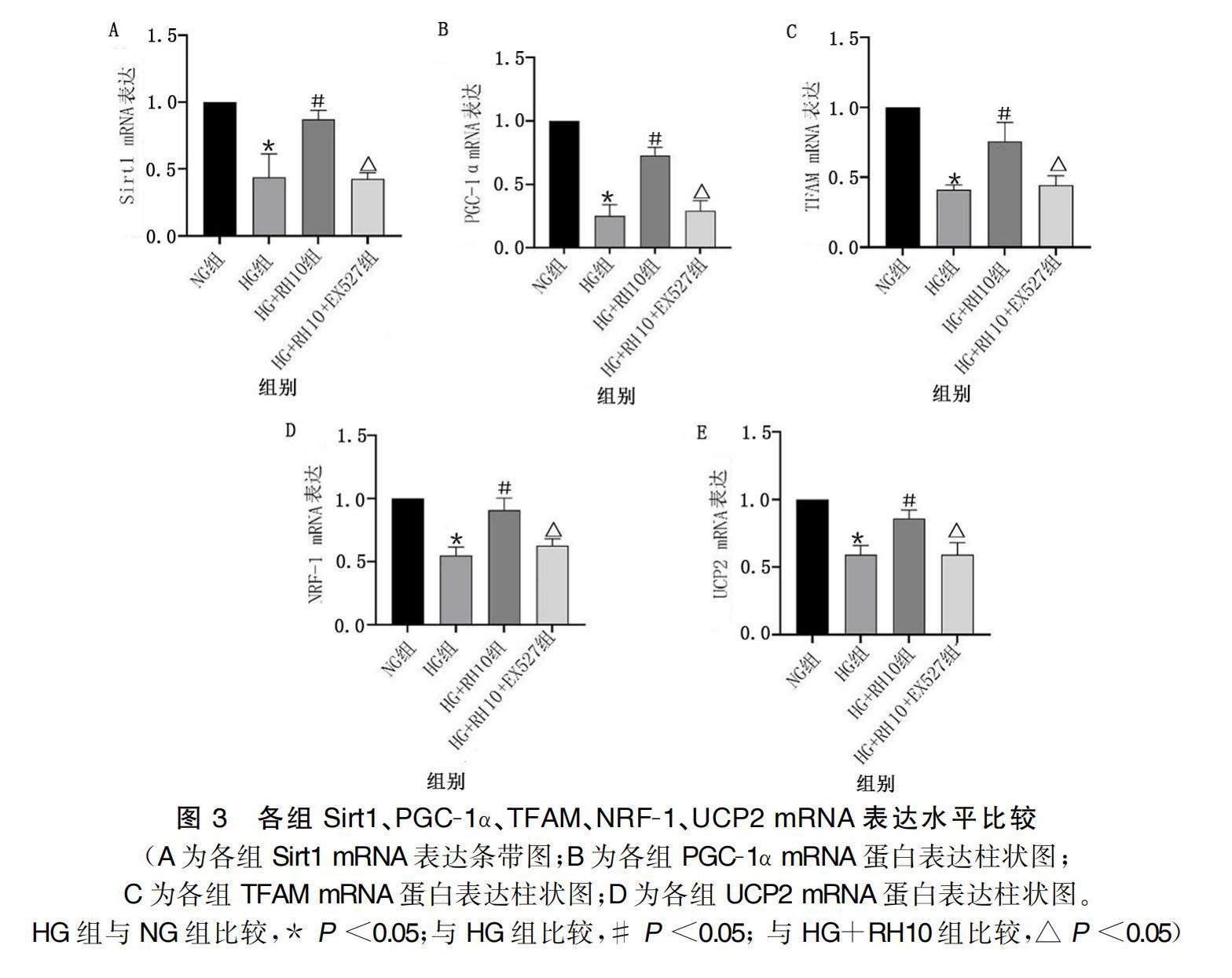
2.3 Sirt1抑制剂EX527对大黄酸干预的H9c2心肌细胞mRNA表达的影响
与NG组相比,HG组Sirt1、PGC-1α、TFAM、NRF-1、UCP2 mRNA表达水平均降低(P<0.05),HG+RH10组各指标mRNA表达水平均明显升高(P<0.05)。与HG+RH10组相比,HG+RH10+EX527组各指标mRNA水平均明显降低(P<0.05)。详见图3。
2.4 Sirt1抑制剂EX527对大黄酸干预的H9c2心肌细胞蛋白表达的影响
与NG组相比,HG组Sirt1、TFAM、PGC-1α蛋白表达均明显减少(P<0.05)。与HG组相比,HG+RH10组Sirt1、PGC-1α、TFAM蛋白表达均明显增加(P<0.05)。与HG+RH10组相比,HG+RH10+EX527组Sirt1、PGC-1α、TFAM蛋白表达均明显降低(P<0.05)。详见图4。
3 讨 论
DCM的主要病理变化包括心肌肥大、坏死、凋亡、间质纤维化、微小血管硬化,其前期以舒张功能障碍为主,逐步进展至心力衰竭[1]。目前除了钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂、胰高糖素肽-1(GLP-1)受体激动剂类的降糖药物具有心血管益处外,大多数降糖药物并无心脏保护作用。
线粒体功能障碍是DCM发病机制之一,目前已有以线粒体为靶点的DCM的治疗药物,如MnTBAP[10]、MitoQ[11]、BH4[12]等有助于改善线粒体氧化应激;曲美他嗪[13]、雷诺嗪[14]、哌克昔林[15]可调节线粒体底物利用,提高左室射血分数。线粒体生物合成对维持线粒体质量至关重要,PGC-1α在调控线粒体生成和呼吸功能的转录控制中起到核心作用,可激活下游多种转录因子,包括TFAM、NRF-1、UCP2、雌激素相关受体-α(oestrogen-related receptor-α,ERR-α)等。TFAM是一种编码线粒体转录因子α的核基因,能够稳定线粒体DNA(Mitochondrial DNA,mtDNA)并启动线粒体DNA复制。大量研究表明TFAM的缺失可导致mtDNA的突变及其拷贝数减少,导致线粒体功能紊乱。NRF-1可作用于TFAM基因的启动子,调控线粒体生成,还参与调节心肌能量代谢[16-17]。UCP2过表达可减少氧化应激引起的心肌细胞凋亡,对糖尿病心肌有保护作用[18-19]。故本实验采用在线粒体功能中起重要作用的PGC-1α、TFAM、NRF-1、UCP2等作为研究指标。
Sirt1是一种高度保守的烟酰胺腺嘌呤二核苷酸(NAD+)依赖的组蛋白去乙酰化酶,大多分布在哺乳动物的心脏、脑、胰腺、肝脏和脂肪组织中,可通过去乙酰化作用调控PGC-1α,影响线粒体生成。白藜芦醇[20]、Exendin-4已被证实可激活Sirt1/PGC-1α通路改善线粒体功能,起到保护心肌作用[21]。本研究用浓度为35 mmol/L的葡萄糖处理H9c2细胞。细胞活力检测结果显示,与5.5 mmol/L葡萄糖组细胞相比,35 mmol/L组细胞活力明显下降,可以作为体外模拟糖尿病心肌损伤的细胞模型。为探究大黄酸在体外是否可以保护H9c2心肌细胞,用不同浓度(5、10、30 μmol/L)的大黄酸干预高糖处理心肌细胞,结果显示,与HG组相比,HG+RH5组、HG+RH10组、HG+RH30组细胞活力均有所升高,但差异无统计学意义。蛋白表达的研究结果显示高糖可导致H9c2心肌细胞Sirt1、PGC-1α、TFAM水平降低,而大黄酸均可增加上述蛋白的表达。其中10 μmol/L浓度的大黄酸组升高最为明显,最终选择10 μmol/L作为大黄酸的干预浓度。
为进一步证实大黄酸是否通过激活Sirt1/PGC-1α通路从而保护心肌细胞,本研究使用EX527来抑制Sirt1。EX527是一种特异性的Sirt1抑制剂,已应用于多项研究[22-23]。EX527作用于大黄酸干预后的高糖H9c2心肌细胞,实验结果显示大黄酸上调了高糖处理后H9c2细胞Sirt1、PGC-1α、TFAM、NRF-1和UCP2 mRNA水平。与大黄酸处理组相比,EX527处理组上述指标mRNA水平均明显降低。在蛋白表达水平,与大黄酸组相比,EX527处理组Sirt1、PGC-1α、TFAM蛋白表达均明显降低,提示EX527可抑制大黄酸引起的Sirt1、PGC-1α、TFAM蛋白的升高。
综上所述,大黄酸通过激活Sirt1/PGC-1α通路,改善线粒体功能,从而保护心肌细胞,为临床治疗DCM提供了新思路。
参考文献:
[1] RITCHIE R H,ABEL E D.Basic mechanisms of diabetic heart disease[J].Circ Res,2020,126(11):1501-1525.
[2] DILLMANN W H.Diabetic cardiomyopathy[J].Circ Res,2019,124(8):1160-1162.
[3] GOLLMER J,ZIRLIK A,BUGGER H.Mitochondrial mechanisms in diabetic cardiomyopathy[J].Diabetes Metab J,2020,44(1):33-53.
[4] YU L M,DONG X,XUE X D,et al.Melatonin attenuates diabetic cardiomyopathy and reduces myocardial vulnerability to ischemia-reperfusion injury by improving mitochondrial quality control:role of SIRT6[J].J Pineal Res,2021,70(1):e12698.
[5] QI B C,HE L J,ZHAO Y,et al.Akap1 deficiency exacerbates diabetic cardiomyopathy in mice by NDUFS1-mediated mitochondrial dysfunction and apoptosis[J].Diabetologia,2020,63(5):1072-1087.
[6] WANG J,HUANG X,LIU H,et al.Empagliflozin Ameliorates diabetic cardiomyopathy via attenuating oxidative stress and improving mitochondrial function[J].Oxidative Medicine and Cellular Longevity,2022,1122:494.
[7] HU H C,ZHENG L T,YIN H Y,et al.A significant association between rhein and diabetic nephropathy in animals:a systematic review and meta-analysis[J].Front Pharmacol,2019,10:1473.
[8] LIU J,CHEN Z H,ZHANG Y J,et al.Rhein protects pancreatic β-cells from dynamin-related protein-1-mediated mitochondrial fission and cell apoptosis under hyperglycemia[J].Diabetes,2013,62(11):3927-3935.
[9] SHENG X Y,WANG M,LU M,et al.Rhein ameliorates fatty liver disease through negative energy balance,hepatic lipogenic regulation,and immunomodulation in diet-induced obese mice[J].American Journal of Physiology Endocrinology and Metabolism,2011,300(5):E886-E893.
[10] ILKUN O,WILDE N,TUINEI J,et al.Antioxidant treatment normalizes mitochondrial energetics and myocardial insulin sensitivity independently of changes in systemic metabolic homeostasis in a mouse model of the metabolic syndrome[J].Journal of Molecular and Cellular Cardiology,2015,85:104-116.
[11] ESCRIBANO-LOPEZ I,DIAZ-MORALES N,ROVIRA-LLOPIS S,et al.The mitochondria-targeted antioxidant mitoq modulates oxidative stress,inflammation and leukocyte-endothelium interactions in leukocytes isolated from type 2 diabetic patients[J].Redox Biology,2016,10:200-205.
[12] BAUMGARDT S L,PATERSON M,LEUCKER T M,et al.Chronic coadministration of sepiapterin and L-citrulline Ameliorates diabetic cardiomyopathy and myocardial ischemia/reperfusion injury in obese type 2 diabetic mice[J].Circulation Heart Failure,2016,9(1):e002424.
[13] ZHAO P,ZHANG J,YIN X G,et al.The effect of trimetazidine on cardiac function in diabetic patients with idiopathic dilated cardiomyopathy[J].Life Sciences,2013,92(11):633-638.
[14] ZACHAROWSKI K,BLACKBURN B,THIEMERMANN C.Ranolazine,a partial fatty acid oxidation inhibitor,reduces myocardial infarct size and cardiac troponin T release in the rat[J].European Journal of Pharmacology,2001,418(1/2):105-110.
[15] BEADLE R M,WILLIAMS L K,KUEHL M,et al.Improvement in cardiac energetics by perhexiline in heart failure due to dilated cardiomyopathy[J].JACC Heart Failure,2015,3(3):202-211.
[16] SCARPULLA R C.Nuclear control of respiratory gene expression in mammalian cells[J].J Cell Biochem,2006,97(4):673-683.
[17] 侯维娜,王瑞鹃.核呼吸因子-1在心脏疾病的相关研究进展[J].实用医学杂志,2018,34(15):2612-2613.
[18] DIAO J,WEI J,YAN R,et al.Effects of resveratrol on regulation on UCP2 and cardiac function in diabetic rats[J].Journal of Physiology and Biochemistry,2019,75(1):39-51.
[19] CADENAS S.Mitochondrial uncoupling,ROS generation and cardioprotection[J].Biochimica et Biophysica Acta Bioenergetics,2018,1859(9):940-950.
[20] FANG W J,WANG C J,HE Y,et al.Resveratrol alleviates diabetic cardiomyopathy in rats by improving mitochondrial function through PGC-1α deacetylation[J].Acta Pharmacologica Sinica,2018,39(1):59-73.
[21] 蔡迎迎,邹少洲,范存霞,等.Exendin-4通过调控Sirt1/PGC1α延缓糖尿病小鼠心肌损伤[J].南方医科大学学报,2018,38(5):520-526.
[22] REN B C,ZHANG Y F,LIU S S,et al.Curcumin alleviates oxidative stress and inhibits apoptosis in diabetic cardiomyopathy via Sirt1-Foxo1 and PI3K-Akt signalling pathways[J].Journal of Cellular and Molecular Medicine,2020,24(21):12355-12367.
[23] WALDMAN M,COHEN K,YADIN D,et al.Regulation of diabetic cardiomyopathy by caloric restriction is mediated by intracellular signaling pathways involving SIRT1 and PGC-1α[J].Cardiovasc Diabetol,2018,17(1):111.
(收稿日期:2022-11-03)
(本文编辑 王雅洁)
