荷叶产地加工与饮片炮制一体化工艺研究△
2024-04-29吴梅青罗栩强陈丹王姣
吴梅青,罗栩强,陈丹,王姣
1.湘潭医卫职业技术学院,湖南 湘潭 411102;2.中山市仙逸堂中药饮片有限公司,广东 中山 528436
荷叶为睡莲科植物莲Nelumbo nuciferaGaertn.的干燥叶,具有清暑化湿、升发清阳、凉血止血之功效,用于暑热烦渴、暑湿泄泻、脾虚泄泻、血热吐衄、便血崩漏[1]。现代药理研究表明,荷叶具有调血脂、抗氧化及衰老、抗炎抑菌、镇静安神、抗疲劳等药理活性[2]。以其为原料的制剂主要有荷叶丸、荷丹片等,荷叶还可以制作荷叶茶和荷叶食品,被中华人民共和国国家卫生健康委员会列入药食同源目录中。荷叶中主要含有生物碱类和黄酮类等活性成分,其中荷叶碱被广泛关注,其具有调血脂、降血糖、抗肿瘤、抗脑缺血等多种药理作用[3]。《中华人民共和国药典》(以下简称《中国药典》)2020年版(一部)中以荷叶碱为荷叶含量测定项的质量控制指标。黄酮类成分具有调血脂、抑菌、抗氧化等多种药理活性[4-5],主要包括金丝桃苷、异槲皮苷等,其为目前研究较多的成分[6-7]。有研究建议将金丝桃苷和异槲皮苷含量测定纳入荷叶质量标准中,以期更全面地反映和评价荷叶的质量,保证其临床用药的合理、有效[8]。
目前,荷叶药材的产地加工过程和饮片炮制过程是相对独立的,产地加工过程为鲜荷叶采收-净制-干燥;饮片公司购买后的炮制过程为再润湿-切丝-干燥,从药材到饮片需经过干燥和润湿过程,费工费时,还可能影响荷叶及其炮制品有效成分,从而影响药效。本研究以湘潭产荷叶为研究对象,采用不同工艺制备荷叶饮片,测定各饮片的醇溶性浸出物的含量,活性成分荷叶碱、金丝桃苷和异槲皮苷的含量,分析并比较荷叶产地加工与饮片炮制一体化(以下简称一体化)工艺饮片和传统饮片的质量差异,并进行验证,优选最佳的一体化工艺,以期为荷叶生产加工及饮片炮制提供参考。
1 材料
1.1 仪器
LC16 型高效液相色谱仪、ATY224 型电子天平(岛津公司);MSA36P-OCE-DB 型百万分之一电子天平(赛多利斯公司);KQ3200E 型数控超声波清洗仪(昆山市超声仪器有限公司);TG1650-WS 型台式高速离心机(湖南赛特湘仪离心机仪器有限公司);300Y 型多功能粉碎机(永康市铂欧五金制品有限公司);GZX-9070MBE 型电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂)。
1.2 试药
对照品荷叶碱(批号:111566-201605)、金丝桃苷(批号:111521-201809)、异槲皮苷(批号:111809-201403)均购自中国食品药品检定研究院;乙腈、甲醇、磷酸均为色谱纯;自制蒸馏水;其他试剂均为分析纯。
荷叶鲜药材购于湖南潭莲食品有限公司,购买后立即放在有冰袋的泡沫箱中,送至实验室进行相关实验。荷叶鲜药材经中山市仙逸堂中药饮片有限公司罗栩强主管药师鉴定为睡莲科植物莲Nelumbo nuciferaGaertn.的鲜荷叶。
2 方法与结果
2.1 荷叶的炮制
2.1.1 传统荷叶饮片制备 称取鲜荷叶4 片(约100 g)晒至七成干,此时整片荷叶不脆,干燥度均匀且能对折成半圆形,上表面绿色、下表面灰绿色。将七成干的荷叶除去叶柄,折成半圆形或折扇形,干燥,得荷叶药材;喷水,稍润,切丝,干燥[1],得传统荷叶饮片1#样品。
2.1.2 荷叶一体化炮制饮片制备 通过预试验发现,将新鲜荷叶在50 ℃下干燥至七成干(含水量约为30%)时,荷叶碱、金丝桃苷和异槲皮苷成分含量最高,且高于传统工艺饮片。参考相关文献[9-10],进行荷叶一体化炮制:称取鲜荷叶4 片(约100 g,共9 个样品,编号为2#~10#,每个样品平行制备3份),分别置烘箱,单叶平铺,在设定不同温度下烘至七成干,取出切丝(宽度约1.0 cm),50 ℃干燥,得一体化炮制饮片样品,见表1。

表1 荷叶样品信息
2.2 水分测定
依据《中国药典》 2020 年版(四部)通则“0832水分测定法第二法烘干法”测定[11]。
2.3 醇溶性浸出物的含量测定
以70%的乙醇为溶剂,按《中国药典》2020 年版(四部)通则“2201 浸出物测定法”项下热浸法操作,测定样品中醇溶性浸出物的含量[11]。
2.4 荷叶碱含量测定
2.4.1 色谱条件 岛津LC16 型高效液相色谱仪;Amethyst C18-H 色谱柱(250 mm×4.6 mm,5 μm);以乙腈-水-三乙胺-冰乙酸(27∶70.6∶1.6∶0.78)为流动相;检测波长为270 nm;流速为1.0 mL·min-1;柱温为35 ℃;进样体积为20 μL。色谱图见图1。

图1 荷叶碱对照品溶液与样品溶液高效液相色谱图
2.4.2 对照品溶液的配制 精密称取荷叶碱对照品适量置于50 mL 量瓶中,加甲醇定容至刻度线,摇匀,即得对照品储备液(荷叶碱质量浓度为0.403 3 mg·mL-1)。精密吸取对照品储备液1 mL置25 mL量瓶中,加甲醇定容至刻度线,摇匀,即得对照品溶液(荷叶碱的质量浓度为0.016 12 mg·mL-1)。
2.4.3 供试品溶液的制备 按《中国药典》2020年版[1]规定制备供试品溶液。取荷叶粗粉约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定质量,加热回流2.5 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,精密量取续滤液5 mL,置10 mL 量瓶中,加水至刻度,摇匀,即得。
2.4.4 线性关系考察 精密吸取荷叶碱对照品储备液0.25、0.50、1.00、2.00、3.00、4.00 mL,分别置于10 mL 量瓶中,加甲醇稀释至刻度,摇匀,按2.4.1项下色谱条件测定峰面积,以各待测成分质量浓度为横坐标(X)、峰面积为纵坐标(Y),绘制标准曲线,得回归方程:Y=64 361X+3 646.6(r=0.999 9)。结果表明,荷叶碱在质量浓度为10.075~161.200 μg·mL-1时与峰面积呈良好的线性关系。
2.4.5 含量测定 取荷叶饮片,按2.4.3 项下方法制备供试品溶液,再按2.4.1 项下色谱条件进样测定,记录峰面积,计算样品中荷叶碱的含量。每个样品平行测定3次,取平均值。
2.5 金丝桃苷和异槲皮素的含量测定
2.5.1 色谱条件 岛津LC16 型高效液相色谱仪;Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 μm);以乙腈-0.1%甲酸溶液(15∶85)为流动相;流速为1.0 mL·min-1;检测波长为354 nm;柱温为35 ℃;进样量为10 μL。
2.5.2 混合对照品溶液的配制 分别精密称取金丝桃苷和异槲皮苷对照品适量,置于25 mL 量瓶中,加50%甲醇定容至刻度线,摇匀,即得质量浓度分别为0.106 8、0.108 2 mg·mL-1的单一对照品储备液。分别精密称取金丝桃苷和异槲皮苷对照品储备液各1 mL,置于25 mL 量瓶中,加50%甲醇定容至刻度线,摇匀,即得质量浓度分别为21.36、21.64 mg·mL-1的混合对照品溶液。
2.5.3 供试品溶液的制备 参考《中国药典》2020年版(一部)月季花中金丝桃苷和异槲皮苷含量测定方法和文献[8]并结合预试验,制备供试品溶液。取荷叶炮制品粉末(过四号筛)约0.2 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 mL,密塞,称定质量,加热回流1 h,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.5.4 专属性考察 取混合对照品溶液、供试品溶液各10 μL 注入高效液相色谱仪,按2.5.1 项下色谱条件进样测定,记录色谱图。结果表明,各成分分离度均大于1.5,理论板数按金丝桃苷计不低于20 000。色谱图见图2。

图2 金丝桃苷、异槲皮苷混合对照品与样品溶液高效液相色谱图
2.5.5 线性关系考察 精密吸取金丝桃苷和异槲皮苷对照品储备液(质量浓度分别0.106 8、0.108 2 mg·mL-1)0.25、0.50、1.00、2.00、3.00、4.00 mL,分别置10 mL 量瓶中,加50%甲醇稀释至刻度,摇匀,分别得系列对照品溶液,按2.5.1 项下色谱条件测定峰面积,以各待测成分质量浓度为横坐标(X)、峰面积为纵坐标(Y)分别绘制标准曲线,计算得金丝桃苷回归方程:Y=38 355X+10 499(r=0.999 3)、异槲皮苷回归方程Y=37 038X+13 009(r=0.999 9)。结果表明,金丝桃苷质量浓度为2.67~42.72 μg·mL-1、异槲皮苷质量浓度为2.71~43.28 μg·mL-1时与峰面积呈良好的线性关系。
2.5.6 精密度考察 精密吸取混合对照品溶液10 μL,按2.5.1 项下色谱条件下进样,连续进样6次,测定峰面积,计算其RSD。金丝桃苷和异槲皮苷峰面积的RSD 分别为1.34%和1.28%,均小于2.0%,表明仪器精密度良好。
2.5.7 稳定性考察 取同一供试品溶液,分别在 0、2、4、8、12、16、24 h 按2.5.1 项下色谱条件下分别进样,测定金丝桃苷和异槲皮苷的峰面积,计算得金丝桃苷和异槲皮苷峰面积的RSD 分别为1.54%、1.67%,表明供试品溶液在24 h内稳定性良好。
2.5.8 重复性考察 取同一个样品,按2.5.3 项下方法制备6份供试品溶液,按2.5.1项下色谱条件下分别进样,测定金丝桃苷和异槲皮苷的峰面积,并计算含量。结果样品中金丝桃苷的平均质量分数为0.40%,含量的RSD 为0.92%;异槲皮苷的平均质量分数为0.58%,含量的RSD 为0.86%。表明此方法的重复性良好。
2.5.9 加样回收率试验 取已知含量的荷叶样品粉末6 份,每份约 0.1 g,精密称定,置25 mL 具塞锥形瓶中,分别精密加入金丝桃苷和异槲皮苷单一对照品储备液,按2.5.3 项下方法制备供试品溶液,再按2.5.1 项下色谱条件下进样测定,记录峰面积,计算金丝桃苷和异槲皮苷加样回收率,结果见表2。金丝桃苷及异槲皮苷平均回收率分别为99.72%(RSD为0.72%)、98.99%(RSD为1.04%)。
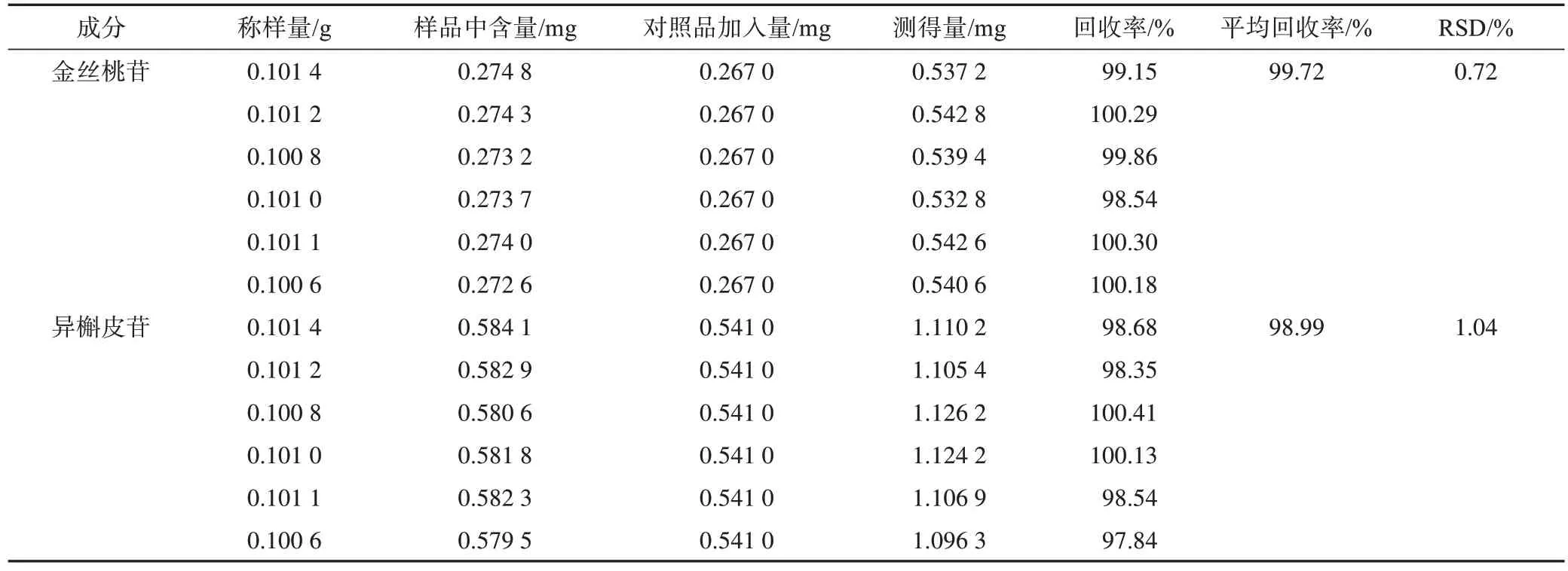
表2 金丝桃苷和异槲皮苷加样回收率测定结果
2.5.10 含量测定 取荷叶药材和荷叶饮片,按2.5.3 项下方法制备供试品溶液,再按2.5.1 项下色谱条件进样,测定样品中金丝桃苷和异槲皮苷的含量。每样品平行测定3次,取平均值。
3 结果
3.1 水分测定结果
《中国药典》2020 年版(一部)规定荷叶及其炮制品的水分不得高于15%[1],根据表3,本研究制得的传统荷叶饮片和9 个一体化炮制饮片中的水分均符合规定。

表3 传统荷叶饮片和9个一体化炮制饮片中水分、醇溶性浸出物测定结果%
3.2 醇溶性浸出物测定结果
《中国药典》2020 年版(一部)规定荷叶的醇溶性浸出物不得少于10.0%[1],根据表3,本研究制得的传统荷叶饮片和9 个一体化炮制饮片的醇溶性浸出物均符合规定。其中醇溶性浸出物量8#最高,达20.10%。
3.3 荷叶碱、金丝桃苷和异槲皮素的含量测定结果
《中国药典》2020 年版(一部)规定按荷叶干燥品中荷叶碱质量分数不得少于0.10%,荷叶饮片中荷叶碱的质量分数不得少于0.070%。10个炮制样品中荷叶碱质量分数为0.58%~0.92%,均符合《中国药典》2020 年版规定。所制得的传统荷叶饮片和9 个一体化炮制饮片中金丝桃苷质量分数为0.18%~0.42%、异槲皮苷质量分数为0.32%~0.60%,测定结果见表4。

表4 传统荷叶饮片和9个一体化炮制饮片中荷叶碱、金丝桃苷、异槲皮苷质量分数测定结果%
3.4 最优炮制工艺的确定
3.4.1 不同炮制工艺中3 个有效成分含量比较 通过预试验发现,将新鲜荷叶在50 ℃干燥至七成干(含水量约为30%)时,荷叶碱、金丝桃苷和异槲皮苷含量最高,且高于传统工艺。结果表明,9 个一体化炮制饮片中,5#~10#饮片中荷叶碱、金丝桃苷和异槲皮苷含量均高于1#。其中8#饮片中荷叶碱、金丝桃苷和异槲皮苷质量分数最高,分别为0.92%、0.42%和0.60%,8#饮片醇溶性浸出物含量相对较高。
3.4.2 不同干燥时间和温度对炮制工艺的影响 新鲜荷叶采摘后如果保存不当,很快脱水、干瘪。本研究购买新鲜荷叶后立即存放在有冰袋的泡沫箱中,送至实验室进行相关实验。荷叶中主要活性成分为生物碱、黄酮类等,高温下容易被破坏,本研究考察了30~110 ℃下干燥时间对炮制工艺的影响。结果表明,干燥温度升高,炮制工艺所需时间越短。2#~4#样品中金丝桃苷和异槲皮苷含量均低于1#,原因可能是低温干燥时间长且处于湿热环境,荷叶中酶活性强,使金丝桃苷、异槲皮苷和荷叶碱发生部分降解与转化,3 个有效成分含量降低。当干燥温度在60 ℃以上时,测得样品中荷叶碱、金丝桃苷和异槲皮苷含量升高;当干燥温度超过90 ℃后荷叶碱、金丝桃苷和异槲皮苷含量又呈现下降的趋势,原因可能是在90 ℃以上荷叶碱和黄酮类成分开始降解。
3.4.3 优选的一体化工艺 根据以上分析,初步优选的一体化工艺为烘箱90 ℃烘至七成干(含水量约30%),取出切丝,置烘箱中50 ℃下烘干。
3.5 验证实验
取同一批荷叶新鲜药材6 份,每份100 g。3份按优选的一体化工艺制备荷叶饮片,3份按传统工艺制备饮片。分别按2.3、2.4、2.5 项下方法测定醇溶性浸出物、荷叶碱、金丝桃苷和异槲皮苷,并按公式(1)计算变化率[12],结果见表5。

表5 传统荷叶饮片和一体化炮制饮片中相关指标测定结果比较%
与传统工艺制备的饮片比较,一体化工艺制备荷叶饮片中水分符合《中国药典》2020 年版要求[1]。荷叶碱、金丝桃苷和异槲皮素含量均增加,变化率分别为16.67%、20.24%和20.41%,醇溶性浸出物无明显变化。验证实验结果与3.2、3.3 项下结果基本一致,证明优选的一体化工艺比较稳定,且两者外观无明显差异,见图3。

图3 荷叶一体化炮制饮片与传统饮片的外观
4 讨论
一体化技术体系的构建是推动一体化稳定发展、提升中药饮片质量的关键[13]。一体化能够从源头保障中药饮片的质量,也是目前研究的热点,已有关于黄丝郁金[14]、广藿香[15]、川芎[16]、虎 杖[17]、黄精[18]、姜半夏[19]等一体化研究的相关报道。
首先通过预试验比较了新鲜荷叶切丝后再干燥和在50 ℃干燥至七成干再切丝荷叶中荷叶碱、金丝桃苷和异槲皮苷的含量,结果发现,新鲜荷叶直接切丝得到的饮片中各成分的含量明显低于50 ℃干燥至七成干再切丝的荷叶;再通过预试验发现,新鲜荷叶在50 ℃下干燥至七成干(含水量为30%)时,荷叶碱、金丝桃苷和异槲皮苷成分含量最高,且高于传统工艺;荷叶中主要活性成分为生物碱、黄酮类等,高温容易被破坏,所以预试验考察了不同温度下烘至七成干所需的时间。基于以上预试验,设计了9 个一体化炮制工艺,以荷叶碱、金丝桃苷、异槲皮苷的含量和醇溶性浸出物得率为指标,优选最佳的一体化炮制工艺:烘箱90 ℃烘至七成干,切丝后,50 ℃干燥,此工艺下所得样品中荷叶碱、金丝桃苷、异槲皮苷含量,醇溶性浸出物均最高,并高于传统工艺,且外观颜色无明显差异。
与传统荷叶饮片加工方法相比,一体化工艺既缩短了生产周期,又节约了生产成本,而且极大程度地保留了荷叶中的活性成分,能有效促进荷叶的开发利用。本研究所用新鲜荷叶仅来源于湘潭县,研究结果是用小批量荷叶样品在实验室进行测试分析确定的,优选的一体化炮制饮片的药理活性是否改变、能否适用于工业化和大规模生产还有待进一步研究。
[利益冲突]本文不存在任何利益冲突。
