基于LNA-TaqMan探针实时荧光定量PCR检测技术的药用黄精掺伪研究△
2024-04-29王多梅胡冲2a蒲婧哲陈灵丽杨建波张亚中张文娟
王多梅,胡冲,2a,蒲婧哲,2,陈灵丽,2,杨建波,2,3,张亚中,2*,张文娟
1.安徽省食品药品检验研究院 药品检验研究所,安徽 合肥 230051;2.国家药品监督管理局 中药质量研究与评价重点实验室,安徽 合肥 230051;3.中国食品药品检定研究院,北京 102629
黄精是一种药食同源的中药资源[1-2],具有提高机体免疫力[3]、降血糖、调血脂[4-5]、抗肿瘤[6-7]、抗菌[8]、抗病毒[9]等药理作用,其在新药研制和保健品开发等方面具有广阔的发展前景。我国黄精种质资源多样,有黄精属植物30 余种。《中华人民共和国药典》2020 年版规定药用黄精的基原为百合科植物黄精Polygonatum sibiricumDelar.ex Redoute、多花黄精P.cyrtonemaHua 和滇黄精P.kingianumColl.et Hemsl的干燥根茎[10]。然而,历代本草记载的药用黄精来源包括多种黄精属植物的根状茎,湖北黄精P.zanlanscianensePamp 作为民间习用中药,也被记载在本草典籍中[11]。湖北黄精的根茎具有润肺滋阴、补脾益肾之功效,可用于治疗体虚乏力、心悸气短、肺燥干咳、糖尿病等多种疾病。因此,市场上将湖北黄精的干燥根茎混淆为黄精的现象较为普遍。而掺假手段也并非完全替代使用,而是在黄精基原药材中掺有少量的湖北黄精或者其他黄精。现有技术仍无法解决此类掺假的定量检测问题。
形态学特征是进行黄精基原植物分类的主要依据。黄精根茎为结节状或连珠状膨大,但由于生长环境、气候条件、土壤养分及生长年限等因素的影响,即使同一种黄精生长在不同地区其形态特征也会存在一定差异,因此形态鉴别的手段往往缺乏准确性。此外,黄精属植物的显微特征及化学成分相似度极高,这使黄精属植物的物种判别缺乏特异性。
鉴于黄精属植物形态特征鉴别的局限性,分子鉴定技术被用于黄精属植物的亲缘关系研究、种质资源鉴别和遗传多样性分析[12-16]。其中锁核酸(LNA)-TaqMan 探针是在TaqMan 探针的基础上选择性对探针中的部分碱基修饰成LNA 碱基,修饰后的核糖2′-O位和4′-C位通过不同的缩水作用形成氧亚甲基桥、硫亚甲基桥或胺亚甲基桥[17-18],并连接成环形,以此提高探针与目标序列之间的亲和力、特异性和灵敏度的方法[19-20],是目前公认的用于基因表达水平分析的重要方法,在生物医药领域得到广泛应用[21-25]。本研究应用LNA-TaqMan实时荧光定量聚合酶链式反应(PCR)检测药用黄精中湖北黄精的掺伪比例,建立相关的掺伪检测方法,为黄精的质量监管和研究提供参考。
1 材料
1.1 仪器
Xinyi-48 型高通量组织研磨仪(宁波新艺超声设备有限公司);HC-2066 型高速离心机(安徽中科中佳科学仪器有限公司);C1000 Thermal Cycler CFX96 型荧光定量PCR 仪、CXF96 Optics ModuleI型凝胶成像仪、164-5050 型基础电泳仪、170-4486型水平电泳槽均购于伯乐生命医学产品(上海)有限公司;ME204 型分析天平 [梅特勒-托利多国际贸易(上海)有限公司];NanoDrop One型超微量分光光度计(赛默飞世尔科技公司)。
1.2 试药
植物基因组DNA 提取试剂盒 [天根生化科技(北 京)有 限公 司];2×M5 Super FastTaqPCR MasterMix(北京聚合美生物科技有限公司);ExTaq™ Version 2.0、琼脂糖均购于宝日医生物技术(北京)有限公司;4S GelRed 核酸染料、DL2000 DNA Marker、引物均购于生工生物(上海)股份有限公司;其他试剂均为国产分析纯。
1.3 样品
黄精Polygonatum sibiricumDelar.ex Redoute、多花黄精P.cyrtonemaHua、滇黄精P.kingianumColl.et Hemsl.、湖北黄精P.zanlanscianensePamp.共计34 份样品由安徽中医药大学杨青山副教授鉴定其基原。样品保存于安徽省食品药品检验研究院,具体信息见表1。

表1 黄精样品信息
2 方法
2.1 引物和探针的设计与合成
从美国国家生物技术信息中心(NCBI)数据库(https://www.ncbi.nlm.nih.gov/)中下载多花黄精、黄精、滇黄精、湖北黄精的trnC-petN序列,通过序列比对分析,以101 位的胞嘧啶(C)>腺嘌呤(A)突变作为单核苷酸多态性(SNP)位点,结合Beacon Designer 8 软件分析并获得湖北黄精特异性探针。探针经过高效液相色谱法(HPLC)纯化,5'端标记荧光素基团FAM,3'端标记非荧光素猝灭基团BHQ1,序列为5'-FAM-attttGatAacAcaTggc-BHQ1-3'(小写字母表示LNA 修饰碱基)。同时利用Primer 3.0 软件设计湖北黄精特异性引物对,通过NCBI 数据库进行BLAST 同源性比对验证后,由生工生物(上海)股份有限公司合成。引物序列为Forward Primer:5'-CAGAGGCAA AGGACTAAG-3';Reverse Primer:5'-TCCCTATTG ATACCGATTTG-3'。
2.2 DNA提取与模板制备
取根茎或叶片样品,用75%乙醇1 mL、灭菌超纯水清洗,吸干表面水分,新鲜样品置40 ℃烘箱中低温烘干水分,取约0.1 g,置球磨仪中研磨成细粉。称取20 mg,置1.5 mL 离心管中,用植物基因组DNA 提取试剂盒进行核酸提取,获得DNA 模板,利用超微量分光光度计测量模板DNA 浓度及纯度,-20 ℃保存备用。
2.3 实时荧光定量PCR反应条件优化
选取湖北黄精、多花黄精、黄精、滇黄精样品各2批,对实时荧光定量PCR条件进行优化,总反应体积为20 μL,包括PCR 反应混合液(2×)10 μL、上下游引物及探针(10 μmol·L-1)、模板DNA 1 μL。分别对体系中引物及探针的浓度及退火温度(Tm)进行反应条件优化,筛选出最佳组合条件。其中引物浓度为0.1~1.0 μmol·L-1、探针浓度为0.1~0.5 μmol·L-1,两者浓度配比筛选出最佳浓度组合;Tm值为52~62 ℃,进行梯度扩增,根据实时荧光定量PCR 扩增曲线临界循环数(Ct)值及扩增曲线形状筛选并确定最佳Tm。
2.4 专属性试验
用2.1项下实时荧光定量PCR引物及探针对表1中湖北黄精、黄精、多花黄精、滇黄精进行扩增反应,以无菌超纯水为空白对照,检验引物及探针的专属性。
2.5 适用性试验
用2.1 项下实时荧光定量PCR 探针及引物对不同产地和来源的10 批湖北黄精进行测试,检验反应体系的适用性。
2.6 重复性及精密度试验
对同一样品(编号:HBHJ-01)重复测定3 次,每次试验记录Ct值,分析组内Ct值变异系数,检测方法的重复性。同时平行测定同一批次湖北黄精(编号:HBHJ-01)样品5 份,标记1~5,记录Ct值,分析组内Ct值变异系数,进行方法精密度考察。
2.7 湖北黄精掺伪程度检测
分别取湖北黄精(编号:HBHJ-01)与多花黄精(DHHJ-01)细粉,按照表2 混合成不同掺伪比例样品,利用优化后的PCR 扩增条件进行扩增,记录不同浓度下扩增曲线Ct值大小,鉴于PCR 呈指数扩增,达到阈值时的扩增轮数为Ct值:标准品(S)与供试品(T)的Ct值之差用ΔCt表示,则样品中的目的DNA 所占比例可用2-ΔCt×100%表示,计算值与期望值比例的百分比作为回收率。本研究中S 为湖北黄精,T为不同掺伪比例样品。
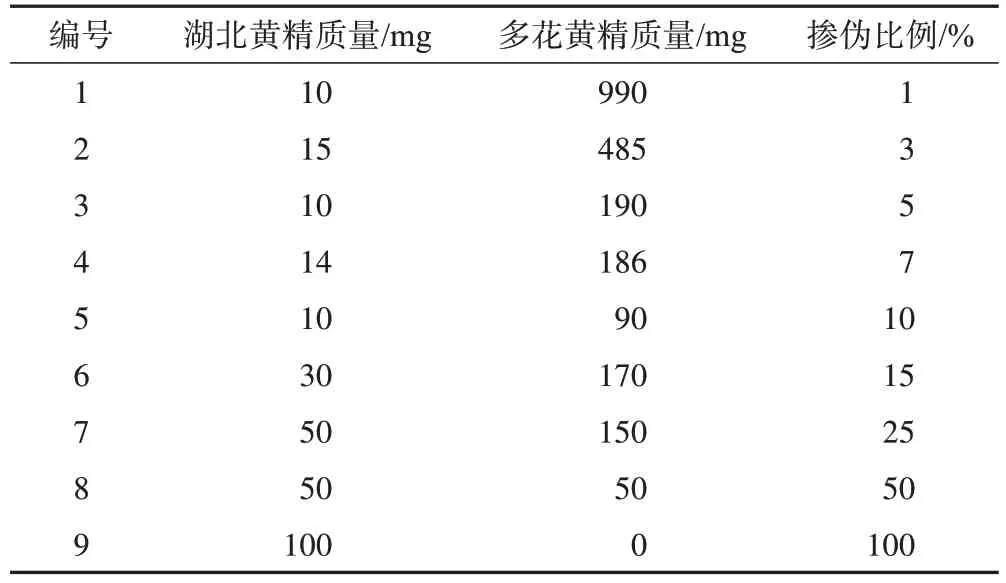
表2 湖北黄精和多花黄精掺伪比例
3 结果
3.1 引物、探针浓度的确定
以湖北黄精DNA 作为模板,选择以引物浓度为0.4 μmol·L-1,探针浓度分别为0.10、0.20、0.30、0.40、0.45、0.50 μmol·L-1进行实时荧光定量PCR,并记录扩增曲线Ct值,结果显示探针终浓度为0.3 μmol·L-1时Ct值最小,且可获得典型的S 形扩增曲线;选择探针浓度为0.3 μmol·L-1,引物浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 μmol·L-1进行实时荧光定量PCR,并记录扩增曲线Ct值,结果显示引物终浓度为0.4 μmol·L-1时Ct值最小。综上所述,选探针终浓度为0.3 μmol·L-1、引物终浓度为0.4 μmol·L-1为最佳组合浓度。
3.2 退火温度考察结果
梯度扩增结果表明,当退火温度高于62 ℃时,定量PCR 扩增曲线平坦,未出现典型的S 形扩增曲线;退火温度为58~60 ℃时,均可获得较好的扩增曲线,且58 ℃时曲线线形最好;温度低于58 ℃时,出现非特异性扩增。因此,最终确定退火温度为58 ℃。
3.3 实时荧光定量PCR优化最终条件
优化后的反应总体系为20 μL,其中包括Premix ExTaq(2×)10 μL、上下游引物(20 μmol·L-1)各0.4 μL、LNA-TaqMan探针(20 μmol·L-1)0.3 μL、模板DNA 2 μL、无菌超纯水补足。反应程序为94 ℃预变性3 min;94 ℃ 10 s,58 ℃ 20 s,72 ℃30 s,共进行40个循环。
3.4 专属性试验结果
对表1中湖北黄精、黄精、多花黄精、滇黄精进行扩增反应结果表明,仅湖北黄精的DNA 有典型的S 形扩增曲线,而黄精、多花黄精、滇黄精的DNA均未出现扩增现象,表明引物和探针有较好的专属性。不同种黄精部分样品的典型扩增曲线见图1。
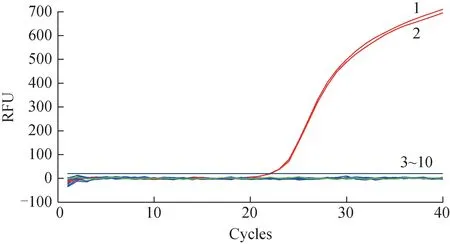
图1 不同种黄精部分样品的实时荧光定量PCR典型扩增曲线
3.5 适用性试验结果
取不同产地和来源的10 批湖北黄精按照上述体系测定。结果显示,所有湖北黄精样品均为阳性扩增,样品Ct值为20.380~22.454(表3),均值为21.502,SD为0.66,表明方法有较好的适用性。
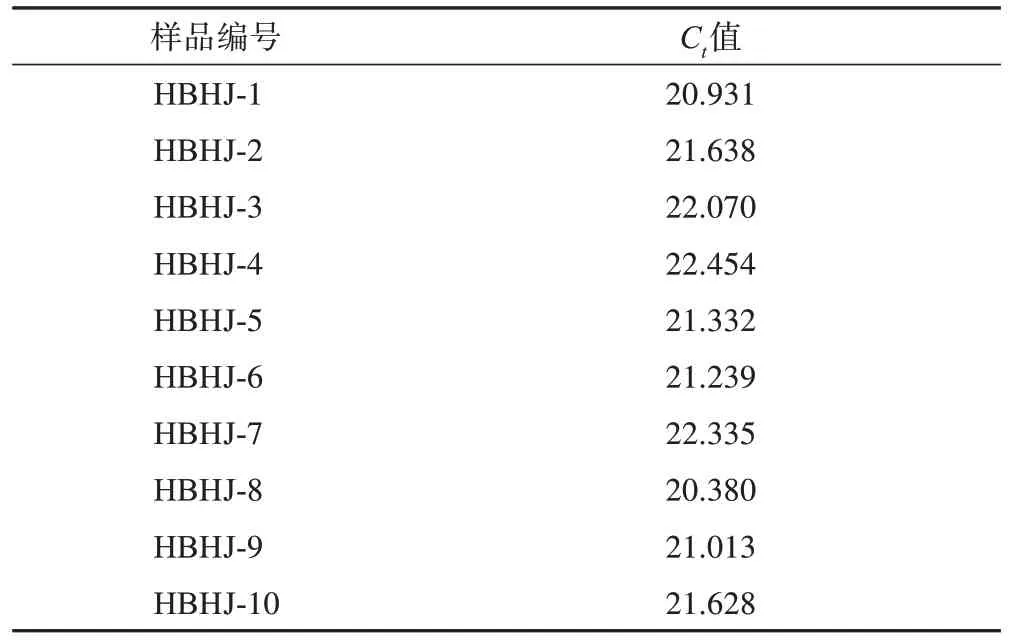
表3 不同种黄精部分样品的荧光定量PCR适用性实验Ct值(n=3)
3.6 重复性及精密度试验结果
按照上述体系重复测定同一样品3 次,结果显示,Ct值分别为20.380、21.013、21.628,均值为21.007,SD 为0.62,组内Ct值变异系数为0.30。表明该方法重复性较好。同时,同一批的5 份湖北黄精样品Ct值分别为20.931、21.638、22.070、22.454、21.332,平均Ct值为21.685,组内Ct值变异系数为0.28。表明该方法精密度较好。
3.7 湖北黄精掺伪程度检测
不同比例混合样品经过上述体系进行实时荧光定量PCR 扩增后,经ΔCt值计算得到的相应的混合样品掺伪比例见表4。计算所得掺伪比例与实际湖北黄精含有量相近,回收率为80.72%~126.13%。结果显示,该方法在湖北黄精掺伪1%时,仍可稳定检出。

表4 不同比例混合黄精样品的掺伪程度检测结果
4 讨论
黄精作为药食同源的中药资源,市场需求量大,发展前景广阔。目前药用黄精的鉴别方法主要是化学成分研究,而黄精块茎作为其药食同源的主要部位,均为结节状或连珠状膨大,其显微特征也极为相似,成分相似度极高,传统鉴定方法容易受人为或环境因素的影响。因此,建立一种能够快速、准确的药用黄精掺伪定量检测方法尤为重要。
随着中药检测技术的发展与检测要求的提高,分子鉴定方法在中药鉴定领域的运用越来越多。目前,运用实时荧光定量PCR 及数字化PCR(dPCR)技术可以实现对检测成分的相对定量甚至绝对定量[26-27]。其中实时荧光定量PCR 具有高效率、高灵敏度、重复度好的优点,目前是公认的用于基因表达水平分析的重要方法[28-29],已经开始逐步运用于药品检验领域[30-31]。但在药用黄精真伪性鉴定上并无相关报道。
本研究利用基于LNA-TaqMan 探针的实时荧光定量PCR 法实现对药用黄精掺伪湖北黄精的相对定量检测,利用湖北黄精与药用黄精叶绿体DNA 中trnC-petN基因间隔区序列差异设计特异性引物及LNA-TaqMan 探针,建立了实时荧光定量PCR 检测湖北黄精掺伪比例的方法。该方法相较于传统的荧光定量方法,引入了新型的核酸类似物LNA。利用设计的引物及探针测定不同混合比例湖北黄精掺伪样品,得到Ct值,通过样品与湖北黄精阳性扩增样品间ΔCt值计算,即可检测湖北黄精掺伪程度,在湖北黄精掺伪1%时仍可稳定检出,无需进行酶切或者电泳,极大减少了检验工作量,同时提高检测的准确度,缩短了检测时间,解决了化学检测手段难以鉴定掺伪比例的难题。本研究的方法能将湖北黄精与药用黄精有效区分,可为湖北黄精掺伪药用黄精定量检测提供参考。
[利益冲突]本文不存在任何利益冲突。
