水稻雄性不育突变体tpa1的表型鉴定与精细定位
2024-04-28万应春班义结蒋钰东王亚欣刘晶晶刘晓晴程育林
万应春 班义结 蒋钰东 王亚欣 刘晶晶 刘晓晴 程育林 王 楠 冯 萍
水稻雄性不育突变体的表型鉴定与精细定位
万应春1,**班义结1,**蒋钰东2,**王亚欣1刘晶晶1刘晓晴1程育林1王 楠1,*冯 萍1,*
1西南大学水稻研究所 / 转基因植物与安全控制重庆市市级重点实验室 / 南方山地农业教育部工程研究中心, 重庆 400716;2四川省农业科学院水稻高粱研究所(四川省农业科学院德阳分院), 国家水稻改良中心四川泸州分中心 / 农业农村部西南水稻生物学与遗传育种重点实验室, 四川德阳 618000
雄性不育材料是杂交水稻育种的关键。本研究通过甲基磺酸乙酯(ethyl methane sulfonate, EMS)诱变优良籼稻保持系西农1B, 筛选得到一个雄性不育突变体。在营养生长阶段与野生型无差异, 生殖生长阶段表现雄配子不育, 雌配子发育正常。表型观察发现,花粉完全破碎消失, 花药外壁角质层异常, 花药内壁乌式体排列异常, 胼胝质合成异常, 绒毡层凋亡异常, 且花粉外壁缺失柱状层。遗传分析表明该突变性状受1对隐性核基因控制, 利用突变体与缙恢10号构建遗传群体, 最终将基因定位于4号染色体引物标记N9和N11之间, 物理距离为74 kb, 该区间共15个预测基因, 通过重测序仅发现在的外显子上发生了单碱基替换, 导致了翻译的提前终止, 随后对野生型和突变体该位点进行测序证实了这一突变, 因此将该基因确定为的候选基因,是一个未被报道过的新的雄性不育基因。本研究将为基因的功能研究奠定基础。
水稻(L.); 雄性隐性核不育;; 精细定位
水稻是世界上主要粮食作物, 也是我国最重要的粮食作物之一, 同时水稻也是单子叶植物生物学研究的模式植物, 因此, 对于水稻的研究具有极为重要的应用价值和科学价值。杂种优势是指杂交后代表现出优于亲本性状的现象, 在植物中广泛存在, 将杂种优势用于育种中能显著提高作物的抗逆性和产量[1], 雄性不育材料是杂种优势育种的关键。雄性不育是指不能产生可育雄配子, 而雌配子正常, 将雄性不育突变体应用于杂种优势育种中, 可极大的提高育种效率, 目前在多种作物的育种中都有应用。
植物的育性涉及很多基因表达调控, 拥有极为复杂的调控网络[2], 目前已克隆的不育基因中雄性不育基因占大多数[3]。已克隆的雄性不育基因涉及到的生物学过程包括花粉减数分裂、绒毡层降解、花粉壁形成、花药开裂、花粉管伸长等, 其中又以核基因为主[4-5]。绒毡层是水稻花药4层中的最内层, 它为花粉粒的发育提供保护和必需的营养, 并为花粉外壁的形成提供前体[6]。绒毡层在花粉母细胞形成早期初步开始形成, 在花粉母细胞减数分裂初期开始启动细胞程序性死亡(programmed cell death, PCD), 绒毡层细胞逐步降解, 细胞质浓缩, 在成熟花粉时期完全消失, 绒毡层的PCD过程是小孢子发育所必须的, 它为小孢子提供胼胝质酶、孢粉素前体、同化物等[7]。在水稻中, 绒毡层的发育与降解十分重要, 绒毡层发育相关基因的异常会导致水稻小孢子的发育异常, 水稻中影响绒毡层形成的基因有OsMADS3、OsMADS8、MSP1、UDT1等[8-11], 这些基因的隐性突变会导致绒毡层的不完全发育, 最终导致雄性不育。而影响绒毡层降解的基因有TDR[12]、PTC1[13]、EAT1[14]、GAMYB[15]、OsUGE1[16]等, 这些基因的隐性突变会让绒毡层PCD开始时期提前或延后, 不能在正确的时期为小孢子的发育提供所需物质, 最终导致小孢子发育异常。EAT1是一种在陆地植物中保守的基本螺旋-环-螺旋转录因子, 正调节水稻花药绒毡层细胞的程序性细胞死亡,突变体的绒毡层PCD过程出现延迟,与互作, 调控绒毡层功能和花粉发育[14]。花粉粒被花粉壁包围, 这可以保护雄性配子体免受各种环境压力和微生物的攻击, 也有利于授粉[17]。花粉壁是植物中最复杂的细胞壁, 由花粉外壁和花粉内壁两部分组成, 花粉外壁和花粉内壁都有各种不同的组织模式[18]。花粉壁的形成是一个复杂的过程, 涉及大量基因的生物学事件发生, 已报道的OsC6[19]、DPW[20]、DPW2[21]、DPW3[22]均参与了花粉壁的形成, 其中DPW3编码一种保守的新的膜相关α整合素蛋白,参与初生外壁形成、花粉外壁形成、乌氏体发育和花药角质层形成,植物的花药表现出花药表皮轮廓不均衡、乌氏体异常、胼胝质沉积和花粉壁形成缺陷, 导致花粉败育和完全雄性不育[22]。由此可见, 植物育性发育过程的每个环节均有由多个基因组成的复杂调控网络, 而对新的雄性不育基因的发掘将有助于我们解析这些复杂的调控网络。
本研究通过EMS诱变籼稻保持系西农1B, 获得了一个可以稳定遗传的雄性不育突变体(tapetum and pollen abnormal 1)对突变体进行表型鉴定, 发现该突变体的绒毡层和花粉壁发育异常, 进一步对其遗传分析和分子定位, 最终将定位在4号染色体上引物标记为N9和N11之间。对定位区间的基因进行分析, 发现该区间范围内尚未有已报道的雄性不育基因, 因此, 本研究结果将为水稻雄性不育和育种提供理论依据和种质资源。
1 材料与方法
1.1 试验材料
水稻(L.)背景材料为籼稻保持系西农1B(L.), 通过EMS诱变得到突变体, 经过多代自交, 突变性状稳定遗传。用籼稻恢复系缙恢10号与突变体杂交, 种植F1并收获F2种子。本研究所用材料均由西南大学水稻研究所提供, 种植于西南大学歇马试验基地和海南南繁基地。
1.2 表型鉴定和花粉育性观察
对野生型和突变体的全生育期的植株表型进行观察, 并对成熟期的植株小穗、花药进行照相, 对成熟花粉使用1% I2-KI溶液(0.6% KI, 0.3% I2, w/w)进行染色分析, 使用Eclipse E600561显微镜对花粉育性进行观察并照相。
1.3 扫描电镜概观察
在前人的研究中将水稻花药发育分为14个时期[23]。随机取野生型与突变体花粉已完成填充的第13期的小穗, 轻轻用镊子剥开颖壳暴露其花药,借助显微镜用镊子剥开花药, 暴露其花药内壁及花粉粒, 同时保留完整花药。利用SU3500扫描电子显微镜(日立, 日本)在–20℃和5.0 kV的加速电压下观察整体花药、花药外壁、花药内壁和花粉粒形态并照相。
1.4 半薄切片观察
为了观察野生型和突变体的花药发育情况,我们选取第8~12期的花药并包埋。将花药置于由0.1 mol L–1PBS (pH 7.4)配置的2.5%戊二醛中4℃中固定24 h, 然后用1%四氧化锇在0.1 mol L–1PBS (pH 7.4)中渗透2 h。随后, 样品用梯度乙醇(50%、70%、85%、95%、100%、100%和100%)脱水, 并包埋在SPI-PON 812树脂中。使用EM-UC6切片机制备半薄切片(2 µm), 用0.5%甲苯胺蓝染色, 并用Eclipse E600显微镜照相。
1.5 透射电镜观察
选取野生型和突变体第10期的花药用半薄切片所述包埋方法包埋进树脂中。使用EM-UC6切片机获得超薄切片, 用醋酸铀和柠檬酸铅溶液染色, 并使用H-7500TEM进行观察和照相。
1.6 石蜡切片与胼胝质染色
取第7~10期的野生型和突变体花药置于FAA固定液中固定, 样品用梯度乙醇(50%、70%、85%、95%、100%、100%和100%)脱水, 分别处理40 min; 将脱水完毕的花药依次置于3∶1、1∶1、1∶3的无水乙醇和二甲苯的混合液中透明, 分别处理40 min; 逐渐加入石蜡进行替换, 直至完全替换为石蜡, 并使石蜡完全浸透材料。将包埋完成的材料用石蜡切片机切片以获得石蜡切片。用纯二甲苯脱去石蜡切片的蜡, 并用梯度乙醇(100%、95%、85%、70%和50%)和磷酸缓冲液进行复水, 用0.1%苯胺蓝溶液对复水的材料进行染色, 用荧光显微镜观察并照相。
1.7 遗传分析与精细定位
利用突变体与缙恢10号杂交获得F1代, F1代自交获得F2代分离群体, 统计F2代不育性状分离情况并分析, 选取F2代中不育单株进行初步定位与精细定位。利用CTAB法提取定位群体叶片DNA[24]。利用公开的水稻数据库Gramene (http://www.gramene.org/)和水稻基因组研究计划(http://rgp.dna.afrc.go. jp/E/publicdata/caps/index.html)开发多态性SSR (Simple Sequence Repeats)标记(表1), 对定位群体进行分子鉴定。PCR总体系为12.6 μL, 含1.25 μL 10×PCR buffer、1 μL 50 ng μL–1DNA模板、0.75 μL 25 mmol L–1MgCl2、0.5 μL 2.5 mmol L–1dNTPs、8.0 μL ddH2O、1.0 μL 10 μmol L–1引物、0.1 μL 5 U μL–1DNA聚合酶。PCR程序为94℃预变性5 min; 94℃变性30 s, 55℃退火30 s, 72℃复性30 s, 35个循环; 72℃延伸10 min。PCR产物经10%非变性聚丙烯酰胺凝胶电泳, 快速银染后观察[25]。利用亲本和突变体群体构建基因池进行全基因组重测序, 使用MutMap进行分析, 比对亲本与突变体在定位区间内的序列差异, 随后对突变位点设计检测引物对野生型与突变体进行测序比对(表1)。
1.8 相关基因表达分析
用植物总RNA提取试剂盒(普洛麦格(北京)生物技术有限公司)提取野生型抽穗期各部位、野生型和突变体花药第6~9期的RNA, 再用UeIris RT mix with DNase (All-in-One) (苏州宇恒生物科技有限公司)反转录得到对应的cDNA。根据中国国家水稻中心数据库数据(https://ricedata.cn/)设计定量引物(表1), 利用ChamQ Universal SYBR qPCR Master Mix (南京诺唯赞生物科技股份有限公司)进行实时荧光定量PCR, 检测候选基因在野生型各部位的表达水平, 检测、、、、、、和基因在野生型和突变体中表达量的变化。
全世界槭树科植物超过200 种,我国已知分布有151种,占全世界槭树种类的75%。河南自然分布的槭树共有2 属、23种、2亚种、9变种, 约占全国槭树科植物种类的15%,但扩散成分丰富,过渡特征明显[2]。其中既有华北五角枫、茶条槭等景观价值很高的种类,也有河南杈叶槭、小杈叶槭等河南特有分布种类。

表1 本研究使用的部分引物

(续表1)
2 结果与分析
2.1 突变体tpa1的表型分析
在田间对野生型和突变体进行整个生育期的表型观察, 发现突变体与野生型在营养生长阶段没有明显差异, 而在生殖生长阶段, 与野生型相比, 突变体表现出完全不能结实的表型(图1-A, B)。为了观察花药整体形态, 将第13期花药置于体视镜下观察, 野生型花药颜色呈黄色, 每颗的4个花药室饱满, 而突变体花药较野生型更为细小, 干瘪, 颜色呈暗黄色(图1-C, D, F, G)。为对花粉活性进行观察, 我们利用1% I2-KI溶液对花粉进行染色, 发现野生型花粉圆润饱满, 被染色为黑褐色, 而突变体完全无花粉(图1-E, H), 表明突变体的花粉发育异常。进一步通过扫描电镜对后期花药进行观察, 与野生型相比, 突变体花药更短, 花药室更干瘪(图1-I, J)。野生型花药外壁可观察到网格状的蜡质层结构, 突变体的花药外壁较野生型更为光滑, 网格状角质层不明显(图1-K, N)。对花药内壁进行观察, 野生型的花药内壁有致密的排列整齐的乌氏体, 而突变体的花药内壁乌氏体数量减少, 排布混乱(图1-L, O)。剥开花药, 野生型可见大量圆形饱满的花粉粒, 而突变体只有少量干瘪破碎花粉(图1-M, P)。以上结果表明突变体花药外壁角质层和内壁乌氏体都出现了异常, 并且最终不能形成花粉。
2.2 突变体tpa1花药切片分析
为了进一步探究突变体花药发育异常的原因, 对第8~12期的野生型和突变体花药进行了半薄切片观察。在第8b期, 野生型小孢子正在进行减数分裂的最后步骤, 形成四分体小孢子, 绒毡层开始变得浓缩, 此时突变体与野生型并无明显差异(图2-A, F)。在第9期时, 野生型绒毡层继续降解, 进一步浓缩, 细胞变得不规则, 而突变体的绒毡层整体形态平整, 且比野生型更厚(图2-B, G); 在第10期时, 野生型的绒毡层进一步发生降解, 明显浓缩变窄, 小孢子开始变大空泡化, 而突变体的绒毡层开始降解, 出现不规则的形态, 依然比野生型更厚, 小孢子也开始空泡化, 但小孢子壁较野生型更为明显(图2-C, H)。在第11期时, 野生型和突变体的绒毡层降解程度增加, 野生型小孢子呈镰刀形, 而突变体小孢子部分出现镰刀形, 且小孢子壁更明显(图2-D, I)。在第12期时, 野生型小孢子开始正常填充淀粉, 而突变体不能正常进行填充, 小孢子逐渐破碎, 发生败育(图2-E, J)。以上结果表明突变体绒毡层降解异常且小孢子壁发育异常。为进一步观察在绒毡层与小孢子壁的变化, 对第10期时野生型和的花药进行超薄切片并在透射电镜下进一步观察。在第10期, 野生型的绒毡层细胞核结构基本消失, 细胞器减少, 小孢子外壁具备明显的外壁外层、柱状层、外壁内层3层结构(图2-K~M)。而的绒毡层中也出现了降解的现象, 细胞质浓缩, 细胞器消失, 但还能观察到拥有清晰核膜的细胞核和少量线粒体, 进一步观察此时突变体的小孢子外壁可以发现, 由于缺少了柱状层外壁外层与外壁内层贴合在一起(图2-N~ P)。该结果表明突变体的绒毡层降解延迟, 且小孢子外壁柱状层缺失, 最终导致了花粉的败育。

图1 野生型西农1B与突变体tpa1育性观察与扫描电镜观察
A, B: 野生型和突变体植株; C, D: 野生型和突变体小穗; E: 野生型花粉碘染; F: 野生型去壳后小花; G: 突变体去壳后小花; H: 突变体花粉碘染; I~P: 扫描电镜观察; I, J: 野生型和突变体花药; K: 野生型花药外壁; L: 野生型花药内壁; M: 野生型花药剥开露出花粉; N: 突变体花药外壁; O: 突变体花药内壁; P: 突变体花药剥开露出花粉。标尺: 10 cm (A, B); 1 mm (C, F); 0.5 mm (D, G); 0.1 mm (E, H); 100 μm (I, J); 10 μm (K~P)。
A, B:plants of wild type and mutant; C, D: spikelet of wild type and mutant;E: pollen iodine staining of wild type; F: spikelet of wild type; G: spikelet of mutant; H: pollen iodine staining of mutant; I–P: SEM observation; I, J: anthers of wild type and mutant; K: outer wall of wild type anther; L: inner wall of wild type anther; M: wild type anthers peeled out pollen; N: anther outer wall of mutant; O: the inner wall of anther of mutant; P: the anther of mutantpeeled and exposed pollen. Bar: 10 cm (A, B), 1 mm (C, F), 0.5 mm (D, G), 0.1 mm (E, H), 100 μm (I, J), 10 μm (K–P).

(图2)
A~E: 野生型st8b~st12期花药半薄切片横切; F~J: 突变体st8a~st12期花药半薄切片横切; K~M: 野生型st10期花药超薄切片透射电镜观察; N~P: 突变体st10期花药超薄切片透射电镜观察。Ba: 柱状层; BP: 双核花粉; dMsp: 异常小孢子母细胞; Dy: 二分体细胞; E: 表皮; En: 内皮; ML: 中间层; MP: 成熟花粉; Msp: 小孢子母细胞; N: 细胞核; Ne: 外壁内层; Nm: 核膜; T: 绒毡层; Tds: 四分体; Ub: 乌式体。标尺: 200 μm (A~J); 2 μm (K, N); 1 μm (L, O); 0.5 μm (M, P)。
A–E: section-thin sections of wild type anthers from st8b–st12; F–J: section-thin sections ofanthers from st8b–st12; K–M: TEM of wild type st10 anther ultra-thin sections; N–P: TEM ofst10 anther ultra-thin sections. Ba: bacula; BP: binuclear pollen; dMsp: abnormal microspore mother cells; Dy: dyad cells; E: epidermis; En: endothelium; ML: middle layer; MP: mature pollen; Msp: microspore mother cells; N: nucleus; Ne: nexine; Nm: nuclear membrane; T: tapetum; Tds: tetrad; Ub: Ubisch body. Bar: 200 μm (A–J); 2 μm (K, N); 1 μm (L, O); 0.5 μm (M, P).
2.3 tpa1胼胝质染色
胼胝质是小孢子在有丝分裂前包裹在小孢子外的一类物质, 具有保护小孢子的作用, 有研究表明, 胼胝质的异常也会导致小孢子的败育[26]。用0.1%苯胺蓝对野生型和突变体胼胝质进行染色观察。在第7期时, 野生型胼胝质信号集中在小孢子中间, 突变体的胼胝质信号较野生型更弱(图3-A, E); 第8a期, 野生型胼胝质信号包裹着二分体小孢子, 突变体只能观察到少量的微弱胼胝质信号(图3-B, F); 第8b期, 二分体进一步分裂形成四分体小孢子,此时野生型中胼胝质信号存在于2个四分体小孢子的中间, 而突变体胼胝质信号较野生型更弱(图3-C, G); 在第9期, 野生型胼胝质降解完全, 四分体小孢子完成释放, 野生型与突变体都不能观察到胼胝质信号(图3-D, H)。以上结果表明胼胝质代谢出现异常。
2.4 TPA1基因的精细定位
用缙恢10号与突变体杂交得到F1代, F1代全部正常结实, 表明不育性状受隐性基因控制。F1代自交得到F2代群体, F2代群体中出现明显的分离。分别表现双亲性状, 其中有1202株可育单株, 422株不育突变体, 遗传分析表明可育表型与不育表型符合3∶1分离比, 表明的突变性状受隐性单基因控制(表2)。选取F2代中10株正常株和30株突变株的DNA作为正常基因池和突变基因池, 利用本实验室现有的平均分布于12条染色体的SSR引物对正常株和不育株的基因池进行连锁及多态性分析。结果表明, 在4号染色体的分子标记R7和R8与突变位点连锁, 通过突变单株验证及分析, 将突变位点定位在R7和R8之间(图4)。进一步在R7和R8之间开发多态性分子标记, 利用F2群体中422株突变体进行进一步精细定位, 最终突变位点定位在引物N9和N11之间, 物理距离为74 kb的范围内, 根据谷类比较图谱资源数据库(http:// www.gramene.org/microsat)以及国家水稻数据中心(http://www.ricedata.cn/)的数据查阅得知, 该区间内有15个预测基因(图4-A)。对这15个预测基因进行分析发现无已报道的育性相关基因, 表明可能是一个从未被发现报道过参与育性调控的基因(表3)。为了进一步确定突变位点所在基因, 利用基于基因组重测序技术的Mut-map方法, 对区间内的基因进行突变位点筛选, 仅在的一个外显子处发现了一个碱基替换, 由“G”碱基突变为“T”碱基, 对应氨基酸由谷氨酸变为了终止密码子, 导致了翻译的提前终止(图4-A, B)。为验证该结果, 设计了该突变位点的检测引物, 从亲本中分别选取了10株野生型和10株突变体进行测序, 发现野生型均为AA或Aa基因型, 突变体均为aa基因型(图4-C)。因此将定为的候选基因。
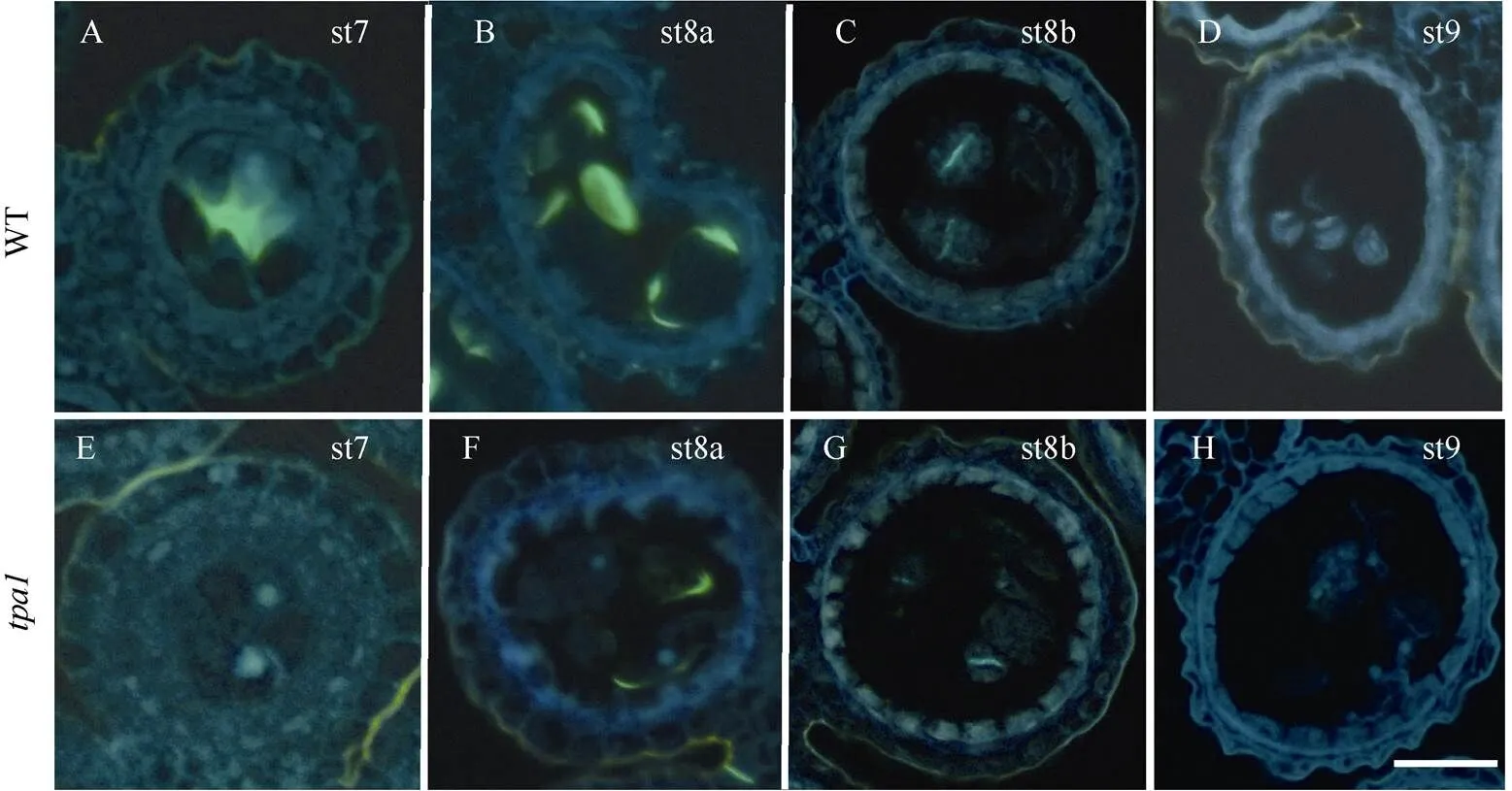
图3 野生型与突变体tpa1胼胝质染色
A~D: 野生型st7~st9期胼胝质染色; E~H:突变体st7~st9期胼胝质染色。标尺: 200 μm (A~H)。
A–D: callose staining of wild type anthers from stages st7 to st9; E–H: callose staining of mutantanthers from stages st7 to st9. Bar: 200 μm (A–H).

表2 突变体tpa1的遗传分析

表3 精细定位区间预测基因
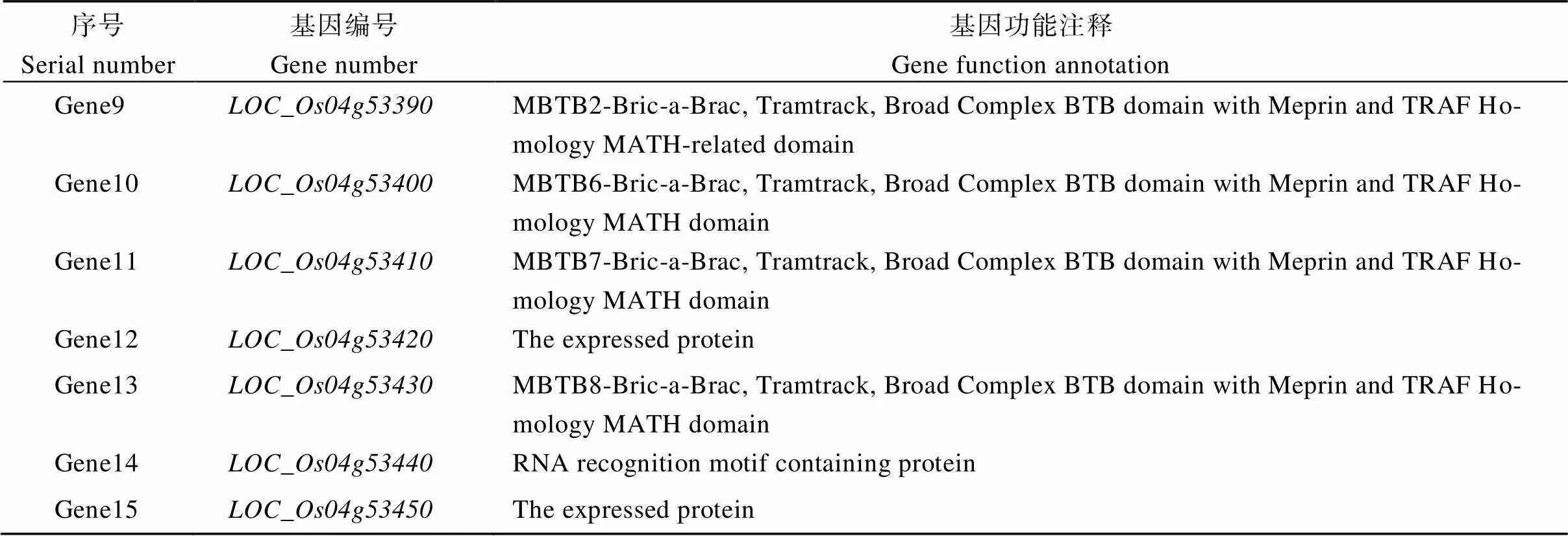
(续表3)

图4 TPA1基因的精细定位
A:初步定位与精细定位; B: 野生型与突变体重测序结果分析; C: 野生型与突变体突变位点测序结果。
A: preliminary positioning and fine positioning of; B: the resequencing results of wild type and mutant; C: wild type and mutantmutation site sequencing results.
2.5 相关基因表达分析
为探究在水稻各部位中的表达水平, 通过RT-qPCR分析了在水稻抽穗期各部位以及第6~11期的小穗中的表达水平, 结果表明,在叶、鞘和花药中有较高水平表达, 而在花药发育第6~12期中,的表达水平几乎一致, 并没有在某个时期特异高表达(图5-A)。在表型分析中, 我们发现了突变体在绒毡层的发育上存在缺陷, 为了探究与哪些基因可能在同一途径发挥功能, 对突变体中绒毡层发育相关基因做了RT-qPCR分析。结果表明,、和在野生型与突变体中表达量无明显差异,、、在突变体第9期中表达量较野生型有明显下降,在突变体中第7、8期表达量都明显低于野生型。推测可能是与、、共同参与了绒毡层发育的调控, 且在调控过程中可能与有更紧密的联系, 还有待进一步的探索(图5-B)。
A:在野生型水稻抽穗期各部位以及第6~12期的小穗中的表达水平; B: 绒毡层发育相关基因在野生型与突变体第6~9期的表达水平。
A: the relative expression level ofgenes in different parts of heading stage and spikelets of st6–st12 in wild-type rice; B: the relative expression level of tapetum development-related genes in wild type and mutantat st6–st9 stage.
3 讨论
3.1 TPA1影响水稻育性
突变体在营养生长阶段与野生型无明显差异, 而生殖生长阶段表现出完全不能结实, 进一步观察发现,的花药外壁存在缺陷, 花药内壁乌氏体不明显且排布不规则, 花药绒毡层凋亡延迟, 胼胝质合成异常, 且花粉外壁缺失柱状层, 这些综合表现最终导致了的花粉败育。绒毡层是植物花药最内部的一层细胞, 它不光为小孢子的发育提供了保护, 也会在适当的时机提供营养物质和酶, 以保障小孢子的正常发育[27]。在花药发育早期, 胼胝质依赖绒毡层进行合成, 而减数分裂时期, 绒毡层又通过分泌胼胝质酶调控胼胝质的正常降解, 以在合适的时候释放四分体小孢子[28]。在突变体中, 在第7期胼胝质发生了异常, 胼胝质的含量明显减少, 之后在第8a期和8b期时突变体中胼胝质含量都低于野生型, 表明突变体胼胝质的合成存在异常,的绒毡层可能在早期就出现了物质合成方面的异常。乌氏体是绒毡层上的一种细胞器, 参与了花粉外壁的合成, 主要包括孢粉素, 致密电子的转运[29], 突变体中乌式体的减少且花粉外壁缺失柱状层, 推测绒毡层的异常导致孢粉素等物质的合成与运输出现了异常, 综合因素导致了突变体花粉外壁柱状层的缺失, 进而导致了花粉无法正常填充, 最终发生败育。
3.2 TPA1是一个新基因
通过精细定位, 我们最终将定位于4号染色体上引物标记N9和N11之间, 物理距离约为74 kb, 在该区间共有预测基因15个, 随后利用重测序技术在一个未被报道的基因的外显子上发现了一处碱基替换, 该突变导致了翻译的提前终止, 并且通过对野生型和突变体该位点进行测序, 证实了这一突变结果, 因此我们将定为的候选基因。通过对的注释信息进行分析发现, 该基因全长12,594 bp, CDS序列长度为7848 bp, 共有14个外显子, 突变体的突变位点位于第14外显子上。对蛋白结构域进行分析, 共发现3个结构域, 包含1个位于N端的Npa1结构域和2个连续的位于C端的NopRA1结构域, 这些结构域都被注释在60S核糖体大亚基发生过程中发挥重要功能。为了探究TPA1在水稻中可能的功能, 对TPA1同家族基因在其他物种中研究结果进行了分析, 在酿酒酵母中, IVA´NV等发现Npa1p在60S核糖体早期成熟过程中发挥重要作用[30]; Shan等[31]发现URB1在核仁中3´ETS rRNA的去除过程发挥功能, 缺失URB1会影响斑马鱼和小鼠的胚胎发育; He等[33]还发现URB1还通过影响核糖体的组装进而影响了斑马鱼消化器官的发育[32]; 玉米中的突变体60S核糖体与40S核糖体积累出现异常, 导致籽粒长度减少。此外, 在已有的研究中, 核糖体合成相关蛋白的异常也可能会导致根、叶、育性以及胚胎发育的异常[34-37]。根据RT-qPCR结果,在叶、鞘和花药中有较高水平表达, 而突变体仅出现了花粉发育的异常, 推测在水稻花药中该基因的功能是保守的, 而在其余部位, 可能存在相同功能的基因。
3.3 TPA1影响花药绒毡层发育
通过RT-qPCR结果我们发现, 在突变体中,的表达水平较野生型有大幅度下降, 根据Uzair等的研究, 突变体表现为绒毡层凋亡延迟,且花粉外壁外层不连续, 柱状层缺失[38], 突变体与具有相似的绒毡层与花粉外壁表型, 但突变体绒毡层与花粉壁异常程度要弱于突变体, 因此推测与可能位于同一途径参与调控绒毡层与花粉外壁的发育。同时我们也发现在突变体中第9期有明显下降的基因还有和, 这2个基因均属于BHLH转录因子家族, 都是参与绒毡层降解的重要转录因子[12,14], 且在之前的报道中认为,与和在同一途径共同参与影响绒毡层, 但并不直接受这2个转录因子调控, 因此可能作为连接或与中间的途径参与绒毡层的发育。
4 结论
本研究鉴定了一个水稻雄性不育突变体, 相较于野生型, 其花药外壁角质层减少, 乌氏体发育异常, 绒毡层凋亡延迟, 胼胝质减少, 花粉外壁柱状层缺失, 表现出完全的雄性不育, 遗传分析表明突变表型受1对隐性核基因控制, 分子定位将确定在4号染色体上引物标记N9和N11之间, 物理距离为74 kb, 该区间内共包含15个预测基因,通过测序将一个从未被报道的基因确定为的候选基因, 表明是一个新的水稻育性发育基因,可能与处于同一途径, 参与绒毡层与花粉壁的发育。
[1] Hochholdinger F, Baldauf J A. Heterosis in plants., 2018, 28: R1089–R1092.
[2] Bhatt A M, Canales C, Dickinson H G. Plant meiosis: the means to 1N., 2001, 6(3): 114–121.
[3] 胡骏, 黄文超, 朱仁山, 李绍清, 朱英国. 水稻雄性不育与杂种优势的利用. 武汉大学学报(理学版), 2013, 59(1): 1–9. Hu J, Huang W C, Zhu R S, Li S Q, Zhu Y G. Male sterility and utilization of heterosis in rice.(Sci Edn), 2013, 59(1): 1–9 (in Chinese with English abstract).
[4] Abbas A, Yu P, Sun L, Yang Z, Chen D, Cheng S, Cao L. Exploiting genic male sterility in rice: from molecular dissection to breeding applications., 2021, 12: 629314.
[5] Zhu Q H, Ramm K, Shivakkumar R, Dennis E S, Upadhyaya N M. Thegene encoding a single MYB domain protein is involved in anther development in rice., 2004, 135: 1514–1525.
[6] Tariq N, Yaseen M, Xu D, Rehman H M, Bibi M, Uzair M. Rice anther tapetum: a vital reproductive cell layer for sporopollenin biosynthesis and pollen exine patterning., 2022, 25: 233–245.
[7] 张秋云, 沈亚琦, 蒋文翔, 刘家林, 王联红, 贺浩华, 胡丽芳. 水稻绒毡层发育相关转录因子研究进展. 湖北农业科学, 2021, 60(19): 5–10. Zhang Q Y, Shen Y Q, Jiang W X, Liu J L, Wang L H, He H H, Hu L F. Research progress on transcription factors related to rice tapetum development., 2021, 60(19): 5–10 (in Chinese with English abstract).
[8] Hu L, Liang W, Yin C, Cui X, Zong J, Wang X, Hu J, Zhang D. Rice MADS3 regulates ROS homeostasis during late anther development., 2011, 23: 515–533.
[9] Cui R, Han J, Zhao S, Su K, Wu F, Du X, Xu Q, Chong K, Theissen G, Meng Z. Functional conservation and diversification of class E floral homeotic genes in rice ()., 2010, 61: 767–781.
[10] Jiang D, Li J, Wu, P, Liu Z L, Zhuang C X. Isolation and characterization of a microsporocyte-specific gene,, in rice., 2009, 27: 469–475.
[11] Jung K H, Han M J, Lee Y S, Kim Y W, Hwang I, Kim M J, Kim Y K, Nahm B H, An G. Rice undeveloped tapetum1 is a major regulator of early tapetum development., 2005, 17: 2705–2722.
[12] Li N, Zhang D S, Liu H S, Yin C S, Li X X, Liang W Q, Yuan Z, Xu B, Chu H W, Wang J, Wen T Q, Huang H, Luo D, Ma H, Zhang D B. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development., 2006, 18: 2999–3014.
[13] Li H, Yuan Z, Vizcay-Barrena G, Yang C, Liang W, Zong J, Wilson Z A, Zhang D. PERSISTENT TAPETAL CELL1 encodes a PHD-finger protein that is required for tapetal cell death and pollen development in rice., 2011, 156: 615–630.
[14] Niu N, Liang W, Yang X, Jin W, Wilson Z A, Hu J, Zhang D. EAT1 promotes tapetal cell death by regulating aspartic proteases during male reproductive development in rice., 2013, 4: 1445.
[15] Liu Z, Bao W, Liang W, Yin J, Zhang D. Identification of gamyb-4 and analysis of the regulatory role of GAMYB in rice anther development., 2010, 52: 670–678.
[16] Wang N, Deng Y, Zhang L S, Wan Y C, Lei T, Yang Y M, Wu C, Du H, Feng P, Yin W Z, He G H. UDP-glucose epimerase 1, moonlighting as a transcriptional activator, is essential for tapetum degradation and male fertility in rice, 2023, 16: 829–848.
[17] Marchant D B, Walbot V. Anther development: the long road to making pollen., 2022, 34: 4677–4695.
[18] Ma X, Wu Y, Zhang G. Formation pattern and regulatory mechanisms of pollen wall in., 2021, 260: 153388.
[19] Li N, Zhang D S, Liu H S, Yin C S, Li X X, Liang W Q, Yuan Z, Xu B, Chu H W, Wang J, Wen T Q, Huang H, Luo D, Ma H, Zhang D B. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development., 2006, 18: 2999–3014.
[20] Shi J, Tan H, Yu X H, Liu Y, Liang W, Ranathunge K, Franke R B, Schreiber L, Wang Y, Kai G, Shanklin J, Ma H, Zhang D. Defective pollen wall is required for anther and microspore development in rice and encodes a fatty acyl carrier protein reductase., 2011, 23: 2225–2246.
[21] Xu D, Shi J, Rautengarten C, Yang L, Qian X, Uzair M, Zhu L, Luo Q, An G, Waßmann F, Schreiber L, Heazlewood J L, Scheller H V, Hu J, Zhang D, Liang W. Defective pollen wall 2 (DPW2) encodes an acyl transferase required for rice pollen development., 2017, 173: 240–255.
[22] Mondol P C, Xu D, Duan L, Shi J, Wang C, Chen X, Chen M, Hu J, Liang W, Zhang D. Defective Pollen Wall 3 (DPW3), a novel alpha integrin-like protein, is required for pollen wall formation in rice., 2020, 225: 807–822.
[23] Zhang D, Luo X, Zhu L. Cytological analysis and genetic control of rice anther development., 2011, 38: 379–390.
[24] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321–4325.
[25] Panaud O, Chen X, McCouch S R. Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (L.)., 1996, 252: 597–607.
[26] Shi X, Sun X, Zhang Z, Feng D, Zhang Q, Han L, Wu J, Lu T. GLUCAN SYNTHASE-LIKE 5 (GSL5) plays an essential role in male fertility by regulating callose metabolism during microsporogenesis in rice., 2015, 56: 497–509.
[27] Wei S, Ma L. Comprehensive insight into tapetum-mediated pollen development in., 2023, 12: 247.
[28] Li H, Zhang D. Biosynthesis of anther cuticle and pollen exine in rice., 2010, 5: 1121–1123.
[29] Marchant D B, Walbot V. Anther development: the long road to making pollen., 2022, 34: 4677–4695.
[30] Rosado I V, de la Cruz J. Npa1p is an essential trans-acting factor required for an early step in the assembly of 60S ribosomal subunits in., 2004, 10: 1073–1083.
[31] He J, Yang Y, Zhang J, Chen J, Wei X, He J, Luo L. Ribosome biogenesis protein Urb1 acts downstream of mTOR complex 1 to modulate digestive organ development in zebrafish., 2017, 44: 567–576.
[32] Wang H, Wang K, Du Q, Wang Y, Fu Z, Guo Z, Kang D, Li W X, Tang J. Maize Urb2 protein is required for kernel development and vegetative growth by affecting pre-ribosomal RNA processing., 2018, 218: 1233–1246.
[33] Shan L, Xu G, Yao R W, Luan P F, Huang Y, Zhang P H, Pan Y H, Zhang L, Gao X, Li Y, Cao S M, Gao S X, Yang Z H, Li S, Yang LZ, Wang Y, Wong C C L, Yu L, Li J, Yang L, Chen L L. Nucleolar URB1 ensures 3' ETS rRNA removal to prevent exosome surveillance., 2023, 615: 526–534.
[34] Zhou K, Zhang C, Xia J, Yun P, Wang Y, Ma T, Li Z. Albino seedling lethality 4; chloroplast 30S ribosomal protein S1 is required for chloroplast ribosome biogenesis and early chloroplast development in rice., 2021, 14: 47.
[35] Yan H, Chen D, Wang Y, Sun Y, Zhao J, Sun M, Peng X. Ribosomal protein L18aB is required for both male gametophyte function and embryo development in, 2016, 6: 31195.
[36] Uzair M, Long H, Zafar S A, Patil S B, Chun Y, Li L, Fang J, Zhao J, Peng L, Yuan S, Li X. Narrow Leaf21, encoding ribosomal protein RPS3A, controls leaf development in rice., 2021, 186: 497–518.
[37] Li K, Wang P, Ding T, Hou L, Li G, Zhao C, Zhao S, Wang X, Li P. Mutation of an essential 60S ribosome assembly factor MIDASIN 1 induces early flowering in., 2022, 23: 6509.
[38] Uzair M, Xu D, Schreiber L, Shi J, Liang W, Jung K H, Chen M, Luo Z, Zhang Y, Yu J, Zhang D. PERSISTENT TAPETAL CELL2 is required for normal tapetal programmed cell death and pollen wall patterning., 2020, 182: 962–976.
Phenotypic identification and fine mapping of male sterile mutantin rice
WAN Ying-Chun1,**, BAN Yi-Jie1,**, JIANG Yu-Dong2,**, WANG Ya-Xin1, LIU Jing-Jing1, LIU Xiao-Qing1, CHENG Yu-Lin1, WANG Nan1,*, and FENG Ping1,*
1Rice Research Institute of Southwest University / Chongqing Key Laboratory of Application and Safety Control of Genetically Modified Crops / Engineering Research Center of South Upland Agriculture, Ministry of Education, Chongqing 400716, China;2Key Laboratory of Southwest Rice Biology and Genetic Breeding, Ministry of Agriculture and Rural Affairs / Luzhou Branch of National Rice Improvement Center, Rice and Sorghum Research Institute, Sichuan Academy of Agricultural Sciences (Deyang Branch of Sichuan Academy of Agricultural Sciences), Deyang 618000, Sichuan, China
Male sterile material is the key to hybrid rice breeding. In this study, a male sterile mutantwas screened by ethyl methane sulfonate (EMS) mutagenesis of excellentcultivar Xinong 1B. There was no difference betweenand wild type at vegetative growth stage. At reproductive stage, male gametes were sterile and female gametes developed normally. Phenotypic observation showed that the pollen ofwas completely broken and disappeared, the stratum corneum of the outer wall of the anther was abnormal, the Ubisch body of the inner wall of the anther was abnormal, the callose synthesis was abnormal, the tapetum apoptosis was abnormal, and the outer wall of the pollen was missing bacula layer. Genetic analysis showed that the mutant trait was controlled by a pair of recessive nuclear genes. A genetic population was constructed using themutant and Jinhui 10. Finally,gene was located between the markers N9 and N11 on chromosome 4, with a physical distance of 74 kb. There were 15 predicted genes in this interval. Resequencing identified that only a single base substitution occurred in the exon of, leading to an early termination of translation. Subsequent sequencing of the wild-type and mutantconfirmed this mutation, thus identified the gene as a candidate gene for, indicating thatwas a new male sterile gene. This study will lay a foundation for the functional study ofgene.
rice (L.); male recessive nuclear infertility;; fine mapping
10.3724/SP.J.1006.2024.32043
本研究由重庆市研究生科研创新项目(CYS22224)和重庆市技术创新与应用发展专项重点项目(CSTB2022TIAD-KPX0014)资助。
This study was supported by the Chongqing Graduate Research and Innovation Project (CYS22224) and the Chongqing Technology Innovation and Application Development Special Key Project (CSTB2022TIAD-KPX0014).
冯萍, E-mail: 554180353@qq.com; 王楠, E-mail: wangnan_xndx@126.com
**同等贡献(Contributed equally to this work)
万应春, E-mail: wanyc1221@126.com; 班义结, E-mail: 2263889500@qq.com; 蒋钰东, E-mail: 289482100@qq.com
2023-10-17;
2024-01-12;
2024-02-08.
URL: https://link.cnki.net/urlid/11.1809.S.20240206.1442.006
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
