信迪利单抗与白蛋白结合型紫杉醇联合应用于晚期食管癌患者中的效果分析
2024-04-28赵华赵胃胃马书美郝朋朋张超
赵华,赵胃胃,马书美,郝朋朋,张超
1.滨州市中心医院肿瘤科,山东滨州 251700;2.滨州市中心医院心内科,山东滨州 251700
食管癌是消化系统常见的恶性肿瘤,由于早期缺少特异性的症状,导致部分患者就诊时病情已步入中晚期,失去了最佳治疗时机。目前,化疗是治疗晚期食管癌的重要手段,但一些研究发现不同药物在晚期食管癌患者的应用效果存在差异性[1-2]。因此,探寻高效且安全的用药方案以保障晚期食管癌患者的疗效已成为临床学者关注的焦点。白蛋白结合型紫杉醇(Albumin Bound Paclitaxel, nab-PTX)是一种新型的紫杉醇制剂,具有高效低毒的特点,且水溶性较好,利于肿瘤组织摄取[3]。同时,随着肿瘤免疫学研究的日益深入,临床发现肿瘤细胞能够利用程序性细胞死亡蛋白-1(Programmed Cell Death Protein 1, PD-1)激活免疫检查点,促使肿瘤抗原难以被提呈至T细胞,继而逃避T细胞的攻击,而食管癌具有较高的突变负荷,易在免疫治疗中获益[4]。信迪利单抗是一种高选择性、高亲和性的免疫球蛋白G4(Immunoglobulin G4, IgG4)单克隆抗体,作为肿瘤治疗的新靶点,其可以诱导强效的抗肿瘤免疫应答[5]。本研究随机选取2020年8月—2023年7月滨州市中心医院收治的150例晚期食管癌患者为研究对象进行随机分组研究,分析信迪利单抗与nab-PTX联合应用的临床获益情况,现报道如下。
1 资料与方法
1.1 一般资料
随机选取本院收治的150例晚期食管癌患者,以随机数表法分为两组。对照组(n=75)中男45例,女30例;年龄45~79岁,平均(59.60±4.87)岁;体质指数(Body Mass Index, BMI):18.05~27.88 kg/m2,平均(22.56±1.45)kg/m2;临床分期:Ⅲ期45例,Ⅳ期30例;病灶部位:食管上段15例,中段45例,下段15例。研究组(n=75)中男43例,女32例;年龄43~78岁,平均(59.65±5.08)岁;BMI:18.12~27.56 kg/m2,平均(22.50±1.62)kg/m2;临床分期:Ⅲ期43例,Ⅳ期32例;病灶部位:食管上段14例,中段44例,下段17例。两组一般资料比较,差异无统计学意义(P均>0.05),具有可比性。本研究经本院医学伦理委员会批准(2023170)。
1.2 纳入及排除标准
纳入标准:①参照《食管癌规范化诊疗指南》[6]中对于食管癌的标准诊断,有可测量的病灶;②肺癌第8版分期标准[7]为Ⅲ~Ⅳ期;③Karnofsky功能状态评分>60分;④病理类型为鳞状细胞癌;⑤生命体征稳定;⑥预计生存时间>3个月;⑦本研究已告知患者及其家属知情同意。
排除标准:①转移性食管癌者;②肝肾功能严重异常者;③合并脑转移者;④合并免疫系统、血液系统疾病者;⑤合并急性或慢性感染性疾病者;⑥患者精神异常者。
1.3 方法
对照组患者采用nab-PTX(国药准字H20193309;规格:100 mg)联合顺铂(国药准字H20073652;规格:10 mg)进行化疗治疗,即第1天实施100 mg nab-PTX+生理盐水20 mL,静脉滴注;第1~3天实施75 mg/m2顺铂静脉滴注;1个疗程为21 d,共治疗3个疗程。在此基础上,研究组联用信迪利单抗(国药准字S20180016;规格:10 mL∶100 mg)治疗,即200 mg信迪利单抗静脉滴注;1个疗程为21 d,共治疗3个疗程。
1.4 观察指标
①参照实体瘤疗效评价标准1.1[8]对患者的疗效予以比较,并将疗效划分为完全缓解(靶病灶完全消失,持续时间>1个月)、部分缓解(靶病灶缩小≥30%,持续时间>1个月)、稳定(缩小未达到部分缓解标准,增加未达到进展标准)、进展(靶病灶增大≥20%,检查到新病灶)。疾病控制率=完全缓解率+部分缓解率+稳定率。客观缓解率=完全缓解率+部分缓解率。②采集患者治疗前后的空腹静脉血3~5 mL,3 000 r/min速度离心,时间10 min,半径10 cm,选择上清液并以酶联免疫吸附法对血清癌胚抗原、细胞角蛋白19片段、鳞状细胞癌抗原水平予以检测。③观察患者的不良反应,包括胃肠道反应、骨髓抑制、发热、肝功能异常、甲状腺功能减退。
1.5 统计方法
采用SPSS 26.0统计学软件处理数据,肿瘤标志物水平为呈正态分布的计量资料,用()表示,行t检验;疗效、不良反应为计数资料,用例数(n)和率(%)表示,行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者疗效比较
与对照组比较,研究组的客观缓解率为62.67%,疾病控制率为89.33%,均高于对照组的42.67%、76.00%,差异有统计学意义(P均<0.05)。见表1。
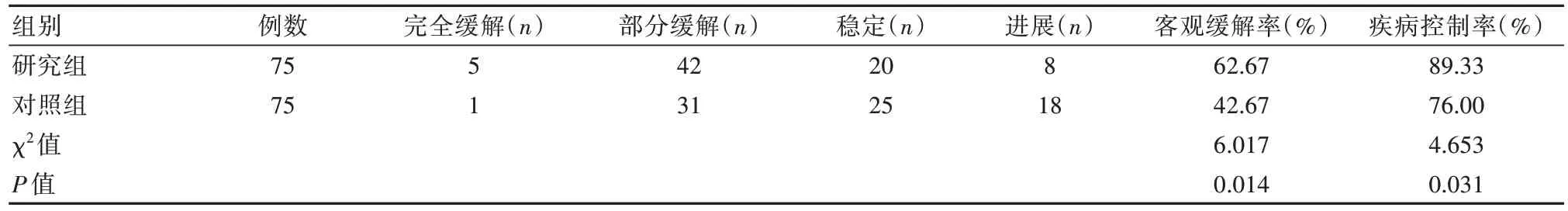
表1 两组患者疗效比较
2.2 两组患者肿瘤标志物水平比较
治疗前,两组患者的癌胚抗原、细胞角蛋白19片段、鳞状细胞癌抗原水平对比,差异无统计学意义(P均>0.05);治疗后,研究组患者的癌胚抗原、细胞角蛋白19片段、鳞状细胞癌抗原水平均低于对照组,差异有统计学意义(P均<0.05)。见表2。
表2 两组患者肿瘤标志物水平比较[(),μg/L]
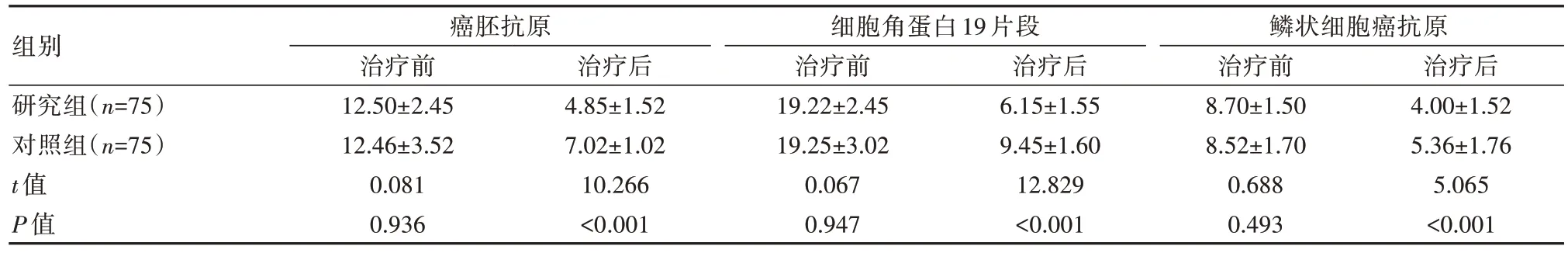
表2 两组患者肿瘤标志物水平比较[(),μg/L]
组别研究组(n=75)对照组(n=75)t值P值癌胚抗原治疗前12.50±2.45 12.46±3.52 0.081 0.936治疗后4.85±1.52 7.02±1.02 10.266<0.001细胞角蛋白19片段治疗前19.22±2.45 19.25±3.02 0.067 0.947治疗后6.15±1.55 9.45±1.60 12.829<0.001鳞状细胞癌抗原治疗前8.70±1.50 8.52±1.70 0.688 0.493治疗后4.00±1.52 5.36±1.76 5.065<0.001
2.3 两组患者不良反应发生率比较
两组患者的胃肠道反应、骨髓抑制、发热、肝功能异常、甲状腺功能减退发生率对比,差异无统计学意义(P均>0.05)。见表3。

表3 两组患者不良反应发生率比较[n(%)]
3 讨论
食管癌在临床较为常见,以吞咽食物时异物感、哽咽感、胸骨后疼痛以及吞咽困难为主要的症状表现,若病灶已发生转移或累及邻近器官,受累器官可能出现相应不适与疼痛感。有调查显示,由于食管癌早期缺少典型症状,50%的患者就诊时已步入局限晚期,5年生存率仅为20.6%~34.0%[9]。
目前,化疗是治疗晚期食管癌的重要手段,其中以氟尿嘧啶或铂类为基础的化疗药物为主,以便杀灭或抑制肿瘤细胞,稳定病情,改善患者的生存质量[10]。nab-PTX是一种新型的化疗药物,由白蛋白与降紫杉醇结合制成,其可以形成稳定的微管,抑制微管蛋白解聚并促进其聚合,保持微管蛋白的稳定性,继而阻断肿瘤细胞的有丝分裂途径,诱导细胞凋亡[11]。然而,单纯化疗方案在晚期食管癌患者中的应用效果有限[12]。信迪利单抗IgG4属于单克隆抗体,可以结合于肿瘤细胞的细胞程序性死亡-配体1,阻断PD-1/细胞程序性死亡-配体1通路,解除免疫抑制效应,促使激活T细胞功能,发挥出杀灭肿瘤细胞的作用[13]。同时,由于单克隆抗体不经细胞色素P450酶或其他代谢酶代谢,联合其他药物对于此类酶的诱导与抑制作用不会影响信迪利单抗的药代动力学[14]。袁园等[15]对42例晚期食管癌患者应用了信迪利单抗与nab-PTX联合治疗,结果显示疾病控制率为87.80%,高于nab-PTX化疗治疗组的60.98%(P<0.05)。姚鹏等[16]采用信迪利单抗与nab-PTX等化疗药物治疗38例晚期食管癌,其客观缓解率为(76.3%)高于nab-PTX化疗红细胞生成素的41.4%(P<0.05)。本研究结果显示,研究组客观缓解率为62.67%,疾病控制率为89.33%,较对照组的42.67%、76.00%高(P均<0.05)。结果说明,nab-PTX化疗能够诱导肿瘤细胞凋亡,信迪利单抗促进了免疫系统激活,利用肿瘤抗原提高肿瘤特性T细胞的活性,抑制或清除肿瘤病灶,与nab-PTX化疗协同作用,进一步提高了疾病控制率与客观缓解率。
癌胚抗原、细胞角蛋白19片段、鳞状细胞癌抗原是食管癌的常见肿瘤标志物,其中癌胚抗原是消化道肿瘤的敏感标志物,可以作为细胞膜结构蛋白在肿瘤细胞表面存在,并分泌至周围体液中[17]。同时,在机体出现恶性肿瘤时可以激活蛋白酶,促使上皮细胞损伤、坏死并释放大量的细胞角蛋白19片段[18]。鳞状细胞癌抗原是各类组织鳞状上皮细胞癌蛋白。本文结果显示,治疗后与对照组结果相比,研究组癌胚抗原、细胞角蛋白19片段、鳞状细胞癌抗原水平更低(P均<0.05)。结果说明,信迪利单抗与nab-PTX联合治疗有效抑制了肿瘤标志物的表达,为疾病预后提供了有力的保障。从安全性来看,两组胃肠道反应、骨髓抑制、发热、肝功能异常、甲状腺功能减退发生率对比,差异无统计学意义(P均>0.05)。结果说明,在nab-PTX化疗的基础上联合信迪利单抗并未增加不良用药风险,安全性较为理想。需要注意的是,信迪利单抗存在甲状腺功能、发热等不良反应问题,临床仍需给予足够的关注。
综上所述,晚期食管癌患者采用信迪利单抗与nab-PTX联合治疗能够有效提高疾病控制率与客观缓解率,调节肿瘤标志物的表达,安全性较为理想。
